番石榴葉總三萜改善3T3-L1脂肪細胞胰島素抵抗*
李秀存, 馬錦錦, 趙晶晶, 葉開和, 呂艷青, 王小康, 魏崧丞, 張曉琦, 葉春玲△
(1暨南大學藥學院藥理學教研室,廣東 廣州 510632;2廣東省婦幼保健院藥學部,廣東 廣州 511400;3暨南大學中藥與天然藥物研究所,廣東 廣州 510632)
?
番石榴葉總三萜改善3T3-L1脂肪細胞胰島素抵抗*
李秀存1,馬錦錦1,趙晶晶2,葉開和1,呂艷青1,王小康1,魏崧丞1,張曉琦3,葉春玲1△
(1暨南大學藥學院藥理學教研室,廣東 廣州 510632;2廣東省婦幼保健院藥學部,廣東 廣州 511400;3暨南大學中藥與天然藥物研究所,廣東 廣州 510632)
[摘要]目的: 觀察番石榴葉總三萜(TTPGL)對3T3-L1脂肪細胞胰島素抵抗(IR)的改善作用,并探討其可能的作用機制。方法: 培養3T3-L1前脂肪細胞并誘導其分化,給予TTPGL(0.3、1、3、10 μg/L),并設溶媒(0.1% DMSO)組、陽性藥正釩酸鈉(Van,10 μmol/L)組、正常對照(control)組和模型(model)組,藥物作用48 h。MTT法檢測藥物對前脂肪細胞活力的影響,油紅O染色法觀察其對細胞分化的影響。建立IR模型后,藥物處理48 h,葡萄糖氧化酶-過氧化物酶法(GOD-POD)檢測IR脂肪細胞上清液中葡萄糖消耗量;比色法檢測游離脂肪酸(FFA)水平;ELISA法檢測脂肪因子分泌水平;real-time PCR檢測IR脂肪細胞蛋白酪氨酸激酶1B(PTP1B)的mRNA表達量;Western blot檢測磷酸化胰島素受體底物1/胰島素受體底物1(p-IRS-1/IRS-1)和磷酸化蛋白激酶B/蛋白激酶B(p-Akt/Akt)的蛋白水平。結果: 與溶媒組比較,TTPGL顯著提高了前脂肪細胞的活力并抑制其分化(P<0.01)。與IR溶媒組比較,無論在基礎狀態下還是胰島素刺激狀態下,TTPGL(1-10 μg/L)均顯著地促進了IR脂肪細胞葡萄糖消耗(P<0.01);TTPGL(0.3~3 μg/L)顯著抑制FFA的產生(P<0.01)。與模型組比較,TTPGL(0.3和3 μg/L)顯著增加IR脂肪細胞脂聯素的分泌(P<0.05)并抑制TNF-α的分泌(P<0.01),TTPGL(3 μg/L)對抵抗素的分泌有顯著抑制作用(P<0.05),對瘦素分泌無顯著作用;TTPGL(3 μg/L)顯著下調IR脂肪細胞PTP1B的mRNA表達(P<0.01);TTPGL(3 μg/L)極顯著上調p-IRS-1/IRS-1的水平;TTPGL(0.3和3 μg/L)顯著上調p-Akt/Akt的蛋白水平(P<0.05)。結論: TTPGL具有顯著改善3T3-L1脂肪細胞IR的作用,其作用機制可能與TTPGL下調了IR脂肪細胞PTP1B mRNA的表達、同時上調p-IRS-1/IRS-1和p-Akt/Akt的蛋白水平有關。
[關鍵詞]番石榴葉總三萜; 胰島素抵抗; 蛋白酪氨激酶1B; 胰島素受體底物1; 蛋白激酶B
糖尿病(diabetes mellitus,DM)及其慢性并發癥已成為繼腫瘤和心腦血管疾病后人類的第3大死亡原因[1]。預計到2025年,全球糖尿病患者將高達3.8億,其中90%以上為2型糖尿病患者。2型糖尿病的主要病理生理基礎是胰島素抵抗(insulin resis-tance,IR)伴或不伴胰島素分泌相對不足[2],它貫穿于2型糖尿病發展的整個過程。
番石榴為桃金娘科番石榴屬植物,主要生長在東南亞的熱帶地區。其主要成分包括黃酮類化合物、萜類化合物以及酚酸化合物,研究表明這些化合物具有抗炎、抗腫瘤、抗氧化、抗糖尿病等作用[3]。在前期的動物實驗中,本課題組首次發現番石榴葉總三萜(total triterpenoids fromPsidiumguajavaleaf,TTPGL)可有效改善由高脂飲食和小劑量鏈脲佐菌素共同誘發的2型糖尿病大鼠IR的作用。本課題采用3T3-L1脂肪細胞建立胰島素抵抗模型,繼續探討TTPGL對3T3-L1脂肪細胞IR的改善作用,并通過觀察TTPGL對IR脂肪細胞蛋白酪氨酸激酶1B(protein tyrosine phosphatase 1B, PTP1B)的mRNA的表達以及對胰島素受體底物1(insulin receptor substrate 1 IRS-1)、蛋白激酶B(protein kinase B, Akt)磷酸化的影響,揭示其改善胰島素抵抗的作用機制。
材料和方法
1材料
1.1樣本與試劑3T3-L1前脂肪細胞株購自中國醫學科學院北京協和細胞資源中心;番石榴葉總三萜由暨南大學中藥與天然藥物化學研究所張曉琦教授提供,其分子結構式見圖1;高糖DMEM培養基、胎牛血清和0.25%胰蛋白酶均購自Gibco。MTT購自Amresco;地塞米松、3-異丁基-1-甲基黃嘌呤、胰島素、油紅O和DMSO購自Sigma;正釩酸鈉(sodium orthovanadate,Van)購自阿拉丁公司;無水乙醇、異丙醇、多聚甲醛和冰乙酸購自天津市北聯精細化學品開發有限公司;TRIzol購自Invitrogen;DNA引物委托上海捷瑞生物工程有限公司合成;ReverTra Ace qPCR RT Kit和SsoFast EvaGreen Supermix qPCR Kit購自TOYOBO;抗GAPDH、 IRS-1、 p-Akt (Ser473)和Akt的抗體購自CST;抗p-IRS-1 (Tyr632)的抗體購自Abcam。

Figure 1.Chemical structural formula of TTPGL
圖1番石榴葉總三萜的化學結構式
1.2主要儀器ELX800多功能酶標儀(Bio-Tek);BR4i低溫高速離心機(Thermo);TS100倒置顯微鏡(Nikon);DK-S22電熱恒溫水浴鍋(上海精宏實驗設備有限公司);79-1磁力加熱攪拌器(北京六一儀器廠);HC-3018R高速冷凍離心機(科大創新股份有限公司);PTC-1152 PCR儀(Bio-Rad);SMYUV-750紫外分光光度計(上海康華生化儀器制造廠);Trans-Blot Turbo蛋白電轉儀(Bio-Rad);ImageQuant LAS 4000凝膠成像系統(GE Healthcare)。
2方法
2.13T3-L1前脂肪細胞的誘導分化3T3-L1前脂肪細胞的培養條件為10% 胎牛血清+100 U雙抗的高糖DMEM完全培養液,于37 ℃、5% CO2環境中培養。當細胞融合后,首先加入誘導液1(0.5 mmol/L IBMX、1 μmol/L DEX和10 mg/L insulin),作用48 h后,換成誘導液2(10 mg/L insulin),作用48 h后,將誘導液換為含10%胎牛血清的DMEM完全培養液,繼續誘導分化,直至80%以上的細胞分化成熟。
2.2MTT法測定3T3-L1前脂肪細胞的活力取生長狀態良好的前脂肪細胞,離心后重懸細胞,調整細胞密度至3×107/L,接種于96孔板,培養24 h后分組給藥,分為空白對照組、溶媒(0.1% DMSO)對照組、陽性藥Van(10 μmol/L)組和藥物番石榴葉總三萜(0.3、1、3、10 μg/L)組。給藥處理48 h,加入5 g/L MTT 20 μL,于CO2培養箱中孵育4 h,移除上清液,加入150 μL DMSO,于搖床混勻10 min,酶標儀上于測定波長570 nm、參比波長630 nm測吸光度(A)值。細胞活力(%)=(實驗組A值-空白對照組A值)/空白對照組A值×100%。
2.3油紅O染色法觀察3T3-L1前脂肪細胞的分化在細胞誘導分化8 d后,首先用PBS洗3次,10%多聚甲醛固定10 min,PBS洗后控干,油紅O溶液染色30 min,再用PBS洗3次,于顯微鏡下觀察到細胞漿內被染成紅色的環狀脂滴。用150 μL異丙醇萃取油紅,酶標儀于490 nm波長處測定吸光度值。細胞分化率(%)=(實驗組A值-空白對照組A值)/空白對照組A值×100%。
2.43T3-L1胰島素抵抗脂肪細胞模型的建立取分化成熟的脂肪細胞,分為模型(model)組和正常對照(control)組,control組給予常規高糖DMEM完全培養基,model組給予1 μmol/L地塞米松作用96 h用于造模,4 d后提取細胞上清液,采用GOD-POD法檢測葡萄糖消耗確定是否造模成功。取造模成功的細胞用于糖脂代謝實驗。
2.5葡萄糖消耗、游離脂肪酸(free fatty acid,FFA)產生及脂肪因子分泌的檢測取造模成功的細胞分組給藥,分為control組、model組、Van(10 μmol/L)組和TTPGL(0.3、1、3、10 μg/L)組。各組藥物作用48 h后提取細胞上清液,GOD-POD法檢測葡萄糖消耗,比色法檢測FFA產生,ELISA法測定脂聯素、瘦素、TNF-α、抵抗素的分泌水平。
2.6real-time PCR檢測IR脂肪細胞PTP1B mRNA的表達6孔板培養細胞并造模,取造模成功的細胞分組給藥(分組同2.5),每組2個復孔。各組藥物作用48 h后,棄上清,PBS洗,TRIzol法提各孔總RNA,real-time PCR檢測PTP1B mRNA的表達。
2.7Western blot檢測IR脂肪細胞p-IRS-1/IRS-1和p-Akt/Akt的蛋白水平6孔板培養細胞并造模,取造模成功的細胞分組給藥(分組同2.5),每組3個復孔。各組藥物作用48 h后,棄上清,PBS洗,加入蛋白裂解液(RAPI:PMSF=100:1)于冰上靜置30 min,提取蛋白,Western blot檢測IRS-1、p-IRS-1、Akt、p-Akt的蛋白水平。
3統計學處理
采用SPSS 17.0統計學軟件進行統計學分析,結果以均數±標準差(mean±SD)表示,單因素方差分析后,均數間兩兩比較用SNK-q檢驗。以P<0.05為差異有統計學意義。
結果
1TTPGL對3T3-L1前脂肪細胞活力的影響
與溶媒組比較,陽性藥Van顯著提高了前脂肪細胞的活力(P<0.01);TTPGL(3和10 μg/L)顯著提高前脂肪細胞活力(P<0.01),并且TTPGL的作用呈劑量依賴性。TTPGL提高前脂肪細胞活力的能力顯著低于Van(P<0.01),見圖2。
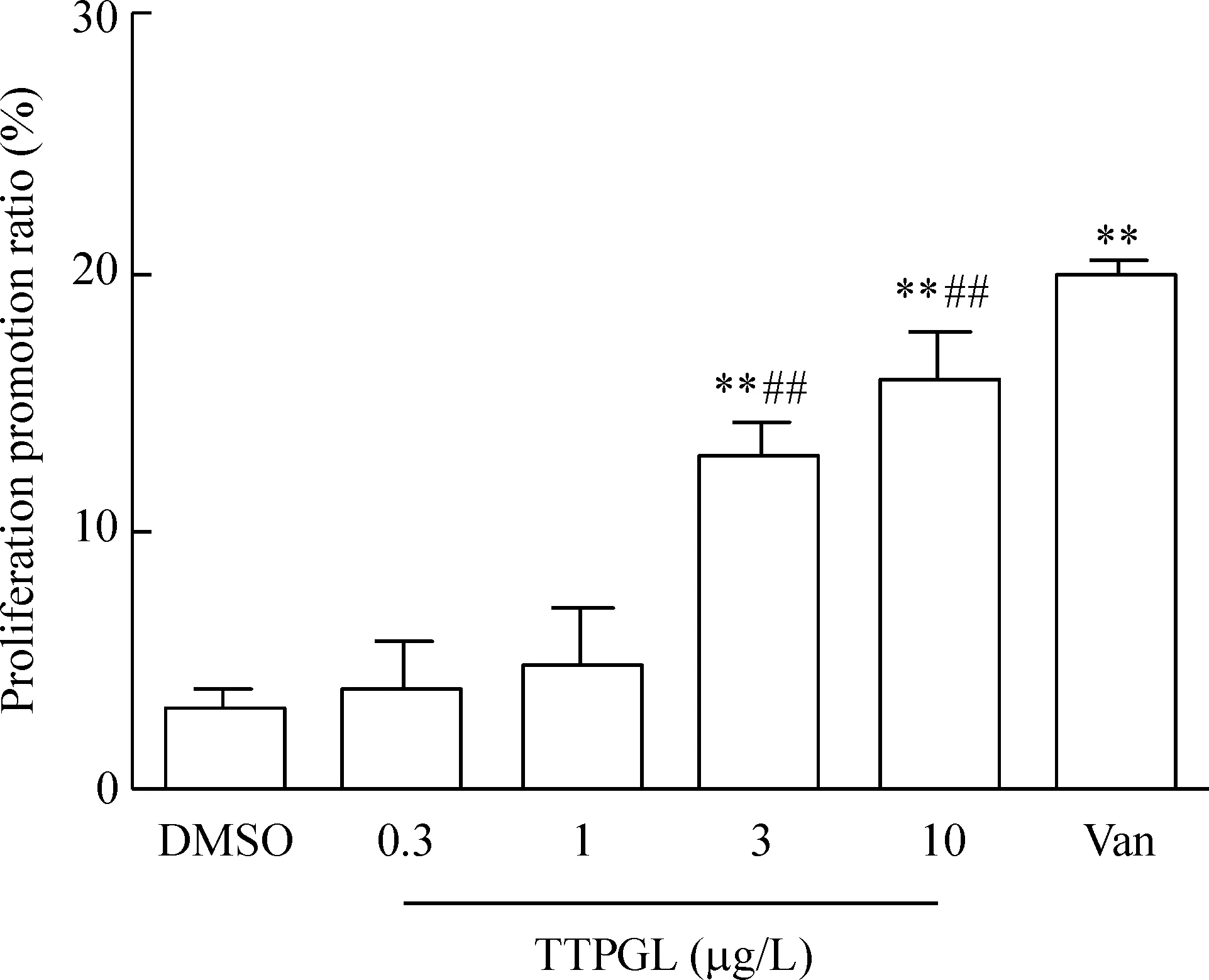
Figure 2.The effect of TTPGL on the cell proliferation of 3T3-L1 preadipocytes. Mean±SD.n=6.**P<0.01vsDMSO group;##P<0.01vsVan group.
圖2番石榴葉總三萜對3T3-L1前脂肪細胞增殖的影響
23T3-L1前脂肪細胞分化前后形態的變化
圖3所示為3T3-L1前脂肪細胞分化前后的形態變化,在顯微鏡下可觀察到分化前為成纖維細胞,呈梭形;待細胞分化成熟后細胞變圓,胞漿內出現大量呈指環狀分布的紅色脂滴,提示細胞分化成熟。
3TTPGL對3T3-L1前脂肪細胞分化的影響
與溶媒對照組比較,陽性藥Van顯著抑制了前脂肪細胞的分化(P<0.01);TTPGL(1、3、10 μg/L)呈劑量依賴性抑制其分化(P<0.05)。與Van組比較,TTPGL(1、3 μg/L)抑制前脂肪細胞分化的能力明顯偏低(P<0.05),而10 μg/L的TTPGL對前脂肪細胞分化的抑制能力和Van無顯著性差異,見圖4。
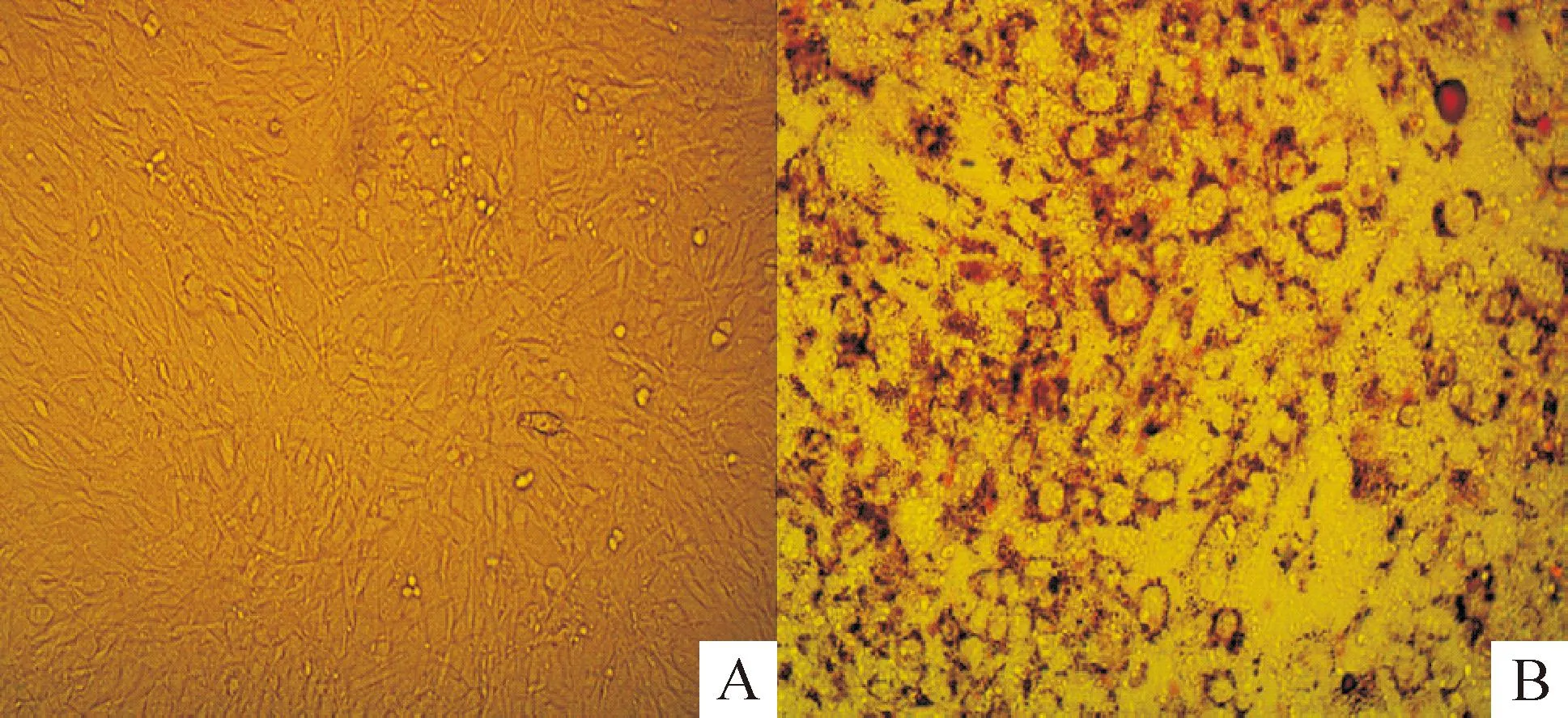
Figure 3.Comparison of 3T3-L1 adipocyte morphology before and after differentiation (×100). A: 3T3-L1 preadipocytes before differentiation; B: 3T3-L1 adipocytes after differentiation.
圖3誘導分化前后3T3-L1脂肪細胞形態的對比

Figure 4.The effect of TTPGL on differentiation of 3T3-L1 preadipocytes. Mean±SD.n=6.*P<0.05,**P<0.01vsDMSO group;#P<0.05,##P<0.01vsVan group.
圖4番石榴葉總三萜對3T3-L1前脂肪細胞分化的影響
4TTPGL對3T3-L1胰島素抵抗脂肪細胞葡萄糖消耗的影響
無論基礎狀態下還是胰島素刺激狀態下孵育48 h后,與control比較,model溶媒組細胞上清液中的葡萄糖含量明顯降低(P<0.01),提示造模成功。與model組比較,陽性藥Van顯著促進IR脂肪細胞葡萄糖的消耗(P<0.01);1、3和10 μg/L TTPGL劑量依賴性促進其葡萄糖消耗(P<0.05)見圖5。
5TTPGL對IR脂肪細胞FFA產生的影響
與control組比較,model組的FFA水平明顯升高(P<0.01);與model組比較,陽性藥Van顯著抑制了IR脂肪細胞FFA的產生(P<0.01);TTPGL在較低濃度下(0.3、1和3 μg/L)顯著抑制FFA的產生(P<0.01),而10 μg/L TTPGL卻不能抑制IR脂肪細胞FFA的產生,見圖6。
6TTPGL對IR脂肪細胞脂聯素、瘦素、TNF-α和抵抗素分泌的影響
模型組與control組比較,差異都具有統計學顯著性(P<0.01);其它各組與模型組比較,可見Van顯著促進IR脂肪細胞脂聯素的分泌(P<0.01),顯著抑制TNF-α與抵抗素的分泌(P<0.01),對瘦素分泌無顯著作用;TTPGL(0.3和3 μg/L)顯著促進了IR脂肪細胞的脂聯素分泌P<0.05),顯著抑制TNF-α的分泌(P<0.01),在3 μg/L濃度下顯著抑制抵抗素的分泌(P<0.05)。對瘦素的分泌無明顯作用。對瘦素和TNF-α的影響,TTPGL和Van無顯著性差異。對脂聯素和抵抗素的影響,TTPGL的作用明顯小于Van(P<0.05),見圖7。
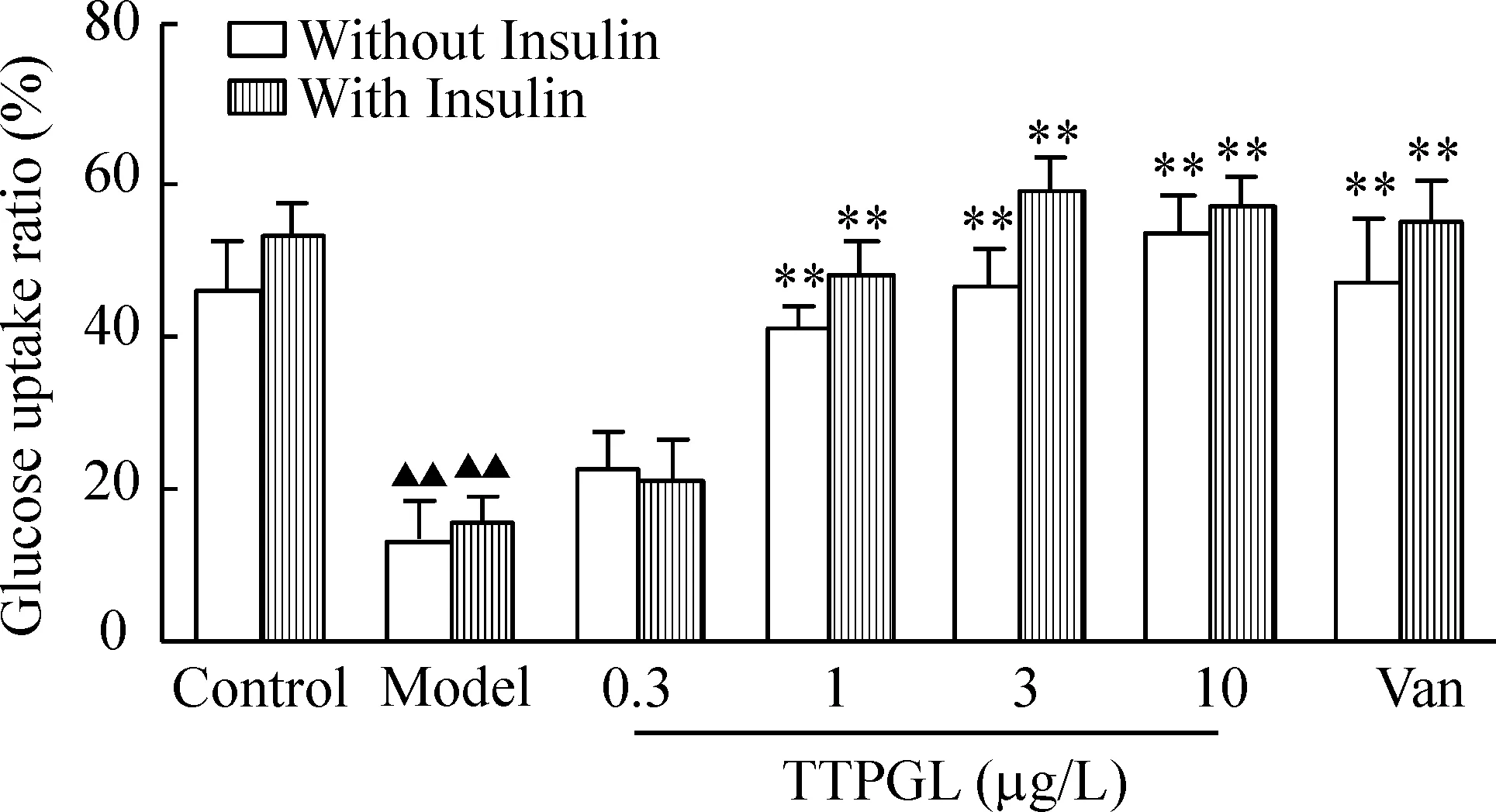
Figure 5.The effects of TTPGL on basal and insulin-stimulated glucose consumption in IR adipocytes. Mean±SD.n=6.▲▲P<0.01vscontrol group;**P<0.01vsmodel group.
圖5番石榴葉總三萜對IR脂肪細胞葡萄糖消耗的影響
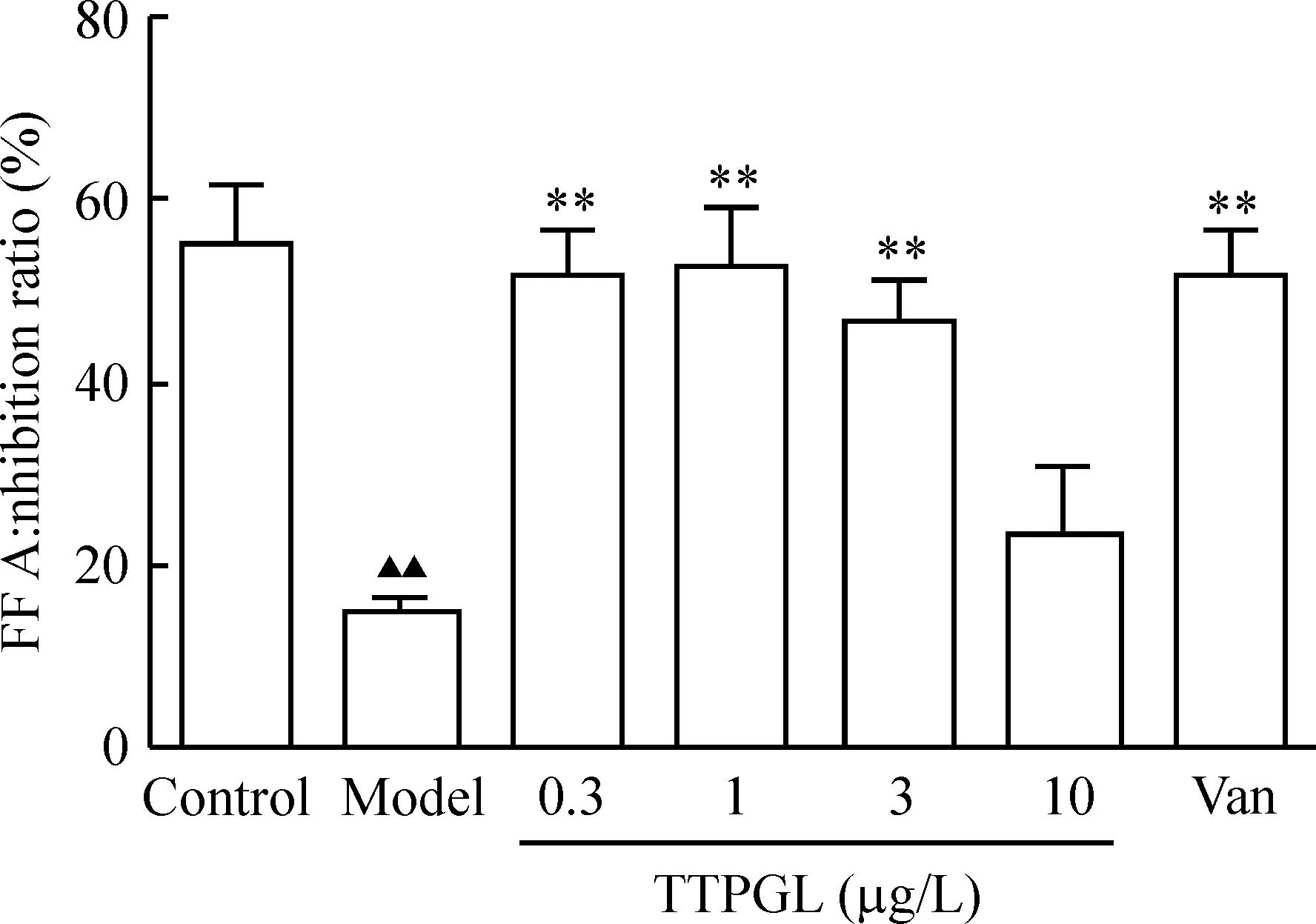
Figure 6.The effect of TTPGL on the production of FFA in IR adipocytes. Mean±SD.n=6.▲▲P<0.01vscontrol group;**P<0.01vsmodel.
圖6番石榴葉總三萜對胰IR脂肪細胞FFA產生的影響
7TTPGL對IR脂肪細胞PTP1B mRNA表達的影響
與模型組比較,陽性藥Van顯著下調了IR脂肪細胞PTP1B 的mRNA表達(P<0.01);TTPGL僅在3 μg/L濃度下顯著下調PTP1B的mRNA表達(P<0.01),見圖8。
8TTPGL對IR脂肪細胞p-IRS-1/IRS-1和p-Akt/Akt水平的影響
與模型組比較,陽性藥Van顯著增加了IR脂肪細胞p-IRS-1/IRS-1與p-Akt/Akt的水平 (P<0.01);
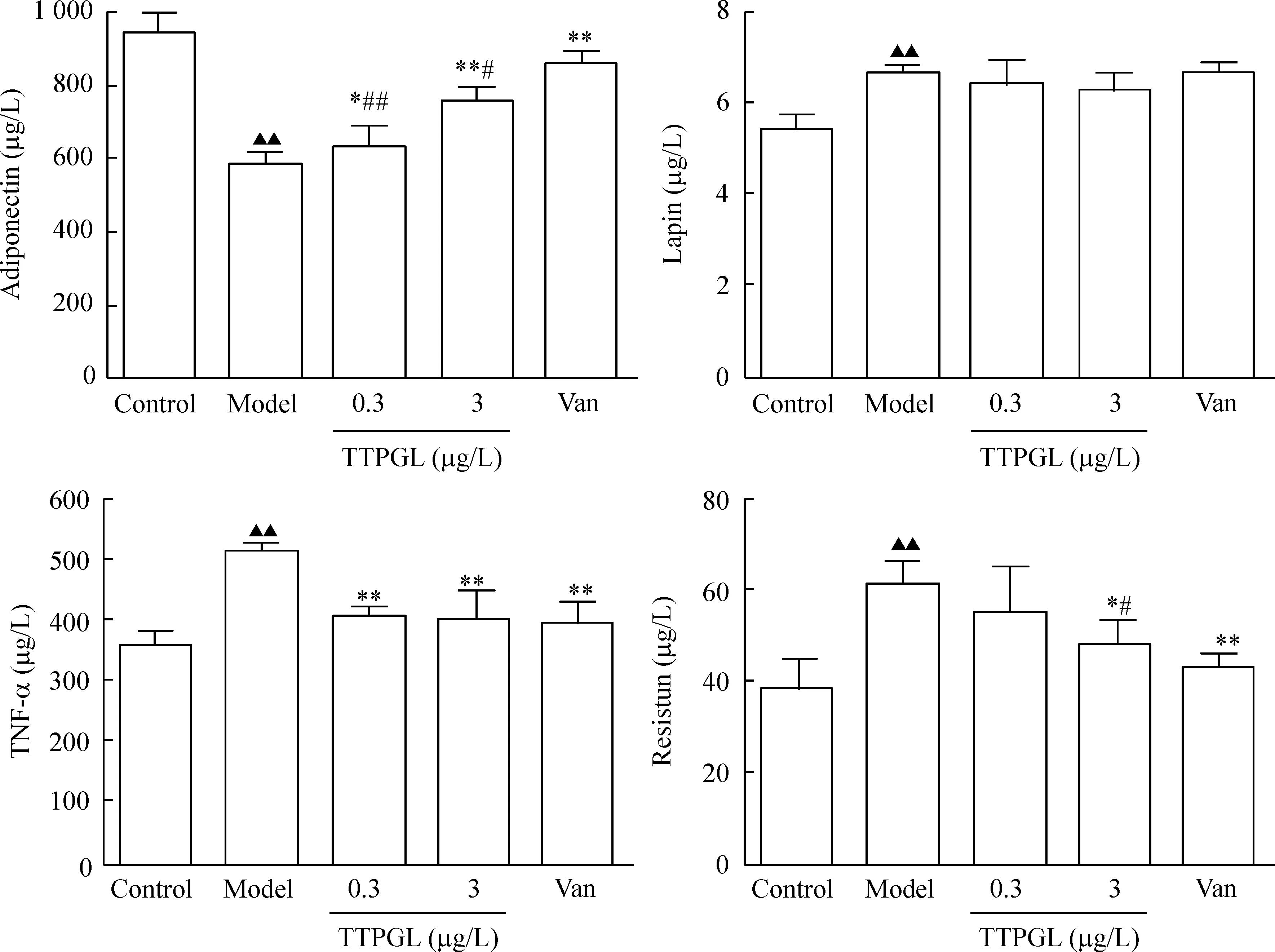
Figure 7.The effects of TTPGL on the level of adipocytokines in IR adipocytes. Mean±SD.n=6.▲▲P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group.#P<0.05,##P<0.01vsVan group.
圖7番石榴葉總三萜對胰島素抵抗脂肪細胞脂肪因子分泌的影響
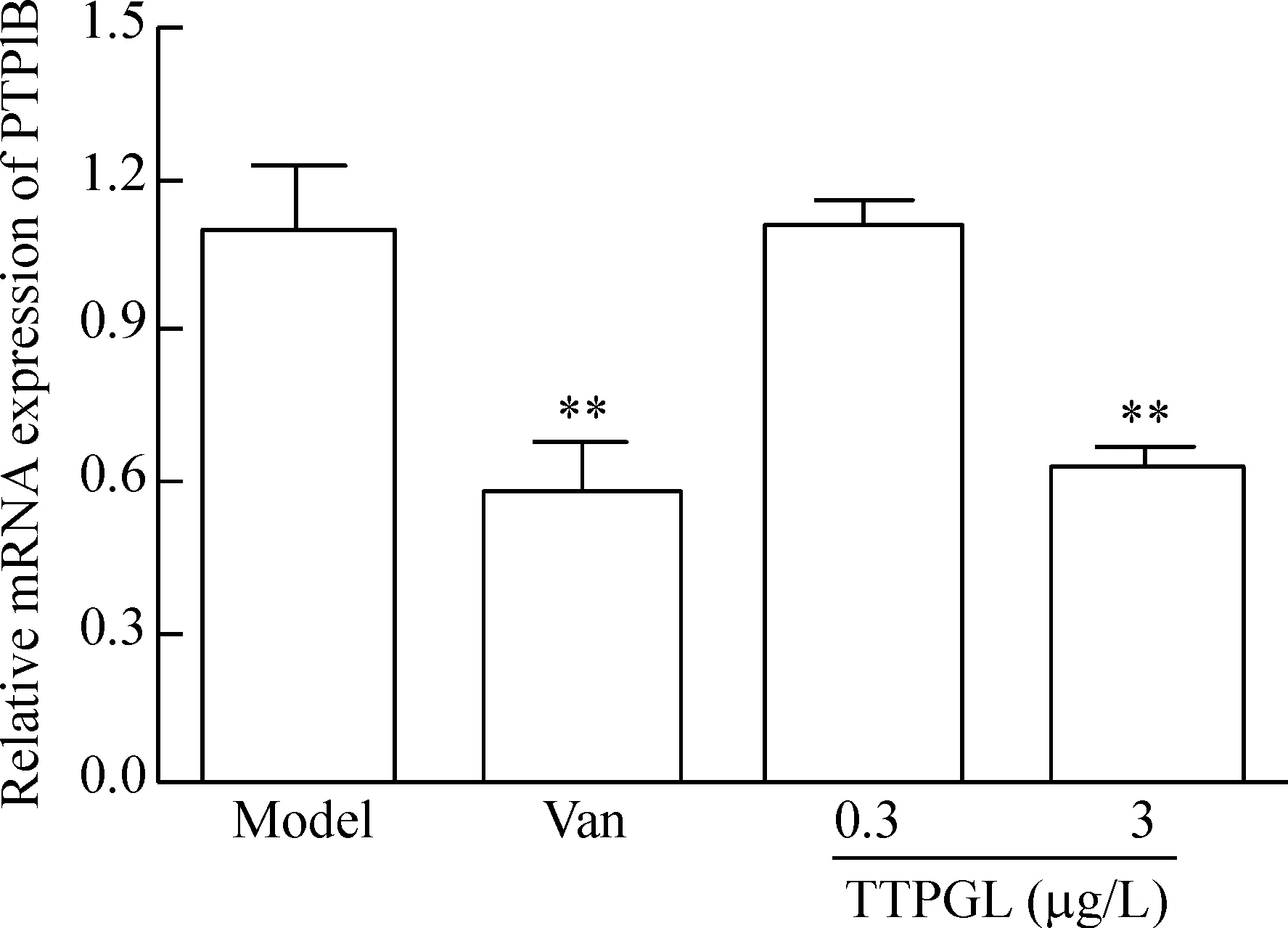
Figure 8.The effects of TTPGL on the mRNA expression of PTP1B in IR adipocytes. Mean±SD.n=6.**P<0.01vsmodel group.
圖8番石榴葉總三萜對胰島素抵抗脂肪細胞PTP1B mRNA表達的影響
3 μg/L TTPGL顯著增加了p-IRS-1/IRS-1 的水平(P<0.01);TTPGL(0.3和3 μg/L)顯著增加p-Akt/Akt 水平(P<0.01)。TTPGL在3 μg/L劑量下對p-IRS-1/IRS-1和p-Akt/Akt的影響與Van比較沒有顯著性差異。在0.3 μg/L劑量下對p-Akt/Akt的作用明顯低于Van(P<0.01),見圖9。
討論
隨著人們生活水平的提高,肥胖人數比例逐年增加,糖尿病與之密切相關,在2型糖尿病人群中,75%的患者伴有肥胖[4]。有研究表明,當肥胖患者通過調節飲食或運動有效的控制了體重,可以在一定程度上改善胰島素抵抗,減輕糖尿病癥狀[5]。除此之外,胰島素抵抗的機制還可能、糖毒性、脂毒性相關[6-7],同時,胰島素的生物學效應還受脂肪因子、PTP1B、PPARγ等多種因子的調節[8-9]。
脂肪細胞分為兩種,未分化的前脂肪細胞又叫小脂肪細胞,分化成熟的脂肪細胞又叫大脂肪細胞,其中大脂肪細胞數量增多和體積增大對脂肪的積累和肥胖的發生起著重要作用[10]。本實驗采用3T3-L1前脂肪細胞,常規培養并誘導其分化,在給予藥物干預后,觀察藥物對細胞的增殖及分化的影響。我們觀察到TTPGL對3T3-L1前脂肪細胞增殖有促進作用,此時增加的是小脂肪細胞數量;在分化實驗中,TTPGL顯著抑制細胞分化的作用,這在一定程度上可抑制大脂肪細胞的數量,避免肥胖的發生,與陽性藥Van作用相一致。
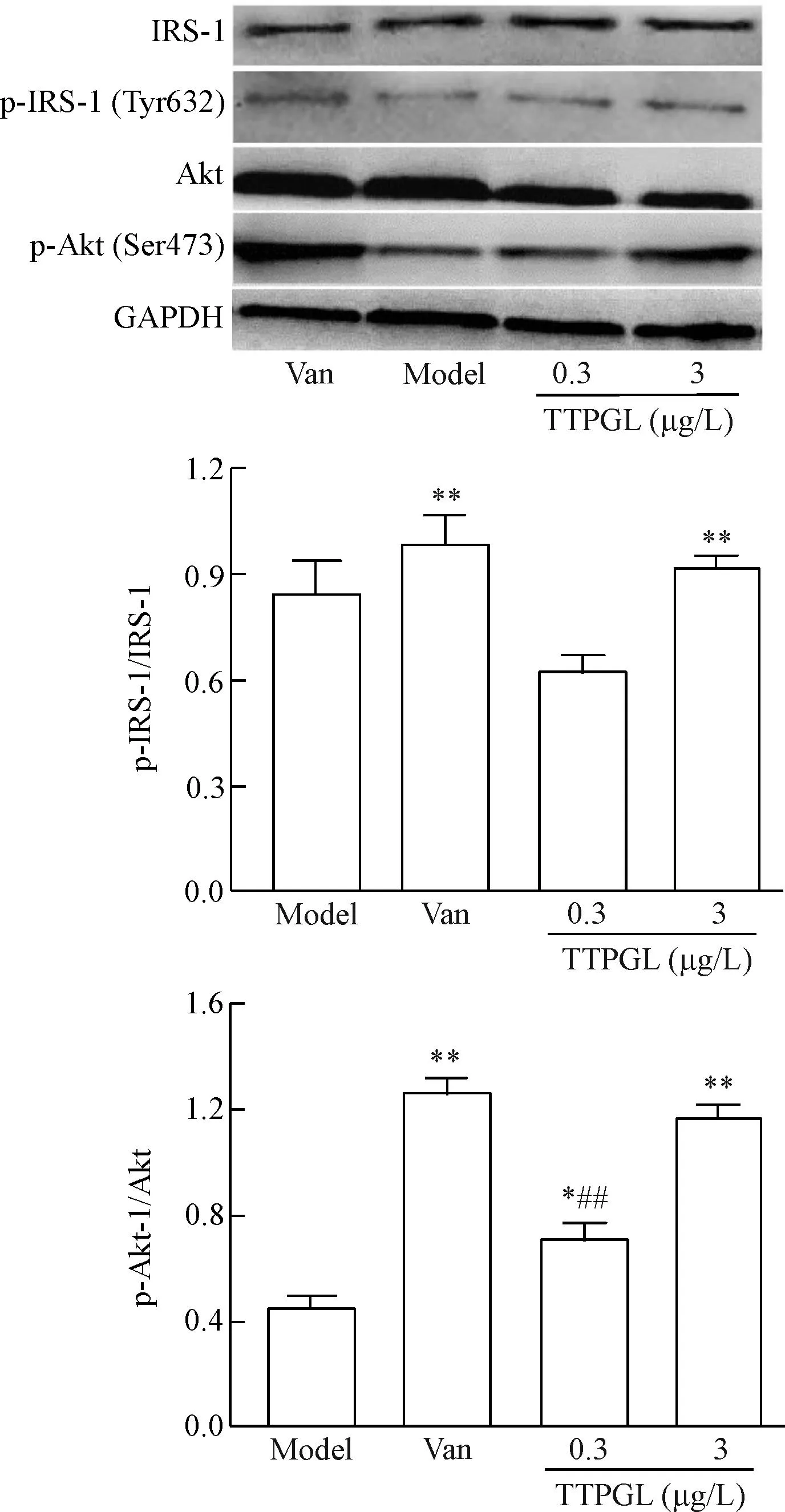
Figure 9.The effect of TTPGL on the relative protein levels of p-IRS-1 and p-Akt in IR adipocytes. Mean±SD.n=6.**P<0.01vsmodel group;##P<0.01vsVan group.
圖9番石榴葉總三萜對胰島素抵抗脂肪細胞p-IRS-1/IRS-1、p-Akt/Akt水平的影響
糖毒性與脂毒性在IR過程中發揮重要作用,同時IR又會加重糖毒性與脂毒性,從而形成惡性循環[11-12]。在本實驗中,我們采用分化成熟的脂肪細胞建立胰島素抵抗模型,給藥處理后,觀察藥物對IR脂肪細胞糖脂代謝的影響。本實驗發現,無論是在基礎狀態下還是胰島素刺激狀態下,TTPGL在較低劑量下顯著促進胰島素抵抗脂肪細胞葡萄糖的消耗并抑制FFA的產生,具有改善 IR脂肪細胞糖脂代謝的作用。
脂肪組織是一個巨大的內分泌器官,它可以分泌多種脂肪因子從而實現對糖脂代謝、炎癥等生理活動的調節。這些脂肪因子在體內增多或減少,對胰島素生物學效應的發揮有重要影響[13]。研究表明一些脂肪因子例如脂聯素等具有胰島素增敏劑的作用[14];另外一些脂肪因子如TNF-α、抵抗素等可引起胰島素抵抗[15-16];瘦素對胰島素抵抗具有雙向調節作用,在一定濃度下具有抑制食欲促進糖脂代謝的作用,當出現瘦素抵抗,瘦素水平升高并引起胰島素抵抗[17]。在脂肪因子分泌的實驗中,發現TTPGL顯著促進了IR脂肪細胞脂聯素的分泌并抑制其TNF-α的分泌,在較高濃度下對抵抗素的分泌也有抑制作用,與陽性藥Van作用相似。
通過以上實驗,我們發現TTGPL具有顯著改善3T3-L1胰島素抵抗脂肪細胞糖脂代謝以及脂肪因子分泌的作用,認為其具有改善IR的作用,其作用與Van一致。Van作為PTP1B的抑制劑,通過抑制PTP1B而改善胰島素信號通路轉導
當胰島素與胰島素受體結合后主要通過IRS-1/PI3K/Akt信號通路進行級聯反應的轉導[18]。在脂肪細胞中,胰島素首先與胰島素受體結合并使其激活,進而使胰島素受體底物發生酪氨酸磷酸化,當磷酸化的IRS與磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)的調節亞基結合,可激活其催化亞基。活化后的PI3K可使絲氨酸/蘇氨酸蛋白激酶磷酸化而使其激活,進而刺激葡萄糖轉運蛋白4 從細胞內轉移到細胞膜,促進葡萄糖轉運[19]。在胰島素信號轉導通路中,任何一個環節出現障礙都可能引起胰島素抵抗。PTP1B作為胰島素信號通路的負性調節因子,它可以通過使胰島素受體及胰島素受體底物發生酪氨酸去磷酸化[20],阻礙胰島素的信號轉導,引起IR。
在接下來的實驗中,本實驗通過觀察TTPGL對PTP1B的mRNA表達以及p-IRS-1、p-Akt 蛋白量的影響,探討藥物作用機制。TTPGL在3 μg/L劑量下顯著抑制PTP1B的mRNA表達,0.3 μg/L劑量下對其無明顯作用;蛋白實驗結果顯示,TTPGL在3 μg/L劑量下顯著增加p-IRS-1/IRS-1與p-Akt/Akt的水平,在0.3 μg/L劑量下對p-IRS-1/IRS-1無明顯作用,對p-Akt/Akt有一定的增加。我們可以推測TTPGL可能通過下調PTP1B的mRNA表達,并上調p-IRS-1與p-Akt蛋白,從而改善胰島素信號通路,與Van的作用相似。
從本實驗中我們得出TTPGL具有改善3T3-L1脂肪細胞胰島素抵抗的作用,其機制與Van相似,但Van存在強烈的胃腸道副反應及腎毒性,而TTPGL是從植物番石榴葉中提取的中藥成分,抗糖尿病動物實驗未見明顯的毒副作用,值得進一步深入研究。
[參考文獻]
[1]Harris JK, Mueller NL, Snider D, et al. Local health department use of twitter to disseminate diabetes information, United States[J]. Prev Chronic Dis, 2013, 10(41):120215-120225.
[2]Hollenberg NK, Parving HH, Viberti G, et al. Albuminuria response to very high-dose valsartan in type 2 diabetes mellitus[J]. J Hypertens, 2013, 25(9):1921-1926.
[3]Wang B, Liu HC, Hong JR, et al. Effect ofPsidiumguajavaleaf extract on alpha-glucosidase activity in small intestine of diabetic mouse[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2007, 38(2):298-301.
[4]Malik VS, Popkin BM, Bray GA, et al. Sugar-sweetened beverages, obesity, type 2 diabetes mellitus, and cardiovascular disease risk[J]. Circulation, 2010, 121(11):1356-1364.
[5]Rasul S, Wagner L, Kautzky-Willer A. Fetuin-A and angiopoietins in obesity and type 2 diabetes mellitus[J]. Endocrine, 2012, 42(3):496-505.
[6]Duprez J, Roma LP, Close A, et al. Protective antioxidant and antiapoptotic effects of ZnCl2 in rat pancreatic islets cultured in low and high glucose concentrations[J]. PLoS One, 2012, 7(10):37920-37927.
[7]Lv ZH, Pei M, Wan L, et al. Association between serum free fatty acid levels and possible related factors in patients with type 2 diabetes mellitus and acute myocardial infarction[J]. BMC Cardiovasc Disord, 2014, 14(1):159-165.
[8]Panzhinskiy E, Ren J, Nair S, et al. Pharmacological inhibition of protein tyrosine phosphatase 1B: a promising strategy for the treatment of obesity and type 2 diabetes mellitus[J]. Curr Med Chem, 2013, 20(21):2609-2625.
[9]Jiang LY. Tang SS, Wang XY, et al. Ppar agonist pioglitazone reverses memory impairment and biochemical changes in a mouse model of type 2 diabetes mellitus[J]. CNS Neurosci Ther, 2012, 18(8):659-666.
[10]Zhang L, Paddon C, Lewis MD, et al. Gsα signalling suppresses PPARγ2 generation and inhibits 3T3L1 adipogenesis[J]. J Endocrinol, 2009, 202(2):207-215.
[11]溫宇,王宏偉,盧慧玲,等. 脂肪酸誘導的3T3-L1脂肪細胞胰島素抵抗的研究[J]. 中國病理生理雜志, 2007, 23(3):543-547.
[12]Ping J, Jie M, Feng B, et al. FFA-Induced adipocyte inflammation and insulin resistance: involvement of ER stress and IKK070705 pathways[J]. Obesity, 2011, 19(3):483-491.
[13]Cua IH, Hui JM, Bandara P, et al. Insulin resistance and liver injury in hepatitis C is not associated with virus-specific changes in adipocytokines[J]. Hepatol, 2007, 46(1):66-73.
[14]Sun WL, Chen LL, Zhang SZ, et al. Inflammatory cytokines, adiponectin, insulin resistance and metabolic control after periodontal intervention in patients with type 2 diabetes and chronic periodontitis[J]. Internal Med, 2011, 50(15):1569-1574.
[15]Vázquez-Carballo A, Ceperuelo-Mallafré V, Chacón MR, et al. TWEAK prevents TNF-α-induced insulin resistance through PP2A activation in human adipocytes[J]. Am J Physiol Endocrinol Metab, 2013, 305(1):101-102
[16]El-Shal AS, Pasha HF, Rashad NM, et al. Association of resistin gene polymorphisms with insulin resistance in Egyptian obese patients[J]. Gene, 2013, 515(1):233-238.
[17]Yadav A, Kataria MA, Saini V, et al. Role of leptin and adiponectin in insulin resistance[J]. Clini Chim Acta, 2013, 417(18):80-84.
[18]Zhang Y, Moerkens M, Ramaiahgari S, et al. Elevated insulin-like growth factor 1 receptor signaling induces antiestrogen resistance through the MAPK/ERK and PI3K/Akt signaling routes[J]. Breast Cancer Res, 2011, 13:(3): R52.
[19]Zeng XQ, Zhang CM, Tong ML, et al. Knockdown of NYGGF4 increases glucose transport in C2C12 mice skeletal myocytes by activation IRS-1/PI3K/AKT insulin pathway[J]. J Bioenergetics Biomembranes, 2012, 44(3):351-355.
[20]Panzhinskiy E, Ren J, Nair S, et al. Pharmacological inhibition of protein tyrosine phosphatase 1B: a promising strategy for the treatment of obesity and type 2 diabetes mellitus[J]. Curr Med Chem, 2013, 20(21):2609-2625.
(責任編輯: 陳妙玲, 余小慧)
Total triterpenoids fromPsidiumGuajavaleaf improves insulin resistance in 3T3-L1 adipocytesLI Xiu-cun1, MA Jin-jin1, Zhao jing-jing2, YE Kai-he1, Lü Yan-qing1, WANG Xiao-kang1, WEI Song-cheng1, ZHANG Xiao-qi3, YE Chun-ling1
(1DepartmentofPharmacology,PharmacyCollege,JinanUniversity,Guangzhou510632,China;2PharmacyDepartment,GuangdongWomenandChildren’sHospital,Guangzhou511400,China;3InstituteofTraditionalChineseMedicineandNaturalMedicine,JinanUniversity,Guangzhou510632,China.E-mail:yechunling2005@163.com)
[ABSTRACT]AIM: To investigate the effects of total triterpenoids fromPsidiumguajavaleaf (TTPGL) on 3T3-L1 adipocyte insulin resistance (IR) and to explore the possible mechanism. METHODS: 3T3-L1 pre-adipocytes were cultured and induced to differentiate into 3T3-L1 adipocytes, then treated with TTPGL (0.3, 1, 3, 10 μg/L) for 48 h. The cells were divided into 0.1% DMSO group, positive drug sodium orthovanadate (Van, 10 μmol/L) group, model group and control group. The effect of TTPGL on the cell activity of pre-adipocytes was detected by MTT assay and its influence on the cellular differentiation was observed by oil red O staining. The IR model of the 3T3-L1 adipocytes was established successfully and then treated with different drugs for 48 h. The glucose consumption in the supernatant of IR adipocyte’s culture medium was assayed by glucose oxidase-peroxidase (GOD-POD), free fatty acid (FFA) levels were measured by colorimetric method, and adipocytokines levels were assayed by ELISA. The mRNA expression of protein tyrosine phosphatase-1B (PTP1B) of IR adipocyte was detected by real-time PCR. The protein levels of phosphorylated insulin receptor substrate 1/insulin receptor substrate 1 (p-IRS-1/IRS-1) and phosphorylated protein kinase B/protein kinase B (p-Akt/Akt) were determined by Western blot. RESULTS: Compared with DMSO group, TTPGL treatment significantly promoted the cell activity of 3T3-L1 pre-adipocytes and inhibited its differentiation (P<0.01). TTPGL (1~10 μg/L) improved glucose consumption of IR adipocytes significantly (P<0.01), with or without insulin stimulation, and TTPGL (0.3~3 μg/L) restrained FFA production remarkably(P<0.01). Compared with model group, TTPGL (0.3 and 3 μg/L) significantly increased the secretion of adiponectin in IR adipocytes (P<0.05), and inhibited the secretion of tumor necrosis factor-α (TNF-α) (P<0.01). TTPGL (3 μg/L) restrained the secretion of resistin significantly (P<0.05), and showed no significant effect on secretion of leptin. It also down-regulated the mRNA expression of protein tyrosine phosphates 1B (PTP1B) in IR adipocytes significantly (P<0.01), and increased the protein levels of p-IRS-1/IRS-1. TTPGL (0.3 and 3 μg/L) up-regulated the protein level of p-Akt/Akt in IR adipocytes significantly (P<0.05).CONCLUSION: TTPGL reduces IR in 3T3-L1 adipocytes. The mechanism may be that TTPGL significantly down-regulated mRNA expression of PTP1B and increased the protein levels of p-IRS-1/IRS-1 and p-Akt/Akt in IR adipocytes.
[KEY WORDS]Total triterpenoids fromPsidiumguajavaleaf; Insulin resistance; Protein tyrosine phosphatase 1B; Insulin receptor substrate 1; Protein kinase B
doi:10.3969/j.issn.1000- 4718.2016.02.021
[中圖分類號]R285; R363; R965.2
[文獻標志碼]A
通訊作者△Tel: 020-85223843; E-mail: yechunling2005@163.com
*[基金項目]廣東省高等學校科技創新重點項目(No. cxzd1111)
[收稿日期]2015- 06- 29[修回日期] 2015- 12- 22
[文章編號]1000- 4718(2016)02- 0314- 07

