CXCL16缺失緩解STZ誘導的糖尿病小鼠的腎臟病變*
趙樂萍, 金雷鋼, 施立華, 張賽賽, 潘薛波, 林灼鋒, 龔方華△
(溫州醫科大學1附屬樂清醫院,2藥學院,浙江 溫州 325035)
?
CXCL16缺失緩解STZ誘導的糖尿病小鼠的腎臟病變*
趙樂萍1,金雷鋼2,施立華2,張賽賽2,潘薛波2,林灼鋒2,龔方華2△
(溫州醫科大學1附屬樂清醫院,2藥學院,浙江 溫州 325035)
[摘要]目的: 探索CXCL16基因缺失對鏈脲佐菌素(STZ)引發的糖尿病小鼠腎臟病變的影響。方法: 選取8周齡雄性C57BL/6JCXCL16基因缺失(C16 KO)小鼠,以及相同年齡及背景的野生型(WT)小鼠,采用STZ誘導的方式,建立糖尿病小鼠模型,觀察CXCL16基因缺失對糖尿病腎病發生發展的影響。結果: 在糖尿病病變方面,與STZ處理的WT小鼠相比,STZ誘導C16 KO糖尿病小鼠的空腹血糖顯著降低,并且其葡萄糖耐受能力得到顯著改善。在糖尿病引發的腎臟病變方面,STZ處理后,C16 KO糖尿病小鼠的尿蛋白量顯著低于WT糖尿病小鼠,此外,C16 KO糖尿病小鼠的腎小球損傷也明顯低于WT糖尿病小鼠。與此同時,與WT糖尿病小鼠相比,C16 KO糖尿病小鼠腎臟組織活性氧簇(ROS)、丙二醛(MDA)、氧化低密度脂蛋白(ox-LDL)水平及凝集素樣氧化低密度脂蛋白受體 1(Lox-1)的mRNA表達水平均顯著下調。此外,在STZ處理后,C16 KO糖尿病小鼠腎組織中的巨噬細胞移動抑制因子(MIF)、炎癥因子TNF-α 和IL-6以及黏附因子ICAM-1和CXCL1的mRNA表達水平均顯著低于WT糖尿病小鼠。結論:CXCL16基因缺失能顯著抑制STZ誘導的糖尿病小鼠腎臟病變。
[關鍵詞]CXCL16基因; 糖尿病腎病; 基因缺失
糖尿病(diabetes mellitus,DM)是一種威脅全人類健康的疾病,是當今醫學界的3大頑癥之一,其引發的各種并發癥是導致老年人群致殘及致死的最主要原因。糖尿病性腎病(diabetic nephropathy,DN) 是糖尿病患者合并有腎小球硬化、腎動脈硬化及腎盂腎炎的合稱,是糖尿病的主要并發癥之一,也是糖尿病的重要致死原因之一。早期的研究表明,糖尿病性腎病的發病率占糖尿病患者的30% 以上,發病年齡以40歲以上者較為顯著,發病高峰在糖尿病后15年左右。目前,多數專家認為該病的發病進展階段包括:(1) 腎臟肥大和高濾過狀態;(2) 正常蛋白尿; (3)早期DN;(4) 顯性DN;(5) 腎衰竭。由于該病起病隱匿,易被漏診或誤診而延誤治療,且其預后惡劣,患者多死于尿毒癥,臨床尚無特效治療方法[1]。因此,DN的早期診斷與治療,顯得尤為重要。目前,DN的診斷主要根據臨床癥狀的表現(如水腫、皮膚黏膜蒼白、視物模糊、血壓升高等)和實驗室的檢查(其中包括蛋白尿、腎功能等)來確定[2]。然而,這些診斷均未能及時反映DN病情發生發展的狀況。此外,有研究認為,遺傳易感性及高血糖(環境因素)是DN發生的啟動因素,它們間的相互作用導致DN的發生與發展[3]。但由于DN的病因和發病機制相當復雜,至今尚有許多問題未能完全闡明。因此,探索新型的生物標記物對探索與DN病情發生發展相關的新型標記,對監測和預警DN的發生發展以及探索其具體的發病機制均具有重要的臨床價值和意義。
趨化因子CXCL16是一個跨膜分子,并具有受體的功能被命名為磷脂酰絲氨酸和氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的清道夫受體[4]。趨化因子CXCL16參與炎癥和免疫應答過程[5]。早期的研究發現,CXCL16在包括冠心病(coronary heart disease,CHD)、慢性腎臟病(chronic kidney disease,CKD)等多種疾病的發病過程中扮演著重要的角色[6-7],CHD和CKD是糖尿病的2個主要并發癥。因此,CXCL16是否直接參與調節糖尿病及其相關并發癥的發生發展還有待進一步深入研究。本文采用CXCL16 基因敲除 (CXCL16 gene knockout,C16 KO)小鼠糖尿病模型,探索CXCL16基因缺失對DN發生發展的影響。
材料和方法
1動物與材料
1.1動物C16 KO小鼠由首都醫科大學安貞醫院杜杰教授惠送。C57BL/6J野生型(wild- type,WT)小鼠由北京維通利華實驗技術有限公司提供。為消除C16 KO與WT小鼠的遺傳差異,C16 KO與野生型WT小鼠進行雜交,經過5~6代的雜交篩選,獲得具有相同遺傳背景的C16 KO與WT小鼠進行實驗研究。所有小鼠均飼養在溫州醫科大學SPF級別的動物實驗中心。
1.2材料血糖試紙購于Roche;尿蛋白、甘油三酯、膽固醇生化試劑盒購于南京建成生物工程研究所;蘇木素伊紅(HE)染色試劑盒購于碧云天生物技術公司;鏈脲佐菌素(streptozocin,STZ)和活性氧簇(reactive oxygen species,ROS)的熒光檢測試劑二氫乙啶(dihydroethidium,DHE)購于Sigma;丙二醛(malondialdehyde,MDA)檢測試劑盒購于碧云天生物技術公司;ox-LDL ELISA Kit購于聯世生物科技有限公司;抽提小鼠腎臟總RNA的TRIzol試劑、cDNA的逆轉錄試劑盒及相關引物購自Invitrogen。
2方法
2.1動物處理將8~9周齡雄性C16 KO隨機分成2組,一組給予45 mg/kg的STZ進行腹腔注射,另外一組給予安慰劑處理作為對照組。同時取年齡相同的WT雄性小鼠,隨機分成2組后分別給予同樣劑量的STZ及安慰劑進行處理。STZ注射3 d后,空腹血糖高于16.7 mmol/L即確定為糖尿病。本實驗中,成功構建C16 KO小鼠DN模型8只,WT小鼠DN模型成功7只。STZ注射后,每周檢測小鼠體重變化狀況,在第12周檢測各組小鼠的空腹血糖值、24 h尿蛋白量之后處死動物、收集血樣及腎臟組織,采用邁瑞全自動生化分析儀檢測血清中的甘油三酯和總膽固醇水平,觀察腎臟損傷狀況。
2.2靜脈葡萄糖耐量試驗(intravenous glucose tole-rance test,IGTT)在STZ注射7周后進行,將上述4組動物在前1天下午5點禁食前稱重,禁食至次日上午8時,按2 g/kg的劑量腹腔注射葡萄糖,分別檢測0、10、30、60和120 min的血糖值。
2.3HE染色將各組小鼠腎臟通過甲醛固定后進行石蠟包埋,切片,采用HE染色法進行腎臟組織染色,觀察腎臟形態學的變化。
2.4ROS的DHE染色將各組小鼠的組織切片經過二甲苯、梯度乙醇脫蠟以后,PBS清洗2次,暗室條件下滴加DHE染色液30 min后脫水固定封片。
2.5MDA檢測將各組小鼠的腎臟組織裂解、勻漿取上清液,按照BCA法利用酶標儀檢測勻漿濃度,參照MDA試劑盒檢測吸光度。
2.6ox-LDL的ELISA檢測將約100 mg腎組織加入到100 mL PBS溶液中,勻漿取上清,-20 ℃過夜,反復凍融2次,使細胞膜破碎,5 000×g離心5 min,按ELISA試劑盒檢測相關濃度。
2.7Real-time PCR檢測腎臟相關基因的表達RNA抽提和逆轉錄等具體方法均按操作說明進行。用于real-time PCR擴增的引物序列見表1。

表1 Real-time PCR的引物序列
F: forward; R: reverse.
3統計學處理
采用GraphPad統計軟件對數據進行分析。統計值以均數±標準差(mean±SD)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用最小顯著性差異法(LSD法),以P<0.05為差異有統計學意義。
結果
1CXCL16缺失對STZ誘導糖尿病病變小鼠體重變化的影響
STZ注射后第3天,C16 KO小鼠有8只空腹血糖量高于16.7 mmol/L,WT小鼠有7只小鼠的空腹血糖量高于16.7 mmol/L,達到糖尿病的血糖標準(本部分數據未提供)。在實驗過程中,對照組的WT小鼠及C16 KO小鼠的體重均逐漸升高,但兩組間差異無統計學意義;而STZ誘導糖尿病病變過程中,野生型小鼠及C16 KO小鼠體重的差異無統計學意義,見表2。
表2各組小鼠體重、空腹血糖、24 h尿蛋白、甘油三酯和總膽固醇含量的變化
Table 2.The changes of body weight, fasting blood glucose (FBG), 24 h urinary protein, triglycerides (TG) and total cholesterol (TC) among wild- type (WT) andCXCL16 knockout (C16 KO) mice treated with or without STZ (Mean±SD)

AnimalTreatmentnBodyweight(g)FBG(mmol/L)24hurinaryprotein(μmol/24h)TG(mmol/L)TC(mmol/L)WTVehicle830.2±0.64.8±1.00.30±0.060.36±0.281.78±0.29STZ725.8±0.7*22.6±2.3*11.32±0.09*1.26±0.45*2.85±0.68*C16KOVehicle831.2±0.34.6±1.10.25±0.030.35±0.211.66±0.27STZ826.3±0.6*17.8±1.6*#9.36±0.03*#1.17±0.38*2.55±0.57*
*P<0.05vsvehicle;#P<0.05vsWT.
2CXCL16缺失對小鼠空腹血糖、24 h尿蛋白、甘油三酯和總膽固醇水平的影響
如表2所示,STZ造模12周后,與注射檸檬酸緩沖液的對照組小鼠相比,STZ處理組的WT和C16 KO小鼠的空腹血糖、24 h尿蛋白、甘油三酯和總膽固醇水平均顯著上調(P<0.05)。此外,在STZ處理的WT和C16 KO小鼠之間,C16 KO小鼠空腹血糖和24 h尿蛋白的上升幅度則顯著低于WT小鼠(P<0.05)。
3CXCL16缺失增強STZ誘導糖尿病小鼠的葡萄糖耐受能力
2組小鼠在注射葡萄糖后血糖濃度持續上升,且在120 min時依然處于較高水平,且C16 KO小鼠的血糖水平始終要低于WT小鼠,其糖耐受的曲線下面積亦顯著低于WT小鼠(P<0.05),該結果也預示了CXCL16基因缺失可能具有改善葡萄糖耐量的作用,見圖1。
4CXCL16缺失緩解STZ誘導糖尿病小鼠的腎臟損傷
在檸檬酸緩沖液注射的對照組小鼠中,WT及C16 KO小鼠腎小球形態完整,未發生明顯的病理變化。在STZ誘導糖尿病腎病小鼠模型中,與C16 KO小鼠相比較,WT小鼠的腎小球出現肥大現象,此外基膜也明顯增厚,并出現系膜溶解現象,見圖2。
5CXCL16缺失降低STZ誘導糖尿病小鼠腎臟組織的氧化應激壓力
STZ誘導的WT及C16 KO糖尿病小鼠腎臟組織中ROS的含量明顯增加。然而,與WT小鼠相比較,C16 KO小鼠腎臟中ROS的升高水平顯著低于WT小鼠,見圖3。

Figure 1.Glucose tolerance curve (A) and the area under glucose tolerance curve (B) in WT and C16 KO mice treated with or without STZ. Mean±SD.n=4.*P<0.05vsWT.
圖1葡萄糖耐受量曲線及其葡萄糖耐受量曲線下面積
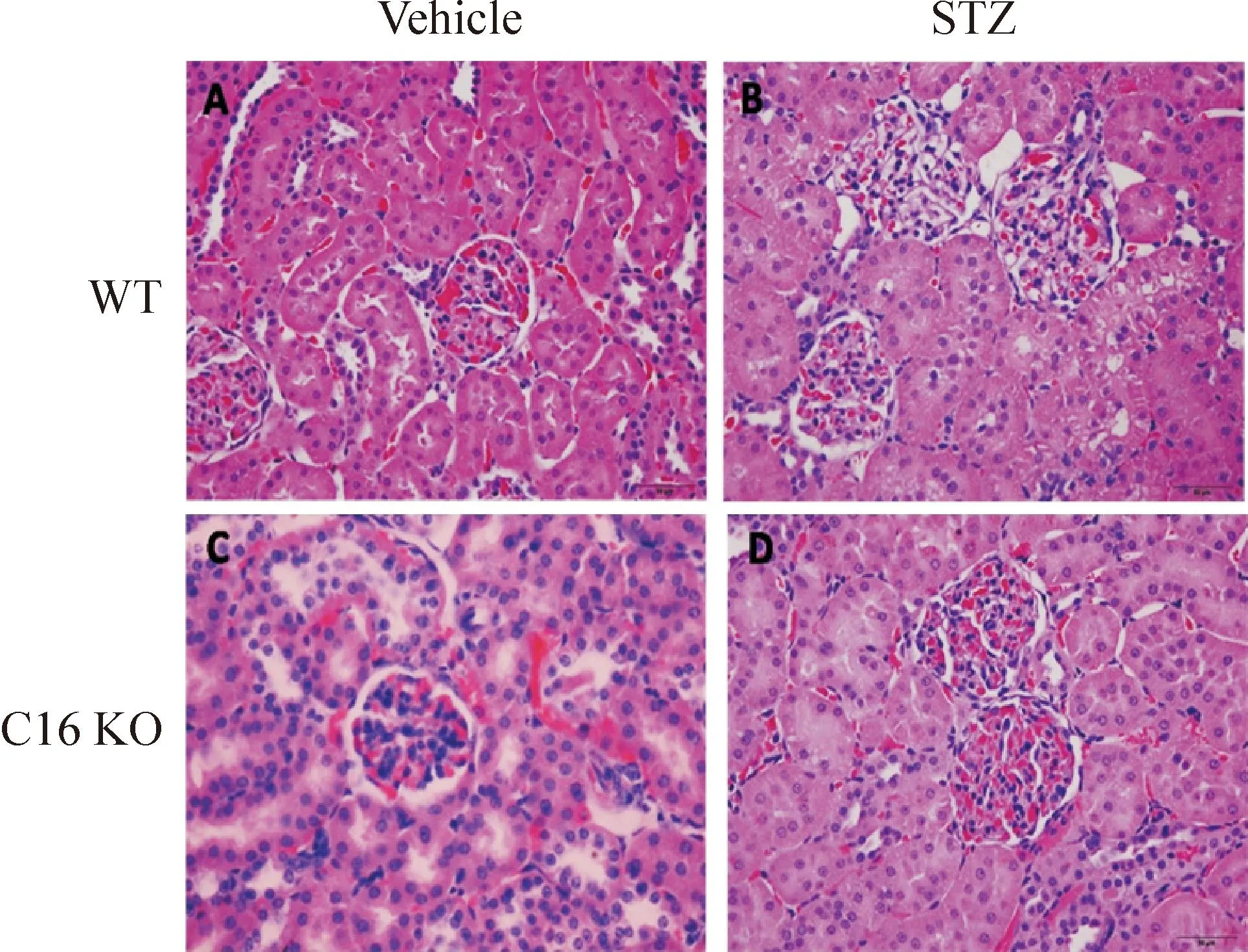
Figure 2.HE staining analysis of kidney sections in WT and C16 KO mice after STZ or vehicle injection (×400).
圖2WT小鼠和C16 KO小鼠注射STZ或vehicle后的腎組織HE染色圖
此外,MDA的檢測結果也表明,在STZ誘導的糖尿病小鼠中,小鼠腎臟組織MDA含量顯著上升;然而,與WT小鼠相比,C16 KO糖尿病腎病小鼠腎臟組織中的MDA水平明顯低于WT小鼠(P<0.01)。STZ誘導的糖尿病小鼠腎臟組織的ox-LDL含量大幅度上升;然而,與WT小鼠相比,CXCL16基因缺失明顯降低小鼠腎臟組織的ox-LDL含量(P<0.01)。此外,real-time PCR檢測也獲得了相類似的結果,即STZ誘導的糖尿病小鼠腎臟組織Lox-1 的mRNA表達水平顯著上升,但CXCL16基因缺失小鼠的Lox-1表達水平上調幅度明顯低于WT小鼠(P<0.05),見圖4。
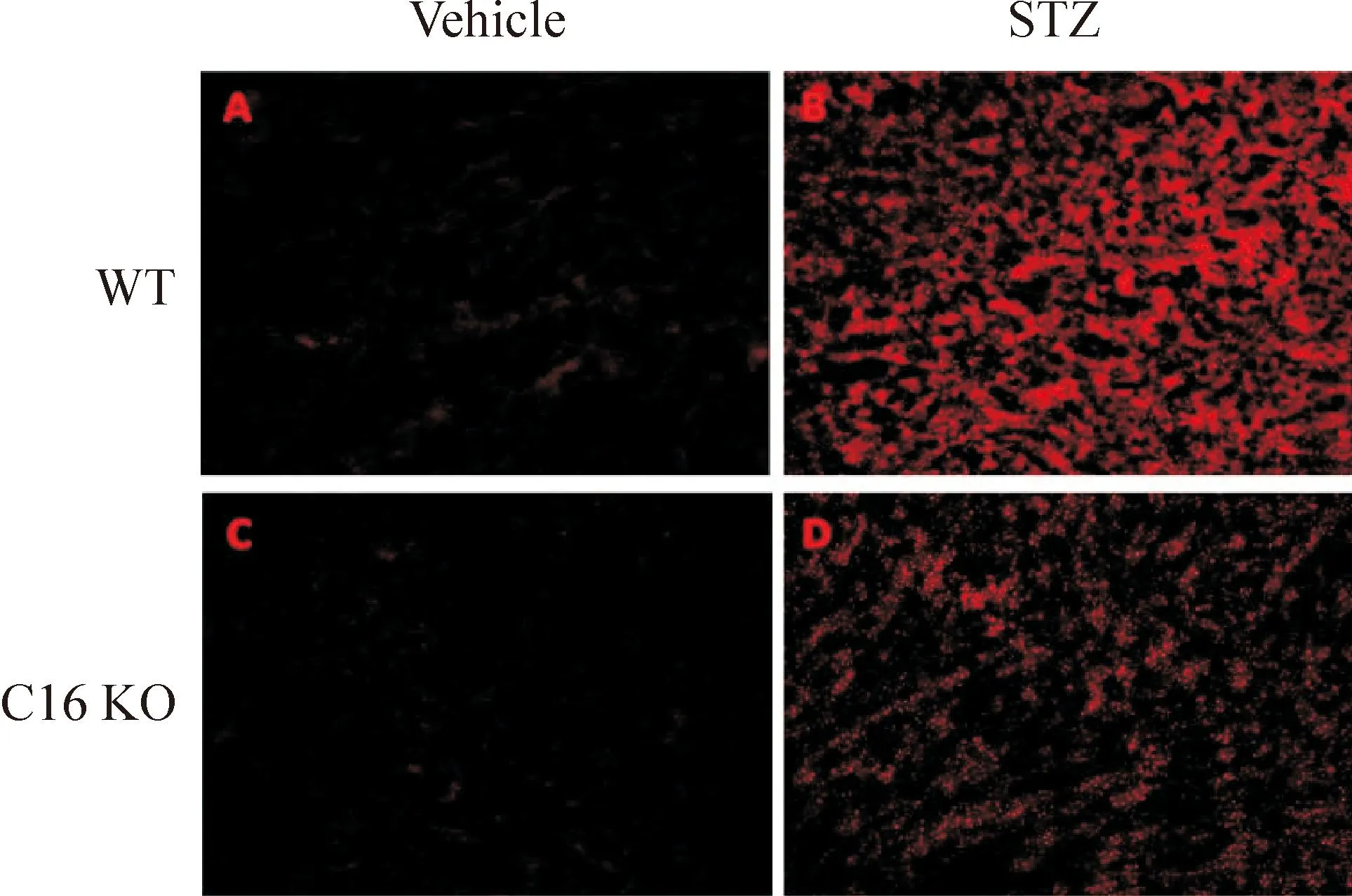
Figure 3.DHE staining analysis of ROS production in WT and C16 KO mice after STZ or vehicle injection (×200).
圖3WT小鼠和C16 KO小鼠注射STZ或vehicle后腎臟中DHE染色檢測ROS
6CXCL16缺失抑制STZ誘導糖尿病小鼠腎臟組織炎癥因子的表達
在STZ誘導的糖尿病小鼠腎臟組織中,MIF的mRNA表達水平迅速上調(P<0.01);與此同時,TNF-α和IL-6表達水平也顯著上調。然而,這些細胞炎癥因子在C16 KO小鼠腎臟組織中的上調幅度則明顯低于WT小鼠,見圖5。
7CXCL16缺失抑制STZ誘導糖尿病小鼠腎臟組織細胞黏附因子的表達
小鼠腎臟組織中ICAM-1和CXCL1的mRNA表達水平在STZ誘導的糖尿病小鼠腎臟組織顯著上調;而CXCL16基因的缺失則明顯抑制這些黏附因子的表達,見圖6。

Figure 4.The levels of MDA (A) and ox-LDL (B), and mRNA expression of Lox-1 (C) in mouse kidney. Mean±SD.n=4.*P<0.05,**P<0.01vsWT mice.
圖4小鼠腎臟中MDA、 ox-LDL水平以及Lox-1的mRNA表達情況.
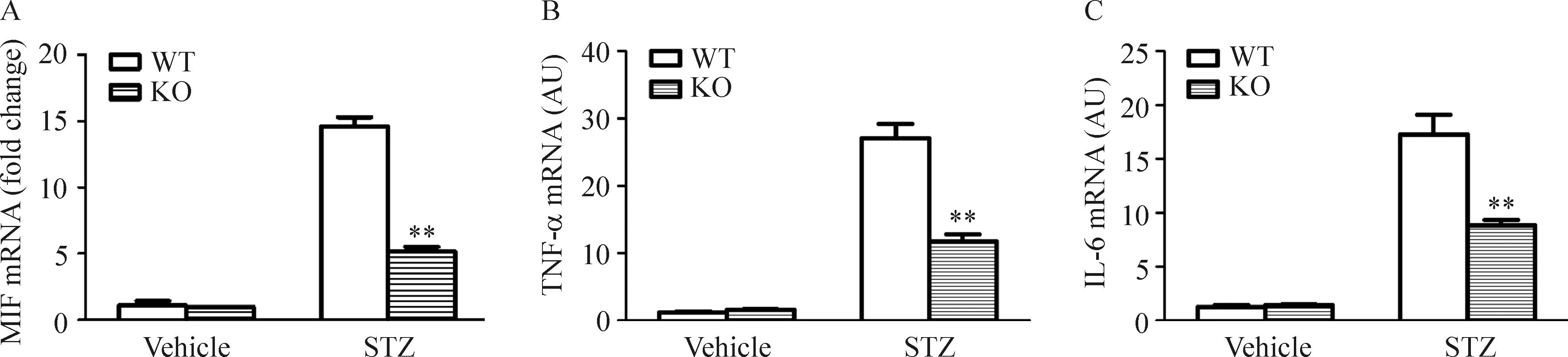
Figure 5.The mRNA expression of MIF (A), TNF-α (B) and IL-6 (C) in mouse kidney. Mean±SD.n=4.**P<0.01vsWT mice.
圖5小鼠腎臟MIF、TNF-α及IL-6 的mRNA表達水平
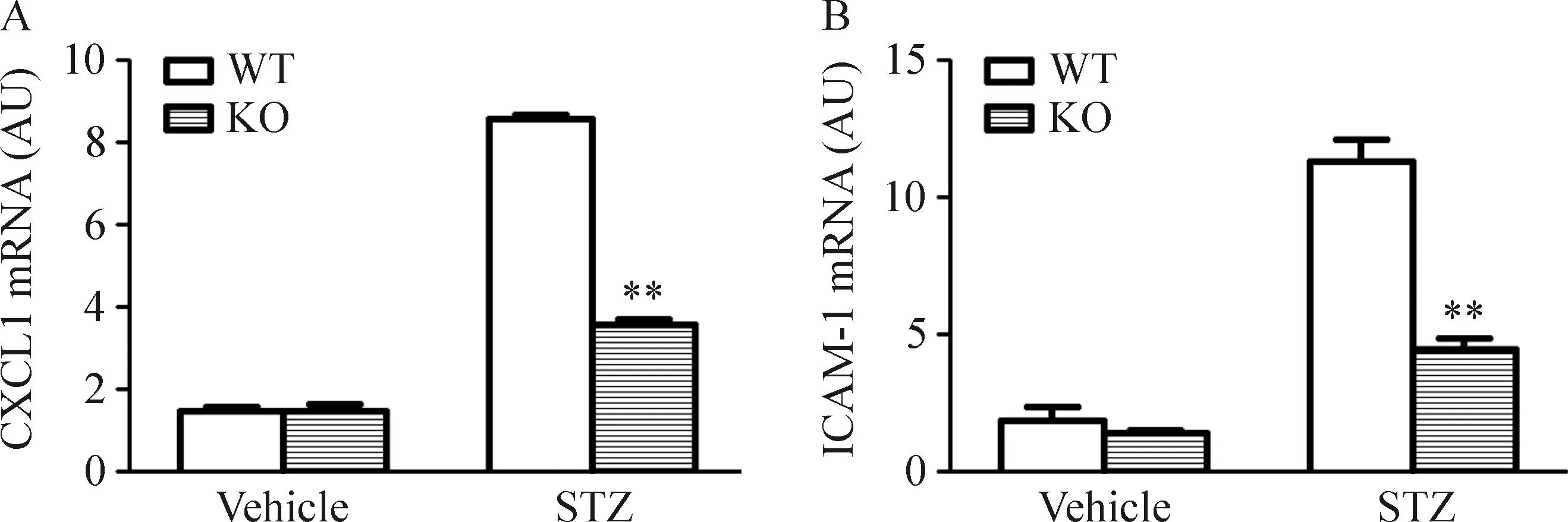
Figure 6.The mRNA expression of CXCL1 (A) and ICAM-1 (B) in mouse kidney. Mean±SD.n=4.**P<0.01vsWT mice.
圖6小鼠腎臟CXCL1和ICAM-1的 mRNA表達水平
討論
DN是糖尿病發生發展過程中常見的慢性并發癥之一,嚴重的甚至會導致腎功能衰竭。伴隨著糖尿病發病趨勢的日益上升,DN在糖尿病患者中的發病比例也在逐年增加,而使其成為了糖尿病致死的主要因素。DN的發病過程會導致腎小球肥大硬化、小管間質纖維化等,繼而損害正常的腎結構改變,使腎功能喪失[8]。由于DN是機體多因素綜合作用的結果,因而其相關的發病機制至今尚未探明。
CXCL16是主要由免疫細胞產生的趨化因子,同時也是機體的清道夫受體。早期研究發現,CXCL16在動脈粥樣硬化的發病扮演著重要的角色[9]。作為清道夫受體,CXCL16可以介導巨噬細胞吞噬ox-LDL,形成泡沫細胞,促進動脈粥樣硬化的發生[10]。在機體內,CXCL16通過與配體結合,引發細胞吞噬ox-LDL,激活炎癥反應等一系列反應,從而促進動脈粥樣硬化的發生發展[11]。此外,基因敲除小鼠實驗結果顯示:CXCL16是一個動脈粥樣硬化的促進因子,在動脈粥樣硬化發展過程中發揮著至關重要的作用[12]。最近研究發現,CXCL16與急性冠脈綜合征患者死亡率密切相關,可能是急性冠狀動脈綜合征新的生物標記[13]。
動物研究發現,CXCL16在高膽固醇血癥導致的嚴重腎損傷,以及單側輸尿管梗阻(單側輸尿管結扎)誘導產生ox-LDL的過程中扮演著重要的角色[14]。作為ox-LDL的趨化因子受體,CXCL16在原發性腎小球疾病引發的腎病中尤其是膜性腎病[15]存在較多表達。我們的前期研究發現,CXCL16與糖尿病腎病的發生發展也存在密切的關系[16]。在Ⅱ型糖尿病患者中,CXCL16的表達水平并未出現明顯上調,但在慢性腎病及糖尿病腎病患者中顯著升高;同時糖尿病腎病患者的CXCL16血清水平要明顯高于單純慢性腎病患者,并與患者的腎功能損害存在密切的關系[16],提示CXCL16與糖尿病腎病的發生發展存在著某種特別的關系。
在本項目研究過程中,我們采用基因敲除的模式,探索CXCL16基因缺失與糖尿病腎病發生發展之間的關系。結果顯示CXCL16基因缺失小鼠顯著抑制了STZ誘導的糖尿病小鼠的腎臟病變狀況,CXCL16基因缺失后,STZ誘導的糖尿病小鼠的空腹血糖及24 h蛋白尿量均明顯降低,同時,小鼠的葡萄糖耐受能力也有顯著改善。此外,組織形態學染色也發現,CXCL16基因缺失顯著改善STZ誘導糖尿病小鼠的腎小球病變。這些結果說明CXCL16基因在糖尿病腎病發病中具有明顯的促進作用。早期的研究發現,糖尿病腎病發病主要集中在腎臟足細胞中的病變[17]。在高糖環境的刺激下,機體細胞內產生大量ROS,進而引發LDL被氧化成ox-LDL。這些ox-LDL在CXCL16作用下,引發腎臟組織相關細胞對ox-LDL的攝取,從而造成腎臟損傷。我們將WT小鼠和C16 KO小鼠成功構建成DN模型后,C16 KO小鼠腎臟中ox-LDL的表達水平相比于WT小鼠明顯降低,提示CXCL16基因的缺失降低了腎臟對ox-LDL的攝取能力,從而緩解了糖尿病引發腎臟損傷的病變狀況。與此同時,ox-LDL的下游效應因子巨噬細胞移動抑制因子的表達水平在C16 KO小鼠中顯著降低,這或許直接或間接地緩解了腎臟組織中相關炎癥因子和細胞浸潤因子的表達,從而緩解高血糖對腎臟細胞損傷的發生發展。
綜上所述,CXCL16在糖尿病腎病發病中扮演著重要角色,CXCL16基因的缺失能有效緩解糖尿病腎病的發生發展。這為開發新型的糖尿病腎病藥物提供了靶點及思路。
[參考文獻]
[1]李克蘭. 糖尿病性腎病的早期診斷與治療[J]. 吉林醫學, 2007, 28(7):934.
[2]趙曉霞. 糖尿病性腎病的診斷與治療進展[J]. 醫學理論與實踐, 2010, 23(7):795-797.
[3]王有德. 糖尿病腎病發病機制的研究進展[J]. 當代醫學, 2010, 16(7):36-40.
[4]Matloubian M, David A, Engel S, et al. A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J]. Nat Immunol, 2000, 1(4):298-304.
[5]胡要, 全智華, 劉江華. 趨化因子CXCL16研究新進展[J]. 醫學綜述, 2010, 16(8):1140-1143.
[6]李定良. 冠心病患者CXCL16的水平測定及臨床意義[D].南寧: 廣西醫科大學, 2011.
[7]Lin Z, Gong Q, Zhou Z, et al. Increased plasma CXCL16 levels in patients with chronic kidney diseases[J]. Eur J Clin Invest, 2011, 41(8):836-845.
[8]Zhu SS, Ren Y, Zhang M, et al.WldSprotects against peripheral neuropathy and retinopathy in an experimental model of diabetes in mice[J]. Diabetologia, 2011, 54(9): 2440-2450.
[9]呂永青, 卜培莉. CXCL16與動脈粥樣硬化的研究關系[J]. 中國實用醫藥, 2009, 4(9):60-62.
[10]Ludwig A, Weber C. Transmembrane chemokines: versatile ′special agents′ in vascular inflammation[J]. Thromb Haemost, 2007, 97(5):694-703.
[11]陳靜文, 嚴激. CXC趨化因子配體16與冠心病關系的研究進展[J]. 中國實用醫藥, 2010, 5(9):246-248.
[12]Yi GW, Zeng QT, Mao XB, et al. Overexpression of CXCL16 promotes a vulnerable plaque phenotype in apolipoprotein E-knockout mice[J]. Cytokine, 2011, 53(3):320-326.
[13]王夢非, 孫建輝, 白江濤, 等. CXCL16與急性冠脈綜合征的相關性分析[J]. 中國心血管病研究, 2010, 8(10): 756-760.
[14]左洋洋, 付蕾, 王文健, 等. 清道夫受體:脂質腎損傷的關鍵[J]. 中國腎臟病雜志, 2014,30(2):155-158.
[15]朱曉燕. CXCL16在原發性腎病綜合征中的變化及其臨床意義[D].濟南: 山東大學, 2012.
[16]Zhao L, Wu F, Jin L, et al. Serum CXCL16 as a novel marker of renal injury in type 2 diabetes mellitus[J]. PLoS One, 2014, 9(1):e87786.
[17]Lewko B, Stepinski J. Hyperglycemia and mechanical stress: targeting the renal podocyte[J]. J Cell Physiol, 2009, 221(2): 288-295.
(責任編輯: 陳妙玲, 羅森)
CXCL16 deficiency attenuates STZ-induced diabetic nephropathy in miceZHAO Le-ping1, JIN Lei-gang2, SHI Li-hua2, ZHANG Sai-sai2, PAN Xue-bo2, LIN Zhuo-feng2, GONG Fang-hua2
(1TheAffiliatedYueqingHospital,2SchoolofPharmacy,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:gongwenheng@163.com)
[ABSTRACT]AIM: To explore the effect ofCXCL16 deficiency on streptozocin (STZ)-induced diabetic nephropathy in mice. METHODS:CXCL16 knockout (C16 KO) mice (8 years old) were used to build up diabetes model by treating with STZ.Age- and gender-matched wild-type (WT) C57BL/6J mice treated with STZ were used as control. All mice were fed with chow diets for 12 weeks, and the development of diabetic nephropathy was evaluated. RESULTS: Compared with the WT mice treated with STZ, C16 KO mice treated with STZ presented lower fasting glucose levels and better glucose tolerance power. C16 KO mice treated with STZ also had lower urine protein levels and smaller areas of glomerular injury as compared with WT mice treated with STZ. Furthermore,CXCL16 deficiency decreased the contents of renal reactive oxygen species (ROS), malondialdehyde (MDA) and oxidized low-density lipoprotein (ox-LDL) and the mRNA expression of lectin-like oxidized low-density lipoprotein receptor 1 (Lox-1), and attenuated the expression of renal inflammatory factors including tumor necrosis factor α (TNF-α) and interleukin 6 (IL-6), as well as chemokines including intercellular cell adhesion molecular 1 (ICAM-1) and chemokine C-X-C motif ligand 1 (CXCL1). CONCLUSION:CXCL16 deficiency obviously inhibits the development of STZ-induced diabetic nephropathy in mice.
[KEY WORDS]CXCL16 gene; Diabetic nephropathy; Gene deficiency
doi:10.3969/j.issn.1000- 4718.2016.02.023
[中圖分類號]R363; R587.1
[文獻標志碼]A
通訊作者△Tel: 0577-86699350; E-mail: gongwenheng@163.com
*[基金項目]浙江省自然科學基金資助項目(No. LY12H07002);浙江省大學生科技創新活動計劃(新苗人才計劃)(No. 2014R413066)
[收稿日期]2015- 09- 21[修回日期] 2015- 12- 08
[文章編號]1000- 4718(2016)02- 0327- 06

