肝細胞癌中microRNA-375調控的基因網絡分析*
黃 波, 肖影群△, 羅達亞, 章 萍, 楊仙荷, 鐘青梅, 王 武, 姚 迪
(1南昌大學附屬感染病醫院病理科,江西 南昌 330002;2南昌大學基礎醫學院生物化學與分子生物學教研室,江西 南昌 330006)
?
肝細胞癌中microRNA-375調控的基因網絡分析*
黃波1,肖影群1△,羅達亞2,章萍1,楊仙荷1,鐘青梅1,王武1,姚迪1
(1南昌大學附屬感染病醫院病理科,江西 南昌 330002;2南昌大學基礎醫學院生物化學與分子生物學教研室,江西 南昌 330006)
[摘要]目的: 探討肝細胞癌中miR-375的表達及其調控的相關靶基因和信號通路。方法: 采用原位雜交檢測miR-375在人肝癌組織芯片的表達情況;人全基因組表達譜芯片檢測4株肝癌細胞株;MAS生物信息學軟件篩選miR-375調控靶基因及相關信號通路。結果: 原位雜交結果顯示miR-375在肝癌組織中的表達明顯高于癌旁組織(P<0.05);人全基因組表達譜芯片結果分析顯示4株轉染miR-375的肝癌細胞的共上調基因有20個,共下調基因有17個;MAS生物信息學軟件分析顯示4株轉染miR-375的肝癌細胞共有的上調信號通路有54條,下調信號通路有48條。結論: miR-375與肝細胞癌有密切的關系。對miR-375調控的肝細胞癌相關靶基因與信號通路進行多元化篩選,為后續全面深入的研究肝細胞癌發生發展的機制提供了便利。
[關鍵詞]肝細胞癌; MicroRNA-375; 原位雜交; 基因芯片
MicroRNA(miRNAs)是近來發現的一組19~24個核苷酸組成的非編碼RNA分子,它們與基因表達的調控相關。這些小分子調控的基因參與體內多種生理進程例如細胞增殖、生長、分化、凋亡及其他等。MicroRNA在轉錄后水平調控目的基因的表達,有證據顯示miRNA在胚胎形成、細胞分化及包括腫瘤在內的許多疾病的發病機制中起重要作用[1]。近幾年的研究結果顯示miR-375的表達異常與多種腫瘤的發生發展相關。現有的關于miR-375與肝細胞癌(hepatocellular carcinoma,HCC)的研究多數是著重于miR-375調控的某一個靶基因,如AEG-1、YAP、ATG7等,忽略了與之相關的信號通路及整個基因網絡,使得miR-375的整體調控性不能被充分的認知。為此本課題利用肝癌組織芯片驗證miR-375與HCC的關系,以高通量基因芯片結果為基礎,結合生物信息學軟件,初步篩選miR-375調控的靶基因、相關信號通路和基因網絡,為后續機制研究奠定基礎。
材料和方法
1材料
1.1細胞4株人肝癌細胞HepG2、Huh-7、Li-7和SMMC-7721購于中國科學院細胞庫;細胞培養于含10% 胎牛血清、1×105U/L青霉素和100 mg/L鏈霉素的高糖DMEM完全培養液中,于37 ℃、5% CO2培養箱中培養。
1.2組織芯片人肝癌組織芯片(HLiv-HCC150CS-01)購自上海芯超生物科技有限公司;肝細胞癌患者75例,取癌/癌旁各1點(癌旁組織是指距離癌組織5 cm以上的非癌組織),共150例組織,芯片上的組織均經常規4%甲醛固定并石蠟包埋,5 μm厚度切片,直徑1.5 mm。
2主要方法
2.1肝癌組織芯片的原位雜交檢測按照Exiqon的原位雜交試劑盒miRCURY LNATMmicroRNA ISH Optimization Kit (FFPE)的操作說明進行實驗。實驗步驟:組織芯片脫蠟,蛋白酶K工作液(200 mg/L)37 ℃消化15 min, 0.1 mol/L的甘氨酸/PBS清洗1 min,DEPC-PBS漂洗5 min 2次,梯度乙醇脫水,置于預雜交液于55 ℃孵育30 min,同時將配好的探針雜交工作液90 ℃加熱4 min,置于冰塊10 min,置于探針雜交工作液于55 ℃雜交 1 h, 5×、1×、 0.2×的SSC于55 ℃洗滌各5 min后,切片置于1×washing buffer中室溫洗滌5 min,切片置于1×blocking buffer中室溫封閉15 min,切片置于1×blocking buffer稀釋(1∶800)的Anti-DIG-AP室溫反應1 h,切片置于1×washing buffer中,室溫洗滌10 min 3次,切片置于1×detection buffer中,30 ℃平衡5 min、切片置于1×detection buffer 稀釋(1∶50)的BCIP/NBT儲備液30 ℃黑暗處顯色0.5~1 h,KTBT緩沖液室溫洗滌切片5 min 2次,水洗切片1 min 2次,核固紅復染30 min后封片鏡檢。
2.2細胞轉染肝癌細胞HepG2、HuH-7、Li-7和SMMC-7721每株分為control組和miR-375 mimic組,接種于8個60 mm培養板中,設S1為HepG2 control mimic,S2為HepG2 miR-375 mimic,S3為HuH-7 control mimic,S4為HuH-7 miR-375 mimic,S5為Li-7 control mimic,S6為Li-7 miR-375mimic,S7為SMMC-7721 control mimic,S8為SMMC-7721 miR-375 mimic。細胞轉染按照Invitrogen公司的轉染試劑盒Lipofectamine? 2000操作說明進行實驗。
2.3轉染前后肝癌細胞株總RNA的提取和實時熒光定量PCR檢測總RNA提取實驗操作按照TRIzol試劑盒說明書進行。取2 μg轉染細胞株的總RNA,采用High Capacity cDNA Reverse Transcription Kit(Applied Biosystems)反轉錄為cDNA。按照RT SYBR Green Master Mix (SABiosciences)的操作說明,以U6為內參照,在Light Cycler 480 Ⅱ Instrument(Roche)上行PCR擴增,每個樣品設置3個復孔。U6基因上游引物序列為5’-CTCGCTTCGGCAGCACA-3’,下游引物序列為5’-AACGCTTCACGAATTTGCGT-3’;所有引物均購自Integrated DNA Technologies。
2.4Roche人全基因組表達譜芯片分析提取的轉染后細胞總RNA進行擴增和質量檢測,NimbleGen One-Color DNA Labeling Kit對RNA進行標記,利用NimbleGen Hybridization System進行基因組芯片雜交分析,Axon GenePix 4000B scanner掃描雜交后芯片,NimbleScan 2.5 軟件進行數據收集和標準化,Agilent GeneSpring GX 12.0 軟件對收集的實驗數據進行進一步的分析。
2.5芯片數據與信號通路分析應用Partek Genomic Suites(Partek)對 miRNA及mRNA表達芯片數據進行整理分析。應用TargetScan 6.2軟件篩選miR-375的預測調控靶點,博奧生物有限公司的生物分子功能注釋系統(Molecule Annotation System,MAS)對差異表達基因相關的信號通路及其調控基因進行分析。
3統計學處理
采用SPSS 20.0軟件進行統計學處理,計數資料率的比較采用2檢驗,計量資料組間比較采用t檢驗,以P<0.05為差異有統計學意義。
結果
1MiR-375的組織分析
miR-375主要定位于肝癌細胞胞漿,陽性信號呈藍色或紫藍色顆粒。根據陽性腫瘤細胞數量和陽性程度綜合評判,由兩位有經驗的病理醫生采用雙盲法獨立閱片并評分,具體標準參考文獻施行[2]: 無陽性腫瘤細胞為0分、<10%陽性腫瘤細胞的為1分、有10%~50%陽性腫瘤細胞的為2分、>50%陽性腫瘤細胞的為3分;無顯色者為0分、弱陽性,淡藍色者為1分、中度陽性,藍色者為2分、強陽性,深藍色者為3分。以兩個分數乘積≥6作為陽性表達的界限。由組織芯片可見miR-375在大部分肝癌組織中高表達,在絕大部分癌旁組織中低表達,見圖1~3。

Figure 1.HE staining of tissue microarray (×40). A, B and C were the liver specimens from 3 patients
圖1組織芯片的HE染色
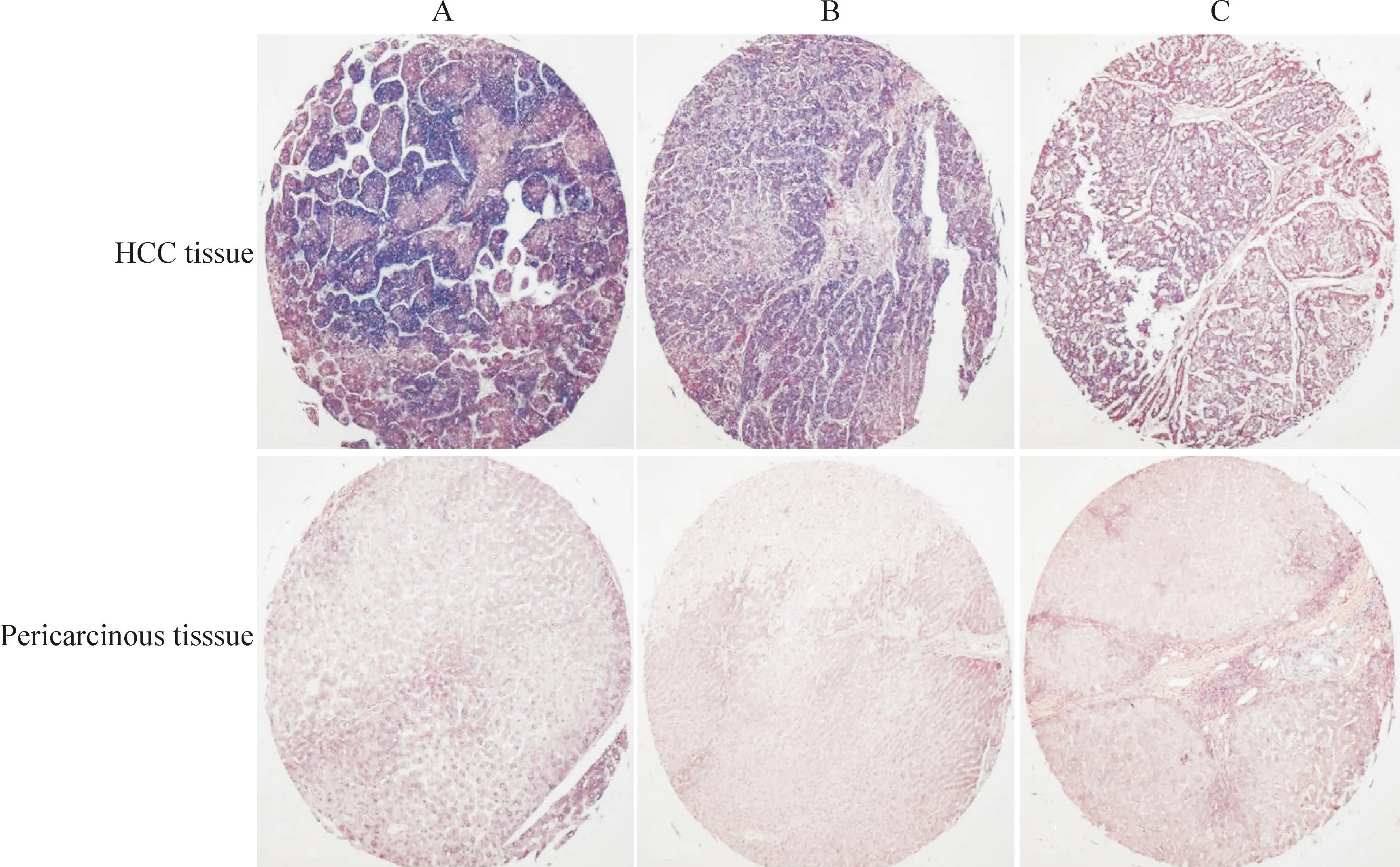
Figure 2.Insituhybridization of miR-375 at tissue microarray (×40). A, B and C were the specimens from 3 HCC patients.
圖2組織芯片的miR-375原位雜交結果(低倍鏡)

Figure 3.Insituhybridization of miR-375 at tissue microarray (×400). A, B and C were the specimens from 3 HCC patients.
圖3組織芯片的miR-375原位雜交結果(高倍鏡)
肝癌組織芯片原位雜交結果顯示,在75例肝癌組織中有41例表達陽性,34例表達陰性;在癌旁組織中,有2例表達陽性,73例表達陰性。miR-375在肝癌組織中的表達明顯高于癌旁組織(P<0.01),與病例年齡、性別、TNM分期及臨床分期無顯著相關性,見表1。
表1肝癌組織芯片miR-375表達與病例臨床病理資料的關系
Table 1.The relationship between the expression of miR-375 and clinicopathologic data.

ParameternTheexpressionofmiR-375PositiveP2Specimens HCCtissue7541(54.67%)<0.0149.587 pericarcinoustissue752(2.67%)Age(year) ≤543918(65.71%)>0.052.376 ≥543623(54.05%)Sex Male6436(56.25%)>0.050.441 Female115(45.45%)Sizeoftumor(cm) ≤54930(61.22%)>0.050.108 ≥52611(42.31%)Clinicalstage(AJCC) 1-2stage4928(57.14%)>0.050.35 3-4stage2613(50.00%)
2miR-375的real-time PCR檢測
以U6為陽性對照檢測miR-375;肝癌細胞(HepG2、Huh-7、Li-7和SMMC-7721)轉染后,miR-375的表達明顯升高,見圖4。
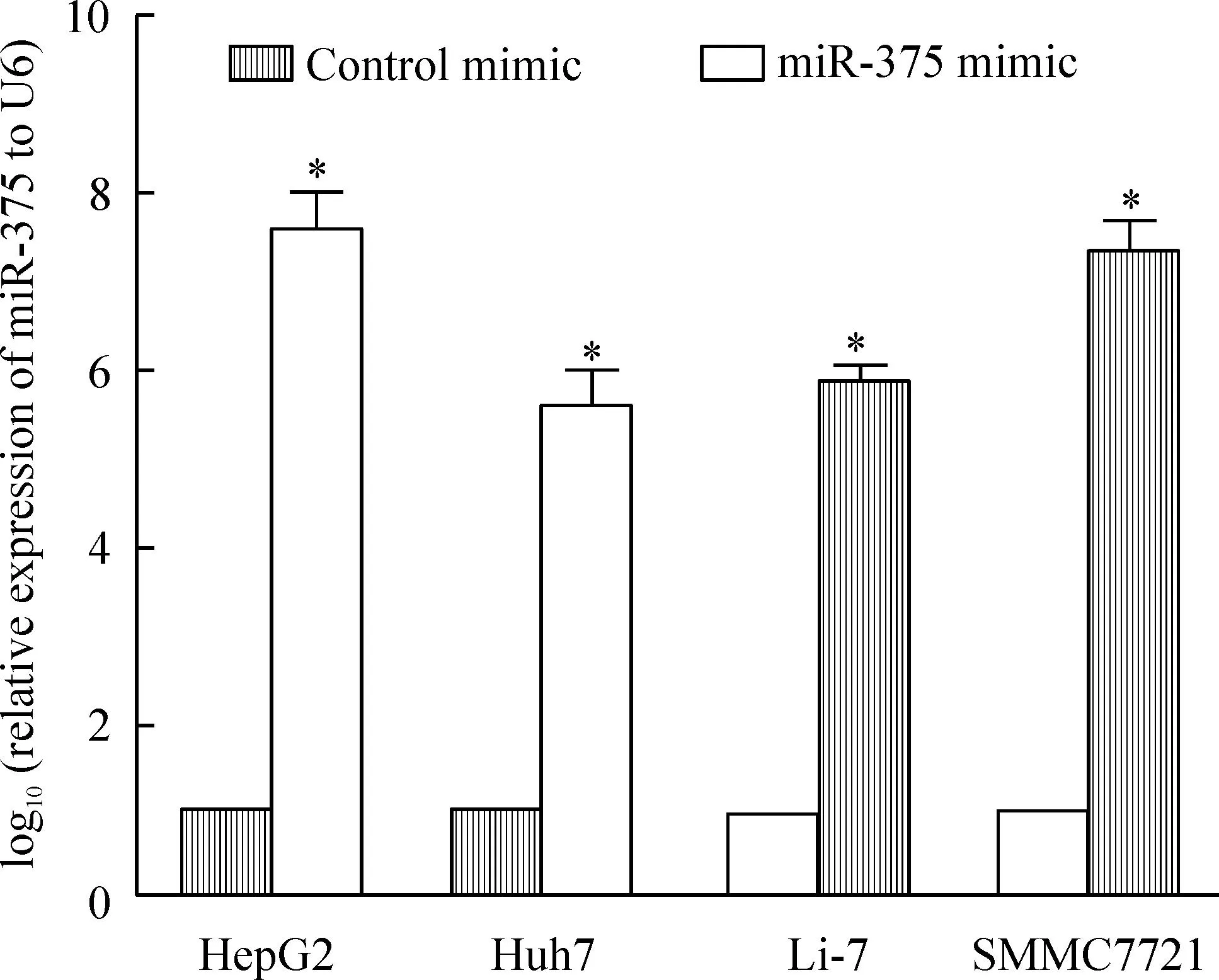
Figure 4.The expression of miR-375 was up-regulated in HCC cell lines after transfected wtih miR-375 mimic. Mean±SD.n=3.*P<0.05vscontrol mimic.
圖4miR-375 mimic轉染后miR-375的表達
3miR-375的人全基因組表達譜芯片檢測
結果顯示,與mimic control轉染組比較,miR-375 mimic轉染的HepG2、Huh-7、Li-7和SMMC-7721細胞株中分別有2 305、424、892和1 050個基因表達上調(倍數值≥2.0);分別有2 162、536、974和998個基因表達下調(倍數值≤-2.0);4個轉染細胞株中的共上調基因有20個,共下調基因有17個,見圖5及表2~3。

Figure 5.Screening of co-expressed genes in HCC cell lines. S1: HepG2 control mimic; S2: HepG2 miR-375 mimic; S3: HuH-7 control mimic; S4: HuH-7 miR-375 mimic; S5: Li-7 control mimic; S6: Li-7 miR-375mimic; S7: SMMC-7721 control mimic; S8: SMMC-7721 miR-375 mimic. A: co-upregulated genes in the 4 HCC cell lines; B: co-downregulated genes in the 4 HCC cell lines.
圖5肝癌細胞株共表達基因篩選
表2 4個肝癌細胞株的共上調基因
4差異表達基因的相關信號通路分析
將前述篩選到差異表達基因輸入MAS生物信息學軟件進行分析,4個細胞株共有的上調相關信號通路有54條,共有的下調相關信號通路下調有48條,見圖6~7。

表3 4個肝癌細胞株的共下調基因

Figure 6.Part of signaling pathways related to up-regulated genes
圖6上調基因相關的部分信號通路
討論
HCC作為常見的惡性腫瘤之一,因缺乏有效的早期診斷方式及治療手段其死亡率一直居高不下[2],關于miR-375與HCC的研究也日愈增多。例如Huang等[4]用miR-25、miR-375和let-7f作為生物標志物,能很明顯的從對照組中區分出HCC,單獨應用miR-375預測HCC時,其特異性為96%,靈敏度為100%;Li等[5]在肝細胞癌標本中發現了6種表達明顯上調的miRNAs,其中的miR-375和miR-92a具有HBV特異性;He等[6]的研究發現miR-375在HCC組織和細胞系中顯著下調,miR-375在肝腫瘤細胞的高表達能抑制細胞的增殖、集落形成、遷移/侵襲并且誘導細胞周期G1停滯和細胞凋亡;Byoung等[7]發現miR-375可通過抑制AEG-1來減弱HCC細胞的遷移侵襲能力; Liu[8]等發現低表達的miR-375通過調控YAP促進HCC的發展;另外,根據Chang等[9]的研究,miR-375在肝癌細胞中的高表達可降低ATG7的表達從而減弱肝癌細胞在低氧條件下的生存能力,使得肝癌細胞的生長速度明顯減慢且更易于發生壞死。由上述可知,現今對miR-375的研究尚無統一定論。
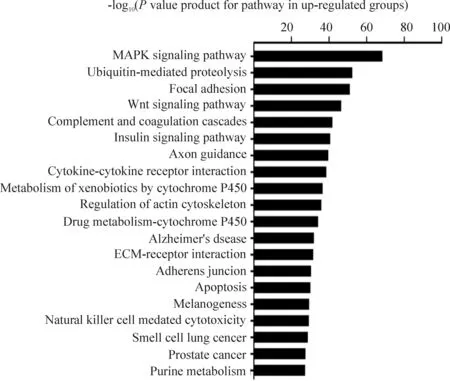
Figure 7.Part of signaling pathways related to down-regulated genes
圖7下調基因相關的部分信號通路
為了進一步探究miR-375與HCC之間的內在聯系,本實驗進行了miR-375的real-time PCR和原位雜交檢測,發現miR-375在肝癌組織中的表達明顯高于癌旁組織,與病例的年齡、性別、腫塊大小及臨床分期無相關性,這可能預示著miR-375僅僅在肝臟癌變過程中起著某種作用,而對肝癌細胞的生長、轉移無影響。“miR-375在肝癌組織中的表達明顯高于癌旁組織”這一實驗結果與前述文獻的一些研究結論有差異。針對這一現象,我們從多個方面進行研究驗證。一是實驗過程,我們是嚴格按照miR-375探針生產公司的操作流程進行,并進行了多次重復實驗;二是實驗條件,在進行了大量的預實驗后,摸索出了最適實驗條件,如蛋白酶K的濃度和消化時間、miR-375探針的濃度和顯色時間等等;三是miR-375探針,我們分別利用了乳腺癌組織、乳腺癌細胞株、肝癌組織和肝癌細胞株進行了大量的實驗驗證,雖然在肝癌組織上其表達情況與部分文獻有差異,但是在乳腺癌上與其它文獻相一致,可以排除探針的問題。根據Li 等[5]的研究,在HBV陽性的血清中,包括miR-375在內的13種miRNAs表達上調,且miR-375具有HBV特異性,可用以區分出HBV組、HCV組和對照組;在HBV陽性的肝癌血清中,包括miR-375在內的6種miRNAs表達顯著上調。因此,我們推測在肝組織中miR-375的表達或許也與HBV感染存在著某種聯系,HBV陽性和陰性的肝癌組織中其miR-375的表達可能存在差異,造成這種差異的原因有待進一步的研究。
現有的大多數HCC與miR-375之間關系的研究都是從單一靶基因入手,這些研究并未把信號通路和相關基因網絡納入研究之中,這或許會使得研究結果有一定的局限性,不利于全面深入的了解HCC發生發展機制,因此本實驗對4個細胞株的差異表達基因進行了初步篩選。其中的部分基因已有了相關研究,Bozkaya等[10]發現MUC1和c-Met在高侵襲性HCC細胞株和HCC組織中高表達,這二者的共表達與HCC的分化程度相關;袁時芳等[11]采用免疫組化方法檢測43例原發性肝癌組織,肝細胞癌34例,膽管細胞癌9例和12例肝硬化及6例正常肝組織中MUC1的表達,發現肝癌組織中可見MUC1強陽性表達,肝硬化病變組織中僅2例可見MUC1弱陽性反應信號,正常肝組織中未見MUC1表達,MUC1在肝癌組織中的陽性表達率與其它兩組肝組織之間差異有統計學意義,而MUC1在肝癌組織中陽性表達與肝癌組織的病理類型和組織學分化無明顯關系。
通過上述差異表達基因結合MAS生物信息學軟件,本實驗篩選出了相關信號通路。這為認識HCC提供了初步方向,也為下一步的機制研究提供了便利。Chen等[12]的研究表明,MSI1在HCC中上調,在肝癌細胞株HepG2中高表達的MSI1能顯著的促進細胞生長、腫瘤形成和細胞周期進程,敲除肝癌細胞株Huh7中的MSI1能極大的抑制細胞生長和腫瘤形成并使細胞周期靜止在G1/S期,激活Wnt信號通路能使MSI1發揮原癌基因的作用從而調控細胞生長和細胞周期;賀松其等[13]發現肝細胞癌的轉移侵襲與Wnt/β-catenin 信號通路密切相關,β-catenin 是Wnt/β-catenin信號傳導途徑中的關鍵調控因子,其表達程度與患者淋巴結轉移及肝內轉移呈正相關,Wnt/β-catenin 信號通路下游轉錄因子T細胞因子4基因表達與肝癌的轉移密切相關,Wnt/β-catenin信號通路成員基因突變和(或)異常表達奠定了肝癌細胞轉移和侵襲的分子學基礎;趙軍艷等[14]用免疫組化SP法檢測肝癌組織芯片,觀察MAPK途徑和JAK-STAT途徑中重要酪氨酸蛋白激酶ERK、p38、c-Jun、JAK、STAT3和STAT5的表達及其相互關系,發現MAPK和JAK-STAT信號通路的過度活化在肝癌發生發展過程中起重要作用;朱虹等[15]通過肝癌細胞實驗結果推測ERK/MAPK信號通路是微環境誘導肝癌產生多藥耐藥的重要胞內信號傳導途徑。
綜上所述,以高通量基因芯片分析結果為基礎,結合生物信息學手段,對miR-375調控的肝細胞癌相關靶基因與信號通路進行多元化篩選,不僅能更全面地認識miR-375的作用機制,也為更準確的地選擇新穎的miR-375調控靶基因提供了可能。在此基礎上,可結合組織水平的免疫組化分析,以能夠更快更精確地把握和驗證miR-375的調控靶基因,為后續全面深入的研究HCC發生發展機制提供了便利,為研發HCC的早期診斷與治療方法奠定理論基礎,同時也為揭示miR-375調控HCC或者其他腫瘤發生發展的機制提供可靠的依據。
[參考文獻]
[1]王寰昱,王亞峰,張昆松,等. 上調miRNA145對肝癌細胞的作用及其機制研究[J]. 中國病理生理雜志, 2015, 31(6):1019-1025.
[2]Tang W, Zhu J, Su S, et al. MiR-27 as a prognostic marker for breast cancer progression and patient survival[J]. PLoS One, 2012, 7(12):e51702.
[3]Braconi C, Henry JC, Kogure T, et al. The role of microRNAs in human liver cancers[J]. Semin Oncol, 2011, 38(6):752-763.
[4]Huang YS, Dai Y, Yu XF, et al. Microarray analysis of microRNA expression in hepatocellular carcinoma and non-tumorous tissues without viral hepatitis[J]. J Gastroenterol Hepatol, 2008, 23(1):87-94.
[5]Li LM, Hu ZB, Zhou ZX, et al. Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocellular carcinoma[J]. Can-cer Res, 2010, 70(23):9798-9807.
[6]He XX, Chang Y, Meng FY, et al. MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo[J]. Oncogene, 2012, 31(28):3357-3369.
[7]Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest, 2009, 119(3):465-477.
[8]Liu AM, Poon RT, Luk JM. MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties[J]. Biochem Biophys Res Commun, 2010, 394(3):623-627.
[9]Chang Y, Yan W, He X, et al. miR-375 inhibits auto-phagy and reduces viability of hepatocellular carcinoma cells under hypoxic conditions[J]. Gastroenterology, 2012, 143(1):177-187.
[10]Bozkaya G, Korhan P, Cokakl M, et al. Cooperative interaction of MUC1 with the HGF/c-Met pathway during hepatocarcinogenesis[J]. Mol Cancer, 2012, 11:64.
[11]袁時芳,王嶺,李開宗,等. MUC1在原發性肝癌和肝硬化組織中的表達及其意義[J]. 中國普通外科雜志, 2003, 12(9):659-662.
[12]Chen K, Gao Q, Zhang W, et al. Musashi1 regulates survival of hepatoma cell lines by activation of Wnt signaling pathway[J]. Liver Int, 2015, 35(3): 986-998.
[13]賀松其,姚飛龍,呂志平,等. Wnt/β-catenin信號通路在肝癌轉移侵襲中的調控機制[J]. 中國實驗方劑學雜志, 2011, 17(7):251-254.
[14]趙軍艷,鄭艷敏. MAPK和JAK-STAT途徑中酪氨酸蛋白激酶在肝癌組織中的表達及意義[J]. 中國組織化學與細胞化學雜志, 2008, 17(4):335-340.
[15]朱虹,陳孝平,羅順峰,等. ERK/MAPK通路參與肝癌產生多藥耐藥的胞內信號傳導[J]. 中華外科雜志, 2007, 45(13):917-920.
(責任編輯: 林白霜, 羅森)
Analysis of gene network regulated by microRNA-375 in HCCHUANG Bo1, XIAO Ying-qun1, LUO Da-ya2, ZHANG Ping1, YANG Xian-he1, ZHONG Qing-mei1, WANG Wu1, YAO Di1
(1DepartmentofPathology,InfectiousDiseaseHospitalAffiliatedtoNanchangUniversity,Nanchang330002,China;2DepartmentofBiochemistryandMolecularBiology,SchoolofBasicMedicine,NanchangUniversity,Nanchang330006,China.E-mail:xiaoyq2008@126.com)
[ABSTRACT]AIM: To investigate the expression of microRNA-375 (miR-375) in hepatocellular carcinoma (HCC) and to analyze the target genes and signaling pathways regulated by miR-375. METHODS: The expression of miR-375 was examined at tissue microarray of HCC byinsituhybridization. The whole human genome chip and bioinformatics analysis were applied to screen out the differential expression genes and signaling pathways in 4 HCC cell lines transfected with miR-375 mimic. RESULTS:Insituhybridization showed the expression of miR-375 in HCC tissues were obviously higher than that in tumor-adjacent tissues (P<0.05). There were 20 co-upregulated genes and 17 co-downregulated genes in all 4 cell lines. Bioinformatic analysis showed that there were 54 signaling pathways related to up-regulated genes and 48 signaling pathways related to down-regulated genes in all 4 cell lines. CONCLUSION: miR-375 may play a key role in the pathological process of HCC. The bioinformatic analysis is able to screen the target genes and signaling pathways regulated by miR-375 and to provide an explicit direction for further mechanism research on HCC.
[KEY WORDS]Hepatocellular carcinoma; MicroRNA-375;Insituhybridization; Gene chips
doi:10.3969/j.issn.1000- 4718.2016.02.029
[中圖分類號]R730.23; R735.7
[文獻標志碼]A
通訊作者△Tel: 0791-88499524; E-mail: xiaoyq2008@126.com
*[基金項目]2011江西省衛生廳科技計劃(No. 20112043); 2012年南昌市市校合作項目(洪財企[80]號)
[收稿日期]2015- 05- 14[修回日期] 2016- 01- 07
[文章編號]1000- 4718(2016)02- 0363- 08

