鐵酸錳納米材料吸附含Ni2+電鍍廢水的性能研究*
包 健 王風賀 紀營雪 蔣永偉#
(1.江蘇省環境科學研究院,江蘇 南京 210036;2.江蘇省環境工程重點實驗室,江蘇 南京 210036;3.南京師范大學環境學院,江蘇 南京 210023)
隨著納米科學的發展,納米材料在各個領域得到了廣泛的應用[1]。納米磁性材料因具有納米材料和磁性材料的共同特征,已成為新的研究熱點。納米鐵酸鹽是一類以Fe氧化物為主要成分的復合氧化物[2],其中鐵酸錳(MnFe2O4)納米材料因其具有穩定的理化性質、較高的比飽和磁化量和比表面積等特性而被廣泛應用于醫學[3]、電子技術[4-5]、催化劑制備[6]及吸附分離[7]等領域。有研究表明,MnFe2O4納米材料可吸附去除污水中的高毒性污染物Cr(Ⅵ),吸附性能比傳統吸附劑更理想[8-9]。吸附處理法是廢水中重金屬去除的有效方法之一,但如何實現吸附劑的快速分離與回用成為當前處理的難點。MnFe2O4納米材料具有的磁性能為解決上述難題提供技術支撐。
電鍍工業已成為全球三大污染工業之一。近年來,電鍍行業在我國得到迅速發展,我國電鍍廢水年排放量巨大,其中含有多種重金屬離子。Ni2+作為電鍍廢水中典型的特征污染物,對人體和環境均存在較大危害,人體接觸Ni2+后,輕者引起過敏性皮炎,重者可致癌[10]。因此,應用磁性納米材料處理含Ni2+電鍍廢水,可促進電鍍行業的良性發展,對于重金屬廢水的污染控制與減排具有重要的社會意義。本研究制備了MnFe2O4納米材料,并評價了其對含Ni2+電鍍廢水的吸附性能。
1 實驗部分
1.1 實驗試劑與儀器
實驗試劑:FeCl3·6H2O、MnCl2·4H2O、NaOH、HCl、NiSO4·6H2O和C2H5OH等,均為分析純。
實驗儀器:多頭磁力加熱攪拌器(HJ-6)、氣浴恒溫振蕩器(ZD-85A)、電子天平(TP-214)、X射線衍射儀(XRD,XRD-6000,日本Shimadzu公司)、高分辨率掃描電子顯微鏡(SEM,JSM-5610LV,日本電子公司)、原子吸收分光光度計(GTA 120,美國Agilent公司)、pH計(pH S-3C)等。
1.2 MnFe2O4納米材料的制備
MnFe2O4納米材料的制備參照文獻[11]中的非表面活性劑水熱法:稱取0.946 g FeCl3·6H2O和0.346 g MnCl2·4H2O,混合后充分研磨,溶于35 mL去離子水,置于磁力攪拌器上攪拌30 min。再取1.2 g NaOH溶于5 mL去離子水,逐滴加入到上述混合液,裝入聚四氟乙烯內襯反應釜中,保持180 ℃反應12 h,然后用去離子水和C2H5OH多次洗滌產物,再置于60 ℃條件下干燥6 h。
1.3 等溫吸附實驗
對待處理實際含Ni2+電鍍廢水中金屬離子組成進行分析,為后續實驗設計提供參考,具體結果如表1所示。由表1可知,實際含Ni2+電鍍廢水含有多種金屬離子,本研究以Ni2+為主要吸附對象。為避免電鍍廢水中共存金屬離子對Ni2+吸附的影響,參考表1實際含Ni2+電鍍廢水中Ni2+的濃度,先稱取44.6 mg NiSO4·6H2O,溶于500 mL去離子水,配制20.0 mg/L模擬含Ni2+電鍍廢水,再分別以模擬含Ni2+電鍍廢水和實際含Ni2+電鍍廢水為研究對象,重點研究吸附時間、溶液pH和溫度對MnFe2O4納米材料吸附性能的影響及材料再生性能。
準確移取150 mL模擬含Ni2+電鍍廢水至250 mL錐形瓶中,加入4.5 mg MnFe2O4納米材料,將瓶口用橡膠塞密封,置于恒溫振蕩器中振蕩48 h。采用磁分離獲得上層懸浮液,經0.45 μm濾膜過濾,采用原子吸收分光光度計測定溶液中Ni2+濃度。根據式(1)和式(2),計算MnFe2O4納米材料的平衡吸附量(Qe,mg/g)及吸附去除率(r,%)。
Qe=(c0-ce)V/m
(1)
(2)
式中:c0和ce分別為初始和吸附平衡后溶液中殘余Ni2+的質量濃度,mg/L;V為溶液體積,L;m為MnFe2O4納米材料的質量,mg。
1.4 再生性能實驗
參照文獻[10]提供的方法,采用0.1 mol/L的NaOH調整溶液pH使吸附Ni2+后的MnFe2O4納米材料解吸,再對解吸后MnFe2O4納米材料的吸附性能進行測試。具體實驗過程如下:(1)取150 mL質量濃度為20.0 mg/L的模擬含Ni2+電鍍廢水于錐形瓶中,保持自然pH,加入4.5 mg的MnFe2O4納米材料,在室溫(25 ℃)下達到吸附平衡,測量平衡濃度,根據式(2)計算吸附去除率;(2)磁分離去掉上清液后,按文獻[10]提供的方法處理材料,使其徹底解吸;(3)將步驟(2)得到的解吸后材料進行再次吸附實驗,按照步驟(1)過程進行,計算第2次吸附去除率;(4)重復吸附過程共5次,計算每次的吸附去除率。
2 結果與討論
2.1 MnFe2O4納米材料表征
MnFe2O4納米材料的XRD、SEM如圖1所示。
圖1(a)中MnFe2O4納米材料的XRD圖譜顯示,各特征衍射峰與MnFe2O4的JCPDS卡片(No.73-1964)的數據有很好的吻合[11],各特征衍射峰依次對應(220)、(311)、(400)、(511)和(440)晶面,且由各峰峰寬及峰形推測材料為納米級。
圖1(b)中MnFe2O4納米材料的SEM圖表明,該材料呈棒形或不規則顆粒狀,大部分尺寸為納米級。
以上結果表明,采用該方法所合成的材料為目標產物MnFe2O4納米材料。
2.2 MnFe2O4吸附性能
2.2.1 吸附時間對吸附性能的影響
在溶液pH為9、溫度為25 ℃時,模擬含Ni2+電鍍廢水(Ni2+初始質量濃度為20.0 mg/L)和實際含Ni2+電鍍廢水(Ni2+初始質量濃度為17.5 mg/L)經MnFe2O4納米材料吸附后水樣中Ni2+濃度隨吸附時間(30、60、120、240、300、600、1 440、2 880 min)的變化,其結果見圖2。

表1 實際含Ni2+電鍍廢水成分分析
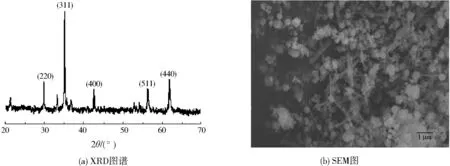
圖1 MnFe2O4納米材料表征Fig.1 Characterization of MnFe2O4 nanomaterial
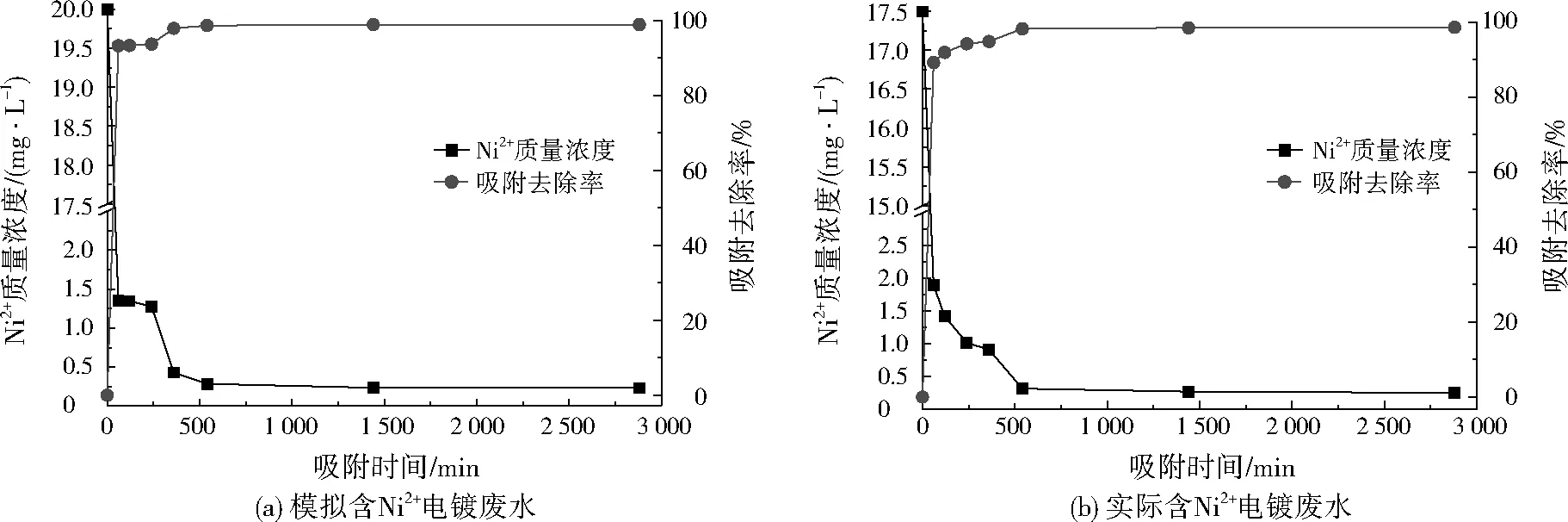
圖2 吸附時間對吸附性能的影響Fig.2 Effects of adsorption time on the adsorption performance
由圖2可知,MnFe2O4納米材料對模擬含Ni2+電鍍廢水和實際含Ni2+電鍍廢水中Ni2+的吸附效果均較為明顯。吸附初期,水樣中Ni2+濃度大幅減少,吸附去除率分別高達93.21%、89.16%;隨著吸附時間的延長,Ni2+濃度呈小幅下降,并有趨向平衡的趨勢;600 min后,溶液中殘余Ni2+濃度基本保持不變,顯示吸附已達到平衡狀態,吸附去除率高達98%左右,殘余質量濃度低于0.3 mg/L,達到《電鍍污染物排放標準》(GB 21900—2008)規定的限值(0.5 mg/L)[12]。
2.2.2 溶液pH對吸附性能的影響
在溫度為25 ℃時,分別取150 mL模擬含Ni2+電鍍廢水和實際含Ni2+電鍍廢水,采用0.1 mol/L NaOH和HCl調整溶液pH至2、5、7、9、12,加入4.5 mg MnFe2O4納米材料,經吸附時間為2 880 min后,比較吸附處理前后水樣中剩余Ni2+的濃度,其結果如圖3及表2所示。
由圖3(a)及表2可知,MnFe2O4納米材料對模擬含Ni2+電鍍廢水中Ni2+的去除性能隨溶液pH的增大而提高,pH為7~12時,MnFe2O4納米材料對Ni2+的吸附去除率可達98%以上,且殘余Ni2+濃度達到GB 21900—2008規定的限值。不同pH條件下,模擬含Ni2+電鍍廢水中Ni2+去除效果的差異,一方面是由于隨著堿性增強Ni2+形成氫氧化物沉淀,另一方面MnFe2O4對Ni2+產生了較強的吸附作用。
由圖3(b)及表2可知,MnFe2O4納米材料對實際含Ni2+電鍍廢水中Ni2+的去除性能隨溶液pH的增大而提高,pH為9~12時,MnFe2O4納米材料對Ni2+的吸附去除率可達98%以上,且殘余Ni2+濃度達到GB 21900—2008規定的限值。因此,工業應用中應盡量保持廢水偏堿性。
2.2.3 溫度對吸附性能的影響
在吸附時間為2 880 min、溶液pH為5時,為研究溫度對MnFe2O4納米材料吸附模擬含Ni2+電鍍廢水和實際含Ni2+電鍍廢水性能的影響,設置恒溫振蕩器至不同溫度(15、20、25、30、35 ℃),恒溫振蕩后,測得MnFe2O4納米材料吸附處理后水樣中Ni2+的殘余濃度,如圖4所示。
圖4(a)表明,對于相同初始Ni2+濃度、pH條件時,不同溫度作用下MnFe2O4納米材料吸附模擬含Ni2+電鍍廢水Ni2+的過程中,25 ℃為最佳吸附溫度。15~25 ℃時,隨著溫度升高,去除效果增強,這是因為溫度一定程度的升高,Ni2+擴散速率增大,且MnFe2O4納米材料中會有更多的吸附位置被活化,故吸附效果會增強[13];但25~35 ℃時,溫度的升高反而不利于吸附進行,這是由于吸附過程一般為放熱反應,高溫不利于吸附過程的進行。同時,溫度增加,吸附到材料表面的Ni2+的解吸程度也相應增加。圖4(b)也表現出類似的變化趨勢,MnFe2O4納米材料吸附實際含Ni2+電鍍廢水Ni2+的吸附過程中,25 ℃為最佳吸附溫度。故實際工業應用過程溫度盡量維持在25 ℃。
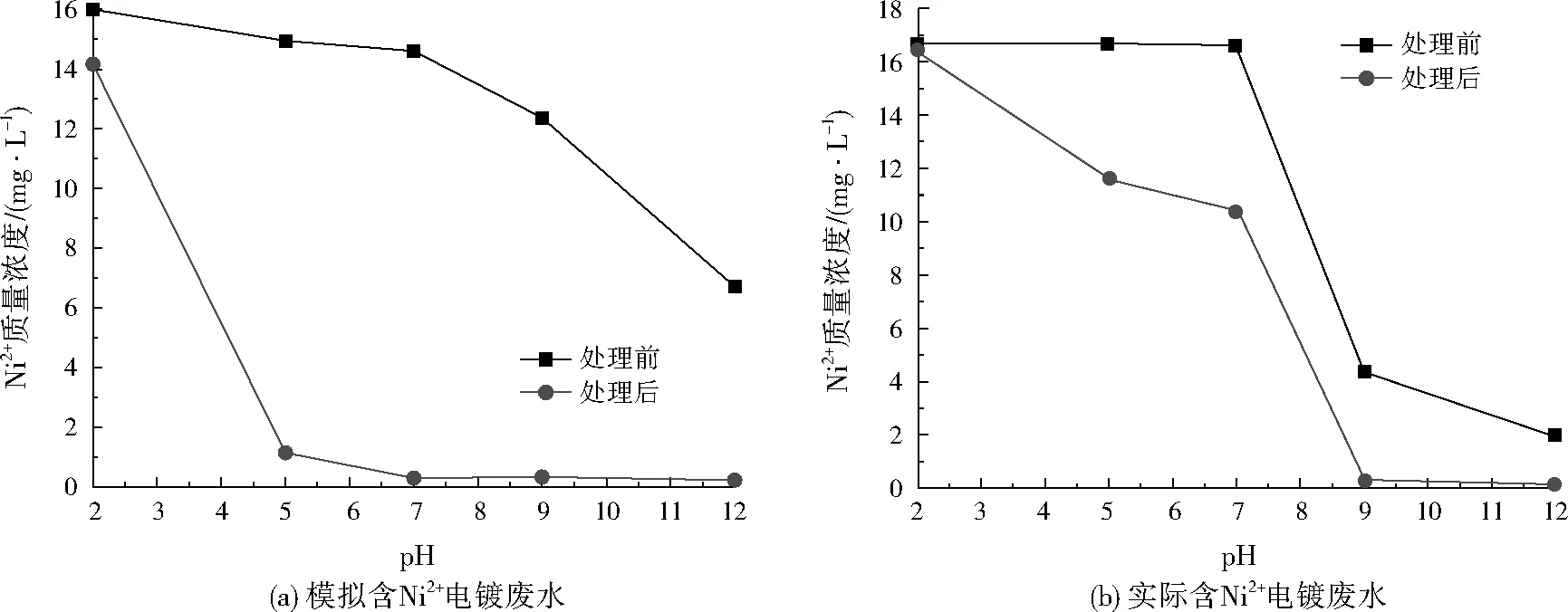
圖3 溶液pH對吸附性能的影響Fig.3 Effects of pH on the adsorption performance
%
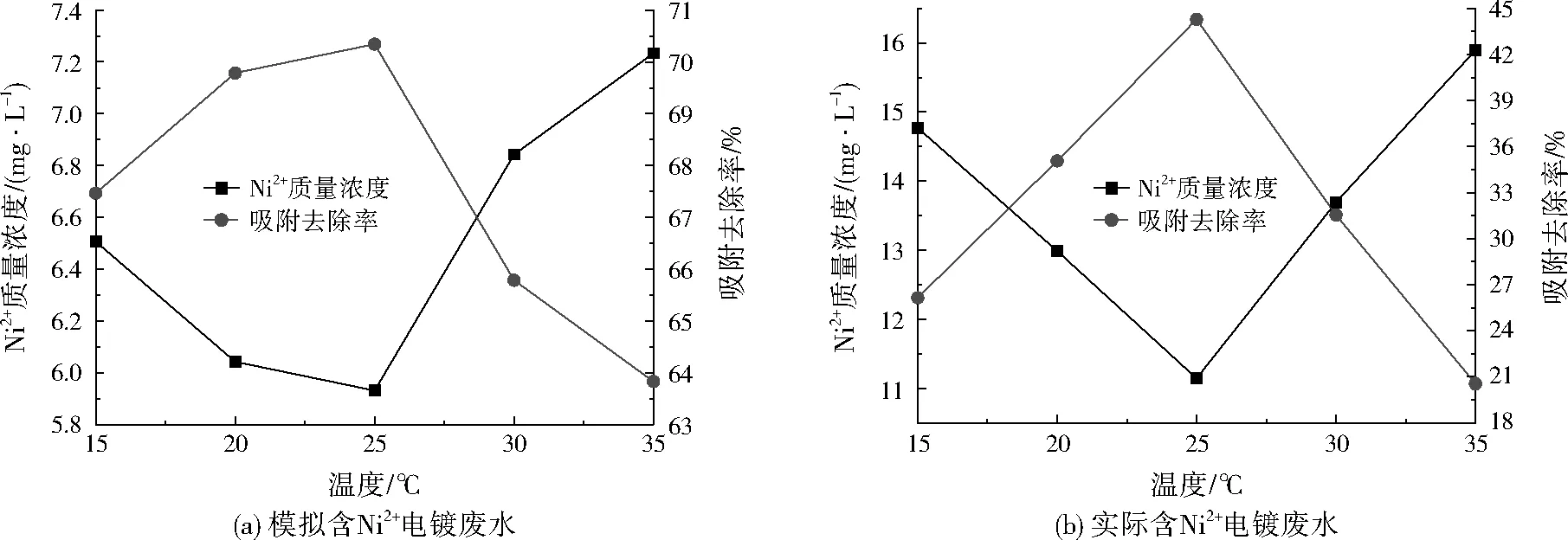
圖4 溫度對吸附性能的影響Fig.4 Effects of temperature on the adsorption performance
2.2.4 MnFe2O4納米材料再生利用性能研究
為研究MnFe2O4納米材料的再生利用性能,該材料吸附Ni2+后,通過外加磁場作用將其回收,再調節溶液的酸堿度,使吸附在MnFe2O4納米材料表面的Ni2+與NaOH形成沉淀,經過洗脫去除。重復吸附5次的實驗結果如圖5所示(吸附時間均為2 880 min)。
由圖5可知,隨著MnFe2O4納米材料吸附利用次數的增加,平衡吸附量略有降低。首次吸附去除率為95.20%,第2次降為93.65%,第5次吸附去除率則為82.24%。故MnFe2O4納米材料每經過一次重復利用,吸附去除率均會有所下降,但重復吸附5次后仍能達到82.24%;同時,MnFe2O4納米材料良好的磁性保證了吸附后磁分離的徹底性,使得MnFe2O4納米材料作為吸附劑具有較好的再生性能和重復利用價值。
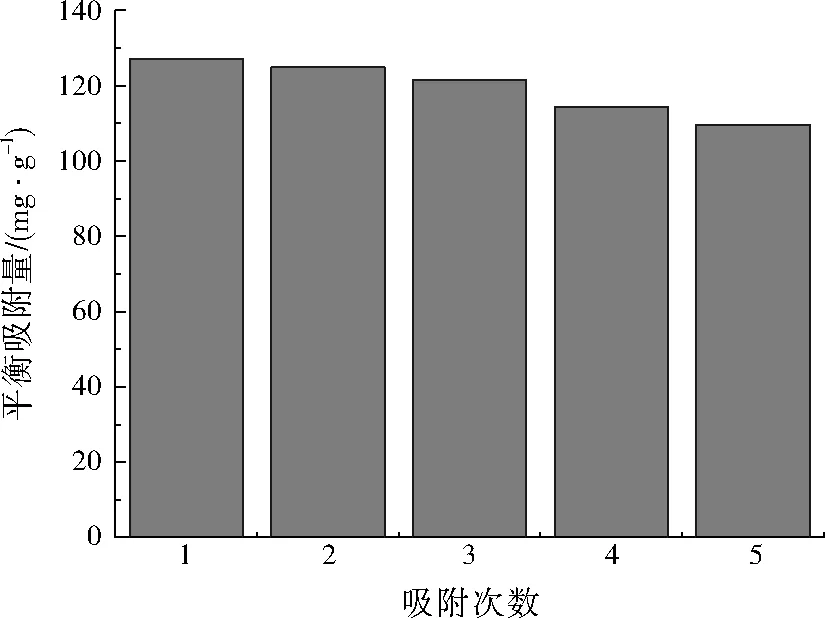
圖5 不同吸附次數下的平衡吸附量Fig.5 Adsorption capacity (Qe) at different adsorption times
3 結 論
(1) 對于20.0 mg/L的模擬含Ni2+電鍍廢水,投加4.5 mg的MnFe2O4納米材料對Ni2+進行吸附,600 min后基本達到平衡狀態,且Ni2+吸附去除率高達98%左右,達到GB 21900—2008規定的限值。
(2) 為保證較理想的吸附去除效果,工業應用時應盡量使廢水保持偏堿性,溫度基本維持在室溫(25 ℃)。
(3) MnFe2O4納米材料具有較好的再生利用性能,重復吸附5次后吸附去除率仍可達82.24%,使得其作為吸附劑在實際廢水處理中具有較好的應用前景。
[1] 雷立,晉銀佳,王婷,等.堿熱—酸熱法合成二氧化鈦-鈦酸納米管復合納米材料對Cd(Ⅱ)和苯酚的同步去除[J].環境科學,2015,36(7):2573-2580.
[2] 江傳銳,虢清偉,卓瓊芳,等.納米鐵酸鹽光催化劑的制備及其在廢水處理中的應用綜述[J].化工環保,2015,35(1):27-33.
[3] KUMAR R V,DIAMANT Y,GEDANKEN A.Sonochemical synthesis and characterization of nanometer-size transition metal oxides from metal acetates[J].Chemistry of Materials,2000,12(8):2301-2305.
[4] BATE G.Magnetic recording materials since 1975[J].Journal of Magnetism and Magnetic Materials,1991,100(1):413-424.
[5] SUGIMOTO M.The past,present,and future of ferrites[J].Journal of the American Ceramic Society,1999,82(2):269-280.
[7] HU J,LO I M C,CHEN G.Comparative study of various magnetic nanoparticles for Cr (Ⅵ) removal[J].Separation and Purification Technology,2007,56(3):249-256.
[8] HU J,LO I M C,CHEN G.Fast removal and recovery of Cr(Ⅵ) using surface-modified jacobsite (MnFe2O4) nanoparticles[J].Langmuir,2005,21(24):11173-11179.
[9] 李獻銳,王娜,焦留國,等.納米級鐵酸錳制備、表征及對Cr(Ⅵ)的吸附作用[J].河北師范大學學報(自然科學版),2013,37(6):614-617.
[10] 王崇俠,高建綱,宋慶平.黃原酸殼聚糖對水中鎳的吸附[J].環境與健康雜志,2010,27(10):888-889.
[11] 沈昱,劉宏文,劉淑紅,等.不同微觀形貌鐵酸錳納米材料的制備及表征[J].大連交通大學學報,2013,34(6):86-89.
[12] GB 21900—2008,電鍍污染物排放標準[S].
[13] 李從軍,羅世煒,湯文浩.生物產品分離純化技術[M].武漢:華中師范大學出版社,2009.

