地熱水中一株好氧反硝化菌的分離鑒定及最優反硝化條件的研究*
張淑楠 王心義,2 夏大平 于洪飛 甄曉歌
(1.河南理工大學資源環境學院,河南 焦作 454000;2.中原經濟區煤層(頁巖)氣河南省協同創新中心,河南 焦作 454000;3.河南理工大學能源科學與工程學院,河南 焦作 454000)
我國華北平原淺層地下水遭受污染的比例已接近1/2,可直接飲用的淺層地下水甚至不足1/4[1],其中尤以“三氮”污染最為嚴重。深層地下水雖然受污染較輕,但隨著開采量的增加,“三氮”含量呈現出進一步升高的趨勢[2-4]。因此,深層地下水劣變機制及修復技術的研究成為當今環境、水文地質領域的熱門。目前,降低地下水“三氮”含量的方法有物理法、化學法和生物法,其中物理法和化學法(如反滲透法、離子交換法、電滲析法等[5])在生產中應用廣泛,但存在處理費用高、生成高濃度含鹵廢液[6]等缺點。生物法因其具有成本低、操作簡單等優點,成為最具發展前景的處理方法[7],其中,自養生物脫氮技術不需添加有機碳源、污泥產量低、發展前景良好,但自養反硝化菌難以培養,且中間產物亞硝態氮易產生積累,目前仍處于實驗室研究階段,未能在工程實例中有效實施[8]。
20世紀80年代,ROBERTSON等[9]首次分離出好氧反硝化菌,打破了反硝化菌只在厭氧條件下生存的傳統認識。此后,國內外研究者又陸續分離出多種好氧反硝化菌,主要包括副球菌屬(Paracoccussp.)[10]、產堿桿菌屬(Alcaligenessp.)[11]、假單胞菌屬(Pseudomonassp.)[12]、芽孢桿菌屬(Bacillussp.)[13-14]、不動桿菌屬(Acinetobacterssp.)[15]等。另有研究得出,菌株的生長環境會不同程度影響菌株的生長狀況和反硝化效果[16]42-43。因此,開展生長環境對菌株反硝化效果的研究具有理論價值和實際意義。
本研究從開封市某酒店1 200 m深地熱井中抽取地熱水(實測溫度36.9 ℃,pH 8.16,溶解氧質量濃度2.57 mg/L),篩選得到1株較高效的好氧反硝化菌,在實驗室條件下進行生長量和脫氮效率研究。本研究在豐富好氧反硝化菌資源的同時,為富氮地熱水原位修復的實際應用提供理論依據。
1 材料與方法
1.1 培養基配制
LB培養基:胰化蛋白胨10 g;酵母提取物5 g;NaCl 10 g;用摩爾濃度5 mol/L的NaOH調節pH至7.0,蒸餾水定容至1 L。
DM基礎培養基:KNO30.361 g;K2HPO47.9 g;KH2PO41.5 g;NaCl 0.5 g;MgSO4·7H2O 0.01 g;微量元素溶液2 mL;pH 7.0~7.5;去離子水定容至1 L。碳源根據實驗要求進行調整。
BTB培養基:在DM基礎培養基上,添加1 mL 1%(質量分數)溴麝香草酚藍(BTB,溶于酒精)和2.5%(質量分數)瓊脂,調節pH 7.0~7.5。
1.2 菌株分離與篩選
將地熱水中的細菌在LB培養基上進行富集,并在BTB培養基上涂布培養,然后挑取有藍色光暈的單菌落在DM基礎培養基上劃線,分離純化3次,并測定脫氮效率,選取脫氮效率最高的1株為目的菌株。本研究所有器皿、培養基使用前均在121 ℃下高溫滅菌20 min。實驗均使用250 mL錐形瓶,培養基量為100 mL,接種量為2%(體積分數)。
1.3 16S rRNA基因序列測定
使用Ezup柱式細菌基因組DNA抽提試劑盒提取16S rRNA基因;采用通用引物27F(引物序列為AGAGTTTGATCCTGGCTCA)和1492R(引物序列為GGTTACCTTGTTACGACTT)對16S rRNA基因進行聚合酶鏈式反應(PCR)擴增。PCR擴增采用25 μL反應體系,94 ℃預變性5 min,1個循環;94 ℃變性30 s ,56 ℃退火30 s,72 ℃延伸90 s,32個循環;72 ℃延伸10 min。將PCR擴增產物采用1.2%(質量分數)瓊脂糖電泳檢測、切膠,用膠回收試劑盒進行目的片段的回收,獲得純化的PCR擴增產物。參考T-載體PCR產物克隆試劑盒說明書進行連接與轉化。選擇在ITPG/X-gal平板上生長的白色菌落,用牙簽挑至含氨芐青霉素的液體培養基,37 ℃培養過夜。采用質粒提取試劑盒抽提質粒,以質粒為模板,以27F和1492R為引物進行16S rRNA基因的PCR擴增,采用瓊脂糖電泳檢測片段大小,選擇與16S rRNA基因片段大小相符合的菌液送樣,由上海生工生物工程股份有限公司進行測序和拼接。
1.4 脫氮效率與最優條件
1.4.1 脫氮效率測定
分別以KNO3、KNO2為唯一氮源,以檸檬酸鈉和琥珀酸鈉為碳源,在pH為8.0下接種等量菌液,調節恒溫振蕩培養箱溫度35 ℃、轉速120 r/min,每隔2 h檢測DM基礎培養基中的菌株生長量(利用600 nm波長處的吸光度(OD600)表示)及硝態氮、亞硝態氮濃度(隨著OD600及硝態氮、亞硝態氮濃度趨于穩定,檢測間隔延長為4 h)。同時以未接種的DM基礎培養基作為空白對照,實驗設3組平行。
測定方法:硝態氮采用紫外分光光度法測定;亞硝態氮采用N-(1-萘基)-乙二胺偶氮分光光度法測定;TN采用過硫酸鉀氧化/紫外分光光度法測定;OD600采用比濁法測定,所用儀器為752型紫外—可見分光光度計;pH、溶解氧采用SX751型多參數測量儀測定。
1.4.2 最優反硝化條件探索
以DM基礎培養基為母液,以KNO3為氮源,調整C/N(質量比,下同)為12∶1,分別以檸檬酸鈉、琥珀酸鈉和甲醇為唯一碳源,考察碳源對篩選菌株的生長量和脫氮效率的影響。此外,考察初始pH、溫度、溶解氧濃度(利用恒溫振蕩培養箱的轉速控制濃度)對菌株的生長量和脫氮效率的影響。除考察不同碳源的影響外,其余實驗均在碳源為檸檬酸鈉和琥珀酸鈉下進行;除考察不同初始pH的影響外,其余實驗均在pH為8.0下進行;除考察不同溫度的影響外,其余實驗均在溫度為35 ℃下進行;除考察不同溶解氧濃度的影響外,其余實驗均設置轉速為120 r/min。各實驗均設3組空白和3組平行。
2 結果與討論
2.1 菌株分離與鑒定
經BTB培養基初篩得到3株好氧反硝化菌,其中1株對硝態氮和TN的去除率最高(40 h內對硝態氮和TN的去除率分別為96.10%、90.60%),記為A1。將A1的16S rRNA基因進行PCR擴增,PCR產物連接載體后,得到長度1 511 bp的序列。將所得序列與美國國立生物信息技術中心(NCBI)的序列進行同源性比對,憑借99%的相似性,鑒定A1屬于芽孢桿菌屬(Bacillussp.)的地衣芽孢桿菌(Bacilluslicheniformis)。
2.2 不同氮源的脫氮效率
2.2.1 氮源種類的影響
以KNO3為唯一氮源時,A1的生長量與脫氮效率變化如圖1(a)所示。4 h后,A1進入對數生長期,生長和代謝活動最為活躍,培養基中的硝態氮被大量用于生長并進行反硝化作用,14 h后,硝態氮質量濃度迅速降低至1.19 mg/L,去除率達到97.66%。18 h后,A1進入穩定期,硝態氮去除率接近100.00%。在整個培養過程中,亞硝態氮出現了輕微積累,于8 h時達到峰值3.01 mg/L,隨后逐漸降低,最終低于0.10 mg/L。亞硝態氮與硝態氮的消耗不同步,表明A1在以KNO3為氮源時,先將硝態氮還原為亞硝態氮,而亞硝態氮又誘導產生了亞硝酸鹽還原酶,從而使亞硝態氮被還原。
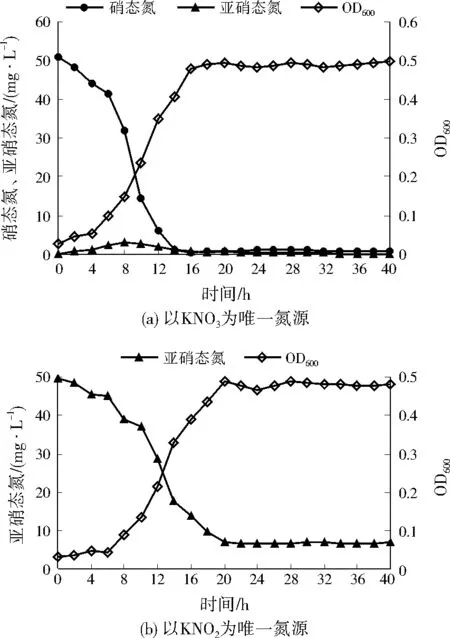
圖1 不同氮源下A1的生長量與脫氮效率變化Fig.1 Growth and nitrogen removal rates of A1 under different nitrogen sources
以KNO2為唯一氮源時,A1的生長量與脫氮效率如圖1(b)所示。6 h后,A1進入對數生長期,A1的反硝化作用也主要發生在對數生長期。經過反硝化作用,亞硝態氮質量濃度由最初的49.82 mg/L降低到6.91 mg/L,去除率達到86.13%。進入穩定期后,亞硝態氮濃度基本沒有變化。
A1分別以KNO3、KNO2為氮源時,均生長良好(分別于4、6 h后進入對數生長期),并具有較高的脫氮效率(對硝態氮、亞硝態氮的去除率分別達到97.66%、86.13%),且對數生長期持續長,說明A1能較好地適應新環境。A1以KNO3為氮源時,進入對數生長期略早于以KNO2為氮源,且脫氮效率也略高于以KNO2為氮源,這是由于硝態氮的氧化還原電位比亞硝態氮高,能被優先利用作為電子受體。
2.2.2 氮源濃度的影響
為考察不同氮源濃度對A1脫氮效率的影響,利用KNO3將硝態氮初始質量濃度分別設置為20、50、80、120 mg/L,接種等量A1,間隔取樣檢測硝態氮的濃度變化,實驗結果如圖2(a)所示。由圖2(a)可以看出:當硝態氮初始質量濃度分別為20、50、80 mg/L時,A1分別在14、14、16 h時完成反硝化作用;經過A1的反硝化作用,硝態氮質量濃度均低于1.00 mg/L,且出水均未發現亞硝態氮的積累,硝態氮去除率隨硝態氮初始濃度的增大而增大。當硝態氮初始質量濃度達到120 mg/L時,A1在36 h時完成反硝化作用,去除硝態氮的速率減慢,說明硝態氮初始濃度過大時,A1的脫氮效率可能受到了抑制。
同樣,設置亞硝態氮初始質量濃度分別為20、50、80、120 mg/L,研究不同亞硝態氮初始濃度對A1脫氮效率的影響,結果如圖2(b)所示。當亞硝態氮初始質量濃度分別為20、50、80 mg/L時,A1分別在16、16、20 h時完成反硝化作用;經過A1的反硝化作用,亞硝態氮分別穩定在1.14、6.39、7.94 mg/L。當亞硝態氮初始質量濃度達到120 mg/L時,在A1的反硝化作用進行40 h時,亞硝態氮的質量濃度為10.94 mg/L,說明亞硝態氮初始濃度過大時,也可能抑制A1的脫氮效率。
2.3 最優反硝化條件
2.3.1 碳 源
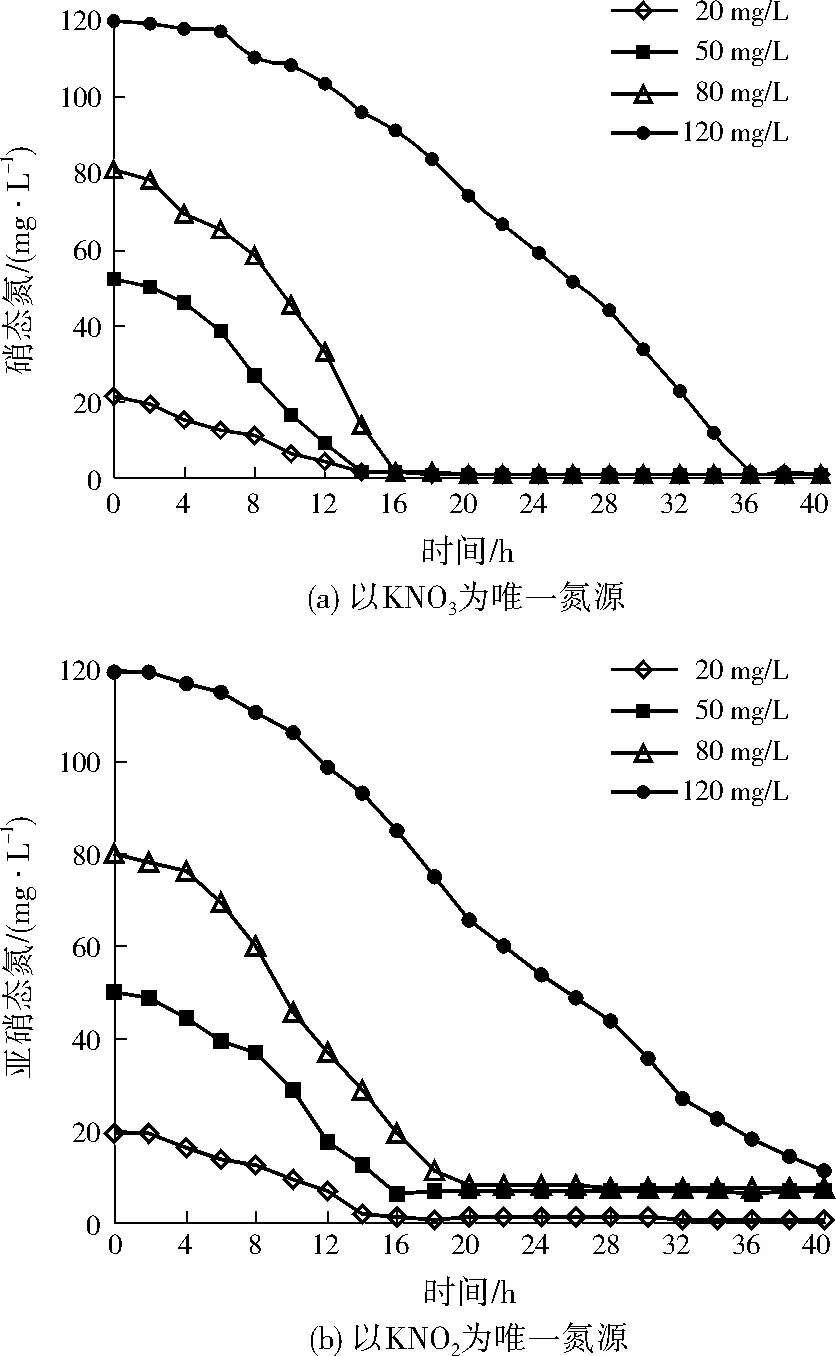
圖2 不同氮源下A1的脫氮效率變化Fig.2 Nitrogen removal rates of A1 under different nitrogen source concentrations
不同碳源對A1的生長量以及脫氮效率的影響如圖3所示。A1分別以琥珀酸鈉、檸檬酸鈉和甲醇作為唯一碳源時,分別于4、6、6 h后進入對數生長期,于14、18、20 h后進入穩定期。分別以琥珀酸鈉和檸檬酸鈉為唯一碳源時,A1的反硝化作用分別在14、16 h后完成,硝態氮去除率分別達到96.10%、96.20%。以甲醇作為唯一碳源時,A1于20 h后完成反硝化作用,所需的反硝化作用時間明顯加長,硝態氮去除率為76.17%,去除率也相對偏低。綜上可知,琥珀酸鈉和檸檬酸鈉比甲醇更適合作為A1的碳源,這是由于檸檬酸鹽、琥珀酸鹽是三羧酸循環中間產物,能被細菌直接利用,同時兩者作為有機酸還能增強周質硝酸還原酶的活性[17]。
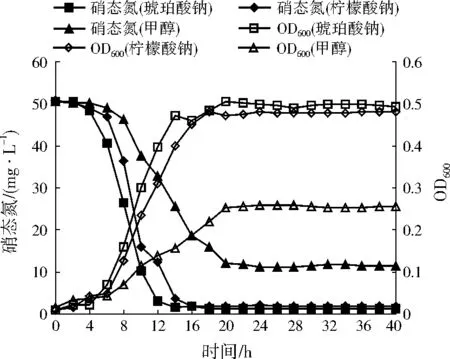
注:硝態氮(琥珀酸鈉)、硝態氮(檸檬酸鈉)和硝態氮(甲醇)分別表示以琥珀酸鈉、檸檬酸鈉和甲醇為碳源時的硝態氮濃度;OD600(琥珀酸鈉)、OD600(檸檬酸鈉)和OD600(甲醇)分別表示以琥珀酸鈉、檸檬酸鈉和甲醇為碳源時的OD600。
圖3不同碳源下A1的生長量與脫氮效率變化
Fig.3 Growth and nitrogen removal rates of A1 under different carbon sources
2.3.2 初始pH
考察初始pH分別為6.0、6.5、7.0、7.5、8.0、8.5時,A1的生長量與脫氮效率變化,結果如圖4所示。A1的脫氮效率因初始pH不同而存在差異。pH為6.0時,硝態氮的去除率最低,僅為74.77%;其次是初始pH為6.5、8.5時,硝態氮的去除率分別為79.42%、87.54%;初始pH為7.0~8.0時,硝態氮的去除率約為90%,初始pH為7.5時,硝態氮去除率最大,達到96.25%。TN的去除率變化與硝態氮基本保持一致。pH為8.5時,A1的生長量較小,TN與硝態氮的去除率較為接近,說明此時硝態氮大多被還原為N2,而用于A1生長所需的硝態氮較少。因此,A1的生長和反硝化作用能在較寬的pH范圍內進行,中性或偏堿性環境最為適宜。
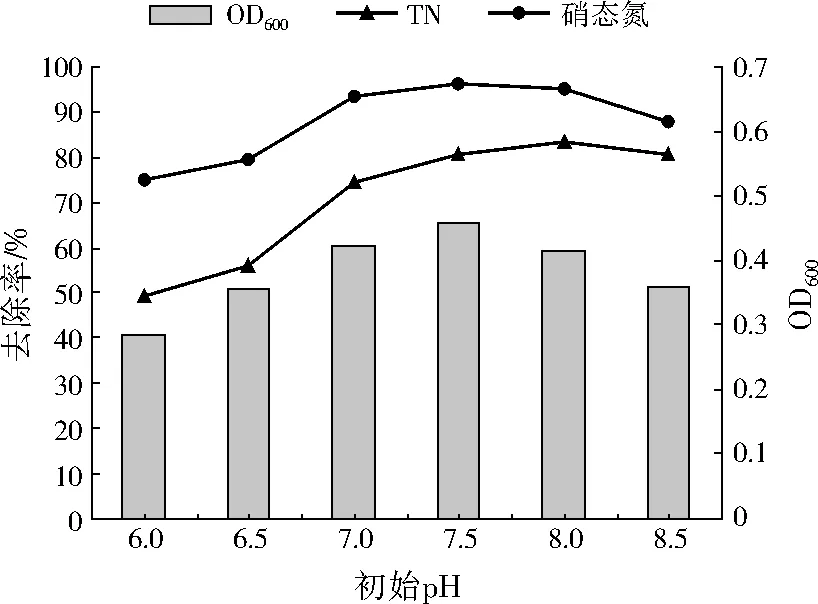
圖4 不同初始pH下A1的生長量和脫氮效率變化Fig.4 Growth and nitrogen removal rates of A1 under different initial pH
2.3.3 溫 度
為考察不同溫度對A1的生長量以及脫氮效率的影響,設置溫度分別為25、30、35、40、50 ℃,如圖5所示。溫度在25~35 ℃時,A1的生長量隨溫度的升高而增加,在35 ℃時達到最大生長量,此時硝態氮和TN的去除率也達到最大,分別為97.61%、82.98%。溫度高于40 ℃時,A1的脫氮效率受到一定程度的抑制,但即便在50 ℃下,A1依然能正常生長,并具有較高的脫氮效率(硝態氮、TN的去除率分別為74.11%、49.50%)。因此,A1是一株耐高溫的好氧反硝化菌,可在較寬的溫度范圍內正常生長并保持較高的脫氮效率。
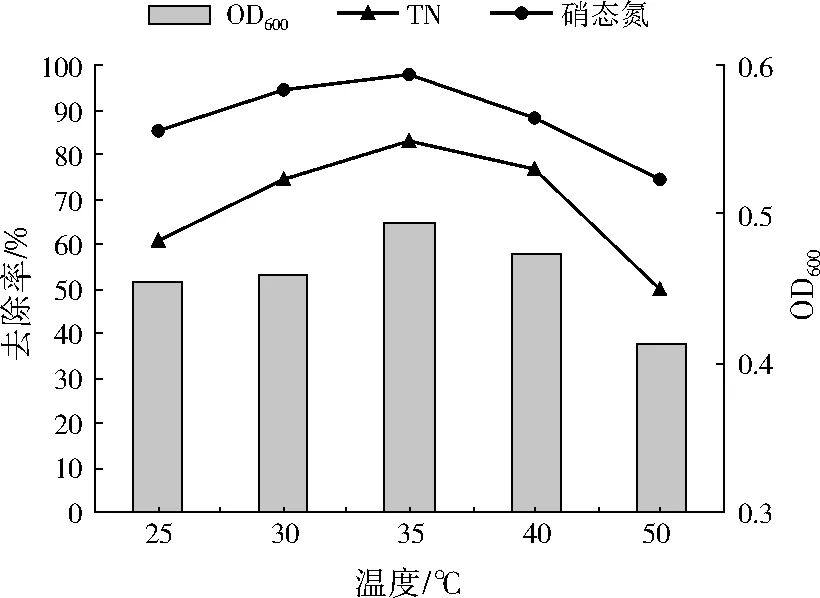
圖5 不同溫度下A1的生長量和脫氮效率變化Fig.5 Growth and nitrogen removal rates of A1 under different temperatures
2.3.4 溶解氧濃度
設置恒溫振蕩培養箱轉速分別為0、60、100、140、180 r/min(對應的溶解氧質量濃度分別為(0.3±0.1)、(2.7±0.3)、(5.3±0.3)、(6.8±0.2)、(8.1±0.2) mg/L),考察不同溶解氧濃度對A1的生長量以及脫氮效率的影響,結果如圖6所示。轉速為140 r/min時,硝態氮去除率達到最大值,為96.22%。

圖6 不同轉速下A1的生長量和脫氮效率的變化Fig.6 Growth and nitrogen removal rates of A1 under different speeds
溶解氧濃度對好氧反硝化菌脫氮效率的影響理論可分為兩類:一類是閾值理論[18],即在一定溶解氧濃度范圍內,好氧反硝化菌會優先選擇氧化還原電位高的O2作為電子受體,脫氮效率受溶解氧濃度的影響極小,但當溶解氧濃度降低到閾值以下時,硝態氮或亞硝態氮逐漸取代O2而成為電子受體,脫氮效率反而隨溶解氧濃度降低顯著升高。馬放等[16]44-45研究發現,菌株Pseudomonaschloritidismutans的脫氮效率與溶解氧濃度的關系正符合該理論;另一類理論認為好氧反硝化菌的脫氮效率在某個溶解氧濃度達到峰值,低于或高于這個溶解氧濃度,脫氮效率均會下降[19],本研究支持該理論。另外,靜置培養(轉速為0 r/min)時,雖然A1生長量不高,但是硝態氮去除率達到90.22%,說明A1可能是兼性好氧菌,在好氧和厭氧環境中均能發揮反硝化作用。
3 結 論
(1) 從開封市某酒店1 200 m深地熱井中抽取地熱水,篩選得到1株生長良好的高效好氧反硝化菌A1,對A1進行PCR擴增和16S rRNA基因序列測定后,確定為地衣芽孢桿菌(Bacilluslicheniformis)。A1在40 h內對硝態氮、TN的去除率分別達到96.10%、90.60%。
(2) 分別以KNO3和KNO2為氮源時,A1均生長良好并具有較高的脫氮效率,且對數生長期長,能較好地適應新環境。相比亞硝態氮,A1更容易利用硝態氮進行反硝化作用。
(3) A1生長與反硝化的最優條件為:以琥珀酸鈉為碳源,初始pH 7.5,溫度35 ℃,轉速140 r/min。A1是耐高溫的反硝化菌,在50 ℃下依然能正常生長并具有較高的脫氮效率。A1又是兼性好氧菌,在厭氧和好養條件下均能發揮反硝化作用。總之,A1生長速度快、適應能力強、脫氮效率高,對于原位修復富氮地熱水具有良好的應用價值。但是,各影響因子對A1的交互影響,仍有待進一步的響應面實驗。
[1] 環境保護部,國土資源部,住房和城鄉建設部,等.華北平原地下水污染防治工作方案[EB/OL].[2015-06-15].http://www.zhb.gov.cn/gkml/hbb/bwj/201304/W0201304263859825 62738.pdf.
[2] ZHAO Li,WANG Xinyi,ZHANG Qing,et al.Study on the transformation mechanism of nitrate in a loose-pore geothermal reservoir:experimental results and numerical simulations[J].Journal of Geochemical Exploration,2014,144:208-215.
[3] 趙麗,王心義,楊英.低溫孔隙地熱水中銨氮的遷移轉化規律研究[J].水土保持學報,2014,28(5):100-104.
[4] 王心義,李任政,張艷欣,等.孔隙地下熱水中典型離子運移的異同性研究[J].水文地質工程地質,2015,42(2):156-160.
[5] 田華祥.地下水污染與防治技術綜述[J].北方環境,2011,23(12):117-119.
[6] 丁煒,朱亮,徐京,等.好氧反硝化菌及其在生物處理與修復中的應用研究進展[J].應用與環境生物學報,2011,17(6):923-929.
[7] 劉虹,張蘭英,劉娜,等.生物可滲透性反應墻修復石油烴污染地下水的效果及微生物多樣性研究[J].環境污染與防治,2013,35(3):1-4.
[8] 艾小凡,王鶴立,陳祥龍.地下水硝酸鹽污染生物修復中的亞硝態氮積累研究[J].環境工程,2014,32(1):33-36.
[9] ROBERTSON L A,KUENEN J G.Thiospaerapantotrophagen.nov.sp.nov.,a facultatively anaerobic,facuhatively autotrophic sulphur bacterium[J].Journal of General Microbiology,1983,129(8):2847-2855.
[10] SHI Zhuang,ZHANG Yu,ZHOU Jiti,et al.Biological removal of nitrate and ammonium under aerobic atmosphere byParacoccusversutusLYM[J].Bioresource Technology,2013,148(7):144-148.
[11] MAKOTO S,YOICHI I.Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge byAlcaligenesfaecalisstrain No.4[J].Journal of Bioscience and Bioengineering,2014,117(6):737-741.
[12] WANG Pan,YUAN Yongze,LI Qian,et al.Isolation and immobilization of new aerobic denitrifying bacteria[J].International Biodeterioration & Biodegradation,2013,76(1):12-17.
[13] SONG Zengfu,AN Jian,YANG Xianle,et al.Isolation and characterization of an aerobic denitrifyingBacillussp.YX-6 from shrimp culture ponds[J].Aquaculture,2011,319(1/2):188-193.
[14] 廖小紅,汪蘋,刁惠芳,等.蠟狀芽孢桿菌WXZ-8的異養硝化/好氧反硝化性能研究[J].環境污染與防治,2009,31(7):17-21.
[15] REN Yongxiang,YANG Lei,LIAN Xian.The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium,AcinetobacterjuniiYB[J].Bioresource Technology,2014,171:1-9.
[16] 馬放,王弘宇,周丹丹,等.好氧反硝化菌株X31的反硝化特性[J].華南理工大學學報,2005,33(7).
[17] 趙驚鴻,黃少斌.一株耐高溫好氧反硝化菌的篩選及特性研究[J].環境科學與技術,2015,38(1):6-10.
[18] PATUREAU D,BERNET N,DELGENES J P,et al.Effect of dissolved oxygen and carbon-nitrogen loads on denitrification by an aerobic consortium[J].Applied Microbiology & Biotechnology,2000,54(4):535-542.
[19] HUANG H K,TSENG S K.Nitrate reduction byCitrobacterdiversusunder aerobic environment[J].Applied Microbiology & Biotechnology,2001,55(1):90-94.

