蟾蜍靈在體內外抑制急性紅白血病細胞K562增殖及下調WT1表達的研究
汪麗佩,李天一,高瑞蘭,杜月光,趙燕娜
(1.浙江中醫藥大學基礎醫學院病理學教研室,浙江 杭州 310053;2.浙江中醫藥大學附屬第一醫院血液病研究所,浙江 杭州 310006)
?
蟾蜍靈在體內外抑制急性紅白血病細胞K562增殖及下調WT1表達的研究
汪麗佩1,李天一1,高瑞蘭2,杜月光1,趙燕娜2
(1.浙江中醫藥大學基礎醫學院病理學教研室,浙江 杭州310053;2.浙江中醫藥大學附屬第一醫院血液病研究所,浙江 杭州310006)
中國圖書分類號:R-332;R282.74;R329.24;R329.28;R733.730.22;R979.1
摘要:目的研究蟾蜍靈在體內外抗K562細胞增殖及對WT1表達影響。方法半固體集落形成實驗檢測蟾蜍靈對K562細胞的增殖抑制作用,流式細胞術分析蟾蜍靈對K562細胞周期的影響,Western blot觀察蟾蜍靈對WT1表達作用。通過高致瘤性K562細胞制備裸鼠皮下荷瘤模型,分組為模型組、蟾蜍靈組及高三尖杉酯堿組,比較各組皮下瘤體積與重量、病理形態學改變及WT1蛋白表達情況。結果① 半固體集落形成實驗、流式及Western blot結果顯示,蟾蜍靈能明顯抑制K562細胞增殖,阻滯細胞在G0/G1期,并下調其WT1蛋白表達,呈劑量依賴性;② 蟾蜍靈組和陽性對照組裸鼠腫瘤的抑瘤率均明顯高于模型組(P<0.05),且蟾蜍靈組和陽性對照組裸鼠皮下瘤重量均明顯低于模型組(P<0.05);③ 病理切片顯示,蟾蜍靈導致K562皮下瘤組織內腫瘤細胞大量壞死、凋亡,繼發出血及纖維化等改變;并明顯抑制K562皮下瘤組織中WT1蛋白表達水平。結論蟾蜍靈在體外可抑制K562細胞增殖及阻滯細胞周期于G0/G1期,并下調其WT1蛋白表達,在體內可明顯抑制裸鼠K562皮下瘤體積和重量,導致皮下瘤組織壞死、凋亡,并可下調其WT1蛋白的表達。
關鍵詞:蟾蜍靈;WT1;K562;細胞周期;G0/G1期;皮下瘤
蟾蜍靈(bufalin)作為傳統中藥蟾酥成分中的蟾毒配基之一,在體外能抑制多種腫瘤細胞生長,并能誘導多種白血病細胞分化[1]。Numazawa等[2]研究表明,蟾蜍靈以劑量依賴方式抑制白血病細胞生長,但相關機制報道較少。我們以急性紅白血病細胞株K562為研究對象,體內外觀察蟾蜍靈單體對K562細胞的作用及其對癌基因WT1蛋白表達的影響,從而為蟾蜍靈進一步應用于白血病治療提供理論依據。
1材料與方法
1.1細胞株與試劑K562細胞株為本實驗室保存。蟾蜍靈、瓊脂粉及細胞周期試劑盒購自美國Sigma公司,高三尖杉酯堿購自北京協和藥廠,DMEM培養基購自美國Gibco公司,新生牛血清購自杭州四季青生物工程材料研究所,無菌注射用水購自平湖沙普愛思制藥公司,WT1抗體、羊抗兔多克隆抗體購自美國Cell Signaling Technology公司。
1.2實驗方法
1.2.1K562細胞株培養在37℃、5% CO2飽和濕度培養箱中用DMEM培養液(含10%新生牛血清)培養,選取對數生長期細胞進行后續實驗。
1.2.2半固體集落形成實驗培養體系含30%小牛血清、1×105U·L-1青鏈霉素、300 mg·L-1L-谷氨酰胺及含0.3%瓊脂的IMDM培養基,接種2×106·L-1細胞。以上體系中分別加入終濃度為0、0.01、0.05、0.1和0.5 μmol·L-1的不同濃度蟾蜍靈,每組設置3個復孔。置于37℃、5% CO2飽和濕度下培養5 d,倒置顯微鏡下計數≥50個細胞組成為1個集落。以蟾蜍靈濃度為橫坐標,集落抑制率為縱坐標繪制生長曲線,同樣的實驗重復10次。集落抑制率/%=(對照組集落數-實驗組集落數)/對照組集落數×100%。
1.2.3流式細胞術檢測細胞周期各組分別取2×105個細胞,冷PBS洗滌1次,離心去上清,加入0.5 mL含PI和RNAase A的DNA染液,室溫避光孵育30 min,流式細胞儀分析白血病細胞DNA含量。以PI熒光強度為橫坐標,以細胞數量為縱坐標繪制曲線圖,調整G0/G1期、S期和G2/M期細胞位置,排除黏連細胞后,分析目的細胞DNA表達情況。使用multicycle 軟件分析,并計算亞二倍體峰的百分率,同時計算細胞增殖指數=(S+G2/M)/(G0/G1+S+G2/M)。同樣的實驗重復5次。
1.2.4Western blot法檢測K562 細胞內WT1蛋白表達收集各組細胞,提取40 μg總蛋白,分別混合上樣緩沖液,100℃加熱5 min后通過10% SDS-PAGE膠分離,并轉膜到PVDF膜上,1% BSA封閉后,WT1一抗4℃孵育過夜,二抗孵育2 h后,ECL顯影,以β-actin為內參,每組實驗重復3 次。
1.2.5高致瘤性K562細胞的制備及皮下荷瘤裸鼠模型的建立和分組取5×107/0.2 mL的對數生長期K562細胞懸液注入4~5周齡裸鼠前肢腋下外側皮下,成瘤2周后處死裸鼠,無菌條件下取瘤塊,杵狀玻璃勻漿器勻碎瘤組織,并用100目孔徑的不銹鋼網過濾后,制成單細胞懸液,接種于100 mL培養瓶,傳代10~15代,即獲得高致瘤性K562細胞。將處于對數生長期的高致瘤K562細胞1×107/0.2 mL接種于4~5周齡免疫缺陷裸鼠前肢腋下外側皮下,并隨機分成3組,每組10只:① 模型組用生理鹽水0.2 mL·d-1灌胃21 d;② 蟾蜍靈組1.5 mg·kg-1·d-1灌胃21 d;③ 陽性對照組高三尖杉酯堿(Hom)1 mg·kg-1·d-1腹腔注射治療3 d。
1.2.6皮下瘤體積與重量檢測治療21 d,頸椎脫臼法處死裸鼠,用游標卡尺測量各組裸鼠瘤體最長徑(a)、最短徑(b)并稱重,得到裸鼠皮下瘤體積V(mm3)=ab2/2,計算抑瘤率。抑瘤率計算公式:抑瘤率/%=(1-治療組瘤體體積/對照組瘤體體積)×100%。
1.2.7腫瘤組織切片及HE染色各組裸鼠處死取瘤組織,固定后包埋、切片,進行HE染色,并在顯微鏡下觀察瘤組織病理情況。
1.2.8免疫組化法檢測腫瘤組織中WT1蛋白表達情況取上述病理石蠟切片,用1 ∶500稀釋的WT1一抗及Envision加強型二抗工作液孵育后,DAB顯色,以出現棕黃色顆粒為陽性顯色,并用蘇木精復染,光學顯微鏡下觀察記錄結果。
2結果
2.1蟾蜍靈抑制K562細胞集落生成處理K562細胞5 d后,蟾蜍靈0、0.01、0.05、0.1和0.5 μmol·L-1處理后的增殖抑制率分別為0、(21.31±2.53)%、(59.28±4.21)%、(70.53±5.10)%及(81.52±6.18)%,提示隨著蟾蜍靈劑量增加,K562細胞集落生成數量明顯降低(P<0.05),呈劑量依賴性(Fig 1)。
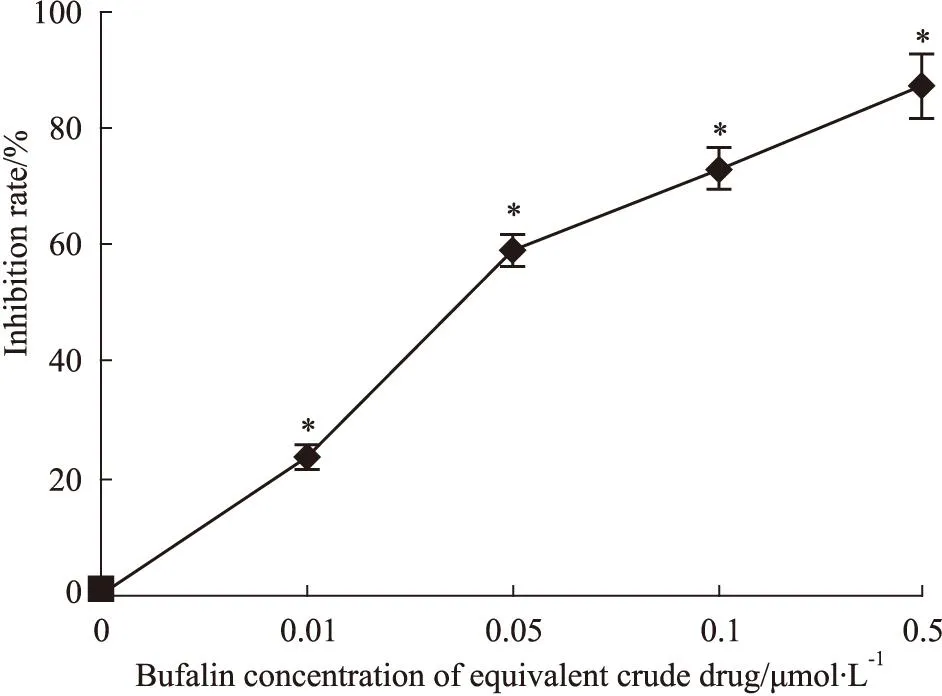
Fig 1 Bufalin inhibits colon number of K562 cell
**P<0.05vsthe untreated control
2.2蟾蜍靈阻滯K562細胞周期隨著蟾蜍靈藥物濃度增加,K562細胞處于G0/G1期的比例從(32.53±0.31)%逐漸升高到(58.97±2.61)%,而S期的比例則從(51.46±0.27)%逐漸降低到(30.72±1.53)%,K562細胞增殖指數從(62.27±0.51)%明顯下降到(40.61±2.01)%(P<0.05,P<0.01),提示蟾蜍靈能夠有效地阻滯K562細胞進入增殖周期S期,而停滯于G0/G1期(Tab 1、Fig 2)。
2.3蟾蜍靈抑制K562細胞中WT1表達K562細胞經不同濃度蟾蜍靈處理5 d后,Western blot結果顯示,隨著蟾蜍靈劑量增加,K562細胞中WT1蛋白表達明顯下降,呈劑量依賴性(Fig 3)。
2.4蟾蜍靈在裸鼠體內抑制K562皮下瘤重量和體積裸鼠接種K562細胞株后,皮下成瘤時間平均為5~10 d,移植后d 10所有裸鼠瘤塊都明顯可見,達到成瘤標準,d 21時處死裸鼠并取皮下瘤,游標卡尺測量瘤體體積及稱重。結果顯示,蟾蜍靈組和陽性對照組裸鼠皮下瘤重量和體積均明顯低于模型組(P<0.05),其抑瘤率則明顯高于模型組(Tab 2)。
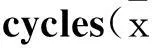
Tab 1 Effects of bufalin on K562 cell ±s,n=5)
**P<0.05,**P<0.01vsthe untreated control
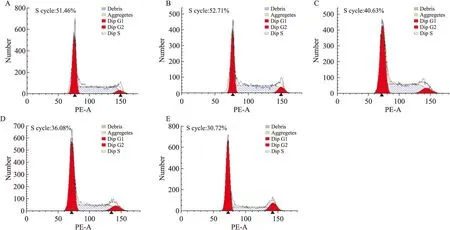
Fig 2Bufalin arrests cell cycle of
K562 cell(n=5)
A:0 μmol·L-1bufalin; B: 0.01 μmol·L-1bufalin; C:0.05 μmol·L-1bufalin; D:0.1 μmol·L-1bufalin; E:0.5 μmol·L-1bufalin
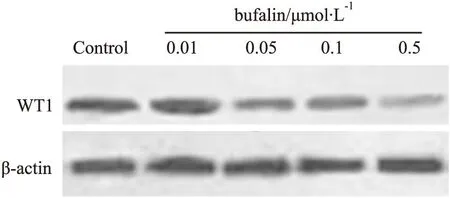
Fig 3 Expression of WT1 in K562 cells analyzed by Western blot

Tab 2 Effect of bufalin on nude mice
**P<0.05,**P<0.01vsmodel group
2.5蟾蜍靈誘導裸鼠皮下瘤壞死凋亡病理切片觀察各組裸鼠皮下瘤組織,低倍鏡及高倍鏡下均可見模型組瘤組織白血病細胞密集,數量多且生長旺盛,細胞異型性明顯,細胞核體積大,染色細膩,核質比明顯增加,并常見病理性核分裂像;蟾蜍靈組皮下瘤組織中出現不同程度的細胞壞死或凋亡,其中核固縮、核碎裂及核溶解現象明顯,細胞排列紊亂,結構不清,并伴隨出血、間質纖維化等改變;而陽性對照組皮下瘤組織亦發生了變性和壞死現象,與蟾蜍靈組相類似(Fig 4、5)。
2.6蟾蜍靈下調裸鼠皮下瘤組織中WT1蛋白表達各組裸鼠皮下瘤組織切片通過免疫組化染色,觀察瘤組織中WT1蛋白表達水平。結果顯示,模型組瘤組織WT1蛋白表達呈強陽性,鏡下顯示所有腫瘤細胞胞質內密集大量棕黃色陽性物質,瘤細胞均出現強陽性反應“”,提示WT1蛋白在模型組中呈高表達狀態;蟾蜍靈組皮下瘤組織在鏡下可見腫瘤細胞內WT1蛋白陽性表達率降低,數量明顯減少,其胞質內棕黃色顆粒樣物質亦減少,而腫瘤細胞壞死、凋亡現象多見,呈現弱陽性“+”,提示WT1蛋白在蟾蜍靈組皮下瘤組織中表達明顯降低;陽性對照組皮下瘤組織在鏡下可見大多數腫瘤細胞壞死、凋亡,細胞排列紊亂,結構不清,WT1蛋白陽性表達的腫瘤細胞少見,腫瘤細胞胞質內少見棕黃色顆粒,大多數細胞WT1表達水平很低,為“±”,提示高三尖杉酯堿亦可下調WT1蛋白的表達(Fig 6、7)。
3討論
白血病作為一種臨床常見惡性腫瘤,占所有惡性腫瘤總發病率的5%左右,隨著環境污染等原因,近年來發病率不斷攀升[3]。現階段白血病尤其是急性白血病的治療仍以化療為主,但是當前臨床常用的化療藥物存在不同程度毒副作用,例如目前常用的高三尖杉酯堿對緩解及治療白血病效果明顯,但其對心血管系統尤其是心肌的毒性作用仍不容忽視[4]。中藥治療腫瘤因其生物活性廣泛、作用緩和,并具有提高機體免疫力、調節內分泌功能、不易導致耐藥及骨髓抑制,且服用方便經濟等獨特優點,日益引起國內外學者的廣泛關注[5]。本實驗發現蟾蜍靈在體內外均可明顯抑制白血病細胞K562增殖,并可下調白血病特異性癌基因WT1蛋白表達,效果與化療藥物相當。

Fig 4 Effect of bufalin on morphology of K562 subcutaneous tumor in nude mice(100×)

Fig 5 Effect of bufalin on morphology of K562 subcutaneous tumor in nude mice(400×)

Fig 6 Expressions of WT1 in K562 subcutaneous tumor of nude mice detected by cell immunochemistry(100×)
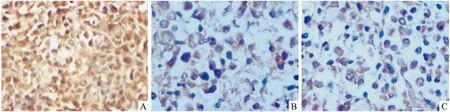
Fig 7 Expressions of WT1 in K562 subcutaneous tumor of nude mice detected by cell immunochemistry(400×)
WT1基因作為一種參與轉錄調控的雙相調節子,是細胞生長、發育過程中的重要調控分子,因發現最初可導致兒童腎母細胞瘤(Wilms′tumor-1)而得名[6]。近年來,在白血病細胞的研究中發現WT1基因參與造血調控,與多種造血生長因子相互作用調節基因的轉錄速度,進而參與造血細胞增殖、分化、凋亡等各個過程。正常人外周血細胞中WT1基因表達很低或無表達,而在多種白血病細胞株及約80%左右白血病患者中,該基因存在過度表達現象,發揮著癌基因的作用。如將這些白血病患者按照FAB分型,則其中分化類型較好的患者外周血中WT1基因表達陽性率明顯低于分化類型相對較差的患者,且隨著病情的惡化其表達相應逐漸增高,與預后不良正相關。因此,臨床上可用于白血病預后的判斷和微小殘留白血病(minimal residual disease, MRD)的監測[7],未來可能成為白血病基因治療和特異性免疫治療的新靶點。有研究顯示,在體外抑制白血病細胞增殖的同時,常可出現WT1基因表達下降[8],推測通過下調WT1表達可能抑制白血病細胞增殖并阻滯其細胞周期,與本文得到結果一致,但其中具體分子機制不詳,仍有待后續的進一步研究。
(致謝:本實驗工作主要在浙江省中西醫結合血液病研究所、國家中醫藥管理局“血液細胞分子生物學”三級實驗室及浙江中醫藥大學基礎醫學院形態研究所的大力支持下完成,在此予以感謝!)
參考文獻:
[1]Zhang L, Nakaya K, Yoshida T, et al. Induction of bufalin of differentiation of human leukemia cells HL-60, U937, and ML1 toward macrophage/monocyte-like cells and its potent synergistic effect on the differentiation of human leukemia cells in combination with other inducers[J].CancerRes, 1992,52: 4634-42.
[2]Numazawa S, Honma Y, Yamamoto T, et al. A cardiotonic steroid bufalin-like factor in human plasma induces leukemia cell differentiation[J].LeukRes, 1995, 19(12): 945-53.
[3]Krille L, Dreger S, Schindel R, et al. Risk of cancer incidence before the age of 15 years after exposure to ionising radiation from computed tomography: results from a German cohort study[J].RadiatEnvironBiophys, 2015, 54(1):1-12.
[4]劉志剛. 高三尖杉酯堿聯合方案治療高白細胞慢性粒細胞白血病療效分析[J]. 華西醫學, 2010, 25(8): 2421-2.
[4]Liu Z G. Curative effect of homoharringtonine united program on patients with chronic myelocytic leukemia[J].WestChinaMedJ, 2010, 25(8): 2421-2.
[5]趙燕娜,高瑞蘭,汪麗佩,等. 白藜蘆醇對K562白血病細胞抑制增殖和誘導分化的作用[J].中國藥理學通報, 2014, 30(6): 853-6.
[5]Zhao Y N, Gao R L, Wang L P, et al. Effect of resveratrol on proliferation and differentiation in K562 cells[J].ChinPharmacolBull, 2014, 30(6): 853-6.
[6]Tian F, Yourek G, Shi X, et al. The development of Wilms tumor: from WT1 and microRNA to animal models[J].BiochimBiophysActa, 2014, 1846(1):180-7.
[7]Steinbach D, Bader P, Willasch A, et al. Prospective validation of a new method of monitoring minimal residual disease in childhood acute myeloid leukemia[J].ClinCancerRes, 2015, 21(6):1353-9.
[8]Li Y, Wang J, Li X, et al. Role of the Wilms' tumor 1 gene in the aberrant biological behavior of leukemic cells and the related mechanisms[J].OncolRep, 2014, 32(6):2680-6.
Bufalin inhibits proliferation and downregulates expression of WT1 in K562 cellsinvivoandvitro
WANG Li-pei1, LI Tian-yi1, GAO Rui-lan2, DU Yue-guang1, ZHAO Yan-na2
(1.DeptofPathology,CollegeofBasicMedicalSciences,ZhejiangChineseMedicalUniversity,Hangzhou310053,China;2.ResearchInstituteofHematology,theFirstAffiliatedHospital,ZhejiangChineseMedicalUniversity,Hangzhou310006,China)
Abstract:AimTo investigate the effect of bufalin on proliferation and expression of WT1 in K562 cells.MethodsThe colony number of K562 cell was detected with semi-solid culture assay. The cell cycle was measured by flowcytometry, and the expression of WT1 was observed with immunocytochemistry. Subcutaneous tumor models established by K562 cells in BALB/C nu/nu mice were divided into three groups, including model group, bufalin group and positive control group. After 21 days, the subcutaneous tumors were removed for calculating the inhibitory rate of tumor growth. HE staining and immunohistochemistry were used to observe the morphological changes and the expression of WT1.Results① Bufalin could significantly decrease the colony number of K562 cell, arrest it at G0/G1phase and down-regulate its expression of WT1 in a dose-dependent manner. ② Compared with the model group, the tumor inhibitory rate was much higher, while the volume and the weight were obviously lower in the other two groups. ③ Bufalin could induce apoptosis, necrosis, hemorrhage and fibrosis with HE staining, and down-regulate the expression of WT1.ConclusionBufalin could inhibit the proliferation, arrest the cell cycle at G0/G1phase and down-regulate the expression of WT1 in vitro. Bufalin could inhibit the tumor inhibitory rate, the volume and the weight of the subcutaneous tumors, induce apoptosis, necrosis, hemorrhage and fibrosis with HE staining and down-regulate the expression of WT1.
Key words:bufalin; WT1; K562; cell cycle; G0/G1phase; subcutaneous tumor
文獻標志碼:A
文章編號:1001-1978(2016)02-0229-05
doi:10.3969/j.issn.1001-1978.2016.02.016
作者簡介:汪麗佩(1983-),女,博士,講師,研究方向:中西醫結合治療血液病,E-mail:wanglipei@gmail.com;趙燕娜(1984-),女,碩士,助理研究員,研究方向:中西醫結合治療血液病,通訊作者,E-mail:zyn77@126.com
基金項目:國家自然科學基金資助項目(No 81403223);浙江省自然科學基金項目(No LQ14H290003);浙江省醫藥衛生科技計劃項目(No 2014KYA151)
收稿日期:2015-10-26,修回日期:2015-11-30
網絡出版時間:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.032.html網絡出版地址:2016-1-25 15:57

