銅暴露對草魚幼魚代謝行為的影響
袁 喜,黃應平,靖錦杰,蔣 清,胥 燾,涂志英,李為民(1.三峽庫區生態環境教育部工程研究中心(三峽大學),湖北宜昌443002;2.三峽地區地質災害與生態環境湖北省協同創新中心(三峽大學),湖北宜昌443002;3.中國科學院水生生物研究所,武漢430072)
?
銅暴露對草魚幼魚代謝行為的影響
袁喜1,2,3,黃應平1,2*,靖錦杰1,2,蔣清1,2,胥燾1,2,涂志英1,2,李為民1,2
(1.三峽庫區生態環境教育部工程研究中心(三峽大學),湖北宜昌443002;2.三峽地區地質災害與生態環境湖北省協同創新中心(三峽大學),湖北宜昌443002;3.中國科學院水生生物研究所,武漢430072)
摘要:為了探討水體中銅污染對魚的生態毒理效應和游泳能力的影響,在實驗室條件下,測定了銅暴露草魚(Ctenopharyngodon idella)幼魚半致死濃度、不同濃度銅暴露(0、0.025、0.050、0.075、0.10 mg·L-1)96 h后組織(肝、鰓、肌肉)銅累積量、相對臨界游泳速度(Ucrit)以及耗氧率(MO2)。結果表明:與對照組比較,銅暴露對組織(肝、鰓、肌肉)銅累積量無顯著影響(P>0.05),銅對草魚幼魚的安全濃度為0.008 mg·L-1。銅暴露草魚幼魚相對臨界游泳速度受抑制顯著(P<0.05),不同濃度暴露后Ucrit分別較對照組下降了18.4%、21.8%、33.8%和38.1%。隨著游泳速度的增加,其速度-代謝率關系為MO2=a+b×Uc,隨著暴露濃度增加,速度參數c值增加,不同濃度銅暴露后c分別比對照組增加了37.78%、33.33%、56.67%和61.11%,表明游泳能量利用率下降。銅暴露導致草魚幼魚有氧代謝范圍增加,0.1 mg Cu·L-1時有氧代謝范圍比對照組增加了37.48%。銅暴露對草魚幼魚的游泳能力以及氧代謝行為產生影響,尤其是導致游泳效率降低、抑制游泳能力。
關鍵詞:草魚;銅;游泳能力;耗氧率
袁喜,黃應平,靖錦杰,等.銅暴露對草魚幼魚代謝行為的影響[J].農業環境科學學報, 2016, 35(2):261-265.
銅類殺菌藥物及肥料的使用造成養殖水體重金屬銅污染,并通過生物富集和生物放大效應對水生態系統產生重要影響,特別是對魚類等水生生物有較強的毒性[1-2]。作為水生生物食物鏈的頂層類群,魚體內污染物水平和魚對污染物產生的生物效應可客觀反映水環境的狀況。研究表明長江沉積物中重金屬銅的富集系數較高[3],關于重金屬銅在草魚(Ctenopharyngodon idella)組織中的積累與分布和毒性效應的研究文獻報道較多,銅對草魚存活率和生長[4]、體內酶活性、抗氧化功能、遺傳物質[5]等方面的影響已有相關研究。但目前關于銅暴露導致草魚幼魚代謝及行為變化的研究尚鮮見報道。
魚類生理生態行為對環境因子變化的適應性最先表現為行為上的改變[6],臨界游泳速度(Ucrit)在某種程度上反映了動物的有氧運動能力,代謝率范圍(Metabolicraterange)用于評價魚類的有氧代謝能力[7-8]。本文通過研究不同濃度水體銅暴露對草魚幼魚游泳能力與代謝范圍以及組織(鰓、肝、肌肉)銅累積量的影響,考察其幼魚因水體銅濃度變化而引發的運動和代謝方面的改變,從而評估銅污染對草魚幼魚潛在的生態毒性,為水生態毒理學基礎研究提供參考,對水體重金屬污染、水產品養殖及環境治理決策具有實際意義。
1 材料與方法
1.1實驗材料
實驗用草魚幼魚于2015年1月購于宜昌養殖場。實驗前將魚在實驗室魚缸(420 L)中馴化2周。每2 d投喂飼料1次,飼料成分:蛋白質>38%,脂肪>5%,纖維素<5%,灰分<12%,濕度<11%。馴養用水為曝氣后的自來水,馴養期間充氣使水體溶氧水平接近飽和,日換水量約為水體的1/3,自然水溫(15±1)℃,自然光照。在實驗前48 h停止喂餌料。
馴養結束后,選取健康幼魚60尾,隨機平均分配至各濃度梯度組,實驗魚體長、體重參數如表1。根據急性毒性試驗結果,本研究共設5個銅(Cu2+)濃度梯度,分別為0、0.025、0.050、0.075、0.10 mg·L-1,暴露時間為96 h。暴露期間不投餌,每日定時換水并補充相應濃度的硫酸銅溶液以保持水體銅濃度基本恒定,實驗條件與馴養期間保持一致。
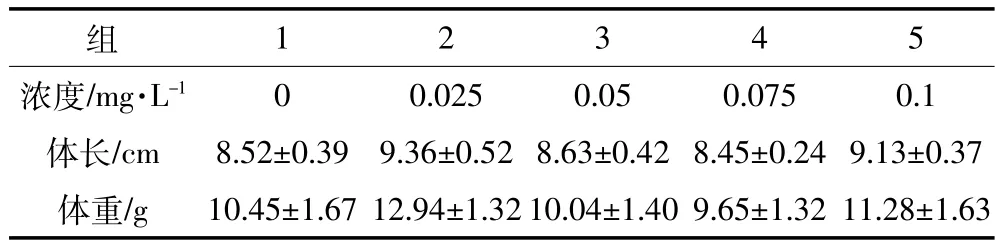
表1 草魚幼魚的體長、體重參數(平均值±標準差)Table 1 Body length and weight parameters of juvenile grass carp(mean±SD)
1.2實驗方法
采用魚類游泳能力測定裝置[9]測定草魚Ucrit。將每個處理實驗魚在暴露96 h后轉入游泳能力測定裝置中馴化2 h(流速為0.1 m·s-1)。適應結束后,采用逐步遞增法,直至實驗魚運動疲勞,其判定標準為:實驗魚被水流沖到游泳區后面篩網上貼網不能游泳,則視為疲勞[9]。Ucrit計算公式:

式中:Ucrit為臨界游泳速度,BL·s-1;U1為實驗魚所能完成的最大游泳速度(實驗魚疲勞前的速度),BL·s-1;U2為速度增量,BL·s-1;T1為在最大游泳速度下未能完成設定歷時的實際持續時間,min;T2為設定時間步長,min。
實驗中時間步長T2=30min,流速增量U2=1 BL·s-1。
實驗過程中每間隔5 min測定一次水中溶解氧含量,利用充氧泵進行內外水槽水的交換,使密封水槽溶解氧量不低于飽和溶解氧濃度的75%。游泳運動代謝率的計算公式:
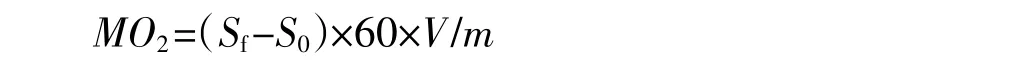
式中:MO2為標準體重的運動代謝率,mg O2·h-1· kg-1;Sf為實驗魚游泳時溶氧值隨時間變化斜率的絕對值(表觀耗氧量);S0是無實驗魚存在的溶氧值隨時間變化斜率的絕對值(細菌耗氧量);60為時間常數,min·h-1;V是實驗水體系統總體積,L;m為魚體重,kg。
代謝范圍為最大耗氧代謝率與最小耗氧率的差值。
魚體組織Cu2+含量測定:將草魚幼魚用丁香酚溶液麻醉后,解剖分離出鰓、肝臟、肌肉組織并于-40℃保存。將各組織樣本(以相同處理下12尾魚組織為一個樣本,分3組,對照組6尾魚)稱取2 g(濕重)并置于50 mL聚四氟乙烯消解罐中,加入4 mL HNO3(65%)過夜,然后加入2 mL HClO4(70%),電熱板上150℃加熱,蒸發至近干,冷卻后加適量0.1% HNO3,轉移到50 mL容量瓶,0.1%HNO3定容。采用SPEC TRA-240FS-石墨爐火焰型原子吸收分光光度計(Varian,美國)測定組織銅含量。利用標準物質法校準(DORM-2 National Research Council,Canada),回收率97.9%~108.3%。組織中重金屬含量用mg·kg-1(濕重,平均值±標準誤)表示。
1.3數據處理
實驗數據利用SPSS 20.0進行單因素方差分析(One-way ANOVA,Duncan post hoc test)并檢驗差異顯著性。統計數據表示為平均值±標準誤(Mean±S.E),顯著性水平為P<0.05。
2 結果與分析
2.1草魚幼魚鰓、肝臟、肌肉組織銅累積量特征
采用靜水急性毒性試驗法測定銅對草魚幼魚的毒性,統計銅污染暴露24、48、72、96 h后草魚幼魚死亡率,直線內插法計算獲得LC50分別為0.12、0.094、0.093、0.078 mg·L-1,根據96 h LC50×0.1計算安全濃度為0.008 mg·L-1。急性銅暴露下草魚幼魚鰓(F=2.04;P=0.16)、肝臟(F=1.99;P=0.17)和肌肉(F=1.99;P= 0.17)組織中銅累積量各處理間差異不顯著。銅暴露后幼魚組織中Cu2+的累積量如圖1所示。
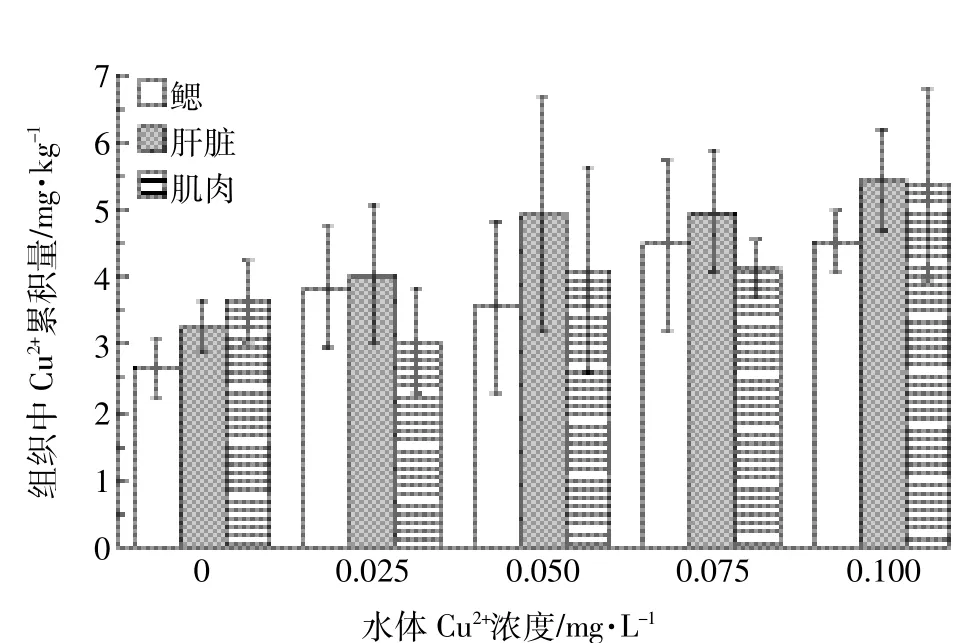
圖1 銅暴露后草魚幼魚鰓、肝臟、肌肉組織銅累積量Figure 1 Gill,liver and muscle copper contents in juvenile grasscarp after exposed to different copper concentrations
2.2銅暴露對草魚幼魚臨界游泳速度的影響
銅暴露對草魚幼魚臨界游泳速度的影響顯著(F=36.21,P<0.001),如圖2所示。隨著銅濃度增加,草魚幼魚相對臨界游泳速度逐漸下降,當銅濃度為0.075~0.10 mg·L-1時,草魚幼魚相對臨界游泳速度顯著降低(P<0.05)。對照組相對臨界游泳速度為(6.83± 0.24)BL·s-1,0.025、0.050、0.075、0.10 mg·L-1暴露組分別為(5.58±0.19)、(5.34±0.18)、(4.53±0.11)、(4.23± 0.05)BL·s-1,為對照組的81.61%、78.19%、66.24%和61.90%。
2.3銅暴露對草魚幼魚耗氧率及活動代謝的影響

圖2 銅暴露對草魚幼魚相對臨界游泳速度的影響Figure 2 Effect of copper exposure on Ucritin juvenile grass carp
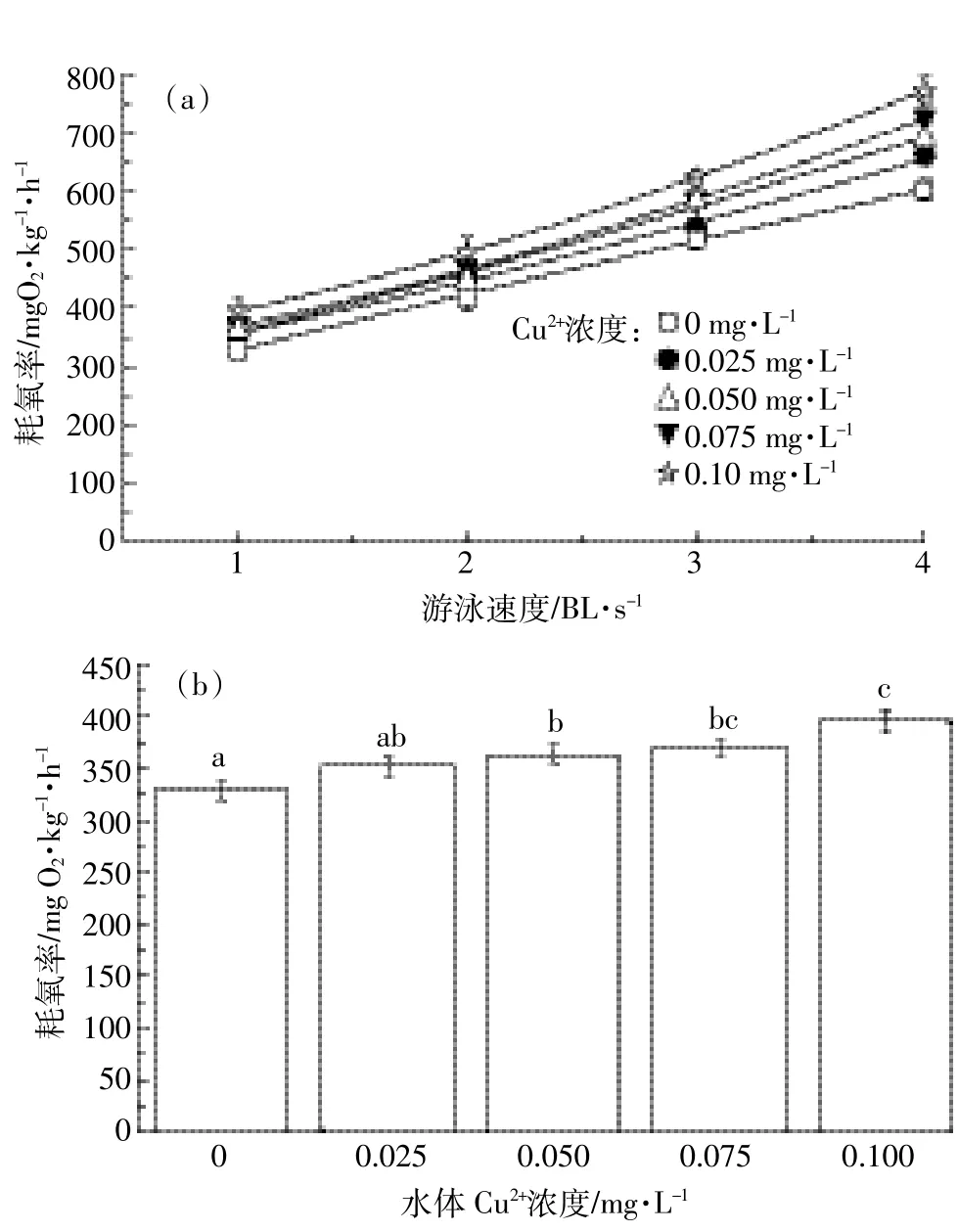
圖3 銅暴露對草魚幼魚代謝率(a)及活動代謝(b)范圍的影響Figure 3 Effect of copper exposure on metabolic rate(a)and metabolic rate range(b)of juvenile grass carp
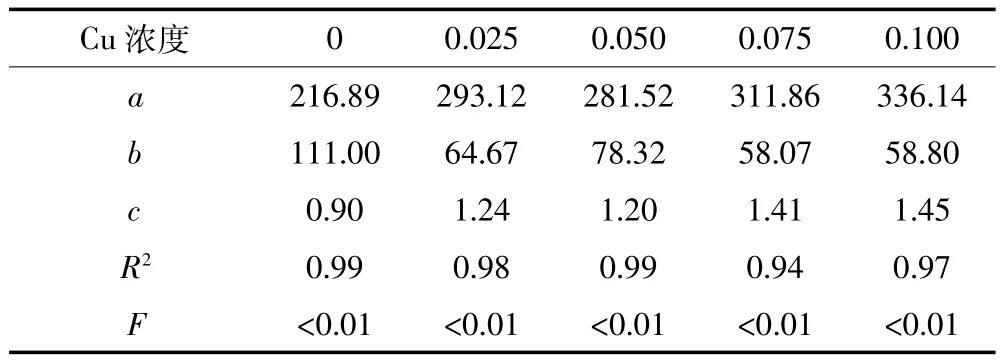
表2 不同銅暴露處理下草魚幼魚游泳速度與代謝率關系Table 2 Relationship between swimming speed and oxygen metabolic rate under different concentrations of copper exposed
圖3a顯示,隨著游泳速度的增大(1~4 BL·s-1),草魚耗氧代謝率呈增加趨勢。游泳速度與草魚幼魚代謝率可以用指數關系MO2=a+b×Uc表示(a、b、c為相關參數),其結果見表2。隨著暴露濃度增加,速度參數c值增加,不同濃度銅暴露使c分別比對照組增加了37.78%、33.33%、56.67%和61.11%。圖3b顯示,銅暴露對草魚幼魚有氧代謝范圍影響顯著(F=7.19,P= 0.005),隨著暴露濃度增加,有氧代謝范圍增大,濃度為0.10 mg·L-1時有氧代謝范圍比對照組增加了37.48%。
3 討論
在評價重金屬污染安全時,污染物毒性以及污染物對魚類行為影響的量化很重要,但是由于不同區系生物受生活環境等因素的影響,如不同物種對銅的耐受性和敏感度存在很大的差異[10]。如銅對廣東魴幼魚(Megalobramaterminalis)安全濃度為0.01 mg·L-1[11],而對中華鱘(Acipenser sinensis Gray)幼魚的安全濃度為0.002 mg·L-1[12],遠低于中國漁業水質標準(銅的最高容許質量濃度為0.01 mg·L-1)。本研究中Cu2+對草魚幼魚安全濃度為0.008 mg·L-1,根據有毒物質對魚類的毒性標準[13],可判斷Cu2+對草魚幼魚具有高毒性。鰓是魚類呼吸濾食的主要器官,直接暴露在重金屬環境中,因而對重金屬的積累較大;肝臟是金屬硫蛋白合成的主要場所,肝臟等組織中重金屬積累明顯;相對其他組織器官而言,肌肉代謝較慢,而且沒有直接暴露于重金屬。因此,魚類對重金屬的累積量為肝臟>鰓>肌肉[14-15]。銅暴露導致鰓和肝臟組織銅硫蛋白絡合物(Cu-MT)的含量明顯增加,加速了Cu2+在魚體內的代謝進程,多余的Cu2+結合蛋白進入血液循環,并排泄到體外[16]。因此急性銅暴露后,魚體肝臟、鰓和肌肉組織重金屬累積量無顯著差異。
魚類呼吸系統的變化能迅速反映出機體自身機能的變化,它們對外環境變化敏感,是反映機體機能狀態的重要指標。代謝率和代謝范圍的測定能在一定程度上反映魚類有氧運動的能力,對魚類行為測定具有重要的意義[17-18]。隨著暴露濃度增加,草魚幼魚呼吸代謝作用增強,有氧代謝范圍顯著增加(F=7.19,P<0.01)。Cu2+等重金屬產生毒性效應的途徑之一是誘導活性氧的產生[19]。在正常生理狀態下,魚類抗氧化系統能夠清除機體代謝所產生的活性氧;在其暴露于一定濃度污染物時,會誘導活性氧產生,導致相關抗氧化酶活性發生變化,對機體產生損傷[20]。低濃度Cu2+能夠誘導鰓組織補償(細胞增生、黏液分泌)反應[21],阻礙Cu2+的進入,降低鰓損害程度[22],而且銅暴露會刺激鰓膜以及口腔上皮,導致魚大量更頻繁地移動,使耗氧率增加[23]。本研究與其相似,低濃度銅暴露誘導產生補償性反應,草魚幼魚呼吸代謝作用增強。耗氧率和游泳速度呈冪函數關系MO2=a+b×Uc,其中反映游泳效率的速度常數c值越大游泳效率越低[9]。實驗中c值變化趨勢隨著暴露濃度的增加而上升,即銅暴露導致游泳效率下降。
研究表明,外源化學物質誘導所產生的解毒作用引起魚類代謝水平升高,能量大量消耗導致活動能力降低[24-25]。重金屬銅暴露使草魚幼魚能量的過量消耗,導致游泳能力的降低,不同濃度Cu2+暴露后Ucrit分別較對照組下降了18.4%、21.8%、33.8%和38.1%。另外,研究表明重金屬暴露可能導致神經細胞內鈣超負荷[26],甚至造成中樞神經系統結構損傷[27],影響神經細胞功能活動,阻礙了神經-肌肉突出的神經傳導[28],影響肌肉收縮。因此,Cu2+暴露導致草魚幼魚臨界游泳速度降低,也可能是神經系統損傷引起的。環境脅迫產生的應激行為反應機理十分復雜,涉及神經系統、內分泌系統及免疫系統的一系列活動,而且環境因素和重金屬之間的相互作用對不同年齡魚類運動和代謝行為影響的研究,在實際應用中具有更重要的生產實踐意義,有待進一步的研究。
4 結論
(1)Cu2+對草魚幼魚具有較高毒性,安全濃度為0.008 mg·L-1,草魚幼魚對Cu2+反應靈敏。急性銅暴露草魚肝臟、鰓和肌肉組織銅累積量無顯著差異。
(2)低濃度Cu2+暴露誘導刺激鰓膜以及口腔上皮產生應激性反應,導致草魚幼魚大量更頻繁地運動,呼吸代謝作用增強,能量過量消耗,游泳效率下降,游泳能力降低。
參考文獻:
[1] Hu M Y, Ye Y F, Xue L Y, et al. Tissue-specific metabolic responses of cyprinus flammans to copper[J]. Archives of Environmental Contamination & Toxicology, 2015, 69(1):112-122.
[2] Eyckmans M, Celis N, Horemans N, et al. Exposure to waterborne copper reveals differences in oxidative stress response in three freshwater fish species[J]. Aquatic Toxicology, 2011, 103(1/2):112-120.
[3]單麗麗,袁旭音,茅昌平,等.長江下游不同源沉積物中重金屬特征及生態風險[J].環境科學, 2008, 29(9):2399-2404. SHAN Li-li, YUAN Xu-yin, MAO Chang-ping, et al. Characteristics of heavy metals in sediments from different sources and their ecological risks in the lower reaches of the Yangtze River[J]. Environment Science, 2008, 29(9):2399-2404.
[4] Hamed N, Shima H, Esmail G, et al. Effect of sublethal doses of copper on growth performance and survival rate of grass carp(Ctenopharyngodon idella)[J]. American-Eurasian Journal of Toxicological Sciences, 2015, 4(3):138-142.
[5] Zhu Q L, Zhi L, Zhuo M Q, et al. In vitro exposure to copper influences lipid metabolism in hepatocytes from grass carp(Ctenopharyngodon idellus)[J]. Fish Physiology & Biochemistry, 2014, 40(2):595-605.
[6] Hansen J A, Woodward D F, Little E E, et al. Behavioral avoidance:Possible mechanism for explaining abundance and distribution of trout species in a metal-impacted river[J]. Environmental Toxicology & Chemistry, 1999, 18(2):313-317.
[7] Lee C G, Farrell A P, Lotto A, et al. Excess post-exercise oxygen consumption in adult sockeye(Oncorhynchus nerka)and coho(O. kisutch)salmon following critical speed swimming[J]. Journal of Experimental Biology, 2003, 206(18):3253-3260.
[8] Holt R E. Climate change in fish:Effects of respiratory constraints on optimal life history and behaviour[J]. Biology Letters, 2015,11(2). doi:10. 1098/rsbl. 2014. 1032.
[9] Tu Z, Li L, Yuan X, et al. Aerobic swimming performance of juvenile Largemouth bronze gudgeon(Coreius guichenoti)in the Yangtze River [J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology, 2012, 317(5):294-302.
[10]王振,金小偉,王子健.銅對水生生物的毒性:類群特異性敏感度分析[J].生態毒理學報, 2014, 9(4):640-646. WANG Zhen, JIN Xiao-wei, WANG Zi-jian. Taxon-specific sensitivity differences of copper to aquatic organisms[J]. Asian Journal of Ecotoxicology, 2014, 9(4):640-646.
[11]曾艷藝,賴子尼,楊婉玲,等.銅和鎘對珠江天然仔魚和幼魚的毒性效應及其潛在生態風險[J].生態毒理學報, 2014, 9(1):1673-5897. ZENG Yan-yi, LAI Zi-ni, YANG Wan-ling, et al. The toxicities and potential ecological effects of copper and cadmium to natural fish larvae and juveniles from the Pearl River[J]. Asian Journal of Ecotoxicology, 2014, 9(1):1673-5897.
[12]姚志峰,章龍珍,莊平,等.銅對中華鱘幼魚的急性毒性及對肝臟抗氧化酶活性的影響[J].中國水產科學, 2010, 17(4):731-738. YAO Zhi-feng, ZHANG Long-zhen, ZHUANG Ping, et al. Effects of antioxidant enzyme in liver and acute toxicity of Cu2+on juvenile Chinese sturgeon[J]. Journal of Fishery Sciences of China, 2010, 17(4):731-738.
[13]張志杰,張維平.環境污染生物監測與評價[M].北京:中國環境科學出版社, 1991. ZHANG Zhi-jie, ZHANG Wei-ping. Pollution of the environment monitoring and evaluation[M]. Beijing:China Environmental Science Press, 1991.
[14]周新文,朱國念, Jilisa Mwalilino,等.重金屬離子Cu、Zn、Cd的相互作用對Pb在鯽魚組織中積累的影響[J].農業環境科學學報, 2002, 21(1):23-25. ZHOU Xin-wen, ZHU Guo-nian, Jilisa Mwalilino, et al. Effect of the interaction of copper, zinc and cadmium on the accumulation of lead in the tissues of the Carassius auratus[J]. Journal of Agro-Environment Science, 2002, 21(1):23-25.
[15]周彥鋒,陳家長,楊光,等.重金屬鎘脅迫下鯽魚不同組織中金屬硫蛋白的動態變化[J].安全與環境學報, 2008, 8(3):18-21. ZHOU Yan-feng, CHEN Jia-zhang, YANG Guang, et al. On the dynamic variations of metallothionein in the different tissues of Carassius auratus due to the exposure of different concentrations of cadmium[J]. Journal of Safety and Environment, 2008, 8(3):18-21.
[16] Ghedira J, Jebali J, Bouraoui Z, et al. Metallothionein and metal levels in liver, gills and kidney of Sparus aurata exposed to sublethal doses of cadmium and copper[J]. Fish Physiology & Biochemistry, 2010, 36 (1):101-107.
[17] Palstra A P, Mes D, Kusters K, et al. Forced sustained swimming exercise at optimal speed enhances growth of juvenile yellowtail kingfish (Seriolalalandi)[J]. Frontiers in Physiology, 2014, 5:506-506.
[18] Yan G J, He X K, Cao Z D, et al. Effects of fasting and feeding on the fast-start swimming performance of southern catfish Silurus meridionalis[J]. Journal of Fish Biology, 2015, 86(2):605-614.
[19] Regoli F, Nigro M, Bertoli E, et al. Defenses against oxidative stress in the Antarctic scallop Adamussium colbecki and effects of acute exposure to metals[J]. Hydrobiologia, 1997, 355(1-3):139-144.
[20]孫翰昌,丁詩華,代梅,等. Cu2+對中華倒刺鲃超氧化物歧化酶活性的影響[J].西南大學學報(自然科學版), 2005, 27(5): 709-712. SUN Han-chang, DING Shi-hua, DAI-Mei, et al. Effect of copper on the activity of SOD(superoxide dismutase)in Barbodes(Spinibarbus sinensis)[J]. Journal of Southwest Agriculture University(Natural Science), 2005, 27(5):709-712.
[21] Arellano J M, Storch V, Sarasquete C. Histological changes and copper accumulation in liver and gills of the Senegal sole, Solea senegalensis [J]. Ecotoxicol Environ Safety, 1999, 44(1):62-72.
[22] Ortiz J B, Gonzalez de Canales M L, Sarasquete C. Quantification and histopathological alterations produced by sublethal concentrations of copper in Fundulus heteroclitus[J]. Ciencias Marinas, 1999, 25(1):119-143.
[23] Ohara J. Alterations in oxygen consumption by bluegills exposed to sublethal treatment with copper[J].Water Research,1971, 5(6):321-327.
[24] Hagenaars A, Vergauwen L, Benoot D, et al. Mechanistic toxicity study of perfluorooctanoic acid in zebrafish suggests mitochondrial dysfunction to play a key role in PFOA toxicity[J]. Chemosphere, 2013, 91(6):844-856.
[25] Xia J G, Nie L J, Mi X M, et al. Behavior, metabolism and swimming physiology in juvenile Spinibarbus sinensis exposed to PFOS under different temperatures[J]. Fish Physiology & Biochemistry, 2015, 41(5):1293-1304.
[26]馬軍,斯頎,葉廣俊.鎘對神經細胞內游離鈣濃度的影響[J].中國公共衛生學報, 1996, 4(1):21-23. MA Jun, SI Qi, YE Guang-jun. Effect of cadmium on intracellular free Ca2+concentration of nerve cell[J]. Chinese Journal of Public Health, 1996, 4(1):21-23.
[27] Lasley S M, Gilbert M E. Impairment of synaptic function by exposure to lead[M]//Evelyn T C. Methods in Pharmacology & Toxicology. Totowa N J: Humana Press, 2004:217-241.
[28] López E, Figueroa S, Oset-Gasque M J, et al. Apoptosis and necrosis:Two distinct events induced by cadmium in cortical neurons in culture [J]. British Journal of Pharmacology, 2003, 138(5):901-911.
YUAN Xi, HUANG Ying-ping, JING Jin-jie, et al. Effect of copper exposure on metabolism behavior of juvenile grass carp(Ctenopharyngodon idella)[J]. Journal of Agro-Environment Science, 2016, 35(2):261-265.
Effect of copper exposure on metabolism behavior of juvenile grass carp(Ctenopharyngodon idella)
YUAN Xi1,2,3, HUANG Ying-ping1,2*, JING Jin-jie1,2, JIANG Qing1,2, XU Tao1,2, TU Zhi-ying1,2, LI Wei-min1,2
(1. Innovation Center for Geo-Hazards and Eco-Environment in Three Gorges Area, China Three Gorges University, Yichang 443002, China;2.Engineering Research Center of Eco-Environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang 443002, China;3.Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Abstract:In this investigation, the eco-toxicological effects of copper on the swimming capability of juvenile grass carp(Ctenopharyngodon idella)were measured. Copper concentrations were measured in the gill, liver and muscle tissues of juvenile grass carp after a 96 h exposure to a range of copper concentrations; 0, 0.025, 0.050, 0.075 mg·L-1and 0.10 mg·L-1. Relative critical swimming speed(Ucrit)and metabolic rate(MO2)range were also measured after exposure. While the exposure did not significantly affect tissue concentrations(P>0.05), it did significantly affect Ucritand MO2range(P<0.05). The safe concentration for juvenile grass carp was 0.008 mg Cu·L-1. Compared to the control group, Ucritdecreased by 18.4%, 21.8%, 33.8% and 38.1% after 96 h exposure to 0.025, 0.05, 0.075 mg Cu·L-1and 0.10 mg Cu·L-1, respectively. The oxygen consumption rate increased exponentially with swimming speed; MO2=a+b×Uc. The speed parameter, c, increased with copper concentration by 37.78%, 33.33%, 56.67% and 61.11%, indicating a decrease in swimming efficiency. MO2range increased by 37.48% after exposure to 0.10 mg Cu·L-1copper. Exposure to copper polluted environment significantly affects the metabolism and swimming performance of juvenile grass carp, especially resulted in the decrease of swimming efficiency, inhibited swimming ability.
Keywords:Ctenopharyngodon idella; copper; swimming performance; oxygen consumption rate
*通信作者:黃應平E-mail:chem_ctgu@126.com
作者簡介:袁喜(1987—),男,湖北仙桃人,博士研究生,主要從事水污染控制及水生態研究。E-mail: chem_ctgu@126.com
基金項目:國家自然科學基金(51309140);國家水專項(2012ZX07104-003-04);湖北省創新群體項目(2015CFA021)
收稿日期:2015-09-26
中圖分類號:X503.225
文獻標志碼:A
文章編號:1672-2043(2016)02-0261-05
doi:10.11654/jaes.2016.02.008

