牦牛高原低氧適應研究進展
張思源+柴志欣+鐘金城
摘要: 人們對不同海拔地區的動物進行解剖學比較并利用基因組學等現代生物技術進行系統分析,得到了低氧適應解剖學依據并挖掘出100多種與低氧適應相關的重要候選基因,初步揭示了一些高原動物低氧適應的遺傳基礎和分子機制。牦牛是生活在青藏高原上的特有物種,是研究高原適應極好的模式動物,具有重要的研究價值。本文從牦牛的組織解剖、生理生化、低氧適應基因等方面綜合分析了牦牛對低氧環境適應的研究進展,為揭示牦牛低氧適應的分子機制和牦牛遺傳育種研究提供理論依據和參考資料。
關鍵詞: 牦牛;低氧適應;分子機制;低氧適應基因;研究進展
中圖分類號: S823.8+52 文獻標志碼: A 文章編號:1002-1302(2016)03-0013-05
氧氣是大多數生物生存的基礎物質,生物有機體的能量供應與代謝都與氧氣密不可分,海拔3 000 m以上的高原地區空氣中氧氣的含量是海平面的73%,海拔5 000 m地區氧氣含量僅是海平面的一半。當環境中氧氣濃度出現變化時,生物有機體會通過一系列調控來適應環境變化,平原地區生活的人或動物在高原生活一段時間,會對高原環境產生適應性,稱為“獲得性習服”,高原世居的人或動物在生理、生化和機體結構上表現出穩定的遺傳特征,對高原環境有較好的適應,稱為“遺傳性適應”[1-2]。生物機體對高原環境適應能力不足時,會對動物的生長、發育和繁殖等生理過程造成有害影響。經過數億年的自然選擇與進化,高原哺乳動物以特有的方式在高原低氧環境中生長繁衍[3]。常見的高原哺乳動物有牦牛、藏羚羊等,研究這些高原動物的低氧適應機制對畜牧業和農業生產都有重要的意義,同時低氧是癌癥等重大疾病產生和發展的重要原因,進行低氧適應原理研究,可為相關疾病的治療提供重要思路。
牦牛生活在海拔3 000 m以上的青藏高原及其周邊地區,是高原動物的代表物種之一,經過長期的自然選擇與人工選擇,牦牛在解剖結構、生理生化指標和基因功能等方面都已獲得穩定、獨特的高原低氧適應特征與機制,為當地牧民提供了不可或缺的生產、生活資料[4]。國內外對牦牛低氧適應性的研究已開展了多年,從組織器官水平到細胞分子水平的研究取得了一定的成就,本文從牦牛的組織解剖、生理生化指標、與低氧適應相關的基因等方面綜合分析了牦牛對低氧環境適應的研究進展,為揭示牦牛低氧適應的機制和牦牛遺傳育種研究提供一些理論依據和參考資料。
1 組織解剖結構與生理生化指標
高原動物長期生活在高原低氧環境中,組織器官形態結構、生理生化指標都有相應的適應性變化。在器官水平上,高原動物具有完善的氧氣輸送系統和強大的心肺攝氧、儲氧能力。在細胞水平上,高原動物相較于移居高原的同一物種在有氧代謝反應中所完成同一做功時耗氧量較少。研究結果表明高原世居動物很大程度上依靠組織適應性。
1.1 肺組織解剖學
肺行使氧和二氧化碳交換功能,還參與機體多種物質的合成與代謝,是呼吸系統中重要的功能器官。牦牛的肺質量約占體質量的1.1%~1.7%,肺臟有6個肺葉,左側2個——尖葉、膈葉,右側4個——尖葉、中葉、膈葉和副葉,肺表面有漿膜組成的胸膜臟層覆蓋,血管與淋巴管等間質結締組織深入肺內,將實質分為許多完整的肺小葉。肺臟由導氣部和呼吸部2個部分組成,肺導氣部包括葉支小管、小支氣管、細支氣管和終末細支氣管,肺呼吸部則由呼吸性細支氣管、肺泡管、肺泡囊和肺泡組成。牦牛肺部氣管粗大,呼吸性細支氣管結構明顯,管壁由假復層柱狀上皮和單層立方上皮間錯排列,上有肺泡開口[5]。肺泡管的斷面數量多,其管壁具有典型的膨大結節。肺泡是構成肺和肺進行氣體交換的主要結構。牦牛肺泡表面積大且多為多面形囊泡、球形或半球形狀,大多數是扁平的Ⅰ型肺泡上皮細胞,位于肺泡壁,其上皮出現小孔,而立方的Ⅱ型肺泡上皮細胞突出在肺泡腔。肺泡隔有2種,一種是肺泡隔厚的區域呈淡紅色半透明薄膜狀,中間可以觀察到一些紅細胞,偶爾可見其他細胞成分,另一種是肺泡隔薄的區域呈線狀,可見扁平的細胞核,無紅細胞[6]。
對不同海拔地區牦牛肺臟解剖學研究表明,高海拔地區牦牛明顯比低海拔地區牦牛單位面積內肺泡數目多,高海拔牦牛肺泡隔的厚度明顯增加,同時也觀察到肺泡隔內毛細血管明顯而豐富,在肺泡隔中占很大的比例。高原牦牛較平原黃牛,氣管短而粗大,軟骨環距離較大,含有較豐富的肌肉、纖維組織和支氣管軟骨。牦牛肺泡隔厚度顯著大于黃牛,且肺泡發育速度較快。牦牛氣-血屏障隨日齡逐漸減小,黃牛則不斷增厚。牦牛肺泡隔充分呼吸呈細線狀,肺泡的快速發育,氣管的形態學特點,氣-血屏障厚度的變化等都為了滿足牦牛在生長發育的過程中對氧氣的需求,更方便于牦牛肺部的氣體交換,便于牦牛個體發育與適應高原低氧環境[7]。
1.2 心血管形態學與血液生理指標
心臟是血液循環的動力器官,血液循環是攜帶氧氣供應全身的唯一循環系統,在能量代謝上起著重要的生理功能。牦牛心臟占總體質量的0.5%~0.8%,對牦牛心臟解剖顯示牦牛右心室肉柱側壁與室間相連處較明顯,左心室肉柱較少且位于隔壁下部,心臟主動脈半月瓣比較發達,在心臟主動脈口的纖維環處出現心骨[9]。紅細胞(RBC)、血紅蛋白(HB)和紅細胞壓積容量(PCV)是反映動物呼吸、運輸等機體性能的重要生理指標,采用顯微鏡法和氰化高鐵法等對牦牛血液進行測定發現RBC、HB和PCV含量在公、母牦牛間無顯著差異;而不同海拔地區牦牛進行比較,生活在高海拔地區的牦牛血液中RBC、HB和PCV明顯偏高[10]。心臟解剖發現牦牛左心室壁較厚且還擁有粗大的心肌纖維素。微循環是血液循環中的最小功能單位,針對牦牛心肌微動脈研究認為:心室壁微動脈走形彎曲甚至扭曲成團、入肌束后呈“T”形甚至呈“Y”形,這些都與狗等平原家畜相似,是經典的“樹皮樣”結構[11]。牦牛心室壁毛細血管的前微動脈表面有明顯的環狀縮窄,同一動脈分出的毛細血管很少匯入同一靜脈,牦牛微靜脈以其獨特的“樹根樣”區別于其他家畜的“生姜根樣”,微靜脈血管肌束間比肌束內粗大,且微靜脈垂直于心肌纖維,有利于血液循環[11-12]。
牦牛機體血液中含氧量下降時,造血功能增強促使RBC、HB和PVC升高,以滿足機體對氧的需求。牦牛微動脈的扭曲有效地增加了血流阻力,從而調節血流量,微靜脈的形狀結構有利于血液的回流,肌束內外大小的差異是承受不同壓力的結果。牦牛同時還存在肺泡內毛細血管多而明顯,血管壁較薄和肺動脈不高等特點。這些形態結構有利于血液循環和氧氣的輸送,增加氧氣利用率,為牦牛高原低氧適應提供解剖形態學和生理生化依據[10,12-13]。
2 低氧適應分子基礎研究
2.1 血管內皮生長因子(VEGF)基因
血管是動物血液流動的生命管道,起著運輸氧氣、營養物質和代謝廢物的作用,血管內皮生長因子( vascular endothelial growth factor,VEGF) 又稱血管通透因子(vascular permeability factor,VPF),廣泛分布于人和動物各個組織,有完整的血小板衍生性生長因子(plate-derived growth factor,PDGF)家族蛋白結構功能域,是內皮細胞增殖和血管再生的關鍵調控因子,該蛋白質是親水性分泌蛋白,N端有分泌信號。VEGF蛋白的不同亞型是由基因的不同剪接方式決定的,是唯一對血管能特異性形成的生長因子。據研究VEGF是最強的血管通透性因子,比組織胺強5 000倍,不受組織胺抑制劑抑制,能形成纖維素網絡,為毛細血管芽生長延伸提供基質。給兔靜脈滴注VEGF可導致動脈壓下降,低氧環境可以刺激VEGF-A及其受體在動物和人組織細胞、內皮細胞中發揮促進新生血管內皮細胞生長增殖及增加血管通透性的功能。VEGF是通過小泡囊形狀的細胞器(vesichlar vacuolar organelle,VVO)引起內皮細胞窗子開放,進而導致血管通透性增加。VEGF對心肌力收縮基本無影響,卻能降低血管外周阻力,增加心率和心輸出量[16]。
利用分子克隆技術和生物信息學等方法對牦牛VEGF-A基因進行分析,VEGF-A基因序列長度為653 bp,開放閱讀框長573 bp,可編碼190個氨基酸;編碼的多肽鏈具有親水性,該蛋白是一種表面蛋白,有4個磷酸化位點。牦牛VEGF-A基因中檢測到2個SNP,PCR-RFLP分型認為在SNP g.15853G>A位點上G>A可更好地適應高原低氧,中性檢測證實2個位點受牦牛所處地理環境的選擇作用。Real-time PCR技術對高原牦牛和高原黃牛不同組織比較發現,牦牛VEGF-A基因在肺部、胰腺中表達量更高一些。牦牛與黃牛VEGF-A基因蛋白序列相同,肺部表達量不同說明低氧適應可能與基因表達量有關,且低氧適應調節主要在肺和脾[17]。
2.2 內皮PAS1蛋白(EPAS1)基因
紅細胞是攜帶氧氣,供機體代謝的運輸載體。各個組織器官的氧氣交換都與血管和紅細胞密不可分,通過對世居高原人和動物的全基因組掃描(whole genome scans)以及候選基因分析[18],挖掘出3個與低血紅蛋白(Hb)濃度有關的基因:EPAS1、EGLN1(EGL nine homolog1)和PPARA(peroxisome proliferator activated-α)基因。內皮PAS1蛋白(EPAS1)又稱缺氧誘導因子2(hypoxia induced factor-2,HIF-2),其主要存在于內皮細胞,大多數由低氧引起的因子或酶的變化均通過EPAS1作用,EPAS1是應激缺氧的關鍵轉錄因子[19]。EPAS1 蛋白是由HIF-1β和HIF-2α組成的異二聚體蛋白質復合物,HIF-2α是調節亞基[20],由bHLH(Basic helix-loop-helix)、PAS(Per/Arnt/Sim)、ODD(oxygen-dependent degradation)和TAD(transactivation domain)4個結構域組成,其中前2個結構域可以介導α和β亞基形成二聚體,與缺氧反應元件(HRE)結合,ODD結構域被脯氨酞羥化酶羥化后使HIF-2α泛素化被蛋白水解酶降解,從而在正常氧濃度情況下細胞內含量較少,處于動態平衡。缺氧條件下,HIF-2α泛素化降解途徑被抑制,形成穩定EPAS1誘導靶基因發揮功能,TAD結構域在HIF-1α和HIF-2α特異調節靶基因中起主導作用。EPAS1 作用的靶基因主要是與能量代謝、血管生長和骨髓造血等相關的基因,這些靶基因中都含有缺氧反應元件( HRE),EPAS1 通過識別核心序列與結合誘導靶基因的轉錄,介導細胞對缺氧的應答[21]。Morita 等發現EPAS1 是 EPO 的主要調節者[22],隨后研究發現,環境中氧氣濃度下降時,細胞會上調VEGF-A和EPO等一系列低氧調節基因的表達量,其中 EPO 的表達量增加是由于 EPAS1 的高表達導致的,在上調表達量的過程中EPAS1蛋白起著紐帶作用,所以多數低氧引起上述酶或因子的變化EPAS1蛋白起關鍵作用。關于人類進入高原腸內鐵的吸收量增加,經研究發現也與EPAS1有關[23]。
吳曉云等對牦牛EPAS1基因的研究顯示,該基因開放閱讀框長2 613 bp,可編碼870個氨基酸,蛋白表現為親水性,是非分泌蛋白。基因中檢測到3個特異性的SNP,群體中的SNP位點都是高度連鎖的狀態,某一基因型表現顯著的海拔差異性。EPAS1基因可作為低氧適應的分子信標,該基因在肺部的表達量豐富,在牦牛體內表達量顯著低于平原黃牛,同時EPAS1基因對VEGF-A基因也有調控作用[17]。
2.3 促紅細胞生成素(EPO)基因
促紅細胞生成素(EPO)主要由腎臟合成,少部分由肝臟和有核紅細胞等合成。EPO促進進入紅細胞系的骨髓多能造血干細胞的增生、分化,進而調節紅細胞數量的主要刺激因子,由低氧誘導和雌激素誘導產生,基因的3′非編碼區包含低氧誘導因子反應元件[24]。EPO的促進紅細胞生成生物學功能是通過特異的促紅細胞生成素受體(EPOR)介導完成的;兩者相互結合后,通過信號傳導途徑來調節紅細胞系的增生與分化[25]。EPOR是造血細胞因子受體超家族成員之一,屬于細胞因子受體,其結構可分為3個部分:胞質部分,跨膜區域,細胞外部分。胞質部分不具有酪氨酸激酶活性,是因為缺少酪氨酸激酶的特征排列順序,所以只有1種亞單位與EPO作用形成同源二聚體,再通過JAK/STAT途徑和Ras/MAP途徑等來傳導信號[26]。色氨酸-絲氨酸-X-色氨酸-絲氨酸結構(WSXWS)是造血細胞超家族共有的特征,而EPOR是此家族中的一員。研究認為WSXWS 結構對EPOR正確構象的形成、蛋白體的組裝、配體的激活等具有重要的作用[27]。
牦牛EPO基因由5個外顯子和4個內含子組成,不同地區牦牛該基因大小約在3 260 bp左右,編碼區長1 527 bp,編碼508個氨基酸,彼此同源性較高,但有差異。對不同地區牦牛EPO基因多態性分析發現其遺傳多樣性比較豐富,基因型與牦牛所處海拔有明顯關系[28-29]。
2.4 低氧誘導因子1(HIF-1)基因
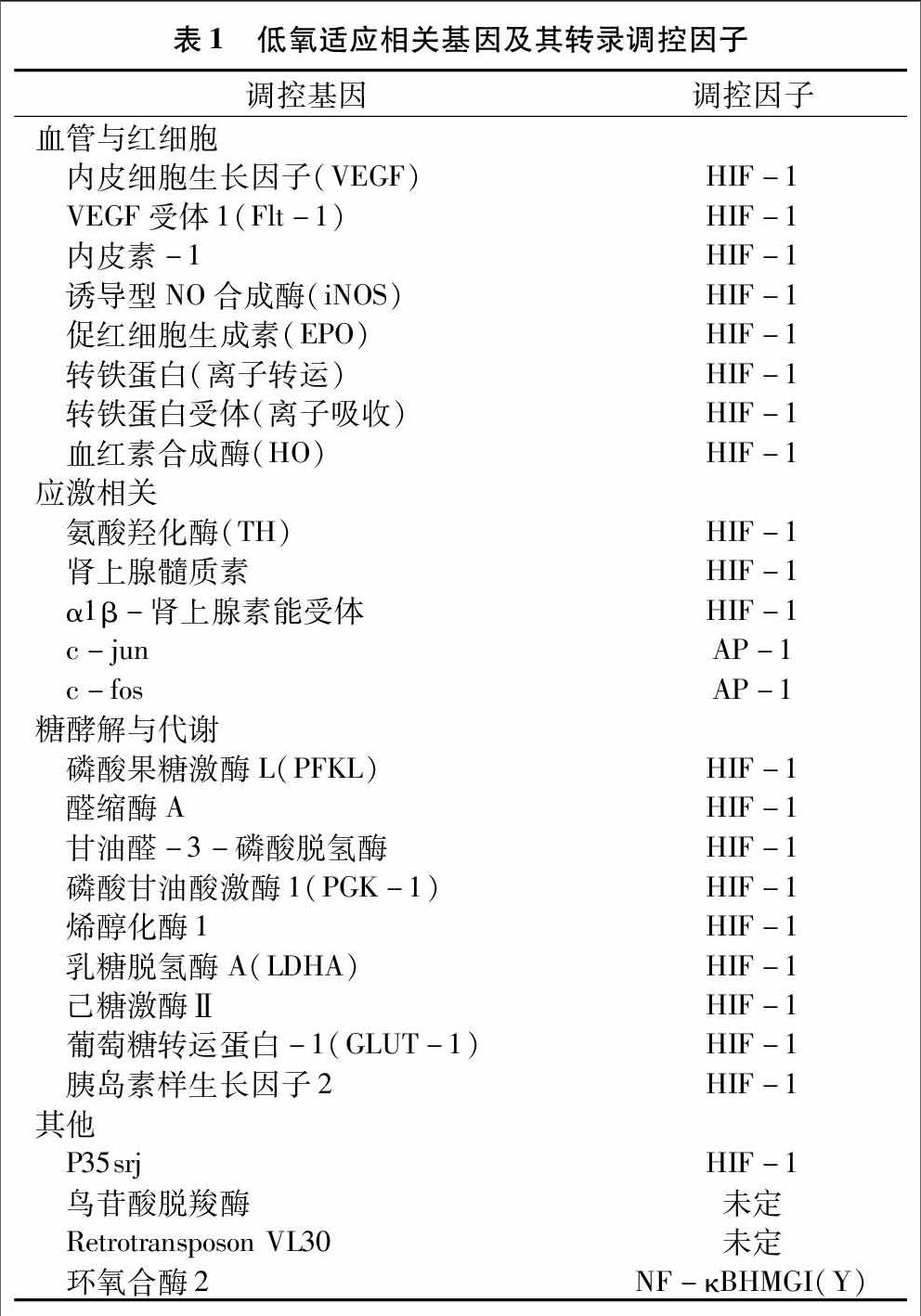
低氧誘導因子1(Hypoxia inducible factor-1 alpha,HIF-1)是參與缺氧誘導適應性反應中重要的蛋白轉錄調節因子[30],具有DNA結合活性。HIF-1是氧濃度敏感性元件,正氧(normoxia)條件下不穩定,半衰期低于5 min,一直處于被合成和降解的狀態,在缺氧環境培養的細胞核中可以檢測到。HIF-1由α和β 2種亞基構成,2個亞基均為含有PAS和bHLH結構的轉錄因子家族成員,α與β亞基還包括入核信號(NLS)和羧基末端的反應活化結構域(TAD),可能參與轉錄起始復合物反應,從而影響基因轉錄。α亞基是調節HIF-1活性的功能單位,而β亞基則是組成性表達,與保持HIF-1結構穩定和活性構象轉變有關[31]。目前發現α亞基有HIF-1α、HIF-2α和HIF-3α 3種,三者表現形式均不相同,都受氧氣濃度調節,與β結合發揮不同的靶基因調控功能,并能夠作為核心與基因產物一起組成復雜的低氧調控網絡。對高原人群全基因組掃描(GWADS)[32]發現HIF-2α基因在人對低氧環境中的調節起核心作用。HIF-1作為低氧適應的主要調控因子(表1)[33],可以參與調控血管形成和紅細胞生成、糖酵解與糖代謝、應激反應等過程。
利用半定量反轉錄PCR和實時定量反轉錄PCR技術研究表明,在牦牛心、肝、肺和肌肉等組織中HIF-1均有表達,其中睪丸與脾中表達量最高,肌肉表達量最低[34]。
2.5 線粒體基因
線粒體是一個半自主細胞器,細胞內約90%的O2被線粒體的氧化磷酸化過程消耗,線粒體處于能量傳遞的中心,是生物體代謝的主要能量供應“工廠”[35]。線粒體基因組編碼區有37個基因,包括12S rRNA和16S rRNA等2個rRNA、TA和TR等22個tRNA,包含3個細胞色素C氧化酶的13個編碼蛋白質的功能基因。這些基因都參與到呼吸鏈中構成酶或反應復合物的組成,這些基因的突變與表達量的差異都會直接或間接影響呼吸鏈的正常運轉,在低氧適應中起著重要作用。作為動物中對低氧反應最敏感的細胞器,線粒體在低氧環境應激反應中起重要作用,高原動物線粒體基因通過多態性來適應高原低氧的環境。細胞在低氧環境中應激時最大的威脅是電子傳遞鏈中電子受體氧分子供應不足導致大量的活性氧(reactive oxygen species,ROS)產生[36]。ROS可以使蛋白質、脂類和DNA等一些大分子物質氧化損傷,甚至有些細胞器也被氧化,進而影響細胞及機體的正常代謝。科學家研究發現線粒體通過自噬的方式解決這一難題,來增加生物機體的高原低氧適應,同時線粒體還可以改變自身的形態結構、數目[37]以及優化呼吸鏈反應體系提高呼吸鏈作用效率來應對低氧環境[38-39]。
通過測定牦牛心肌、骨骼肌線粒體總抗氧能力(T-AOC)、乳酸脫氫酶(LDH)和超氧化物歧化酶(SOD)等的含量來研究線粒體氧自由基代謝,結果顯示線粒體抗氧化能力隨海拔升高而不斷增強。對牦牛骨骼肌線粒體的平均截面積、平均體積和面數密度等超微結構與平原黃牛對比研究,發現牦牛線粒體小而多,密度大,面積隨年齡有先降后升的特點,在出生和發育過程線粒體結構形態的變化都表現出良好的遺傳學特點[40-41]。
2.6 其他重要基因
在低氧環境中,細胞中一部分控制糖代謝的酶類和相關基因的表達量將上調,使得細胞內主要通過糖酵解來維持ATP的供應。研究發現因谷胱甘肽硫轉移酶(glutathione S-transferase,GST) 基因的存在使得長期生活在高海拔地區的人或動物體內并未產生過多引起脂質氧化的活性氧。閆惠琴等[3]研究發現GSTT1缺失基因型頻率在高原與平原人之間存在著顯著差異,GSTT1-105變異基因型頻率差異也十分顯著,所以GSTT1和GSTP這2種基因可能與高原低氧適應有關。通過群體遺傳學統計的方法用基因組掃描和外顯子測序技術對藏族人高海拔環境適應性進行研究,挖掘出EPAS1、過氧化物酶體增殖物激活受體(PPARA)和脯氨酸羥化酶-2(EGLN2)等候選基因參與能量代謝通路調控過程,與低氧誘導因子活性也密切相關[18,32]。熱休克蛋白( heat shock protein,HSP)基因具有保護機體或細胞的功能,其中HSP70基因與高原低氧環境下是否患高山病有很大關系。研究顯示肺泡表面活性物質相關蛋白(pulmonary surfatcant-associated protein,SP) 基因SP-A能夠增強Ⅱ型肺泡細胞的氧化能力。對SP的多態性分析發現SP基因多個多態性位點與高原低氧適應相關聯。葡萄糖轉運體1( glucose transporter 1,GLUT-1)在低氧環境中其數量與活性會明顯升高,對該基因進行SNP檢測,同樣也發現與高原低氧適應相關聯的SNP[42]。
3 低氧適應基因組學研究
為全面了解與低氧適應相關基因的調節作用,Karen等利用抑制性消減雜交技術(subtractive suppression hybridization,SSH)創建了1個 cDNA 文庫來確定低氧反應信號轉換通路和相關基因,并使用該文庫創立微陣列檢測,篩選與缺氧耐受能力相關的基因型。該文庫涵蓋了300多個低氧上調表達的表達序列標記和基因。SSH文庫除擁有低氧適應主要相關基因外還涵蓋了參與糖代謝、細胞凋亡和神經傳導等方面的相關基因,這些低氧調節相關基因已通過微陣列分析法、實時 PCR 法和蛋白印跡法得到驗證[43]。
對牦牛基因組水平的進化分析,可以識別進化過程中自然選擇對牦牛基因組的影響,并能進一步解析牦牛多種抗逆特性的分子機制及其適應高原環境的能力。使用共線性的方法,從人、黃牛和牦牛等7個物種中鑒定了8 923個高質量的同源基因,對這些同源基因做抗逆適應性進化分析,結果顯示牦牛中與能量代謝和低氧應答相關的基因進化速率明顯快于黃牛。將同源基因進行自然選擇分析,識別了5個(Camk2b、Gcnt3、Hsd17b12、Whscl、Glul)與營養能量代謝以及3個(Adam17、Arg2、Mmp3)與低氧應答相關的正選擇基因,這些基因可能與牦牛在高原地區牧草資源稀缺的環境下維持高效的能量代謝以及低氧環境生存密切相關。此外,分子鐘方法估算表明牦牛和黃牛大約在500萬年前分化,這與人和黑猩猩的分化時間基本相同[44]。
4 展望
我國有上千萬人生活在面積約250萬km2的高原之上,每年有大量的游客去高原,游客中有很多為高原不適應者。對低氧適應分子機制的研究將有助于對這些人的體質進行判斷,并進行相應的治療。低氧代謝通路與多種疾病如心血管疾病、腫瘤的發生發展密切相關[45]。隨著全球人口的快速增長,高原的戰略地位也愈顯重要。人們在過去的30年里投入了大量的人力物力進行低氧分子機制的研究,高海拔適應是許多基因調控和蛋白結構的協調變化,同時也需這些基因相互作用。目前,對藏羚羊的低氧適應“遺傳基礎”[46]與藏獒低氧適應機制[47]研究有了突破性進展,對牦牛低氧適應的研究雖已經取得一定的成績,但就揭示牦牛高原低氧適應生理機理和分子機制還有一定距離,有許多問題需要進一步研究與探討,如基因組分析中基因組的充分注釋、相關候選基因試驗驗證和轉錄組的研究等。為更全面了解高海拔適應的分子機制,需擴大基因組研究的范圍,并對序列多態性與轉錄變異分析等進行整合分析。全基因組基因表達變化的分析增加我們對高原適應轉錄調控變異的了解,總的來說研究牦牛對高原低氧適應,應該多領域、多學科共同分析與研究。
參考文獻:
[1]Ge R L,Chen Q H,Wang L H,et al. Higher exercise performance and lower VO2max in Tibetan than Han residents at 4 700 m altitude[J]. Journal of Applied Physiology,1994,77(2):684-691.
[2]Ge R L,He G W,Chen Q H,et al. Comparisons of oxygen transport between Tibetan and Han residents at moderate altitude[J]. Wilderness & Environmental Medicine,1995,6(4):391-400.
[3]Hassanin A,Ropiquet A,Couloux A,et al. Evolution of the mitochondrial genome in mammals living at high altitude:new insights from a study of the tribe Caprini (Bovidae,Antilopinae)[J]. Journal of Molecular Evolution,2009,68(4):293-310.
[4]Cai L,Wiener G. The yak[R]. Bangkok,Thailand:FAO Regional Office for Asia and the Pacific,1995:47-52.
[5]楊 波. 不同年齡牦牛肺臟支氣管系的形態結構[D]. 蘭州:甘肅農業大學,2010.
[6]成令忠,鐘翠平,蔡文琴. 現代組織學[M]. 上海:上海科學技術文獻出版社,2003.
[7]楊 琨. 牦牛胎兒肺臟發育的形態學研究[D]. 蘭州:甘肅農業大學,2012.
[8]魏 青. 不同發育階段高原牦牛和平原黃牛肺泡顯微結構的研究[D]. 西寧:青海大學,2007.
[9]俞紅賢,莫重存. 青海牦牛心臟的比較解剖學特點[J]. 黑龍江畜牧獸醫,2000(6):4-5.
[10]李春生. 大通牦牛生理生化指標的測定[J]. 黑龍江畜牧獸醫,2014,2(3):168-170.
[11]Brown R E. The pattern of the microcirculatory bed in the ventricular myocardium of domestic mammals[J]. The American Journal of Anatomy,1965,116(2):355-374.
[12]賀延玉. 犢牦牛和成年牦牛心臟微血管構筑的研究[D]. 蘭州:甘肅農業大學,2007.
[13]伊平昌,顧冬花. 大通縣高原型牦牛12項血液指標的測定[J]. 四川畜牧獸醫,2014(2):29-30.
[14]Toi M,Matsumoto T,Bando H. Vascular endothelial growth factor:its prognostic,predictive,and therapeutic implications[J]. The Lancet Oncology,2001,2(11):667-673.
[15]Olofsson B,Jeltsch M,Eriksson U,et al. Current biology of VEGF-B and VEGF-C[J]. Current Opinion in Biotechnology,1999,10(6):528-535.
[16]Mkinen T,Jussila L,Veikkola T,et al. Inhibition of lymphangiogenesis with resulting lymphedema in transgenic mice expressing soluble VEGF receptor-3[J]. Nature Medicine,2001,7(2):199-205.
[17]吳曉云. 牦牛EPAS1和VEGF-A基因的克隆、SNPs檢測及其表達分析[D]. 蘭州:甘肅農業大學,2012.
[18]Simonson T S,Yang Y Z,Huff C D,et al. Genetic evidence for high-altitude adaptation in Tibet[J]. Science,2010,329(5987):72-75.
[19]Favier J,Kempf H,Corvol P,et al. Coexpression of endothelial PAS protein 1 with essential angiogenic factors suggests its involvement in human vascular development[J]. Developmental Dynamics,2001,222(3):377-388.
[20]Hu C J,Wang L Y,Chodosh L A,et al. Differential roles of hypoxia-inducible factor 1alpha (HIF-1α) and HIF-2α in hypoxic gene regulation[J]. Molecular and Cellular Biology,2003,23(24):9361-9374.
[21]Asikainen T M,Ahmad A,Schneider B K,et al. Stimulation of HIF-1α,HIF-2α,and VEGF by prolyl 4-hydroxylase inhibition in human lung endothelial and epithelial cells[J]. Free Radical Biology and Medicine,2005,38(8):1002-1013.
[22]Morita Masanobu,Ohneda O,Yamashita T,et al. HLF/HIF-2α is a key factor in retinopathy of prematurity in association with erythropoietin[J]. The EMBO Journal,2003,22(5):1134-1146.
[23]Reynafarje C,Lozano R,Valdivieso J. The polycythemia of high altitudes:Iron metabolism and related aspects[J]. Blood,1959,14(4):433-455.
[24]Jacobson L O,Goldwasser E,Fried W,et al. Role of the kidney in erythropoiesis[J]. Nature,1957,179(4560):633-634.
[25]Sawyer S T,Penta K. Association of JAK2 and STAT5 with erythropoietin receptors. Role of receptor phosphorylation in erythropoietin signal transduction[J]. The Journal of Biological Chemistry,1996,271(50):32430-32437.
[26]Mulcahy L. The erythropoietin receptor[J]. Seminars in Oncollogy,2001,28:19-23.
[27]Yoshimura A,Zimmers T,Neumann D,et al. Mutations in the Trp-Ser-X-Trp-Ser motif of the erythropoietin receptor abolish processing,ligand binding,and activation of the receptor[J]. The Journal of Biological Chemistry,1992,267(16):11619-11625.
[28]鐘金城. 牦牛幾個功能基因的結構及其系統進化研究[D]. 成都:電子科技大學,2008.
[29]許海霞,吳建平,張利平,等. 牦牛、黃牛和綿羊EPO基因部分片段遺傳多態性分析[J]. 中國獸醫學報,2013,33(6):950-955.
[30]Semenza G L. Hypoxia-Inducible factors in physiology and medicine[J]. Cell,2012,148(3):399-408.
[31]Makino Y,Cao R,Svensson K,et al. Inhibitory PAS domain protein is a negative regulator of hypoxia-inducible gene expression[J]. Nature,2001,414(6863):550-554.
[32]Yi X,Liang Y,Huerta-Sanchez E,et al. Sequencing of 50 human exomes reveals adaptation to high altitude[J]. Science,2010,329(5987):75-78.
[33]錢令嘉. 低氧適應相關基因及其研究策略的思考[J]. 中國基礎科學,2001(9):10-15.
[34]王德朋,李紅閣,郭松長,等. 青海家牦牛HIF-1α基因組織特異性表達[J]. 安徽農業科學,2007,35(29):9173-9175.
[35]Papa S. Mitochondrial oxidative phosphorylation changes in the Life span. Molecular aspects and physiopathological implications[J]. Biochimica et Biophysica Acta:Bioenergetics,1996,1276(2):87-105.
[36]Kaelin W G. ROS:really involved in oxygen sensing[J]. Cell Metabolism,2005,1(6):357-358.
[37]Rumsey W L,Abbott B,Bertelsen D,et al. Adaptation to hypoxia alters energy metabolism in rat heart[J]. The American Journal of Physiology,1999,276(1/2):H71-H80.
[38]Ali S S,Hsiao M,Zhao H W,et al. Hypoxia-adaptation involves mitochondrial metabolic depression and decreased ROS leakage[J]. PLoS One,2012,7(5):e36801.
[39]左清清,姚 娜,董坤哲,等. 低氧適應的線粒體調控機制研究進展[J]. 畜牧獸醫學報,2013,44(7):993-999.
[40]王 勇,李 莉. 不同海拔地區牦牛組織線粒體LDH活性測定[J]. 安徽農業科學,2008,36(33):14536-14537.
[41]Amano T,Yamado W,Nabika T. Polymorphism of blood protein in native cattle,yaks and their hybrids in Tibet[J]. Report of the Society for Researches on Native Livestock,1990,13:1-11.
[42]韓樹鑫,茍 瀟,楊舒黎. 動物低氧適應的生理與分子機制[J]. 中國畜牧獸醫,2010,37(9):29-34.
[43]Seta Karen A,Millhorn D E. Functional genomics approach to hypoxia signaling[J]. Journal of Applied Physiology,2004,96(2):765-773.
[44]胡泉軍.牦牛基因組數據庫建設[D]. 蘭州:蘭州大學,2014.
[45]Lendahl U,Lee K L,Yang H,et al. Generating specificity and diversity in the transcriptional response to hypoxia[J]. Nature Reviews Genetics,2009,10(12):821-832.
[46]Ma L,Shao X J,Wang Y P,et al. Molecular cloning,characterization and expression of myoglobin in Tibetan antelope (Pantholops hodgsonii),a species with hypoxic tolerance[J]. Gene,2014,533(2):532-537.
[47]Gou X,Wang Z,Li N,et al. Whole-genome sequencing of six dog breeds from continuous altitudes reveals adaptation to high-altitude hypoxia[J]. Genome Research,2014,24(8):1308-1315.

