自發性腦出血中紅細胞對血腦屏障通透性的影響
江雷振 史保中 葛朋莉
1)河南科技大學第一附屬醫院神經外科 洛陽 471000 2)河南安陽地區醫院血液科 安陽 455000
自發性腦出血中紅細胞對血腦屏障通透性的影響
江雷振1)史保中1)葛朋莉2)
1)河南科技大學第一附屬醫院神經外科 洛陽 471000 2)河南安陽地區醫院血液科 安陽 455000
目的 研究自發性腦出血(SICH)中紅細胞對血腦屏障(BBB)通透性的影響。方法 大鼠自體血腦內注射法造成自發性腦出血模型,用腦立體定位儀向大鼠右側尾狀核注入自體全血(WB)或紅細胞(RBC)以建立SICH動物模型。分組按照不同時間點(6 h、1 d、3 d、5 d)處死大鼠,處死前經尾靜脈注射2%伊文思藍(Evans blue,EB)溶液 2 mL/kg,取標本后用甲酰胺浸泡法檢測腦組織EB含量。結果 BBB通透性檢測腦組織EB含量:RBC、WB、SO組6 h、1 d、3 d、5 d比較,其中在RBC第1、3天組明顯高于6 h和5 d組,SICH后6 h開始升高,1 d達到高峰,3 d開始恢復,5 d有所下降(P<0.05)。結論 SICH后導致BBB功能障礙,紅細胞對BBB結構破壞起至關重要的作用。
自發性腦出血;紅細胞;血腦屏障;通透性
腦內出血(intracerebral hemorrhage,ICH)是指多種原因所致的大腦內血管破裂至腦實質內的出血,是臨床上致殘、致死率很高的神經系統常見的疾病之一。主要包括自發性腦內出血(spontaneous intracerebral hemorrhage,SICH)和創傷性腦內出血(traumatic intracerebral hemorrhage,TICH)。前者占所有腦卒中的44%以上,后者占頭外傷的15%以上[1]。SICH在亞洲國家占腦卒中的20%~30%[2],但病死率卻最高,主要原因之一即腦水腫。研究認為[3],SICH后血腫的占位效應、周圍缺血、神經毒性以及血腦屏障(blood brain barrier,BBB)的破壞可能在腦水腫的形成過程中起一定的作用。SICH后腦水腫是BBB通透性增高所導致的一種主要病理狀態,在其持續發展的病理過程中又進一步加重BBB的損壞,因此腦水腫與BBB的狀態密切相關。研究SICH后血腫中主要成分紅細胞對腦水腫的影響以及與BBB通透性的關系,不但能為腦水腫形成的病理生理機制深入研究奠定基礎,也會能為臨床治療SICH后腦水腫開辟新的有效途徑。
本實驗用鼠腦立體定向儀向大鼠右側尾狀核注射全血和紅細胞液進行局灶性堆積制作SICH模型;在6 h、1 d、3 d、5 d 4個時段處死動物,處死前2 h經尾靜脈注射依文思藍(Evans Blue,EB)檢測BBB通透性,以闡明在SICH后紅細胞對BBB通透性的影響。
1 材料與方法
1.1 主要儀器與試劑 腦立體定向儀;微量注射器;牙科磨鉆;721型紫外分光光度計;電熱恒溫水浴鍋;伊文思藍;甲酰胺。
1.2 動物分組制作模型
1.2.1 動物分組:選用健康成年雄性清潔級SD大鼠80只,體質量210~300 g,均由河南科技大學醫學院動物實驗中心提供。將大鼠隨機分4組:紅細胞(red blood cell,RBC)組、全血(whole blood,WB)組、假手術(sham operation,SO)組、正常(normal group,NG)組,其中RBC組、WB組、SO組按照實驗設計的處死時間(6 h、1 d、3 d、5 d)再分為4個亞組,每亞組5只,用于檢測腦EB含量。
1.2.2 血液標本的制備:WB標本的制備:麻醉成功后,用38 ℃的溫水加熱鼠尾使尾部動脈擴張,從尾尖2 cm處剪斷,用EP管取動脈血1 mL,以備用。RBC標本的制備:應用Xi等[4]的方法制RBC,將1 mL股動脈血依次:①500 r/min離心操作15 min;②移除離心管中上半層的血漿和RBC上的薄層乳糜狀物質;③在剩余的RBC中加入5倍RBC體積的等滲鹽水,500 r/min離心操作7 min,移去上清液;④將步驟③再重復2次,即得RBC;⑤將所得的RBC加等量等滲鹽水,備用。
1.2.3 麻醉及SICH模型制作手術方法:① RBC組模型手術:根據大鼠體質量,用2%戊巴比妥鈉按2 mL/kg行腹腔內注射麻醉。麻醉成功后,俯臥位固定。調整立體定向儀,剃毛消毒,頭部正中縱形切口長約1.0 cm,確定右側尾狀核位置(參照包新民等主編《大鼠腦立體定位圖譜》),即前囟前0.2 mm,正中線旁開3 mm,顱骨鉆孔,直徑約1 mm,微量注射器將大鼠自體紅細胞液50 μL以10 μL/min的速度推注入腦(進針深度達硬膜下6 mm),留針5 min后緩慢拔針。骨蠟封骨孔間斷縫切口,消毒。② WB組制作:同RBC組方法,注射全血50 μL。③ SO組模型制作:同RBC組模型方法,進針后不往腦內注射任何液體,留針5 min。④ NG組麻醉成功后,不做處理,直接斷頭取材。
1.3 采集標本 在RBC、WB、SO 的3組模型完成后,按6 h、1 d、3 d、5 d時間點對各組大鼠處死并取材。
1.4 檢測方法與指標 采用甲酰胺浸泡法[5]檢測腦組織中EB含量。制作標準曲線:用精確度為0.1 mg的電子天平稱取5 mg的EB加到25 mL容量瓶中,將等滲鹽水加至25 mL,充分搖勻后用移液管吸取0.3 mL,加入到5.7 mL甲酰胺溶液里配置成第一管標準液,然后用移液管吸取第一管標準液3 mL,再加入3 mL甲酰胺溶液。如此程序依次配制8管標準液,其所含伊文思藍(EB)的量依次是20、10、5、2.5、1.25、0.625、0.3125、0.15625 μg/mL。加橡塞密封后置入37 ℃水浴鍋中孵育24 h。依次編號加入比色皿中,用紫外光光度計比色,測定各標準管中相應的光密度值(X),并求出其與伊文思藍(EB)含量(Y)的直線回歸方程Y=29.029X-0.1178(R2=0.9999,P<0.001)。
應用甲酰胺浸泡法檢測腦組織中EB的含量評定BBB損傷的程度。腦組織EB含量(μg/g濕腦)=A×甲酰胺量(mL)/腦組織濕質量(g),其中A為根據標準曲線的回歸方程求得的樣本伊文思藍(EB)的含量,結果以μg/g表示。
檢測組在相應的時間點處死前經尾靜脈注射2% EB溶液 2 mL/kg,觀察眼結膜、暴露皮膚、四肢等處在數秒后被藍染,表示注射EB的成功。2 h后灌注并斷頭取腦,冠狀面切開取血腫周圍腦組織約100 mg,用濾紙吸除表面水分,稱取濕質量后,置于含5 mL甲酰胺溶液的試管中,加塞密封,37 ℃水浴鍋中孵育48 h,離心取上清液,加入比色皿中,用721型紫外分光光度計在波長為632 nm處進行比色,測定其光密度(OD)值。根據預先設定的標準曲線,計算各組大鼠腦組織中EB含量。
1.5 統計學方法 采用統計軟件SPSS 21.0對實驗結果進行分析,計量資料2組間采用獨立樣本t檢驗,多組采用單因素方差分析,多組間的兩兩比較采用LSD檢驗。檢驗水準α=0.05。
2 結果
2.1 神經功能評分 待大鼠自然蘇醒,按照Bederson評分法[6]判定制作的腦出血斷模型是否成功(Ⅰ級:將大鼠尾巴提起,正常側前肢向地面伸展,癱瘓側前肢則回并收屈曲于腹下;Ⅱ級:除有Ⅰ級體征外,向癱瘓側推大鼠時阻力較健側明顯減低;Ⅲ級:除有以上體征外,SD大鼠活動時軀體向癱瘓側旋轉)。
2.2 各組腦組織EB含量的變化 見表1。
2.2.1 組間比較:RBC組和WB組在第1天時EB含量明顯高于SO組和NG組(P<0.05),RBC組稍高于WB組(P<0.05),而WB組亦明顯高于SO組和NG組(P<0.05),RBC組高于WB組(P<0.05)。
2.2.2 組內比較:RBC組第1天明顯高于6 h、5 d(P<0.01),稍高于3 d;RBC組第3天高于6 h、5 d(P<0.01),RBC組第5天高于6 h(P<0.01);WB組第1天明顯高于6 h、5 d(P<0.01),稍高于3 d,WB組第3天高于6 h 、5 d(P<0.01),WB組第5天高于6 h(P<0.05);SO以及NG組內相比無明顯變化(P>0.05)。
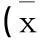
表1 各組不同時間點腦組織EB含量的變化±s)
3 討論
3.1 動物模型制作的意義 本課題主要探索SICH中紅細胞與BBB通透性的關系。實驗所選用的SD大鼠,因其與人類大腦發育以及結構形式基本近似[7-8],最有利于研究本課題的基本條件,且價格低廉易于飼養,模擬人的SICH好發部位——尾狀核的基底節區,定位也較容易。研究提示[9],制作SICH模型時注入1 μL自體血相當于人類腦出血約0.75 mL。本研究課題注入50 μL制造相當于人類大腦約30 mL的出血量,從本次實驗結果可以肯定制作的動物模型是符合實驗要求標準的。因此,本課題所選用大鼠自體血腦內注射法制作SICH動物模型實驗設計的成功,更符合模擬人類SICH的各項病理學特征。
3.2 SICH中紅細胞對BBB功能的影響 通過檢測腦組織EB含量,說明SICH后BBB通透性改變程度。EB作為染料制劑,與血漿白蛋白具有很高的親和力,因此其常作為一種示蹤劑在神經科學研究中檢測觀察BBB的通透性。正常情況下,血漿白蛋白無法穿過BBB,所以向血管內注入EB使血液染色,如果神經系統中的BBB是完整的,血液中的EB無法通過BBB進入腦組織,則無法使腦組織藍染;如果BBB結構被破壞,EB可以通過BBB進入腦組織而使之著色藍染。所以,通過檢測腦組織中EB的含量,證明BBB通透性的變化,進而反映SICH后腦水腫的嚴重程度與BBB破壞的關系[10-11]。
本實驗結果表明,RBC組、WB組、SO組在SICH后的第6小時,腦組織中的EB含量開始升高;SICH后第1天時,RBC組EB含量最高達(161.607±6.376)μg/g,比其他各分組明顯高;SICH后第3天時,RBC組EB含量仍處于較高水平,但已經趨于平穩;SICH第5天時各組EB含量已開始下降,但仍高于其他時間點。WB組在SICH后第1天時,EB含量顯示最高,可達(154.35±4.658)μg/g,明顯高于假手術組;在第3天時趨于平穩,但仍較高,在SICH第5天時EB含量開始下降,可以看出WB組與RBC組的EB含量呈動態變化,但WB組各時間點均低于紅細胞組。而SO組、NG組EB含量在各時間點均無明顯變化。4組EB含量比較發現,RBC組1 d明顯比SO組、NG組高(P<0.01),WB-1 d組高于SO-1 d組(P<0.05),RBC-1 d組比WB-1 d組含量高(P<0.05),SO組、NG組比較無顯著差異(P>0.05)。提示RBC-1 d組的腦組織EB含量比其他各分組明顯增高。
在SICH后血腫中的RBC所產生的毒性物質與BBB的通透性之間關系密切,呈正相關。說明BBB的通透性的改變對SICH后腦水腫的形成起至關重要的作用,研究和了解BBB通透性與血腫中RBC之間的關系,認識其在健康和疾病時的功能改變對神經系統疾病的預防和治療具有重要的臨床意義。
[1] Siddique MS, Gregson BA, Fernandes HM, et al.Comparative study of traumatic and spontaneous intracerebral hemorrhage[J].J Neurosurg, 2002,96(1):86-89.
[2] 饒明俐.中國腦血管病防治指南[J].中風與神經疾病雜志,2005,22(5):388-393.
[3] Shi BZ, Meng XF, Yang JX, et al.Effect of erythrocytes on brain water content and haem oxygenase-1 expression in rats with traumatic intracerebral haemorrhage[J].Acta Neurochir (Wien), 2012,154(6):1 081-1 086;1 086.
[4] Xi G, Keep RF, Hoff JT.Erythrocytes and delayed brain edema formation following intracerebral hemorrhage in rats[J].J Neurosurg, 1998,89(6):991-996.
[5] Belayev L, Busto R, Zhao W, et al.Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats[J].Brain Res, 1996, 739(1/2):88-96.
[6] Broderick JP, Brott TG, Duldner JE, et al.Volume of intracerebral hemorrhage.A powerful and easy-to-use predictor of 30-day mortality[J].Stroke, 1993,24(7):987-993.
[7] Semple BD, Blomgren K, Gimlin K, et al.Brain development in rodents and humans:Identifying benchmarks of maturation and vulnerability to injury across species[J].Prog Neurobiol, 2013(106/107):1-16.
[8] Bayer SA, Altman J, Russo RJ, et al.Timetables of neurogenesis in the human brain based on experimentally determined patterns in the rat[J].Neurotoxicology, 1993,14(1):83-144.
[9] 何綱,劉茂才.實驗性腦出血動物模型的研究進展[J].國外醫學·神經病學神經外科學分冊,2001,28(2):80-83.
[10] 胡全美,虞佩蘭,吳中匡,等.兔腦水腫模型腦組織伊文思蘭定量測定[J].湖南醫學院學報,1984,9(2):131-136.
[11] Manaenko A, Chen H, Kammer J, et al.Comparison Evans Blue injection routes:Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model[J].J Neurosci Methods, 2011,195(2):206-210.
(收稿 2015-03-12)
河南科技大學青年科學基金(項目編號:2010QN0037)
R-332
A
1673-5110(2016)07-0021-02

