氮源對(duì)解脂耶氏酵母合成共軛亞油酸的影響
張白曦,李敏,陳海琴,陳衛(wèi), 2,張灝*
1(江南大學(xué) 食品學(xué)院,江蘇 無錫,214122) 2(江南大學(xué) 食品科學(xué)與技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,江蘇 無錫,214122)
?
氮源對(duì)解脂耶氏酵母合成共軛亞油酸的影響
張白曦1,李敏1,陳海琴1,陳衛(wèi)1, 2,張灝1*
1(江南大學(xué) 食品學(xué)院,江蘇 無錫,214122)2(江南大學(xué) 食品科學(xué)與技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,江蘇 無錫,214122)
摘要為了提高解脂耶氏酵母重組菌株合成反-10,順-12-共軛亞油酸的產(chǎn)量,以YNBDSa為發(fā)酵培養(yǎng)基進(jìn)行搖瓶發(fā)酵,研究氮限制策略及氮源種類對(duì)菌株合成脂肪酶Lip2、亞油酸異構(gòu)酶PAI及反-10, 順-12-共軛亞油酸產(chǎn)量的影響。結(jié)果表明:高氮培養(yǎng)基更利于菌體生長以及產(chǎn)物的合成,反-10, 順-12-共軛亞油酸產(chǎn)量達(dá)到4.3 g/L,是低氮培養(yǎng)基對(duì)應(yīng)結(jié)果的8.6倍;采用有機(jī)氮為氮源時(shí),Lip2酶活及PAI表達(dá)量顯著高于無機(jī)氮的結(jié)果,反-10, 順-12-共軛亞油酸產(chǎn)量最高達(dá)到4.6 g/L,是無機(jī)氮結(jié)果的46倍。
關(guān)鍵詞解脂耶氏酵母;氮源;反-10, 順-12-共軛亞油酸;產(chǎn)量
反-10,順-12-共軛亞油酸(trans-10,cis-12-conjugated linoleic.acid, t10, c12-CLA)是一種十八碳的多不飽和脂肪酸,也是具有重要生理活性的共軛亞油酸(CLA)的兩種異構(gòu)體之一,具有抑制腫瘤細(xì)胞增殖、減少脂質(zhì)積累及增強(qiáng)免疫力等生理功能[1]。目前,CLA的合成主要包括化學(xué)合成法和生物合成法。由于化學(xué)合成法得到的CLA異構(gòu)體成分復(fù)雜,存在安全風(fēng)險(xiǎn),使其在醫(yī)藥領(lǐng)域的應(yīng)用受到限制[2]。生物合成法得到的異構(gòu)體結(jié)構(gòu)較單一、反應(yīng)條件溫和,因而得到越來越多的關(guān)注[3]。
本實(shí)驗(yàn)室通過基因工程手段構(gòu)建出1株高產(chǎn)t10, c12-CLA的解脂耶氏酵母重組菌株(Yarrowia lipolytica CCFM-JU277-9),該菌在菌體細(xì)胞處于對(duì)數(shù)期中后期時(shí)啟動(dòng)外源基因亞油酸異構(gòu)酶(PAI)的表達(dá)。亞油酸異構(gòu)酶PAI不受底物的抑制,并且催化游離形式的亞油酸(LA)合成且只合成 t10, c12-CLA一種單體[4],為生物轉(zhuǎn)化法合成單一t10, c12-CLA提供了可能性。由于Y.lipolytica自身合成的底物L(fēng)A有限,而植物油中紅花籽油LA的含量最高,約占總脂肪酸的80%。因此,本文采用紅花籽油作為底物來源,通過Y.lipolytica自身合成并分泌的脂肪酶Lip2[5],將甘油三酯形式的紅花籽油水解為游離脂肪酸形式,游離型LA進(jìn)入Y.lipolytica細(xì)胞內(nèi),作為底物被PAI轉(zhuǎn)化為t10, c12-CLA。
氮源含量與微生物脂質(zhì)積累密切相關(guān),而脂質(zhì)含量的提高有利于t10, c12-CLA的合成積累。微生物一般是在培養(yǎng)基中碳源充足、另一種元素受限的情況下啟動(dòng)脂質(zhì)積累,其中氮限制是調(diào)控微生物積累脂質(zhì)最常用的方法[6]。氮源種類則與微生物中蛋白表達(dá)密切相關(guān)[5,7],而Lip2及外源蛋白PAI的表達(dá)量是影響Y.lipolytica合成t10, c12-CLA的重要因素。本文從氮限制策略以及氮源種類兩方面研究其對(duì)Y.lipolytica合成t10, c12-CLA的影響機(jī)制,通過培養(yǎng)基優(yōu)化進(jìn)一步提高了Y.lipolytica合成t10, c12-CLA產(chǎn)量。
1材料與方法
1.1菌株
重組解脂耶氏酵母(YarrowialipolyticaCCFM-JU277-9),構(gòu)建于本實(shí)驗(yàn)室,保藏于中國微生物菌株保藏管理委員會(huì)普通微生物中心,其保藏號(hào)為CCFM-JU277-9。
1.2培養(yǎng)基與培養(yǎng)方法
YNBDO培養(yǎng)基[8]:6.7 g/L無氨基酸酵母氮源,10.0 g/L葡萄糖,5.0 g/L,NH4Cl 0.1 g/L 尿嘧啶,2.0 g/L酪蛋白水解物,20 g/L 油酸。
YNBDSa發(fā)酵培養(yǎng)基:將YNBDO培養(yǎng)基中的油酸替換為紅花籽油(SaO),其余成分及含量不變。
YN20BDSa發(fā)酵培養(yǎng)基:將YNBDSa培養(yǎng)基中的酪蛋白水解物增加到20.0 g/L。紅花籽油在吐溫-80水溶液中超聲乳化,膜過濾滅菌待用,當(dāng)葡萄糖基本耗盡時(shí)添加到發(fā)酵培養(yǎng)基。
Y.lipolyticaCCFM-JU277-9劃線于YNBD平板培養(yǎng)基,并在YNBD液體培養(yǎng)基中活化,以1%的接種量接種到發(fā)酵培養(yǎng)基中,28 ℃、200 r/min培養(yǎng)至發(fā)酵結(jié)束。
1.3研究方法
1.3.1無脂質(zhì)生物量的確定
發(fā)酵液于8 000 r/min離心15 min,收集菌體細(xì)胞,保留發(fā)酵上清液,用生理鹽水洗滌菌體2次,洗滌后的液體與發(fā)酵上清液合并留作脂質(zhì)提取,菌體重懸于生理鹽水中預(yù)凍2 h,經(jīng)冷凍干燥后稱量干菌重m1,測定細(xì)胞中總脂質(zhì)的質(zhì)量m2,無脂質(zhì)生物量即為m1-m2。
1.3.2葡萄糖含量的確定
根據(jù)葡萄糖測定試劑盒檢測發(fā)酵液中葡萄糖含量,具體參照說明書。
1.3.3脂質(zhì)提取及分析
發(fā)酵上清液和菌體細(xì)胞中脂質(zhì)提取及甲酯化方法采用鹽酸甲醇法,通過氣相色譜定性定量分析,具體方法參照文獻(xiàn)[9]。
1.3.4PAI表達(dá)量及Lip2酶活測定方法
取相同量菌體細(xì)胞,4 ℃環(huán)境下玻璃珠振蕩破碎,10 000 r/min 離心10 min,上清液即為PAI粗酶液,通過Western Blot檢測PAI表達(dá)量,具體檢測方法參考文獻(xiàn)[10]。
取等體積發(fā)酵液于10 000 r/min離心5 min,上清液即為Lip2脂肪酶粗酶液。根據(jù)堿式滴定法測定胞外Lip2脂肪酶酶活[11],操作如下:50 mmol/L、pH 8.0的Tris-HCl緩沖液5 mL,紅花籽油與2%聚乙烯醇溶液體積比為1∶3的紅花籽油乳化液4 mL,粗酶液1 mL,37 ℃、100 r/min振蕩10 min,加入15 mL終止液。
37 ℃、pH8.0條件下,以每分鐘粗酶液水解紅花籽油乳化液生產(chǎn)1μmol 游離脂肪酸所需的酶量定義為1個(gè)酶活單位(U)。
2結(jié)果與分析
2.1氮限制策略對(duì)重組菌株合成t10, c12-CLA的影響
YNBDO培養(yǎng)基是Y.lipolytica ex novo脂質(zhì)積累途徑的常用培養(yǎng)基[8],其氮源含量較低,以便通過氮限制啟動(dòng)脂質(zhì)積累。但由于重組Y.lipolytica是在菌體進(jìn)入對(duì)數(shù)期中后期時(shí)啟動(dòng)PAI基因表達(dá)[4],此時(shí)需要大量的氮源存在,YNBDO培養(yǎng)基中氮含量不高,因而可能會(huì)影響異源蛋白的表達(dá)。因此,本文研究了氮限制培養(yǎng)基與非限制培養(yǎng)對(duì)重組菌株生長及t10, c12-CLA合成的影響。
結(jié)果如圖1所示,重組菌株在YN20BDSa高氮培養(yǎng)基的生長延滯期明顯縮短,發(fā)酵25 h左右葡萄糖基本耗盡,而低氮培養(yǎng)基在發(fā)酵35 h左右出現(xiàn)此現(xiàn)象。葡萄糖耗盡時(shí)添加紅花籽油,重組Y.lipolytica菌株利用培養(yǎng)基中經(jīng)Lip2脂肪酶水解得到的游離LA為碳源,出現(xiàn)了生長速率減慢二次生長期,一直持續(xù)到發(fā)酵結(jié)束。YN20BDSa高氮培養(yǎng)基最大生物量達(dá)到13.7 g/L,而YNBDSa低氮培養(yǎng)基為11.5 g/L。高氮培養(yǎng)基pH基本穩(wěn)定在6.0左右,而低氮培養(yǎng)基的pH則發(fā)生較大的變化,在發(fā)酵20 h左右迅速降低,直至發(fā)酵42 h左右穩(wěn)定在pH3.0。低氮培養(yǎng)基中pH的降低可能是重組Y.lipolytica產(chǎn)酸的作用。Y.lipolytica有較強(qiáng)的產(chǎn)酸能力,工業(yè)中已用于檸檬酸、異檸檬酸和酮戊二酸的生產(chǎn)[12]。
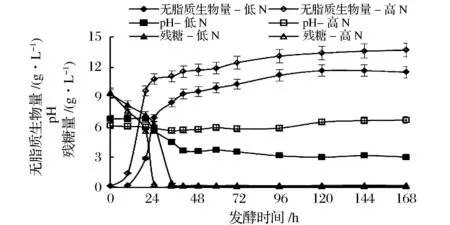
圖1 重組Y. lipolytica在不同氮含量發(fā)酵培養(yǎng)基中生物量、pH、殘?zhí)橇侩S發(fā)酵時(shí)間的變化Fig.1 Time-course variations in the biomass, pH and glucose concentration of recombinant Y. lipolytica in different nitrogen concentrations
一方面較低的氮含量可能影響了異源蛋白PAI的表達(dá);另一方面較低的pH對(duì)PAI和Lip2脂肪酶的活性有抑制作用,降低了t10, c12-CLA的轉(zhuǎn)化效率。結(jié)果如圖2所示。
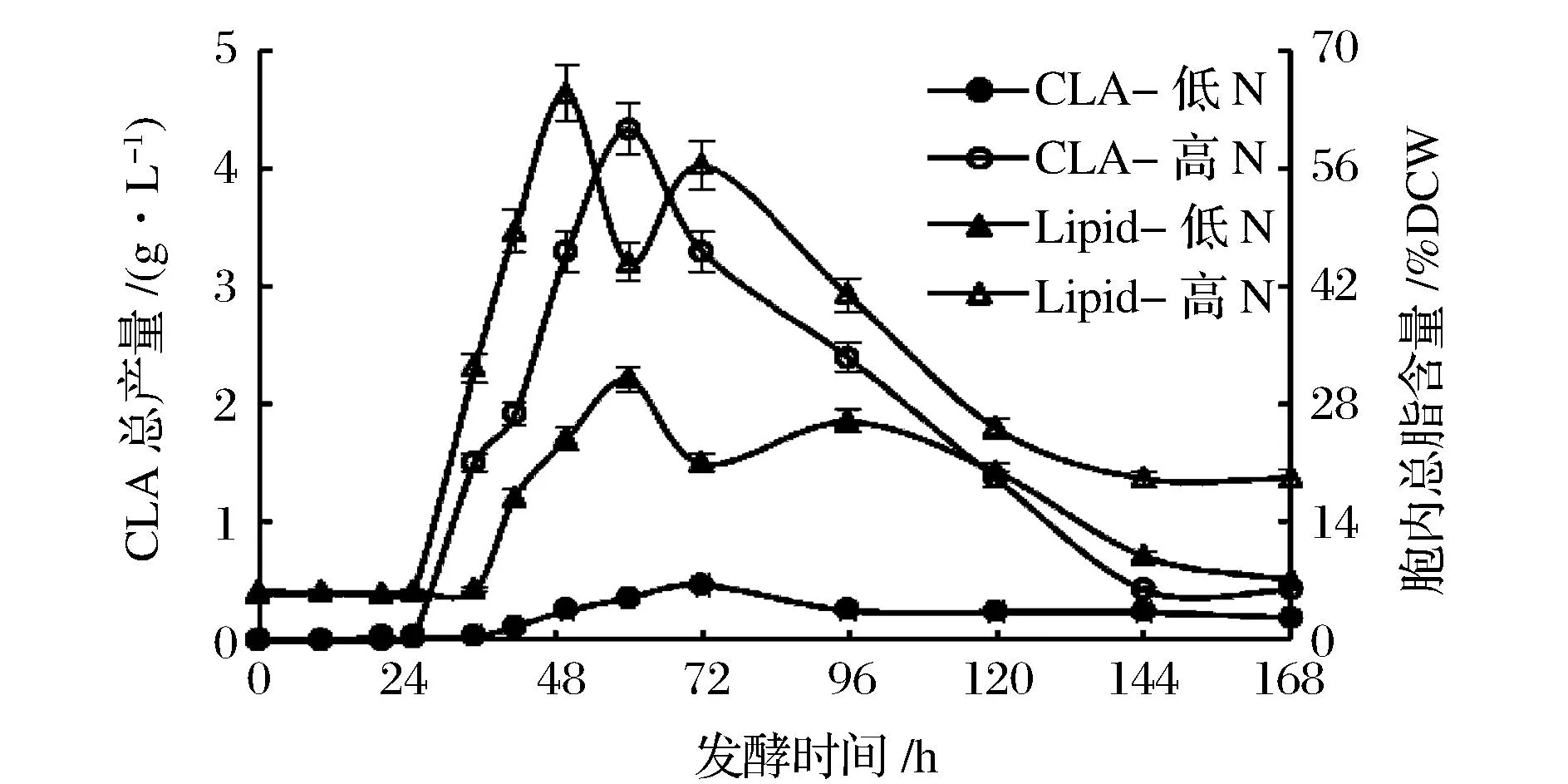
圖2 Y. lipolytica在不同氮含量發(fā)酵培養(yǎng)基中CLA總產(chǎn)量及胞內(nèi)總脂含量隨發(fā)酵時(shí)間的變化Fig.2 Time-course variations in CLA production and lipid content of Y. lipolytica cultivated with different nitrogen concentrations
低氮條件培養(yǎng)時(shí),t10, c12-CLA的總產(chǎn)量明顯低于高氮培養(yǎng)的結(jié)果。氮限制培養(yǎng)基對(duì)應(yīng)的胞內(nèi)總脂含量也比高氮培養(yǎng)基低,并未實(shí)現(xiàn)通過氮限制達(dá)到脂質(zhì)積累的目標(biāo)。t10, c12-CLA產(chǎn)量隨發(fā)酵時(shí)間的進(jìn)行呈現(xiàn)先增加后降低的趨勢,在低氮培養(yǎng)的72 h左右,t10, c12-CLA產(chǎn)量達(dá)到最高,為0.5 g/L,高氮培養(yǎng)發(fā)酵60 h左右,t10, c12-CLA產(chǎn)量達(dá)到最高為4.3 g/L,是低氮培養(yǎng)結(jié)果的8.6倍。
綜上所述,氮限制策略并未實(shí)現(xiàn)脂質(zhì)積累,提高目標(biāo)產(chǎn)物產(chǎn)量的目的,非限制性培養(yǎng)基YN20BDSa更利于重組Y.lipolytica菌株生長、異源蛋白表達(dá)以及t10, c12-CLA的合成。
2.2氮源種類對(duì)重組菌株合成t10, c12-CLA的影響
分別用25 g/L的酪蛋白水解物、胰蛋白胨、牛肉浸膏、NH4Cl、NH4NO3和(NH4)2SO4替代YN20BDSa培養(yǎng)基中的氯化銨和酪蛋白水解物,研究有機(jī)氮源和無機(jī)氮源對(duì)重組Y.lipolytica產(chǎn)物合成的影響。
不同氮源對(duì)重組Y.lipolytica生物量的影響如圖3所示,分別以3種有機(jī)氮為氮源進(jìn)行培養(yǎng)時(shí),菌體生物量相近,均在14.0 g/L左右,顯著高于以3種無機(jī)氮為氮源時(shí)的結(jié)果,其生物量均低于9.0 g/L。WEETE研究表明,有機(jī)氮源是真菌生物細(xì)胞生長的最佳氮源[13]。
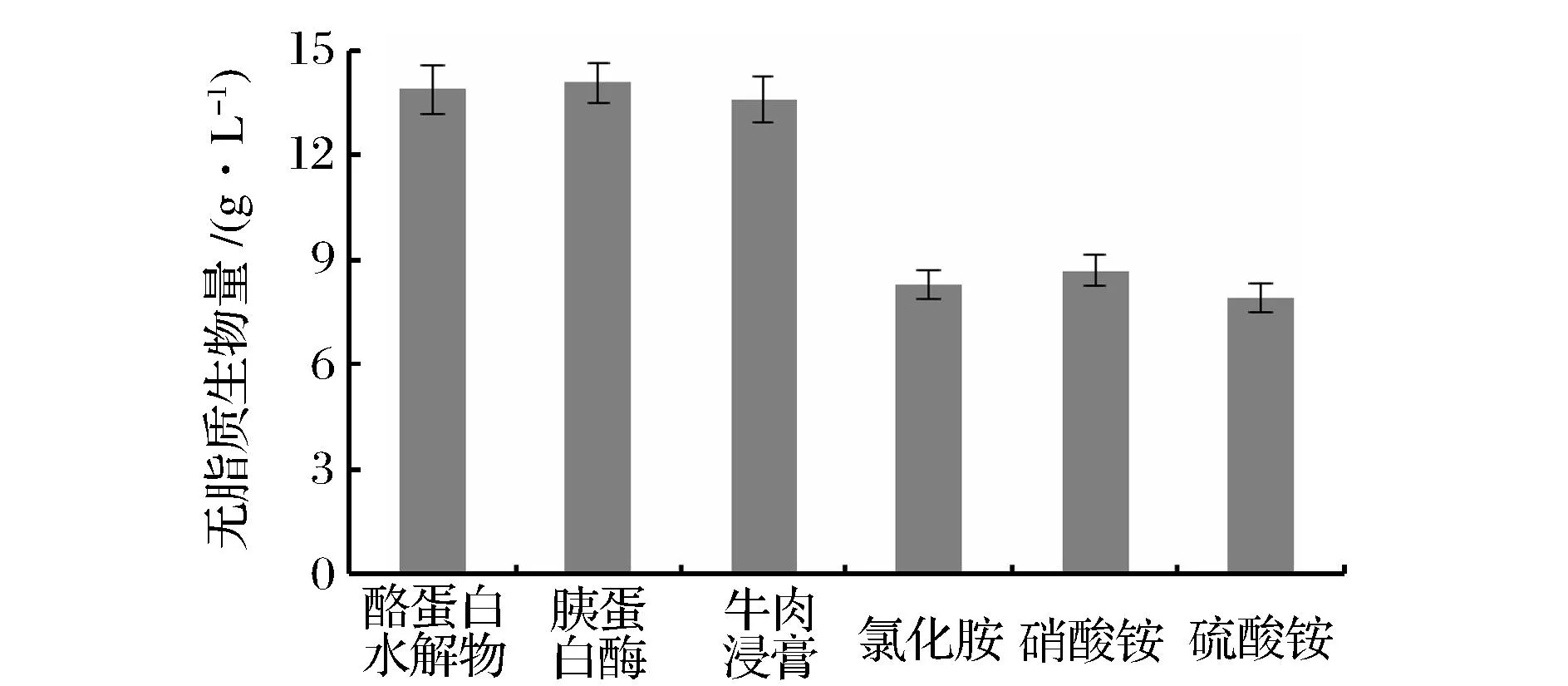
圖3 不同氮源對(duì)重組Y. lipolytica生物量的影響Fig.3 Effects of different nitrogen sources on the biomass of recombinant Y. lipolytica
重組菌株合成t10, c12-CLA時(shí),需要脂肪酶Lip2及亞油酸異構(gòu)酶PAI的共同參與。不同氮源對(duì)Lip2及PAI的影響如圖4所示,3種無機(jī)氮源培養(yǎng)基對(duì)應(yīng)的Lip2酶活均在7.0 U/mL以下,3種有機(jī)氮源的Lip2酶活均在46.0 U/mL左右,是無機(jī)氮結(jié)果的6.5倍;而重組Y.lipolytica在有機(jī)氮源培養(yǎng)基中的PAI表達(dá)量也明顯高于無機(jī)氮源的結(jié)果。推測導(dǎo)致以上結(jié)果的原因如下:首先,有機(jī)氮源含有豐富的蛋白質(zhì)、多肽及游離氨基酸,特別是酪蛋白水解物含有18種游離氨基酸,可被重組Y.lipolytica直接吸收,用于合成細(xì)胞生長及t10, c12-CLA合成所需的各種蛋白質(zhì)[14],利用效率高于無機(jī)氮源;其次,由于無機(jī)氮是以NH4+形式為菌體提供氮元素,有文獻(xiàn)報(bào)道NH4+大量存在會(huì)抑制Y.lipolytica合成Lip2[15]。
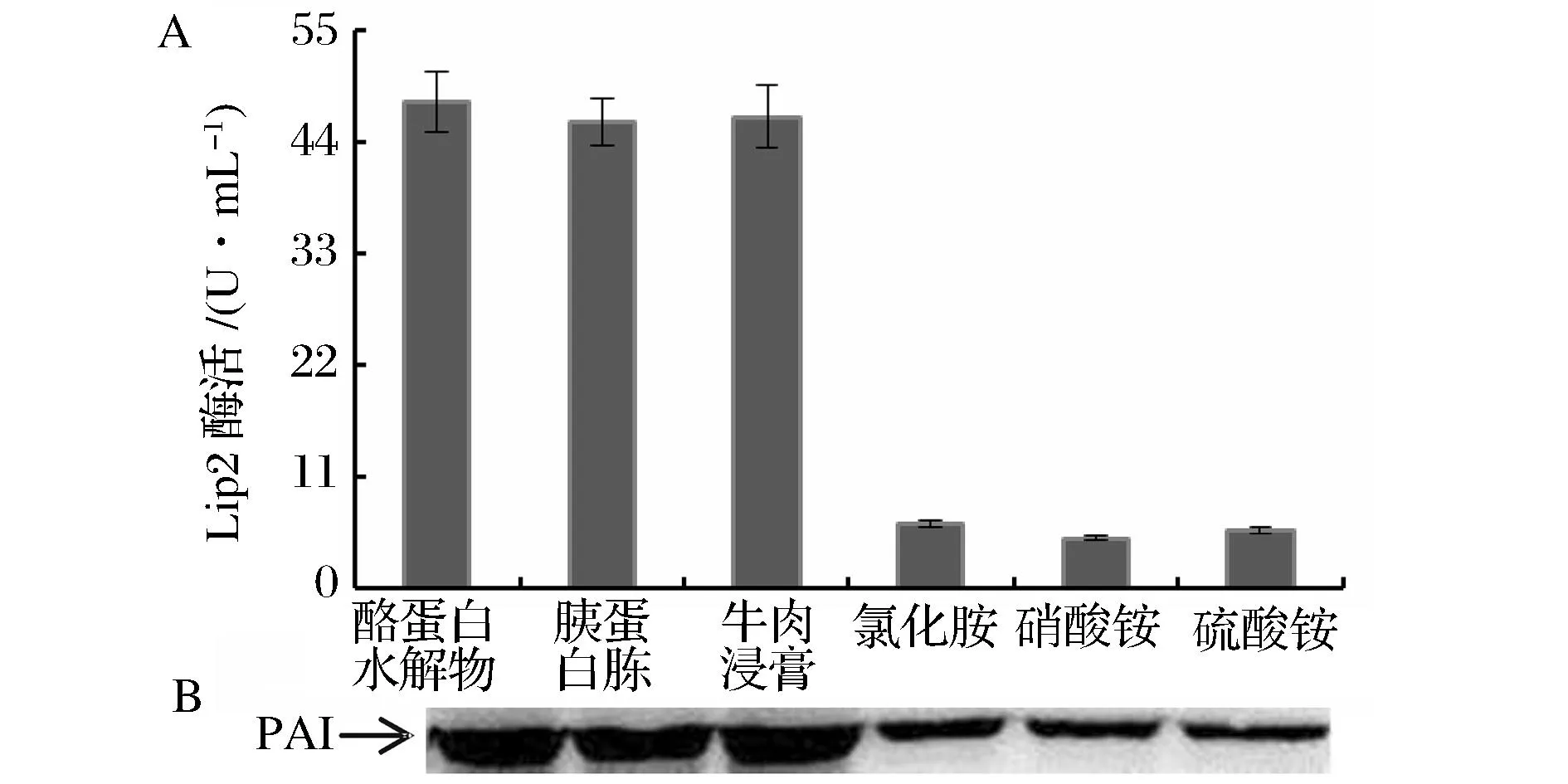
圖4 不同氮源對(duì)重組Y. lipolytica Lip2酶活及PAI表達(dá)量的影響Fig.4 Effects of different nitrogen sources on Lip2 activity(A)and PAI expression(B)
如表1所示,不同氮源對(duì)產(chǎn)物t10, c12-CLA合成的影響與生物量、Lip2酶活及PAI表達(dá)量的結(jié)果一致。當(dāng)以有機(jī)氮源進(jìn)行培養(yǎng)時(shí),發(fā)酵進(jìn)行到60 h產(chǎn)物產(chǎn)量即達(dá)到最高值,比無機(jī)氮的最高產(chǎn)量出現(xiàn)時(shí)間提前12 h;3種有機(jī)氮源對(duì)應(yīng)的t10, c12-CLA產(chǎn)量相似,均高于4.0 g/L,是無機(jī)氮結(jié)果的40倍。有機(jī)氮源與無機(jī)氮源的t10, c12-CLA產(chǎn)量差異如此懸殊是重組Y.lipolytica菌體生物量、Lip2酶活及PAI表達(dá)量協(xié)同作用的結(jié)果,菌體生長速度快、關(guān)鍵酶的表達(dá)量及酶活高,則產(chǎn)物合成效率高。
表1 不同氮源對(duì)重組Y. lipolytica CLA合成的影響
3結(jié)論
培養(yǎng)基中氮含量及氮源種類對(duì)Y.lipolytica重組菌株合成t10, c12-CLA 有明顯的影響。氮限制培養(yǎng)基一方面抑制了異源蛋白PAI的表達(dá),另一方面促使菌株合成有機(jī)酸,較低的pH對(duì)PAI和Lip2酶活有抑制作用,從而降低了t10, c12-CLA的轉(zhuǎn)化效率;高氮培養(yǎng)基更利于菌株的生長以及t10, c12-CLA的合成,產(chǎn)物產(chǎn)量達(dá)到4.3 g/L,是氮限制結(jié)果的8.6倍。無機(jī)氮源抑制菌株中關(guān)鍵酶PAI及Lip2的合成,進(jìn)而降低產(chǎn)物t10, c12-CLA的產(chǎn)量,因此確定有機(jī)氮為Y.lipolytica合成t10, c12-CLA的最適氮源,t10, c12-CLA的產(chǎn)量達(dá)到4.6 g/L,是無機(jī)氮源對(duì)應(yīng)結(jié)果的46倍。
參考文獻(xiàn)
[1]CHURRUCA I,FERNANDEZ-QUINTELA A,PORTILLO M P.Conjugated linoleic acid isomers:Differences in metabolism and biological effects[J].Biofactors,2009,35(1):105-111.
[2]嚴(yán)梅榮,顧華孝.共軛亞油酸合成方法的研究進(jìn)展[J].中國油脂,2003,28 (7):40-42.
[3]周凌華,張灝,陳衛(wèi),等.生物合成共軛亞油酸菌種的篩選與鑒定 [J].無錫輕工大學(xué)學(xué)報(bào),2004,23 (5):53-57.
[4]ZHANG Bai-xi,CHEN Hai-qin,LI Min,et al. Genetic engineering of Yarrowia lipolytica for enhanced production of trans-10, cis-12 conjugated linoleic acid[J].Microbial Cell Factories,2013,12:70.
[5]NAJJAR A,ROBERT S,GUERIN C,et al. Quantitative study of lipase secretion,extracellular lipolysis,and lipid storage in the yeast Yarrowia lipolytica grown in the presence of olive oil: analogies with lipolysis in humans [J].Applied Microbiology and Biotechnology,2011,89(6):1 947-1 962.
[6]PAPANIKOLAOU S, AGGELIS G. Lipid production by Yarrowia lipolytica growing on industrial glycerol in a single-stage continuous culture[J].Bioresource Technology,2002,82(1):43-49.
[7]KEBABCI O,CLHANGLR N.Comparison of three Yarrowia lipolytica strains for lipase production:NBRC1658,IFO 1195,and a local strain[J].Turkish Journal of Biology,2012,36:15-24.
[8]BEOPOULOS A,MROZOVA Z,THEVENIEAU F,et al. Control of lipid accumulation in the yeast Yarrowia lipolytica[J].Applied and Environmental Microbiology,2008,74(24):7 779-7 789.
[9]ZHANG Bai-xi,RONG Chun-chi,CHEN Hai-qin,et al. De novo synthesis of trans-10,cis-12 conjugated linoleic acid in oleaginous yeast Yarrowia Lipolytica[J].Microbial Cell Factories,2012,11:51.
[10]HORNUNG E,KRUEGER C,PERNSTICH C,et al. Production of (10E,12Z)-conjugated linoleic acid in yeast and tobacco seeds[J].Biochimica Et Biophysica Acta,2005,1 738(1-3):105-114.
[11]滕宏飛,王丹靜,徐青,等.橄欖油乳化法測定脂肪酶活性的優(yōu)化研究[J].食品工業(yè),2011(6):80-83.
[12]FICKERS P,BENETTI P H,WACHE Y,et al. Hydrophobic substrate utilisation by the yeast Yarrowia lipolytica,and its potential applications[J].FEMS Yeast Research,2005,5(6-7):527-543.
[13]WEETE JD.Lipid biochemistry of fungi and other organisms[M].New York and London:Plenum Press,1980:97-111.
[14]FICKERS P,NICAUD J M,GAILLARDIN C,et al. Carbon and nitrogen sources modulate lipase production in the yeast Yarrowia lipolytica[J].Applied Microbiology,2004,96(4):742-749.
[15]GASMI N,AYED A,NICAUD J M,et al. Design of an efficient medium for heterologous protein production in Yarrowia lipolytica: case of human interferon alpha 2b[J].Microbial Cell Factories,2011,10:38.
Effects of nitrogen sources on the synthesis of conjugated linoleic acid byYarrowialipolytica
ZHANG Bai-xi1,LI Min1, CHEN Hai-qin1,CHEN Wei1,2,ZHANG Hao1*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122,China)2(State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122,China)
ABSTRACTIn order to increase the yield of trans-10, cis-12-conjugated linoleic acid(t10, c12-CLA)in recombinant Yarrowia lipolytica, effects of nitrogen limitation strategy and different nitrogen sources on lipase (Lip2) activity, conjugated linoleic acid isomerase (PAI) expression and t10, c12-CLA production were investigated using flask fermentation with YNBDSa medium. The results indicated that high nitrogen concentration in medium was more conducive to the growth of recombinant yeast and production of t10, c12-CLA, and the yield of t10, c12-CLA reached 4.3 g/L, which was 8.6 times higher than that produced in nitrogen limitation medium. Organic nitrogen sources were more effective for the expression of PAI and Lip2. Yield of t10, c12-CLA was up to 4.6 g/L, which was 46-folds increase compared with inorganic nitrogen sources.
Key wordsYarrowia lipolitica; nitrogen sources; t10, c12-conjugated linoleic acid; yield
收稿日期:2015-10-29,改回日期:2015-12-02
基金項(xiàng)目:國家自然科學(xué)基金青年基金項(xiàng)目(31501457)
DOI:10.13995/j.cnki.11-1802/ts.201603002
第一作者:碩士研究生(張灝教授為通訊作者,E-mail:zhanghao@jiangnan.edu.cn)。

