不同2型糖尿病腎病模型建立方法及成模特點比較
閆永恒,李漸鵬,劉戰偉,徐志祥,王新春,徐同成,邱 斌,劉振華,杜方嶺(山東省農業科學院農產品研究所,濟南 5000;山東農業大學食品科學與工程學院,山東泰安 7000;濟南誠匯雙達化工有限公司,濟南 500)
?
不同2型糖尿病腎病模型建立方法及成模特點比較
閆永恒1,2,李漸鵬1,劉戰偉3,徐志祥2,王新春2,徐同成1,邱斌1,劉振華1,杜方嶺1
(1山東省農業科學院農產品研究所,濟南250100;2山東農業大學
食品科學與工程學院,山東泰安271000;3濟南誠匯雙達化工有限公司,濟南250101)
摘要:綜述不同的2型糖尿病腎病建模方式并進行比較,以方便實驗者根據實驗目的、實驗室條件及經驗等,從中選擇出適合的建模方式,為2型糖尿病腎病的預防和治療提供科學依據。
關鍵詞:2型糖尿病腎病;動物模型;鏈脲佐菌素
糖尿病腎病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常見的微血管并發癥,病因和發病機制目前尚不明確,研究成果提示為代謝紊亂、炎性反應機制、氧化應激、血流動力學改變、細胞因子、遺傳因素及自噬等多種因素共同導致了糖尿病腎病的發病[1]。糖尿病腎病發病不可逆,在服藥之外需要醫學營養治療的有效輔助,即通過調整營養素結構來起到控制血糖、維持理想體重和預防營養不良發生的作用。根據2013年版《中國2型糖尿病防治指南》,中國患病人群中2型糖尿病占90.0%以上[2]。由于我國城市化進程加快、老齡化水平上升、國民生活方式轉變加之肥胖和超重的比例上升,短期內我國糖尿病患病率急劇增加,對社會醫療衛生服務成本造成巨大壓力,因此對于2型糖尿病預防與治療手段的完善進程亟需加快。
從Minkowski和Von Mehring用切除狗胰腺的方法建立糖尿病模型以來,隨著糖尿病研究范圍的擴大,使用的實驗動物種類也逐漸增多,如主要用于遺傳學、病因學、神經學系統研究的靈長類動物獼猴等哺乳動物[3]和主要用于藥物篩選、血液生化、發病機制研究的大鼠等嚙齒類動物模型。其中鼠科動物因具有體積小、易繁殖、飼養條件要求低、飼料喂養依從性高、起病迅速等優點成為公認的誘導糖尿病腎病的理想模型。大鼠模型的建立模擬了2型糖尿病初期病理,為發病機理的進一步研究,探索有效的降低糖尿病腎病發病風險的生活干預方式提供了可能。國內外學者長期嘗試建立大鼠糖尿病腎病模型的過程中,選用了不同的品種和途徑,然而,現階段普遍認可及應用最廣的建模方式質量參差不齊,有成功率低、成功可復制率較低、成模標準未確立、耗時較長、無法兼顧高效和低廉及模型無法模擬人類糖尿病腎病后期病理等桎梏,本文旨在系統總結不同的糖尿病腎病建模方式并進行比較,以方便實驗者根據實驗目的、實驗室條件及實驗經驗,從中選擇出較為合適的建模方式。
1 自發性2型糖尿病腎病模型
2型糖尿病發生糖尿病腎病所占比例較高,是現階段醫學研究熱點之一,因此研究的自發性模型也相對較多,現簡述應用較多的幾種自發性2型糖尿病腎病模型特點及應用現狀(附表)。
自發性模型鼠雖然在一定程度上模擬了人類糖尿病腎病發病存在的遺傳性因素,但仍有自身桎梏。一方面,由于發病過程中遺傳因素占比巨大,導致這些動物模型后期飼養方式轉變對病變影響較小,也無法兼顧人類發病的生活方式影響因素。另一方面,雖然對于不同單一品種的自發性2型糖尿病模型的研究均顯示其具有典型的糖尿病腎病病理改變[4-8],但不同模型鼠之間的橫向比較較少,導致部分實驗者在選擇自發性模型時出現困惑。李娜等[9]在對自發性2型糖尿病KK-Ay/Ta和C57BL/KsJ-db/db小鼠比較后發現,品系的差異導致發病時間和異常持續時間均有不同,實驗者須根據具體實驗傾向選擇模型。最后,自發性2型糖尿病動物模型建立標準并不統一,往往獲得渠道狹窄,因為遺傳性病變導致存活時間短且不能生育,價格昂貴,日常實驗需要耗時地進行回交誘導突變來測試病理生理過程,不適用于大規模飼養探索。
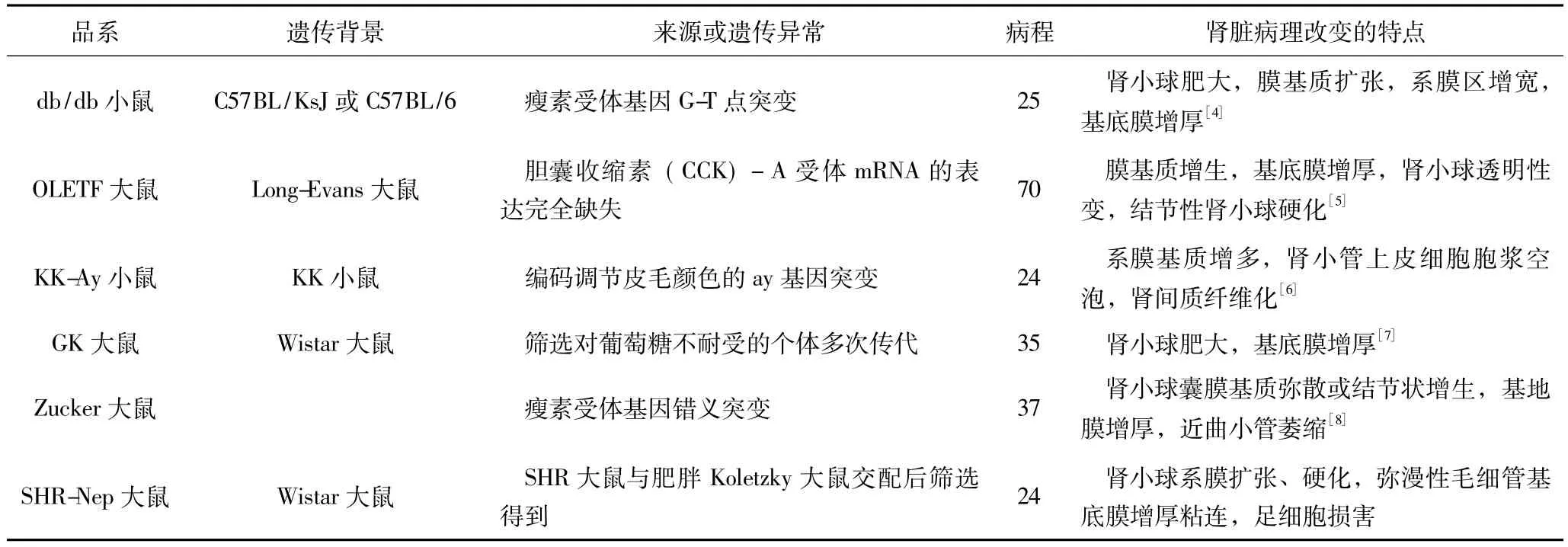
附表 幾種自發性2型糖尿病腎病模型特點
2 誘導性糖尿病腎病模型
2.1實驗動物的選擇
誘導性建模常用大鼠品系以Wister和SD為主。陳楓等[10]對比SD大鼠和Wistar大鼠成模成功率后發現,Wistar大鼠成模率高、死亡率低且成模后體征表現優于SD大鼠。王曉琳等[11]在對比不同性別的Wistar大鼠建模結果后,得出雄性大鼠對鏈脲佐菌素(STZ)敏感程度高于雌性大鼠。陳靜等[12]選取7~9w齡雄性SD大鼠35只探討大鼠體質量對1型糖尿病造模成功率的影響,發現體質量180~240g大鼠糖尿病成模率較高,隨著體質量的增加,成模率會降低,死亡率增大。綜上所述,7~9w 180~240g的雄性Wistar大鼠是較為理想的2型糖尿病腎病的動物模型。
2.2實驗試劑
在誘導性模型建立過程中,鏈脲佐菌素(STZ)是不可或缺的關鍵試劑也是最關鍵的一環。在糖尿病腎病的發生和發展中,胰島β細胞生存狀態起關鍵性的作用[13]。STZ作為一種DNA烷基化試劑,能通過GLUT2葡萄糖轉運蛋白(GLUT2 glucose transport protein)獨自進入細胞,對胰腺胰島胰島素誘發的β-細胞具毒性。需要注意的是,隨著STZ誘導的糖尿病給藥方式不同,其成模效果上也隨之帶來差別。劉長青等[14]采用pH4.5檸檬酸磷酸鹽緩沖液(PBS)、pH 5.5、pH 7.0 Hanks,及pH 7.0生理鹽水4種溶劑溶解STZ對小鼠腹腔注射,觀察溶劑類型及其酸堿度對模型成功率的影響,發現pH 4.5檸檬酸造模成功率最高,有借鑒意義。模型制作的另一個關鍵是STZ溶液的保存及應用,特別是檸檬酸磷酸鹽緩沖液濃度及PH值要符合要求,溶液應充分混勻,避光保存。現配現用,最好在配制后10min內注射完畢。注射藥物后48h后,模型鼠即可出現血糖升高,飲水量、尿量增加,故給予充足水分和食物動物密度不宜過大,通風要好,防止相互撕咬及各種感染,在有創操作時注意局部消毒。
2.3模型建立方式
實驗室誘導模型基于實驗條件和操作技術不同的影響,發展出若干不同的糖尿病腎病模型建立方式。以鏈脲佐菌素為主的注射定向破壞胰島β細胞,并在此基礎上做出不同的優化與改進,成為現在被廣泛接受的造模主要方式。
2.3.1單純腹腔注射在模型建立方法方面,無論哪種模型建立方法,STZ溶液都扮演著至關重要的角色。STZ注射劑量問題是模型建立的關鍵。在注射方式上,沈亞非等[15]對比了尾靜脈注射和腹腔注射鏈脲佐菌素,發現兩者都可以建立標準的糖尿病腎病模型,但尾靜脈注射較難掌握,易出現操作誤差,腹腔注射較易操作、準確。在注射劑量上,李偉等[16]對比注射40、50、60、70mg/kg的STZ成模率和死亡率以后,得出注射60mg/ kg的STZ是致SD大鼠發生糖尿病腎病的最佳劑量的結論。李光輝等[17]對比注射55、65、75mg/kg的STZ成模率和死亡率以后,得出注射65mg/kg的STZ注射方式具有成模率高、病死率低、感染率低的優點。
上述實驗者結論均為高劑量STZ注射有利于建模,卻均未完全考慮STZ對胰島β細胞的強靶向作用,導致胰島素急劇下降,結果更接近于對于建立1型糖尿病模型,而非2型糖尿病模型。所以我們在建立2型糖尿病腎病模型時,不宜采用大劑量STZ注射。因此,陳楓等[10]對比55、45、35、25mg/kg不同劑量STZ造模的成功率和死亡率后,所提出的建立2型糖尿病腎病模型注射STZ 35mg/kg的最優劑量是更為合理的。現今報道也有采用多次小劑量STZ的注射代替一次大劑量注射的方法,以減少STZ對腎臟的過大毒性作用。STZ溶液基本要求是現配先用,故而實驗室條件不同,配置到注射時間間隔不同都有可能造成造模效果的差異。
2.3.2鏈脲佐菌配合單腎切除(結扎)該方法是在大鼠禁食12h后進行腹腔注射3%的戊巴比妥鈉進行麻醉,從左側脊柱與肋骨相交處稍下方切開皮膚及肌層,暴露腎臟,選擇性摘除左腎或于腎門處結扎,縫合肌層和皮膚,術后4w,禁食12h,再進行小劑量STZ溶液的腹腔注射。單側腎臟切除導致保留的腎臟代償性肥大、高過濾,腎小球毛細血管壓力增大,促進糖尿病腎小球損傷。邢淑麗等[18]通過腹腔注射鏈脲佐菌素45mg/kg(冬季)和35mg/kg (夏季)聯合單側腎臟切除成功制造出穩定性強、可復制性高的大鼠DN模型,可以看到該方法從致病原理和注射劑量控制上都是較為合適的。李世芬等[19]比較了腹腔STZ注射配合單腎切除與腹腔STZ注射配合單腎結扎兩種造模方法,發現2種造模方法在模型成立上無較大差別,操作難度相同,隨病程加長不排除單腎切除存活率低于單腎結扎的可能,故而建議實驗者在考慮此類方法時采取單腎結扎方式。該方法未能廣泛普及的原因有三點:一是對于實驗者經驗要求較高,手術過程繁瑣;二是單側腎臟切除后造成的健側腎臟的代償性增生并不完全符合人類2型糖尿病腎病疾病發展特點;三是模型鼠相對于傳統腹腔注射死亡率升高。
2.3.3鏈脲佐菌素配合高脂高糖飲食研究表明,由胰島素代謝障礙而導致的高血糖是DN發生的最關鍵原因,飲食中蛋白含量過高是DN的危險因素,脂代謝紊亂亦是DN發生的一項獨立的影響因素。芝敏等[20]比較不同飲食結構建立2型糖尿病腎病大鼠模型時發現,高糖高脂可導致糖尿病腎病大鼠更為明顯的高血壓和更加嚴重的微量白蛋白尿,且等易導致腎小球硬化,病理損害相對較重。故而STZ注射配合高脂高糖飲食法既繼承了高脂高糖法對于人類生活習慣的模擬性并誘導出胰島素抵抗,又加以注射STZ引起β細胞受損并誘發胰島素代償性分泌障礙,大大縮短了建模速度,同時與單側腎切除相比對實驗者技術要求低,建模過程中動物模型死亡率低,成為目前運用最廣泛的方法。建模通用標準高糖高脂飼料:蔗糖10%、豬油10%、植物油10%、膽固醇5%、普通基礎飼料65%、另有0.2%膽鹽以促進對脂肪吸收。
董建一等[21]采用高脂飼料喂養4w加一次性注射25mg/kg的STZ溶液的方法探索建立2型糖尿病腎病模型,成模率僅為67%且模型不穩定。郭俊秀等[22]對該方法合理性進行了驗證,通過高脂高糖飼養6w后,一周一次共兩周的30mg/kg的STZ腹腔注射,建立起了穩定的大鼠糖尿病腎病的模型。證明了高脂高糖聯合STZ注射法是理想的造模方法。
需要注意的是,在高脂高糖飲食階段,高脂高糖飼養會造成強飽腹感,引起實驗動物進食量的減少,導致胰島素抵抗現象出現緩慢、血糖升高不明顯。對此,林瓊等[23]對原有方式進行了改良,即高糖高脂飼料喂養+5%葡萄糖水飲水,一方面加速胰島素抵抗的出現(2w),另一方面,高糖引起滲透性利尿也有加速腎臟損傷的作用。另外通過連續3d小劑量腹腔注射STZ (30mg/kg),避免了一次性注射高劑量STZ導致的誘導1型糖尿病傾向和動物模型死亡,同時也減少了STZ本身的腎毒性所造成的腎臟損害。
2.3.4鏈脲佐菌素注射配合高糖高脂飲食合并單腎切除Mikio S等[24]為加速糖尿病腎臟病損傷的出現,采取用40mg/kg的STZ溶液靜脈注射加切除右腎,手術后2w再喂以高糖高脂飲食的方法。這種在高糖高脂飼養+腹腔注射小劑量STZ的基礎上進行單側腎臟切除的方式建立糖尿病腎病模型的方法又稱“三聯法”,它結合了運用最優的建模因素:單側腎切除引起腎臟代償性肥大,鏈脲菌素注射耗損胰島B細胞,高脂高糖模擬人類致病因素。一方面,三聯法的優勢在于大大縮短了造模用時,且造模的成功率以及成模后的穩定性,病理改變的顯著性,蛋白尿的嚴重性也較單純的小劑量STZ加高脂或STZ加單側腎切除實驗方案更加優越。但另一方面,我們無法忽略這種方法的不足——合并了上述種種造模方式的短板,特別是實驗流程上的繁瑣,使大多實驗者望而卻步。
2.4成模標準
多年來,對于2型糖尿病腎病成模標準一直存在諸多差異,這些差異或會導致研究結果的可借鑒意義和可重復性大大下降。現在最普遍的成模標準為,開始72h后至少連續3d尾靜脈檢測血糖為基,以連續3次血糖>16.65mmol/尿糖強陽性;尿量大于對照組的50 %的標準判定是否建模成功。上述標準雖被廣泛接受卻也存在問題:汪峰等[25]在對于鏈脲佐菌素誘導糖尿病大鼠模型穩定性進行探討時發現,腹腔注射STZ溶液3w后有30%的大鼠模型空腹血糖值回到正常水平,這表示模型建立時存在不穩定的可能,所以提出參照目前的72h模型判定方式無法囊括造模不穩定現象,建議采用腹腔注射STZ后第3w空腹血糖值≥16.7為模型建立新標準。曾玉琴等[26]通過OGTT葡萄糖耐量實驗方式篩選成模大鼠。郭學軍等[27]發現,在有明確胰島病理改變的模型組大鼠中OGTT異常陽性率顯著高于空腹血糖異常陽性率,提出在動物實驗中OGTT比空腹血糖監測更有診斷意義,不易造成漏診。另外,在判斷DN模型是否成功時,從源頭實驗動物的選擇到造模結束后動物模型基礎指標(包括血壓、血糖、血肌酐、血尿素氮、尿蛋白定量等)的檢測方法的標準化均需要引起實驗者們的重視。
3 結論與討論
第一,自發性的動物模型和誘發性的動物模型在一定程度上共同模擬了臨床糖尿病腎病的癥狀,包括胰島素抵抗、高血糖、高血脂等,但兩種模型的應用價值卻不盡相同。誘發性糖尿病小鼠模型相比,自發性動物模型由于其存在遺傳因素作用,糖尿病腎病的產生與臨床患者更為相似,應用價值更高。如db/db小鼠是由于瘦素(leptin)受體基因缺陷失去功能,在出生后2w內就發生高胰島素血癥,3~4w發展為肥胖,8w后就發展為非常嚴重的高血糖癥,期間伴有胰島素抵抗,β細胞功能衰竭,一般在8~10個月內死亡,可發生明顯的腎病[28]。但是自發性模型相較于普通誘導鼠類模型的獲得渠道更為狹窄,成本較高,故而運用未似誘發性模型廣泛。誘發性的動物模型則更強調了后天成長因素,與現代社會普遍不科學飲食和不健康生活方式相近,但亦有其缺點:首先,其忽略了DN發病的遺傳因素;其次,其存在造模時間偏長、穩定性不足的問題;最后,多數建模成功產生了血糖升高等類似2型糖尿病的癥狀后,模型體型缺與正常小鼠體型差異無顯著性,未出現肥胖現象。2種小鼠模型都存在一定的優點與缺陷,研究者可根據實際需要參照相關數據進行選擇。
第二,在模型建立方法方面。胰島素抵抗是2型糖尿病最顯著的特征,有無胰島素抵抗也是區別1型和2型糖尿病腎病動物模型的標準[29]。1型糖尿病的病理生理學和病理學特征是胰島B細胞數量顯著減少和消失所導致的胰島素分泌顯著下降或缺失,表現為起病迅速,中度至重度的臨床癥狀。由此可見2型糖尿病與1型糖尿病主要區別在于: 2型糖尿病較1型糖尿病胰島細胞破壞程度輕,發病速度慢,所以STZ注射法建立2型糖尿病一定要控制劑量,否則將有建模發展成1型糖尿病的可能性。有研究表明STZ對于腎臟損害是可疊加性的,所以實驗者在糖尿病腎病建模過程中,在一次注射失敗情況下,采用二次補注的方法的合理性有待商榷。
第三,實驗動物的存活是模型建立的前提,但糖尿病腎病模型建立過程容易發生動物死亡,王彥江等[30]探討了STZ誘導糖尿病大鼠造模過程中模型鼠的死亡原因,發現模型鼠的死亡可能與實驗操作過程中感染、大鼠自身營養不良、淋巴循環受阻、STZ本身的毒性以及環境氣候條件的變化有關,實驗者在實驗過程中應對以上因素加倍注意。
參考文獻
[1]趙龍,關廣聚.糖尿病腎病發病機制研究進展[J].中華腎臟病雜志,2013,29(7) :554-558.
[2]中華醫學會糖尿病學分會.中國2型糖尿病防治指南[J].中國糖尿病雜志,2014,88(7),1227-1245.
[3]王艷靜,葉華虎,邵軍石.獼猴自發性糖尿病動物模型的初步探討[J].中國比較醫學雜志,2004,1(1) :13.
[4]吳靜,王華旻.db/db小鼠的實驗室應用[J].生物科學進展,2013,1:12-18.
[5]陳婧,易煒.OLETF大鼠自發性2型糖尿病動物模型研究概述[J].廣州中醫藥大學學報,2015,1:178-182.
[6]劉曉丹,楊剛,范秋靈,等.自發性2型糖尿病動物模型KKAy小鼠腎臟損害的特征與演變[J].中國醫科大學學報,2011,2:104-106.
[7]胡泊洋,江道峰,王張,等.自發性2型糖尿病動物模型GK大鼠的發病特征研究[J].中國實驗方劑學雜志,2013,10:203-207.
[8]Ruth,Kava,M.R.C.Greenwood,P.R.Johnson.,等.糖尿病動物模型研究進展(二) Zucker (肥胖)大鼠[J].實驗動物科學與管理,1992,2:78-83.
[9]李娜,張周.兩種自發性2型糖尿病小鼠生物學特性比較[J].中國比較醫學雜志,2011,1:101-106.
[10]陳楓,程錦楠,唐小平,等.大鼠品系及藥物劑量對糖尿病大鼠模型的影響[J].瀘州醫學院學報,2011,2: 156-158.
[11]王曉琳,邱宗蔭,夏永鵬.性別差異對實驗性鏈脲佐菌素糖尿病大鼠造模的影響[J].第三軍醫大學學報,2009,17:1668-1671.
[12]陳靜,馮波,王成,林菁艷.大鼠體質量對1型糖尿病造模成功率的影響[J].現代醫藥衛生,2014,5:670-674
[13]PettepherCC,Ledoux SP,Bohr VA,et al.Repair of Alkaltlabile sites within the mutoehondral DNA of RINr 38 cells after exposure to the mtrosourea streptozotocin[J].J Bio Chem,1991,266:3113.
[14]劉長青,宋立江,郭金銘.不同溶劑和體重在鏈脲佐菌素血糖模型的作用比較[J].衛生研究,2008,37(3) : 276-277.
[15]沈亞非,徐焱成.鏈脲佐菌素誘導實驗性糖尿病大鼠模型建立的研究[J].實用診斷與治療雜志,2005,2: 79-80.
[16]李偉,張紅,殷松樓,褚璇.不同劑量鏈脲佐菌素誘導SD大鼠糖尿病腎病模型的研究[J].徐州醫學院學報,2006,1:52-55.
[17]李光輝,陳正,廖德懷,等.不同劑量鏈脲佐菌素建立大鼠糖尿病模型[J].廣東醫學,2010,S1:45-46.
[18]邢淑麗,鄭君芙,黃文政.單側腎切除STZ誘導糖尿病腎病大叔動物模型研究[J].中國中醫急癥,2006,15(6) :643-644.
[19]李世芬,王心如,王玉翠,等.SD大鼠糖尿病腎病模型構建的比較[J].南京醫科大學學報(自然科學版),2010,30(8) :1123-1128.
[20]芝敏,梁新華,徐佩茹.不同飲食結構建立的2型糖尿病腎病大鼠模型比較[J].中國老年學雜志,2014,8: 2179-2181.
[21]董建一,王亮,王福金,等.建立Ⅱ型糖尿病大鼠模型的探討[J].實驗動物科學,2010,4:59-61.
[22]郭俊秀,武華,高向東.鏈脲佐菌素加膳食高脂高糖飼料誘導的2型糖尿病大鼠模型的驗證[J].山西中醫學院學報,2009,2:51-52.
[23]林瓊.2型糖尿病腎病大鼠模型的建立及慢病毒載體介導siRNA對I型膠原抑制作用的研究[D].第二軍區大學:海軍臨床醫學院,2011.
[24]Mikio S,Hideyuki Y,Tsutomu H,et al.High-fat diet in low—dose-streptozotocin—treated heminephrectomized rats induces all features of human type 2diabetic nephropathy: a new rat model of diabetic nephropathy[J].Nutirtion,Metbaolism&Cardiovsacular Diseases,2006,16:477-484.
[25]汪峰,楊國珍,劉宓,等.鏈脲佐菌素誘導的糖尿病大鼠模型穩定性觀察[J].貴陽醫學院學報,2012,1: 40-42.
[26]曾玉琴,胡清,朱建勇.2型糖尿病大鼠脂聯素受體基因表達的相關性研究[J].山西醫藥雜志,2012,4: 333-335.
[27]郭學軍,鄒移海,吳凌,劉曉秋.鏈脲佐菌素誘導SD 和Wistar大鼠糖尿病模型的影響因素[J].中國實驗動物學報,2008,4:103-106.
[28]Hndkins KL,Pichaiwong W,Wietecha T,et al.BTBR Ob/Ob mutant mice model progressive diabetic[J].Nephropathy,2010,21(9) :1533-1542.
[29]Wang Q,Wang Y,Minto AW,et al.MicroRNA-377 is upregulated and can lead to increased fibronectin production in diabetic nephropathy[J].FASEB J,2008,22 (12 ) : 4126-4135.
[30]王彥江,謝席勝,馮勝剛,等.STZ誘導糖尿病大鼠造模法中大鼠死亡原因探討[J].四川大學學報(醫學版),2014,4:691-695.
(責任編輯李婷婷)
Comparison of Different Modeling Methods and Characteristics of Type 2 Diabetic Nephropathy Rat Model
YAN Yong-heng1,2,LI Jian-peng1,LIU Zhan-wei3,XU Zhi-xiang2,WANG Xin-chun2,XU Tong-cheng1,QIU Bin1,LIU Zhen-hua1,DU Fang-ling1
(1Institute of Agro-Food Science and Technology,Shandong Academy of Agricultural Science,Jinan 250100,China;2College of Food Science and Engineering,Shandong Agricultural University,Tai'an 271000,China)
Abstract:We summarized different modeling methods of type 2 diabetic nephropathy to facilitate the experimenters to choose suitable modeling methods according to the laboratory conditions to provide scientific basis for the prevention and treatment of tyre 2 diabetic nephropathy.
Keywords:type 2 diabetic nephropathy; animal model; STZ
通訊作者:杜方嶺(1972—),男,碩士,研究員,研究方向:特殊醫學用途配方食品。
作者簡介:閆永恒(1992—),女,在讀碩士研究生,研究方向:特殊醫學用途配方食品。
基金項目:國家自然科學基金(項目編號: 31401487) ;山東省農業科學院科技創新重點項目(項目編號: 2014CXZ03)。

