含左氧氟沙星或含莫西沙星方案治療耐多藥肺結核的療效分析
李琦 姜曉穎 梁建琴 楊坤云 闞曉宏 邱麗華 唐神結 蔡寶云 卜建玲 劉玉琴 牛國強 余衛業 高飛 張立群 初乃惠 李亮 高微微
?
·論著·
含左氧氟沙星或含莫西沙星方案治療耐多藥肺結核的療效分析
李琦 姜曉穎 梁建琴 楊坤云 闞曉宏 邱麗華 唐神結 蔡寶云 卜建玲 劉玉琴 牛國強 余衛業 高飛 張立群 初乃惠 李亮 高微微
目的 回顧性分析以左氧氟沙星(Lfx)或莫西沙星(Mfx)作為核心藥物的化療方案治療耐多藥結核病(MDR-TB)患者的療效、轉歸及其相關因素,為氟喹諾酮類藥物在MDR-TB治療中的合理選擇提供依據。 方法 選取2009年7月至2010年7月我國10家結核病診療機構確診為MDR-TB的患者共232例。其中,應用含Mfx(含Mfx組)化療方案的患者124例,含Lfx(含Lfx組)化療方案的患者108例。收集治療前、中、末的細菌學、影像學等資料,療程末評估療效和治療轉歸。采用SPSS 17.0軟件進行數據分析。計量資料呈正態分布時采用t檢驗、非正態分布時采用秩和檢驗。計數資料采用χ2檢驗,當理論頻數<1時,采用Fisher確切概率法檢驗。采用logistic回歸對與治療轉歸相關的因素進行分析,以P<0.05為差異有統計學意義。 結果 (1)治療6個月末,含Lfx組患者和含Mfx組患者的痰涂片陰轉率[88.4%(61/69)、79.0%(79/100)]和痰培養陰轉率[81.5%(53/65)、(73.6%(67/91)]相接近(χ2值分別為2.541、2.404,P值均>0.05)。治療24個月末,含Lfx組患者的痰培養陰轉率(92.2%,47/51)高于含Mfx組(76.9%,50/65)(χ2=3.794,P<0.05)。(2)治療24個月末,含Lfx組的空洞閉合率(48.8%,20/41)高于含Mfx組(23.2%,13/56)(χ2=5.801,P<0.05),而病變吸收好轉率在兩組間[81.0%(64/79)、76.2%(64/84)]差異無統計學意義(χ2=0.561,P>0.05)。(3)含Lfx組與含Mfx組總不良反應發生率[(25.0%(27/108)、26.6%(33/124)]相接近(χ2=0.012,P>0.05)。其中,兩組藥物性肝損傷的發生率最高,分別達16.7%(18/108)和10.5%(13/124)。(4)含Lfx組與含Mfx組治療成功率相接近,分別達61.1%(66/108)和59.7%(74/124)(χ2=0.050,P>0.05)。含Mfx組的死亡率(6.5%,8/124)高于含Lfx組(0.9%,1/108)(Fisher 確切概率法,P<0.05),丟失率(14.5%,18/124)低于含Lfx組(24.1%,26/108)(χ2=3.341,P<0.05)。(5)logistic回歸分析顯示僅癥狀體征評分≤6分和既往未應用阿米卡星(Am)是影響治療成功的獨立因素(β=-0.670、-0.679;Waldχ2=4.696、3.866;OR=0.512、0.507;95%CI=0.279~0.938、0.258~0.998;P值均<0.05)。 結論 含Lfx與含Mfx的化療方案的療效與治療成功率接近,患者臨床狀況和既往相關核心藥物使用情況與治療成功有關。
結核/治療; 抗結核藥; 藥物療法
2015年世界衛生組織(WHO)報告[1]耐多藥結核病(MDR-TB)的治療成功率僅為50%,而死亡率高達16%,顯示MDR-TB的療效仍不盡如人意。為此,選擇有效的抗結核藥物組成合理的化療方案是提高MDR-TB治療成功率的關鍵。國內外規范與指南均以新一代氟喹諾酮類藥物[左氧氟沙星(Lfx)或莫西沙星(Mfx)]作為治療MDR-TB的核心藥物,并制定了藥物選擇原則和順序[2-4]。但如何評價兩種藥物的治療作用仍有爭議[5-6]。本研究對Lfx或Mfx作為核心藥物的化療方案治療MDR-TB患者的療效進行分析,探討相關影響因素,為氟喹諾酮類藥物在MDR-TB治療中的合理選擇提供依據。
對象與方法
一、研究對象
選取2009年7月至2010年7月在首都醫科大學附屬北京胸科醫院、湖南省胸科醫院、解放軍第三○九醫院、上海市肺科醫院、山東省胸科醫院、安徽省胸科醫院、黑龍江省傳染病防治院、陜西省結核病防治院、深圳市第三人民醫院、內蒙古自治區第四醫院確診為MDR-TB、且納入“十一五”傳染病防治科技重大專項課題的患者共232例。其中,應用含Mfx化療方案的患者124例,含Lfx化療方案的患者108例。
納入標準:(1)按照中華醫學會結核病學分會制定的《肺結核診斷和治療指南》[7]診斷的肺結核患者;(2)經病原學檢查和藥物敏感性試驗(簡稱“藥敏試驗”)(入組前3個月內)確診的MDR-TB患者[即痰結核分枝桿菌培養及菌型鑒定為結核分枝桿菌,藥敏試驗顯示對包括異煙肼和利福平在內的2種及2種以上抗結核藥物耐藥,但不含對氟喹諾酮類藥物和阿米卡星(Am)耐藥],所有檢查和診斷符合WHO[8]和中國防癆協會制定的《耐多藥結核病化學治療的意見(試行)》[9];(3)年齡18~65歲;(4)胸部X線攝片(簡稱“胸片”)顯示肺內病變,有或無空洞;(5)無嚴重心、肝、腎疾患,無血液等系統功能異常,非孕婦;(6)自愿成為受試者并簽署《知情同意書》。
二、研究方法
1. 化療方案:6Z-Am-Mfx-X-Y/18Z-Mfx-X-Y(含Mfx組),6Z-Am-Lfx-X-Y/18Z-Lfx-X-Y(含Lfx組)。方案中,Z為吡嗪酰胺,Am為阿米卡星,Lfx為甲磺酸左氧氟沙星,Mfx為莫西沙星,X、Y為按照MDR-TB患者藥敏試驗結果選擇的2種敏感的一線或二線抗結核藥物,包括丙硫異煙胺(Pto)、對氨基水楊酸(PAS)、乙胺丁醇(E)和對氨基水楊酸異煙肼(Pa)。強化期(注射期)為6個月,鞏固期為18個月。兩種化療方案的制定原則均符合WHO和中國防癆協會制定的相關指南[2,9]。
2. 治療前患者資料:一般人口學資料(性別、年齡)、耐藥資料(類型、數量)、臨床資料[病程、治療史、影像學、體質量指數(BMI)、癥狀體征評分]、既往核心藥物(Z、Am、Mfx或Lfx)應用情況、本次方案中按照MDR-TB患者藥敏試驗結果選擇的藥物情況等。
3. 治療中檢測項目:分別于治療2、3、6、12、18、24個月末及治療12個月后每月或隔月查痰涂片及結核分枝桿菌培養。分別于治療前和治療3、6、12、18、24個月末行影像學檢查(攝X線胸片或胸部CT)。每月查血常規、肝腎功能、心電圖等,注射期每月查尿常規等。每月觀察不良反應。
4. 療效評估:按照中華醫學會《臨床診療指南結核病分冊》[10]制訂的標準評定。(1)痰菌陰轉為連續2次痰涂片或培養陰性(至少間隔30 d),且不再復陽。(2)X線影像學病變范圍以所有病灶相加后占有的肺野數計算,病灶“顯著吸收”為病灶吸收≥1/2原病灶,“吸收”為病灶吸收<1/2原病灶,“不變”為病灶無明顯改變,“惡化”為病灶擴大或播散。(3)“空洞閉合”為空洞閉合或阻塞閉合,“縮小”為空洞縮小≥原空洞直徑的1/2,“不變”為空洞縮小或增大<原空洞直徑的1/2,“增大”為空洞增大>原空洞直徑的1/2。
5. 治療轉歸評估:按照文獻[8]所列標準評估。(1)治愈:患者完成療程,在療程的后12個月,至少5次連續痰培養陰性,每次間隔至少30 d。(2)完成治療:患者完成療程,但缺乏細菌學檢查結果(即在治療的最后12個月痰培養的次數少于5次)。(3)治療成功:治愈與完成治療的總和。(4)死亡:在治療過程中患者由于各種原因導致的死亡。(5)失敗:治療的最后12個月5次痰培養中有2次或2次以上陽性或治療最后的3次培養中有任何一次是陽性或臨床決定提前中止治療者(如因嚴重不良反應)。(6)丟失:由于任何原因治療中斷連續2個月或以上。
6. 質量控制:各單位參加本研究的所有人員均進行統一培訓。各單位均由專人對患者進行診治、隨訪及督導。患者信息采集采用網上信息采集系統及紙質版雙采集。
三、統計學分析
1.資料分析:采用回顧性分析的方法,分析含Mfx和含Lfx組的療效和治療轉歸,并探討與治療成功相關的影響因素。
2.統計學處理:采用Excel表建立數據庫,以SPSS 17.0軟件進行數據分析。計量資料呈正態分布時采用t檢驗、非正態分布時采用秩和檢驗。計數資料采用χ2檢驗,當理論頻數<1時,采用Fisher確切概率法檢驗。采用logistic回歸對與治療轉歸相關的因素進行分析,以P<0.05為差異有統計學意義。
結 果
一、納入的MDR-TB患者治療前基本情況
如表1所示,含Mfx組患者的耐藥數量、癥狀體征評分、既往Am應用率、此次治療E使用率均高于含Lfx組,差異有統計學意義(P<0.05),其余指標在兩組間差異無統計學意義(P>0.05)。
二、兩組MDR-TB患者療效評估結果
1.痰菌陰轉結果:兩組能夠留取合格痰標本進行痰檢的MDR-TB患者(部分患者在部分時段中斷治療或因咯痰癥狀緩解導致無痰或無法獲得合格痰標本)在治療的不同時段痰涂片和培養的痰菌陰轉結果見表2。從表中可見,在治療6個月末(強化期末),兩組患者的痰涂片和痰培養陰轉率相接近(P>0.05),在治療12、18、24個月末,含Lfx組患者的痰培養陰轉率高于含Mfx組(P<0.05)。
2.影像學結果:兩組完成強化期和鞏固期療程的MDR-TB患者影像學改變見表3。從表中可見,鞏固期末,含Lfx組治療前影像學顯示有壁空洞[部分患者為蟲蝕樣(無壁)空洞,無法確切判斷其縮小與閉合,故除外]的患者的空洞閉合率高于含Mfx組,而病變吸收好轉率在兩組間差異無統計學意義(P>0.05)。
3.不良反應發生情況:兩組MDR-TB患者主要不良反應發生率見表4。從表中可見,兩組總不良反應發生率接近,差異無統計學意義(P>0.05)。在各種不良反應中,藥物性肝損傷的發生率最高,分別達10.5%和16.7%。此外,含Mfx組中7例患者、含Lfx組中6例患者因嚴重不良反應退組,其余患者在干預后繼續治療。
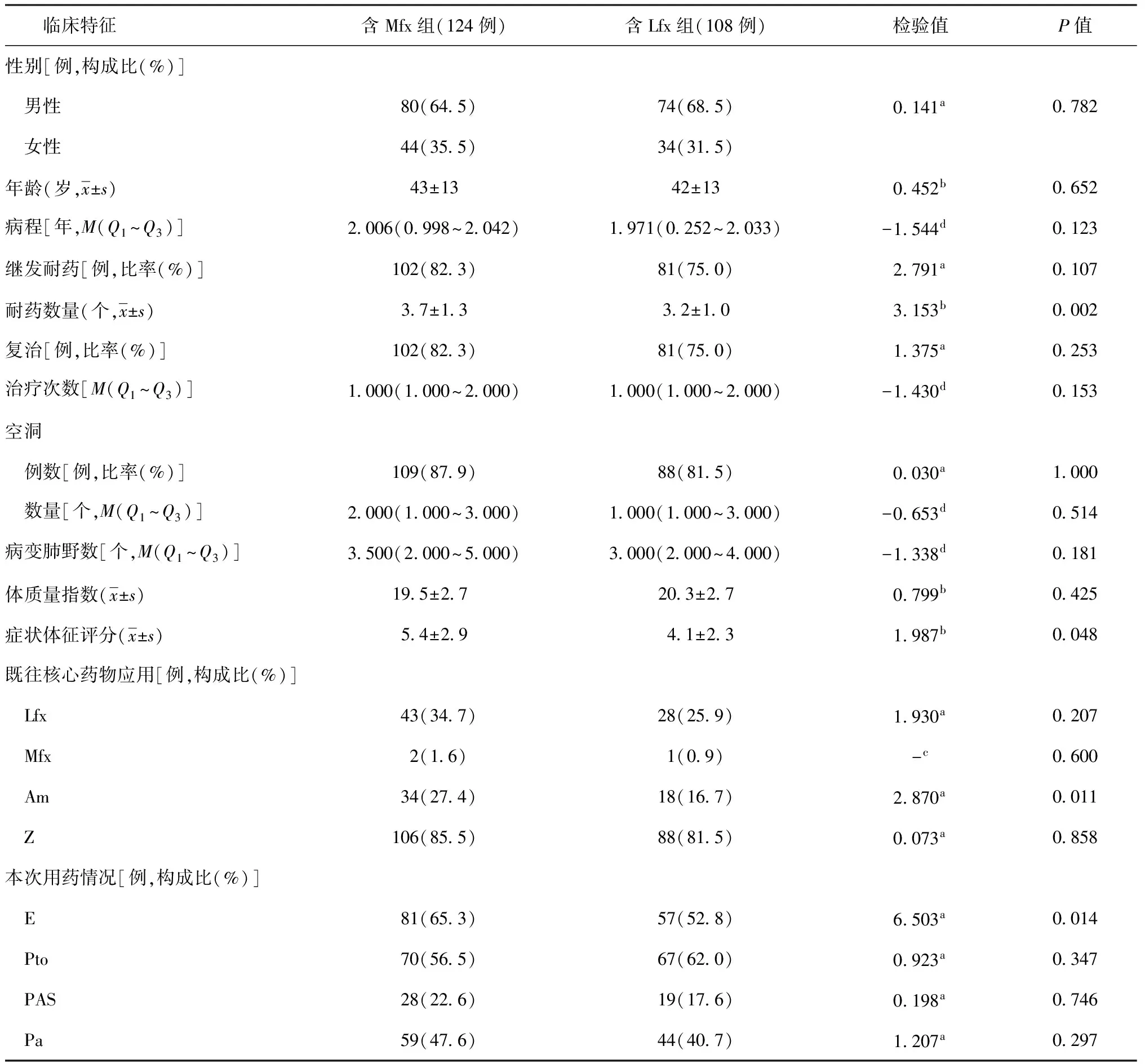
表1 不同臨床特征在納入的MDR-TB患者治療前的差異
注a:采用卡方檢驗,b:采用t檢驗,c:采用Fisher確切概率法檢驗,d:采用秩和檢驗
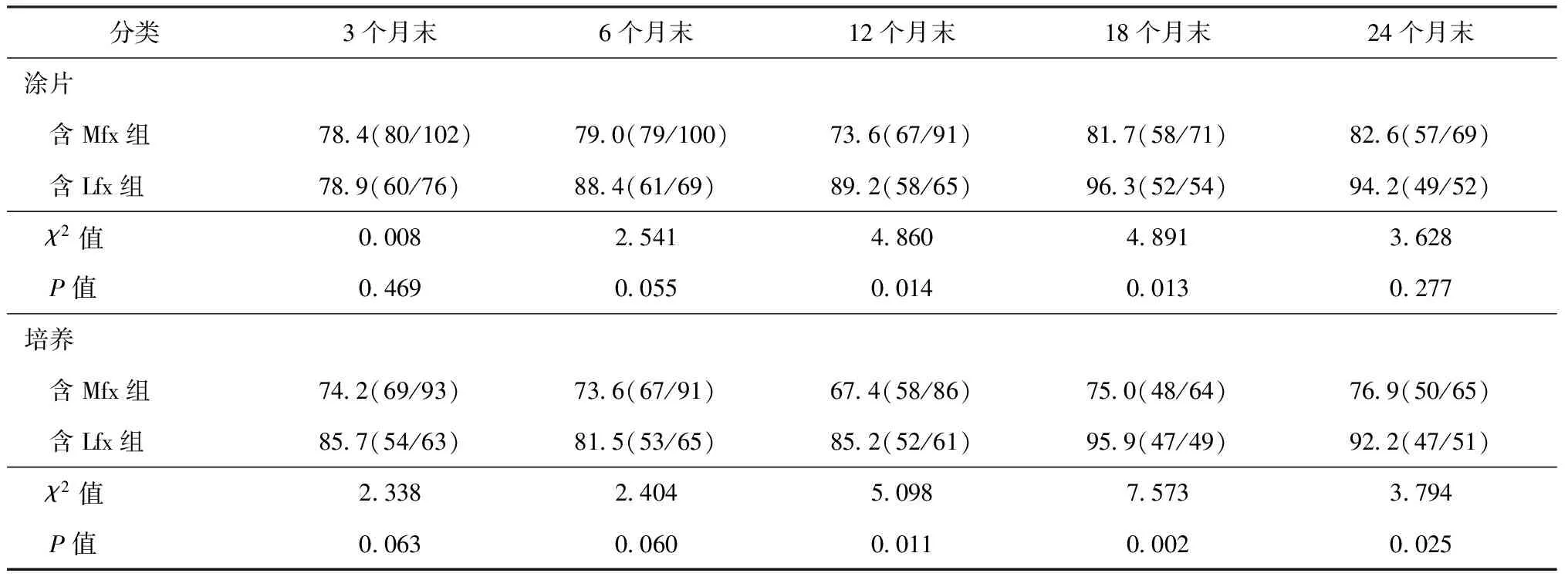
表2 兩組MDR-TB患者不同療程痰菌陰轉結果
注 表中括號內數值為“痰菌陰轉例數/檢測總例數”,括號外數值為“陰轉率(%)”
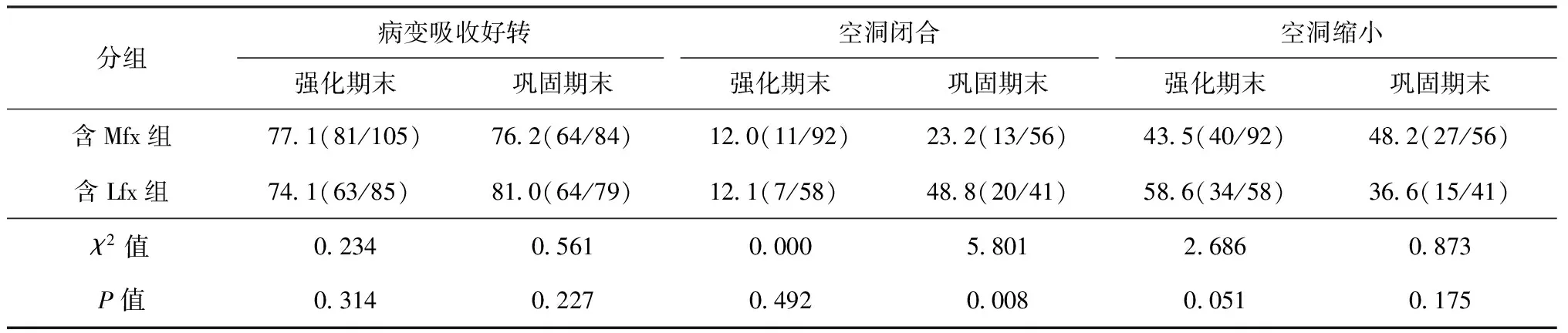
表3 兩組MDR-TB患者不同療程影像學改變結果
注 病變吸收好轉為病變顯著吸收和吸收的患者總和;表中括號內數值為不同時段“病變吸收好轉例數/觀察例數、空洞閉合例數/觀察例數、空洞縮小例數/觀察例數”,括號外數值均為“比率(%)”
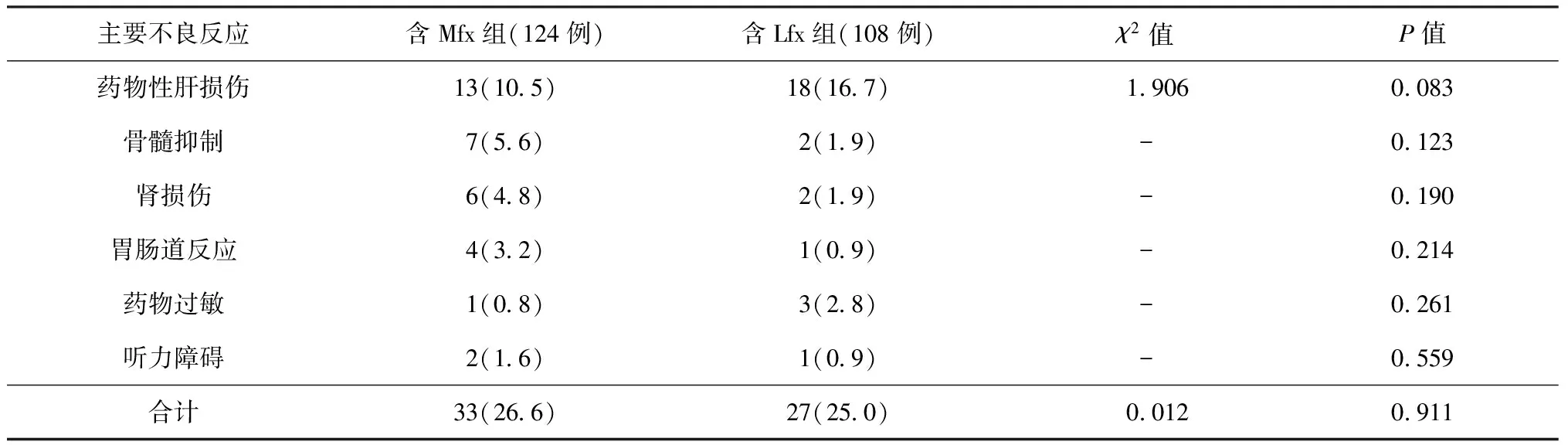
表4 主要不良反應在兩組患者中的發生情況
注 表中括號外數值為例數,括號內數值為“比率(%)”;“-”表示采用Fisher確切概率法檢驗
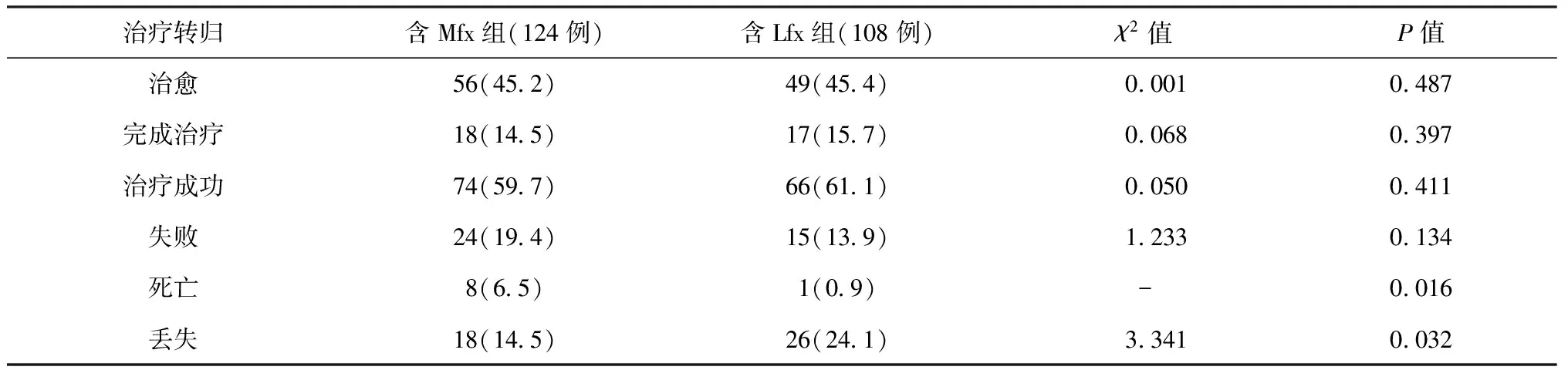
表5 不同治療轉歸在各方案組中的結果分析
注 表中括號外數值為例數,括號內為“比率(%)”;“-”表示采用Fisher確切概率法檢驗
三、兩組MDR-TB患者治療轉歸結果
兩組MDR-TB患者治療轉歸結果見表5。從表中可見,兩組治療成功率分別達到59.7%和61.1%,差異無統計學意義(P>0.05)。但含Mfx組的死亡率高于含Lfx組、丟失率低于含Lfx組,差異有統計學意義(P<0.05)。死亡原因分析顯示含Mfx組8例死亡患者中,7例死于肺部感染和原發病加重所致呼吸衰竭,1例患者死于自殺;含Lfx組1例患者死于自殺。丟失原因分析顯示含Mfx組11例患者失訪、7例患者因嚴重不良反應退組;含Lfx組20例患者失訪、6例患者因嚴重不良反應退組。
四、與治療成功率相關的因素分析
以治療成功率作為因變量,以兩組治療前差異有統計學意義的指標(耐藥數量、癥狀體征評分、既往是否應用Am、此次治療是否應用E,見表1)作為協變量,進行多因素logistic回歸分析(逐步法),各變量的賦值見表6。結果顯示僅癥狀體征評分≤6分和既往未應用Am是影響治療成功的獨立因素,見表7。

表6 MDR-TB患者logistic多因素分析變量賦值表

表7 影響治療成功的相關因素分析
討 論
早在20世紀90年代,國內外文獻就報道了氟喹諾酮類藥物的抗結核分枝桿菌活性[11-13]。Ahuja等[14]對9153例MDR-TB患者的治療轉歸進行Meta分析,顯示含氟喹諾酮類藥物的化療方案對提高MDR-TB的治療療效發揮重要作用。因此,國內外指南均將氟喹諾酮類藥物作為 MDR-TB和廣泛耐藥結核病(XDR-TB)化療方案中的主要或核心藥物,并建議MDR-TB化療方案應首選Lfx,而Mfx則主要用于XDR-TB的治療[2-3]。有研究表明Mfx的最低抑菌濃度低于Lfx,抗結核分枝桿菌活性高于Lfx,其體外活性和早期殺菌活性與異煙肼類似[15]。動物實驗亦顯示Mfx具有較強的早期殺菌和滅菌作用[16]。因此,中國防癆協會《耐藥結核病化學治療指南(2015年版)》提出“有條件者可直接選用最高代氟喹諾酮類藥物,如Mfx[4]。但 Lee等[5]的回顧性研究卻顯示含Lfx和Mfx的化療方案治療MDR-TB的轉歸和不良反應發生率接近,提示2種藥物治療MDR-TB是等效的。
一、含Lfx或含Mfx化療方案的療效分析
在國內,常采用痰菌陰轉率、病變吸收好轉率(顯著吸收+吸收)、空洞閉合率和不良反應發生率評估抗結核治療的療效。就痰菌陰轉率而言,表2顯示在獲得合格痰標本的MDR-TB患者中,無論應用Lfx還是Mfx,治療3個月末、6個月末的痰菌(培養)陰轉率均達到73%以上,顯示Lfx和Mfx的早期殺菌效果相接近,與Koh等[17]的觀察結論相一致。而在鞏固期的不同時段Lfx組的痰菌陰轉率均高于Mfx組,顯示Lfx的細菌學療效似乎略高于Mfx。這些結果與一些應用動物模型觀察Lfx和Mfx療效的結果不一致[15-16]。分析其原因,一是MDR-TB患者在耐藥種類、肺內病理改變、菌量負荷、藥物劑量、聯合用藥等方面與MDR-TB小鼠模型不盡相同,體外的研究結果不能完全反映臨床實際效能;二是MDR-TB患者抗結核治療后的痰菌陰轉率受多種因素影響,除了藥物的作用以外,還與患者耐藥狀況、查痰率等因素有關。如:隨治療療程的延長和有效,MDR-TB患者的痰量逐漸減少,特別在療程的后期很難獲取到合格的痰標本,加之患者對治療中定期檢查和評估的依從性,導致很難獲得準確的痰菌陰轉率評估療效;三是不能完全排除Lfx組耐藥平均個數[(3.2±1.0)個]少于Mfx組[(3.7±1.3)個]對療效的影響。就影像學改變而言,表3顯示無論應用Lfx還是Mfx,兩組患者療程末病變吸收好轉率和空洞縮小率相接近(P>0.05),顯示兩種藥物通過殺菌、滅菌機制,控制結核分枝桿菌感染、減少滲出、促進病變好轉的作用相類似。至于鞏固期末Lfx組的空洞閉合率高于Mfx組(48.8%和23.2%,P<0.05),不能完全說明Lfx的療效優于Mfx,因為空洞閉合除了與治療有關,亦與空洞形成的時間、空洞的特點、空洞內菌量負荷等有關。不良反應發生率是影響MDR-TB患者治療療效與轉歸的重要因素,從表4可以看出,兩組總不良反應發生率和各種不良反應發生率均接近(P>0.05),以藥物性肝損傷的發生率最高,但兩組亦接近。提示無論應用Lfx還是Mfx,對MDR-TB患者的不良反應發生率沒有明顯的影響。
二、含Lfx或含Mfx化療方案的治療轉歸分析
2008年,WHO明確了MDR-TB患者治療轉歸的評估指標與標準[8],本研究按照此標準評估。如表5所示,兩組患者的治愈率分別為45.4%和45.2%(P>0.05)、治療成功率分別為61.1%和59.7%(P>0.05),均高于全球21個MDR-TB高負擔國家同期的治療成功率水平[18]。顯示含Lfx或Mfx的化療方案在治療MDR-TB中的作用接近,與Lee等[5]和Jiang等[19]的報道相一致。就不良反應治療轉歸而言,無論應用Lfx還是Mfx,兩組患者的失敗率接近(P>0.05)。Mfx組的死亡率高于Lfx組,患者主要死于大咯血和呼吸衰竭,但無一例死于本方案的不良反應。在治療中,MDR-TB患者的死亡主要與其肺內病變特點(如空洞、支氣管擴張等)、嚴重合并癥和并發癥有關,很難說明Lfx或Mfx作用的優劣或差異。此外,Lfx組丟失率高達24.1%,明顯高于Mfx組(P<0.05),可能與這些患者既往曾應用Lfx,對再次或繼續應用的依從性差有關。Toczek等[20]也發現MDR-TB患者治療中的依從性與丟失率可能相關。
三、對治療成功率的相關影響因素分析
鑒于本研究顯示含Lfx或Mfx的化療方案治療MDR-TB患者的療效接近,但表1顯示含Lfx組和含Mfx組患者在耐藥數量、癥狀體征評分、既往Am使用率和此次E使用率差異均有統計學意義(P<0.05),難以充分說明Lfx和Mfx的作用接近。為此,本研究采用logistic回歸的分析方法,選擇上述兩組間差異有統計學意義的指標對治療成功率進行相關分析,結果顯示僅癥狀體征評分≤6分和既往未應用Am有利于治療的成功。提示早期診斷、規律合理用藥、避免肺臟反復破壞是提高MDR-TB治愈率的重要保證。
綜上所述,Mfx與Lfx的療效和治療轉歸基本接近。為此,應該根據MDR-TB患者的耐藥情況、臨床特征、經濟狀況等合理選擇用藥。
[1] World Health Organization. Global tuberculosis report 2015. Geneva: World Health Organization,2015:67.
[2] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Geneva: World Health Organization,2011:16.
[3] International Union Against Tuberculosis and Lung Disease. Guidelines for clinical and operational management of drug-resistant tuberculosis. Paris: International Union Against Tuberculosis and Lung Disease, 2013:71-98.
[4] 中國防癆協會. 耐藥結核病化學治療指南(2015).中國防癆雜志,2015,37(5):421-469.
[5] Lee J, Lee CH, Kim DK, et al. Retrospective comparison of levofloxacin and moxifloxacin on multidrug-resistant tuberculosis treatment outcomes. Korean J Intern Med, 2011, 26(2): 153-159.
[6] Hu Y, Coates AR, Mitchison DA. Sterilizing activities of fluoroquinolones against rifampin-tolerant populations ofMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2003, 47(2):653-657.
[7] 中華醫學會結核病學分會.肺結核診斷和治療指南.中華結核和呼吸雜志,2001,24(2):70-74.
[8] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Emergency update 2008. Geneva: World Health Organization,2008: 58.
[9] 中國防癆協會. 耐多藥結核病化學治療的意見(試行). 中國防癆雜志, 2003,25(1):4-9.
[10] 中華醫學會. 臨床診療指南結核病分冊.北京:人民衛生出版社,2005:86.
[11] Ji B, Truffot-Pernot C, Grosset J. In vitro and in vivo activities of sparfloxacin (AT-4140) againstMycobacteriumtuberculosis. Tubercle, 1991, 72(3):181-186.
[12] Rastogi N, Goh KS, Bryskier A, et a1.In vitro activities of levofloxacin used alone and in combination with first- and se-cond-line antituberculous drugs againstMycobacteriumtuberculosis. Antimicrob Agents Chemother, 1996, 40(7): 1610-1616.
[13] 陸宇,朱莉貞,段連山,等.左氧氟沙星的抗結核作用研究.中華結核和呼吸雜志,2000,23(1):50-54.
[14] Ahuja SD, Ashkin D, Avendano M, et al. Multidrug resistant pulmonary tuberculosis treatment regimens and patient outcomes: an individual patient data meta-analysis of 9,153 patients. PLoS Med, 2012, 9(8): e1001300.
[15] Johnson JL, Hadad DJ, Boom WH, et al. Early and extended early bactericidal activity of levofloxacin, gatifloxacin and moxifloxacin in pulmonary tuberculosis. Int J Tuberc Lung Dis, 2006, 10(6):605-612.
[16] Zheng M, Jin H, Fu L, et al. A comparative study on the activities of six combination regimens against multidrug-resistantMycobacteriumtuberculosisinfection in BALB/c mice. J Chemother, 2013, 25(2): 81-86.
[17] Koh WJ, Lee SH, Kang YA, et al. Comparison of levofloxacin versus moxifloxacin for multidrug-resistant tuberculosis. Am J Respir Crit Care Med, 2013, 188(7): 858-864.
[18] World Health Organization. Towards universal access to diagnosis and treatment of multidrug-resistant and extensively drug-resistant tuberculosis by 2015. WHO progress report 2011. Geneva: World Health Organization,2011:19.
[19] Jiang RH, Xu HB, Li L. Comparative roles of moxifloxacin and levofloxacin in the treatment of pulmonary multidrug-resistant tuberculosis: a retrospective study. Int J Antimicrob Agents, 2013, 42(1): 36-41.
[20] Toczek A, Cox H, du Cros P, et al. Strategies for reducing treatment default in drug-resistant tuberculosis: systematic review and meta-analysis. Int J Tuberc Lung Dis, 2013, 17(3):299-307.
(本文編輯:郭萌)
Analysis on efficacy of regimen containing levofloxacin or moxifloxacin in treatment of multidrug-resistant pulmonary tuberculosis
LIQi*,JIANGXiao-ying*,LIANGJian-qin,YANGKun-yun,KANXiao-hong,QIULi-hua,TANGShen-jie,CAIBao-yun,BUJian-ling,LIUYu-qin,NIUGuo-qiang,YUWei-ye,GAOFei,ZHANGLi-qun,CHUNai-hui,LILiang,GAOWei-wei.
*BeijingChestHospital,CapitalMedicalUniversity&BeijingTuberculosisandThoracicTumorResearchInstitute,ClinicalCenteronTuberculosisControl,ChineseCenterforDiseaseControlandPrevention,Beijing101149,China
s:LIQi,Email:lq703@hotmail.com;LILiang,Email:liliang69@hotmail.com
Objective To analyze efficacy, prognosis and its related factors of patients with multidrug-resis-tant pulmonary tuberculosis (MDR-TB) treated with levofloxacin (Lfx) or moxifloxacin (Mfx) as core drug, and to provide the basis for the rational choice of fluoroquinolones in the treatment of MDR-TB. Methods We analyze retrospectively 232 patients confirmed with MDR-TB from 10 special hospitals of tuberculosis in China during July 2009 to July 2010. One hundred and twenty-four cases were treated with regimen containing Mfx (Mfx group) and 108 cases were treated with regimen containing Lfx (Lfx group). The data of bacteriology and radiology were collected before treatment, medium-term treatment and at the end of treatment. The efficacy and prognosis were assessed at the end of treatment. Data were analyzed using SPSS 17.0 software. Measurement data showed a normal distribution or non normal distribution were used byttest or rank sum test, respectively. Enumeration data were used by Chi-square test and Fisher exact probability test was used when the frequency theory was less than 1. The efficacy and the related factors of prognosis were tested using logistic regression.P<0.05 was considered significant difference statistically. Results (1) The rates of sputum smear and culture negative conversion were 79.0% (79/100) and 73.6% (67/91) in the Mfx group, and 88.4% (61/69) and 81.5% (53/65) in the Lfx group at the end of sixth month, respectively (χ2=2.541,2.404,P>0.05). However, the rates of sputum culture negative conversion (92.2%,47/51) in the Lfx group was higher than that (76.9%,50/65) in the Mfx group (χ2=3.794,P<0.05) at the end of 24th month. (2) The rate of cavity closure (48.8%,20/41) in the Lfx group was higher than that (23.2%,13/56) in the Mfx group at the end of 24th month (χ2=5.801,P<0.05). But the rates of focus absorption improvement were not different between groups (χ2=0.561,P>0.05). (3) Incidence of adverse reactions were similar in two groups (Lfx group: 25.0% (27/108); Mfx group: 26.6% (33/124);χ2=0.012,P>0.05). The incidence of drug-induced liver injury in the two groups was the highest, reaching 16.7% (18/108) and 10.5% (13/124), respectively. (4) The rate of treatment success was also similar in two groups with 59.7% (74/124) and 61.1% (66/108), respectively (χ2=0.050,P>0.05). The mortality in Mfx group (6.5%,8/124) was higher than that (0.9%,1/108) in Lfx group (Fisher exact test,P<0.05), but the default in the Mfx group (14.5%,18/124) was less than that (24.1%,26/108) in the Lfx group (χ2=3.341,P<0.05). (5) Analysis using logistic regression showed that symptom and sign score less than 6 in patients and no use with amikacin in the past were the independent factors (β=-0.670,-0.679;Waldχ2=4.696,3.866;OR=0.512,0.507;95%CI=0.279-0.938,0.258-0.998;allPvalues were less than 0.05). Conclusion The efficacy and the rate of treatment success are similar in two groups. The treatment success is associated with symptom and core drug used or not in MDR-TB patients.
Tuberculosis/treatment; Antitubercular agents; Drug therapy
10.3969/j.issn.1000-6621.2016.06.004
“十一五”國家科技重大專項(2008ZX10003014)
101149首都醫科大學附屬北京胸科醫院 北京市結核病胸部腫瘤研究所 中國疾病預防控制中心結核病防治臨床中心(李琦、姜曉穎、蔡寶云、卜建玲、張立群、初乃惠、李亮、高微微);解放軍第三○九醫院 全軍結核病研究所結核二科(梁建琴);湖南省胸科醫院結核耐藥科(楊坤云);安徽省胸科醫院科教科(闞曉宏);山東省胸科醫院內科五病房(邱麗華);上海市肺科醫院結核五病區(唐神結,現在首都醫科大學附屬北京胸科醫院結核病多學科診療中心 北京市結核病胸部腫瘤研究所);黑龍江省傳染病防治院(劉玉琴);陜西省結核病防治院(牛國強);深圳市第三人民醫院(余衛業);內蒙古自治區第四醫院結核科(高飛)
李琦,Email:lq703@hotmail.com;李亮,Email:liliang69@hotmail.com
2016-03-09)
注:李琦與姜曉穎對本文具有同等貢獻,為并列第一作者

