茶樹根際促生菌的篩選與促生特性的研究
韓麗珍,鄧兆輝,朱春艷,梁彩嬌,韋德萍
(貴州大學 生命科學學院,貴州 貴陽 550025)
?
茶樹根際促生菌的篩選與促生特性的研究
韓麗珍*,鄧兆輝,朱春艷,梁彩嬌,韋德萍
(貴州大學 生命科學學院,貴州 貴陽 550025)
摘要:從貴州地區的茶樹根際土壤中分離篩選出6株根際促生菌,經16S rRNA基因分子鑒定,它們分屬于假單胞菌屬(Pseudomonas sp.)、芽孢桿菌屬(Bacillus sp.)、束村氏菌屬(Tsukamurella sp.)、伯克霍爾德氏菌屬(Burkholderia sp.)和根瘤菌屬(Rhizobium sp.)中。促生特性的研究結果顯示,溶磷解鉀性能最優的菌株為GD-3菌株,固氮效能最高的KKS-6-N1菌株,此外6個菌株具有溶磷解鉀固氮、產IAA、產NH3、產HCN能力、可分泌嗜鐵素及具有ACC脫氨酶活性等多種促生性能,可作為研制微生物肥料的優良菌株資源。
關鍵詞:茶樹;根際促生菌;促生特性
植物根際促生菌(plant growth-promoting rhizobacteria, PGPR)是指定植于植物根部系統并能促進植物生長的細菌。其促生機制主要包括:(1)細菌通過固氮酶的作用固定空氣中的氮氣,為植物提供氮素營養;(2)分泌有機酸,加速土壤中無效磷及難溶性鉀的釋放,從而增加土壤中游離P、K離子的含量,為植物提供營養;(3)分泌植物激素,如吲哚乙酸(IAA)、細胞分裂素、赤霉素等,以促進植物生長發育;(4)分泌嗜鐵素,不僅可與植物根際病原菌爭奪有限的鐵,抑制病原微生物生長繁殖而起生物防治作用;而且能與土壤中的Fe3+螯合形成復合體后被植物吸收,改善植物的鐵營養[1-2]; (5)具有ACC(1-氨基環丙烷-1-羧酸)脫氨酶活性,通過將植物乙烯的合成前體ACC分解成丁酮酸和氨來降低乙烯水平,從而增加植物抗逆能力[3-5];(6)通過競爭生態位,產生抗生素、氫氰酸(HCN)等物質,對植物病原菌具有抑制作用;(7)誘導系統抗性(ISR)等[6]。多年來,研究者在水稻、甘蔗、玉米、小麥、高粱等作物和一些牧草上分離獲得很多PGPR菌株,對其固氮、溶磷、產生植物激素和抑病機理、菌肥研制等方面進行了有益的探索[7],而在茶樹等經濟林木中的研究鮮有報道[8]。
貴州作為茶葉大省之一,迄止2011年茶種植面積為24.5萬hm2,位居全國第二位[9]。到2014年底,全省茶園面積已達44.1萬hm2,連續兩年排名全國第一[10]。近年來,貴州茶園氮磷流失及土壤酸化、土壤普遍缺磷缺鉀狀況明顯,有效磷和有效鉀的含量處于缺乏或很缺乏的均占到40%以上[11-15]。土壤中氮磷鉀含量對茶樹生長及茶葉的產量品質均有較大影響。因此,本文擬從貴州茶園根際土壤中分離、篩選出具有促生性能的菌株進行研究,研究結果不僅可豐富植物促生菌資源,且可為茶樹微生物菌肥的研制及提高茶葉品質產量奠定基礎。
1材料與方法
1.1材料
1.1.1土樣采集
3份土壤樣本來源于貴州省遵義市寬闊水自然保護區茶園(107°9′E,28°13′N),分別標為KKS-6、KKS-7及HSD6,該茶園種植茶樹約20-30年茶齡;1份土壤樣本采集自貴州大學茶園(106°32′E,26°17′N),標為GD,茶樹茶齡約10年。分別取茶樹根際土壤裝入標本袋中、置于4℃冰箱保存備用。
1.1.2培養基
解鉀菌篩選及活性測定選用亞歷山大硅酸鹽培養基[16],固氮菌篩選及活性測定用Ashby無氮培養基[17],解磷菌篩選培養基參考趙小蓉等的方法配制[18],CAS培養基按照榮良燕等的方法配制[19],DF培養基和ADF培養基參考陳倩等的方法配制[20]。
1.1.3主要試劑及儀器
化學藥品均為國產分析純,Premix rTaq購自TaKaRa,細菌DNA提取試劑盒購自Omega,16S rRNA基因擴增引物由TaKaRa合成,主要儀器為THZ-82A氣浴恒溫振蕩器(江蘇普天,中國)、GelDoc XRS+凝膠成像儀(Bio-Rad,USA)、S1000快速梯度PCR儀(Bio-Rad,USA)、759紫外分光光度計(上海菁華,中國)等。
1.2方法
1.2.1菌株的分離與篩選
準確稱取土壤10.0 g,加入帶玻璃珠并裝有90 mL無菌水的250 mL三角瓶中振蕩10 min后靜置,取上清液1 mL依次通過10倍倍比稀釋、分別獲得終濃度為10-2、10-3、10-4、10-5、10-6的土壤懸液。利用涂布法將以上各濃度的土壤懸液分別涂布于解鉀固體培養基、解磷固體培養基和Ashby無氮固體培養基上,挑出有透明圈的菌落及具不同菌落形態的菌落進行純化并保存。將純化的初篩菌株接種到相應的篩選培養基上培養后,分別測定水解圈(D)和菌落直徑(d)。
1.2.2菌株的16S rRNA基因擴增及分子鑒定
采用細菌DNA抽提試劑盒提取菌株總DNA。以細菌總DNA為模板,利用原核生物16S rRNA基因通用引物27f(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492r(5’-TACGGYTACCTTGTTACGACTT-3’)進行PCR擴增。25 μL反應體系包括DNA模板1 μL,PCR Premix rTaq 12.5 μL,上下游引物各1 μL,ddH2O 9.5 μL。擴增程序為:94℃ 5 min預變性;94℃變性45 s,55℃退火45 s,72℃延伸90 s,共30個循環;72℃延伸10 min。擴增產物經瓊脂糖凝膠電泳檢測后,送上海英駿生物工程有限公司測序。所得的序列與NCBI數據庫和EzTaxon數據庫進行BLAST分析對比,選擇同源性較高模式菌株的16S rRNA基因序列,采用MEGA6.0軟件,用鄰接法(Neighbor-Joining)構建系統發育樹、置信度經Bootstrap法1000次重復檢驗。
1.2.3菌株促生特性的研究
1.2.3.1解鉀活性的測定
將待測菌液按5%接種量接入50 mL解鉀液體培養基中、以加入等量無菌水的解鉀培養液為對照組,30℃ 100 rpm搖床振蕩培養5 d,設置3個重復。培養液的處理采用過氧化氫灰化法,用原子吸收法測定對照組及處理組中的水溶性鉀含量[21]。
1.2.3.2解磷活性的測定
將待測菌株的活化菌懸液1 mL接種入解磷液體培養基中,對照接入1mL無菌解磷培養液,置于28℃ 150 rpm搖床振蕩培養7 d;培養液經10000 rpm離心10 min,取上清液用鉬銻抗分光光度法測定水溶性磷含量[22]。
1.2.3.3固氮效能的測定
在含1%葡萄糖的Ashby無氮培養基中加入待測菌懸液(OD6001.0)1 mL,以加入1 mL無菌水的為對照,置于30℃ 150 rpm搖床振蕩培養8 d后取出測氮定糖,設置3個重復;定糖采用蒽酮光電比色法,定氮采用柰氏比色法,固氮效能的測定參考成澤艷的方法[23]。
1.2.3.4產IAA能力的測定
以Salkowski法測定產吲哚乙酸的能力。將待測菌株接種于含有100 mg/L色氧酸(過濾除菌)的LB液體培養基中, 30℃ 180 rpm搖床培養1 d。取50 μL菌懸液滴于白色陶瓷板上,加入等量 Salkowski比色液;以加入50 mg/L吲哚乙酸的比色液作為陽性對照。白色陶瓷板于室溫下避光放置30 min后觀察,顏色變紅者表明菌株可分泌IAA[24]。
1.2.3.5產NH3能力的測定
將菌株接到含10 mL蛋白胨水(10 g/L)試管中、28°C培養3 d后,每管加入0.5 mL Nessler's試劑,顏色由褐色轉為黃色則表明有NH3產生[25]。
1.2.3.6產HCN能力的測定
在NB培養基中添加4.4 g/L甘氨酸,將細菌劃線接種于該平板上,另將浸過2%碳酸鈉、0.5% 2,4,6-三硝基苯酚的Whatman 1號濾紙置于培養基上,28°C培養4 d,濾紙顏色由橘黃色轉為紅色則表明有HCN產生[25]。
1.2.3.7產嗜鐵素能力的定性測定
利用CAS法測定產嗜鐵素能力。將CAS培養基劃分成若干等分,接種待測菌株(10 μL 106CFU/mL),28°C培養2 - 3 d,如菌株周邊有黃綠色暈圈產生,即表明該菌株具產嗜鐵素能力[19,26]。
1.2.3.8ACC脫氨酶活性的定性測定
將待測菌株接入5 mL無氮液體培養基中,30℃ 200 rpm 振蕩培養1 d;吸取0.1 mL培養液接種至5 mL DF培養基振蕩培養1 d;按2%接種量轉接入5 mL ADF培養基中繼續培養2 d。能以ACC為唯一氮源生長的菌株為 ACC 脫氨酶陽性菌株[17]。
1.3數據處理
試驗數據處理采用Excel 2010 和SPSS 軟件,多重比較采用LSD法。
2結果與分析
2.1菌株的分離篩選
4份茶園根際土樣經選擇性培養基篩選后,在Ashby無氮培養基上獲得菌落形態明顯不同的2個菌株KKS-6-N1和KKS-7-N7。在解鉀培養基上獲得12個菌株(表1),水解圈直徑/菌落直徑之比值2.0的為菌株GD-3和GD-12。在解磷培養基上獲得7個菌株(表2),水解圈直徑/菌落直徑比值接近2.0的有KKS-6-P9和KKS-7-P10。將初篩獲得的6個菌株分別置于其余兩種選擇培養基上,發現菌株GD-3及KKS-7-N7還可以在解磷培養基上生長,且D/d比值為2.86和4.57;菌株GD-12、KKS-6-P9和KKS-7-P10還可在無氮培養基上生長。因而,確定GD-3、GD-12、KKS-6-N1、KKS-7-N7、KKS-6-P9和KKS-7-P10共6個菌株進行促生特性的研究。

表1 茶樹根際土壤解鉀菌的初篩特性

表2 茶樹根際土壤解磷菌的初篩特性
2.2菌株的分子鑒定
根據擴增的1.5 Kb片段長度的菌株16S rRNA基因核苷酸序列,與相近屬種模式菌株的16S rRNA基因序列構建系統發育樹(圖1),可初步鑒定KKS-6-N1為根瘤菌屬(Rhizobiumsp.),菌株KKS-7-N7及GD-3為假單胞菌屬(Pseudomonassp.),GD-12為芽孢桿菌屬(Bacillussp.),KKS-6-P9為束村氏屬(Tsukamurellasp.),KKS-7-P10為伯克霍爾德氏菌屬(Burkholderiasp.)。
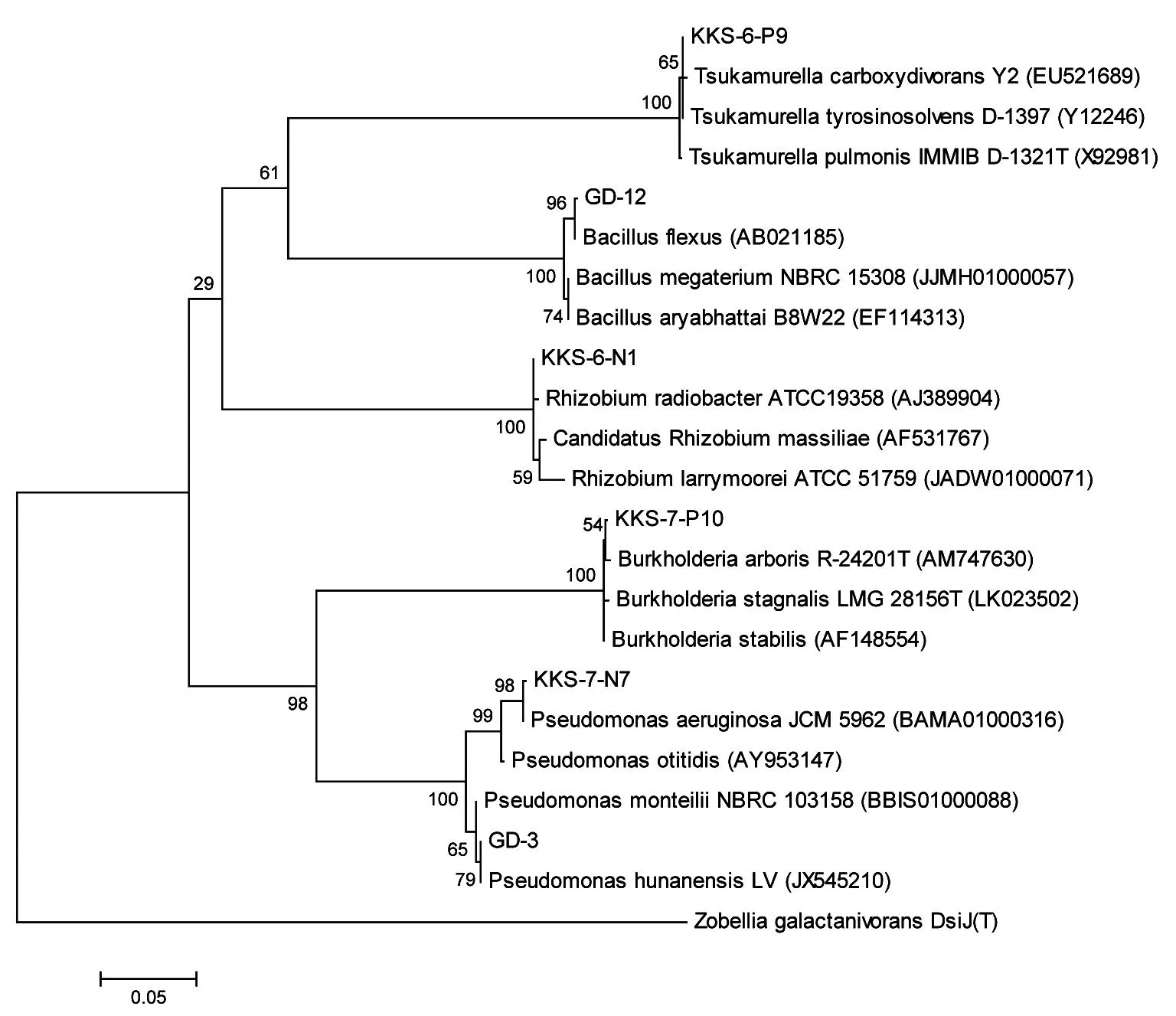
圖1 茶樹根際促生菌的16S rRNA基因系統發育樹Fig. 1 Phylogenetic tree based on the 16S rRNA sequences
2.3菌株促生特性的研究
2.3.1菌株的解鉀解磷活性及固氮效能
待測的6株菌株中,僅有GD-3和GD-12具有解鉀性能,接種GD-3與GD-12菌株的處理組中,水溶性鉀含量分別為3.970.52 mg/L、3.900.10 mg/L,而對照組僅為1.270.22 mg/L, 處理組水溶性鉀含量超過對照組的3倍以上。
除GD-12和KKS-6-N1菌株不能在解磷培養基上生長外,將其余4個菌株置于解磷液體培養基中培養,測定發酵液中的有效磷含量(表3),結果表明,處理組的水溶性磷含量均顯著高于對照組,且4個菌株之間并無顯著差異。
以往研究多采用乙炔還原法測定固氮酶活性來間接反映固氮菌的固氮作用,但其受環境因子、反應容器體積及溫育時間、采樣方法、儀器及操作誤差等因素的影響[27]。固氮效能是指固氮菌每消耗1 g糖從空氣中固定氮素的毫克數[16]。本研究對6株待測固氮菌株進行了固氮效能測定(圖2),結果顯示KKS-6-N1固氮效能最高,高達12.51±0.34毫克氮/克糖;其余4株菌固氮效能均接近或高于5毫克氮/克糖。

圖2 6株茶樹根際促生菌的固氮效能

菌株GD-3KKS-7-N7KKS-6-P9KKS-7-P10對照組有效磷含量(mg/L)99.67±13.15b97.47±4.21b79.67±5.99b84.88±12.84b17.89±9.15a
注:表中數據為平均數±標準誤。小寫拉丁字母表示顯著水平α=0.05時多重比較(LSD法)結果。
2.3.2其他促生性能的定性測定
篩選獲得的6個菌株進行了產IAA、產HCN、產NH3及分泌嗜鐵素的能力,是否具有ACC脫氨酶活性等涉及促生機理的定性研究。結果表明,僅KKS-7-N7具有產IAA能力;GD-12、KKS-6-P9和KKS-6-N1具有產HCN能力,而菌株KKS-7-N7由于培養過程中產生綠色色素而無法準確判定。6株菌都具有產NH3的能力。除了GD-12外,GD-3、KKS-6-N1、KKS-7-N7、KKS-6-P9和KKS-7-P10等5個菌株具有分泌嗜鐵素的能力。除了KKS-6-N1和KKS-7-N7菌株外,其余4個菌株均具有ACC脫氨酶活性。
3結論與討論
本文從4份貴州地區茶園根際土壤中分離篩選到6個菌株,其中除菌株KKS-6-P9屬于放線菌門(Actinobacteria)、束村氏菌科(Tsukamurellaceae)、束村氏菌屬外,其余5個菌株均為細菌菌株,它們分屬于假單胞菌屬、芽孢桿菌屬、伯克霍爾德氏菌屬和根瘤菌屬中,體現出根際促生菌的多樣性。
孫建光等[17]報道,類芽孢桿菌和芽孢桿菌為小麥、水稻、玉米、白菜及芹菜等作物根際及土壤中的固氮菌優勢種群,部分菌株具有ACC脫氨酶活性,少數菌株具有抗病潛能。除GD-3外,本文篩選到的5個菌株均具有一定的固氮能力,且大多有ACC脫氨酶活性和產NH3能力;固氮效能最高的是根瘤菌屬KKS-6-N1菌株。已有研究表明,根瘤菌也可不形成根瘤而作為非豆科植物根際有益菌,促進植物生長[28]。
近年來,國內外學者分離的解鉀菌呈現多樣性,包括芽孢桿菌屬[29]、固氮菌屬(Azotobactersp.)、微桿菌屬(Microbacteriumsp.)、中華根瘤菌屬(Sinorhizobiumsp.)、根瘤菌屬(Rhizobiumsp.)、慢生根瘤菌屬(Mesorhizobiumsp.)、屈撓桿菌屬(Flexibactersp.)和假單胞菌屬等[30]。羅華元等人[31]篩選獲得34株具有解鉀能力的菌株,發酵液的水溶性鉀含量在0.4-10.6 mg/L之間。本研究中,解鉀菌GD-3與GD-12分屬于假單胞菌屬和芽孢桿菌屬,培養液中的水溶性鉀含量約4 mg/L,居于中等水平;2個菌株還具有ACC脫氨酶活性及其他促生潛能。
目前已報道的解磷菌包括細菌、真菌和放線菌,其中細菌最多,約20個屬,真菌約5個屬,放線菌中以鏈霉菌(Streptomycesspp.)居多[32-33]。本研究篩選到一株解磷菌株KKS-6-P9,屬于放線菌門、束村氏菌屬,該菌還具有產HCN、產NH3、產嗜鐵素及具ACC脫氨酶活性,這是首次發現該屬的菌株具有促生潛能。楊艷華等人[34]從茶樹根際篩選獲得23株解無機磷細菌,集中在Burkholderiasp.,Paenibacilluspolymyxa,Enterobactersp.和Bacillussp.,最大的解磷活性高達100 μg/mL。本文篩選的6株茶樹根際細菌中,有4株具有解磷特性,它們分屬于假單胞菌屬、伯克霍爾德氏菌屬和束村氏菌屬,這也與Bruto等[35]報道的大多數根際促生菌具解磷特性相符。
綜上所述,本研究從茶樹根際篩選到5株細菌菌株及1株放線菌,溶磷解鉀性能最優的菌株為GD-3(Pseudomonassp.),固氮性能最優的菌株是KKS-6-N1(Rhizobiumsp.),具有解鉀固氮性能的菌株為GD-12(Bacillussp.),具有解磷固氮性能的菌株為KKS-6-P9(Tsukamurellasp.)、KKS-7-P10(Burkholderiasp.)和KKS-7-N7(Pseudomonassp.);且多個菌株具有產NH3、產HCN、產IAA、產嗜鐵素及ACC脫氨酶的能力。以上篩選菌株均有多種促生特性,應該具有一定的田間應用潛力,促生機理的進一步深入研究將為微生物菌肥的研制提供參考依據。
參考文獻:
[1]Ma Y, Prasad MN, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils. Biotechnol Adv. 2011,29(2):248-258.
[2]Rajkumar M, Ae N, Prasad MN, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction. Trends Biotechnol, 2010, 28(3):142-149.
[3]Belimov AA, Dodd IC, Hontzeas N, et al. Rhizosphere bacteria containing 1-aminocyclopropane-1-carboxylate deaminase increase yield of plants grown in drying soil via both local and systemic hormone signaling[J]. New Phytol, 2009, 181(2): 413-423.
[4]Farwell AJ, Vesely S, Nero V, et al. Tolerance of transgenic canola plants (Brassica napus) amended with plant growth-promoting bacteria to flooding stress at a metal-contaminated field site[J]. Environ Pollut, 2007, 147(3): 540-545.
[5]Gamelero E, Berta G, Massa N, et al. Interations between Pseudomonas putida UW4 and Gigaspora rosea BEG9 and their consequences for the growth of cucumber under salt-stress conditions[J]. J Appl Microbiol, 2010, 108(1): 236-245.
[6]鄭國華,王金昌,王小紅. 植物根際細菌的促生機制[J]. 江西科學,2012,30(4):454-458.
[7]劉方春,邢尚軍,馬海林,等. 干旱生境下根際促生細菌的篩選、鑒定及應用[J]. 核農學報,2014,28(7):1306-1313.
[8]馬海林,邢尚軍,劉方春,等. 冬棗(Ziziphus jujube Mill.)根際3株促生細菌的篩選與鑒定[J]. 應用與環境生物學報,2013,19(4):650-654.
[9]黃彩梅,王愛杰,鄒天才,等. 貴州茶種植業發展的茶園區劃研究[J]. 貴州林業科技, 2012,140(4):42-45.
[10]胡伊然,周雪,莫雪,等. 貴州茶園土壤氮、磷流失的危害及其防控[J]. 耕作與栽培, 2015,(6):44-46.
[11]陳立杰. 貴州茶園土壤現狀分析與對策[J]. 山地農業生物學報,2005,24(3):249-252.
[12]梁遠發,田永輝. 貴州茶園土壤研究主要成果與展望[J]. 貴州科學,2008,26(2):100- 103.
[13]周國蘭,趙華富,王校常,等. 貴州茶園土壤肥力狀況[J]. 貴州農業科學,2009,37(8):116-120.
[14]尹杰,牛素貞,劉進平,等. 貴州有機茶園土壤肥力的調查[J]. 西南農業學報,2013, 26(1):226-229.
[15]趙華富,周國蘭,劉曉霞,等. 貴州茶區土壤養分狀況綜合評價[J]. 中國土壤與肥料,2012,(3):30-34.
[16]任建國,王俊麗. 太子參土壤固氮菌與解鉀菌的分離、篩選及鑒定[J]. 西南師范大學學報(自然科學版),2015,40(2):59-65.
[17]孫建光,胡海燕,劉君,等. 農田環境中固氮菌的促生潛能與分布特點[J]. 中國農業科學,2012,45(8):1532-1544.
[18]趙小蓉,林啟美,李保國. 溶磷菌對4種難溶性磷酸鹽溶解能力的初步研究[J]. 微生物學報,2002,42(2):104-109.
[19]榮良燕,姚拓,趙桂琴,等. 產鐵載體PGPR菌篩選及其對病原菌的拮抗作用[J]. 植物保護,2011,37(1):59-64.
[20]陳倩,胡海燕,高淼,等. 一株具有ACC脫氨酶活性固氮菌的篩選與鑒定[J]. 植物營養與肥料學報,2011,17(6):1515-1521.
[21]盛下放,黃為一,殷永嫻. 硅酸鹽細菌的解鉀作用及對棉花的增產效果[J]. 土壤, 2001,(3): 163-165.
[22]中國土壤學會編. 土壤農業化學分析方法[M]. 北京:中國農業科技出版社,1999.
[23]成澤艷. 茶樹根際微生物區系分析及生物菌肥的初步研制[D]. 四川農業大學,2004.
[24]吳翔,甘炳成,黃忠乾,等. 一株產IAA菌株的篩選、鑒定及培養條件優化. 四川農業大學學報,2014,32(4):432-435, 461.
[25]康貽軍,程潔,梅麗娟,等. 植物根際促生菌的篩選及鑒定[J]. 微生物學報,2010,50(7): 853 -861.
[26]趙翔,謝志翔,陳紹興,等. 適合高產鐵載體細菌篩選、檢測體系的改進與探析[J]. 微生物學通報,2006,33(6):13-18.
[27]樊蕙. 乙炔還原法測定固氮作用的限制因素[J]. 微生物學通報,1995,22(4):235-238.
[28]李婷,何來,梁泉峰. 非豆科植物的根瘤菌促生機制的研究進展[J]. 中國農業科技導報, 2013, (2):97-102.
[29]饒正華,林啟美. 解鉀菌與解磷菌及固氮菌的相互作用[J]. 生態學雜志,2002,21(2):71-73.
[30]李新新,高新新,陳星,等. 一株高效解鉀菌的篩選、鑒定及發酵條件的優化[J]. 土壤學報,2014,51(2):382-388.
[31]羅華元,常壽榮,王紹坤,等. 云煙高端品牌植煙區根際土壤高效解鉀菌的篩選[J]. 西南農業學報,2011,24(5):1813-1817.
[32]Chang CH, Yang SS. Thermo-tolerant phosphate-solubilizing microbes for multi-functional biofertilizer preparations[J]. Bioresour Technol, 2009, 100(4): 1648-1658.
[33]Seulki J, Hee SM, Doyun S, et al. Survival of introduced phospahte-solubilizing bacteria (PSB) and their impact on microbial community structure during the phytoextraction of Cd-contaminated soil[J]. J Hazard Mater, 2013, 263: 441-449.
[34]楊艷華,李俊州,臧睿,等. 茶樹根際土壤解磷細菌的篩選及解磷活性分析[J]. 河南農業科學,2014,(9): 60-65.
[35]Bruto M, Prigent-Conbaret C, Muller D, et al. Analysis of genes contributing to plant- beneficial functions in plant growth-promoting rhizobacteria and related Proteobacteria[J]. Sci Rep, 2014(4): 6261.
Identification and Characterization of Plant Growth-promoting Rhizobacteria Isolated from Rhizosphere soils of Tea Trees
HANLi-zhen*,DENGZhao-hui,ZHUChun-yan,LIANGCai-jiao,WEIDe-ping
(CollegeofLifeSciences,GuizhouUniversity,Guiyang,Guizhou550025,China)
Abstract:Based on sequence conservation of 16S rRNA, six strains of plant growth-promoting rhizobacteria (PGPR), which isolated from rhizosphere soils of Guizhou tea trees, were identified as Pseudomonas sp., Bacillus sp., Tsukamurella sp., Burkholderia sp. and Rhizobium sp. GD-3 showed the most efficiency in phosphatesolubilization and potassium decomposition, and KKS-6-N1 had the most efficiency in nitrogen fixing. In addition, other growth-promoting characteristics, e.g. nitrogen fixation,IAA, NH3, HCNproduction,siderophore secretion and 1-aminocyclopropane-1-carboxylic acid (ACC) deaminase activity, were also investigated in these six strains, justifying their potentials for development ofbiological fertilizer as microbial resources in the future.
Keywords:Tea trees; Plant growth-promoting rhizobacteria; Growth-promoting characteristics
文章編號:1008-0457(2016)01-0051-06國際DOI編碼:15958/j.cnki.sdnyswxb.2016.01.011
中圖分類號:Q938.1
文獻標識碼:A
*通訊作者:韓麗珍,女,博士,教授,碩士生導師,主要研究方向:環境微生物及微生物生態學;E-mail:hanlizhen11@163.com。
基金項目:貴州省大學生創新訓練計劃項目“貴州省茶樹根際促生菌的促生機理研究”(201510657041)。
收稿日期:2016-1-30;修回日期:2015-2-2

