猴源GII.17 型諾如病毒基因組 P 結構域及其變體的原核表達、純化和抗原性鑒定
劉 波, 李 超, 陶玉芬, 李昕潼, 劉建生, 和占龍, 劉紅旗
(中國醫學科學院/北京協和醫學院醫學生物學研究所, 昆明650118)
猴源GII.17 型諾如病毒基因組 P 結構域及其變體的原核表達、純化和抗原性鑒定
劉 波, 李 超*, 陶玉芬, 李昕潼, 劉建生, 和占龍, 劉紅旗
(中國醫學科學院/北京協和醫學院醫學生物學研究所, 昆明650118)
目的 表達、純化和鑒定猴源GII.17型諾如病毒(NoV)基因組P結構域及其變體蛋白。方法 基于本實驗室獲得的猴源GII.17型NoV 基因組P結構域的核苷酸序列,按大腸桿菌密碼子使用的偏好性優化P結構域的核苷酸序列,人工合成相應的基因。以此基因為模板,通過PCR方法擴增得到P結構域的變體基因。采用無縫連接的方法將P結構域基因及其變體克隆到原核表達載體,進行蛋白誘導表達和純化。最后,通過免疫印跡法和ELISA法分析表達蛋白的抗原性。結果 測序結果表明,P結構域及其變體成功地克隆至原核表達載體。SDS-PAGE分析顯示,P結構域在原核細胞的超聲裂解上清和沉淀中都有表達,而其變體主要表達于上清。免疫印跡和ELISA結果顯示,表達純化得到的P結構域及其變體蛋白具有很好的抗原性。表達的蛋白免疫小鼠制備的相應抗體ELSIA效價可達到1∶32 000。結論 成功地表達了猴源GII.17 NoV基因組 P結構域及其變體蛋白,并且通過免疫小鼠得到了相應的抗體,為后期檢測試劑盒的研發、病毒鑒定和病毒受體結合實驗奠定了基礎。
猴; 諾如病毒基因組; P結構域; 蛋白表達; 抗原性
諾如病毒(Norovirus, NoV)是導致非細菌性急性胃腸炎的主要病原體, 是近年來導致人類由腹瀉引起的發病率和死亡率增高的主要原因[1]。該病易在醫院、療養院、學校等人員密集、半封閉的環境中引起暴發性流行[2,3]。盡管所有年齡人群對該病毒均敏感,但該病毒對兒童和免疫缺陷人群健康的威脅最為嚴重[4,5]。人群中NoV自1990年代首次確認到2014年, 世界范圍主要流行GII.4基因型。近年來, GII.17型開始出現, 并且成為亞洲主要流行基因型[6-8]。有報道[9-11]人NoV也能感染豬和犬等動物。
NoV屬于杯狀病毒科諾瓦克病毒屬,直徑為26~35 nm, 無包膜, 球形, 呈二十面體對稱,基因組為單股正鏈 RNA,全長約為 7.5 kb, 包含三個開放閱讀框(ORF)。ORF1長約5 kb,編碼非結構蛋白,經翻譯后修飾成 6個功能蛋白。ORF2 長約1.8 kb, 編碼541個左右氨基酸的衣殼蛋白(VP1)。VP1蛋白折疊成兩個區域: 殼區(S區)和突出區(P區),其中S區為VP1的內殼,P區位于VP1結構的殼外, 包含P1和 P2兩個亞區, P2亞區位于衣殼蛋白的最外層, 易發生變異。ORF3長約 0.6 kb,編碼一個微小結構蛋白(VP2),VP2蛋白的具體功能還不是很清楚,它可能參與病毒衣殼的構建,也可能有助于整個衣殼蛋白的穩定。VP1蛋白的P區是病毒首先與受體結合的區域[12],也是誘導中和抗體的主要抗原區[13]。因此,P區域不僅是研究病毒感染機制的靶點,也是疫苗研究的重點區域。
NoV的研究有兩大難點,一方面該病毒目前還不能在體外培養,另一方面還沒有人NoV感染的動物模型,這兩方面給該病毒的致病機理研究和疫苗研發帶來極大的阻力[14,15]。近期,作者課題組從猴糞便樣品中獲得了GII.17型NoV基因組,本研究基于獲得的GII.17型病毒序列,根據大腸桿菌密碼子偏好,對VP1的P結構域核苷酸序列進行了優化,通過人工方法合成了P結構域基因后,定向克隆到原核表達載體中,通過誘導表達和純化得到了P結構域及其變體蛋白。ELISA和免疫印跡法確定目的蛋白具有良好的抗原性。
1 材料與方法
1.1 實驗動物
清潔級8周齡雄性BALB/c小鼠,由全國醫學靈長類研究中心小動物實驗部(中國醫學科學院醫學生物學研究所)提供[SYXK(滇)2010-0007]。所有操作均按照醫學生物研究所動物實驗倫理委員會要求進行。
1.2 病毒、質粒和菌株
猴源(獼猴)GII.17型NoV基因組和原核表達質粒pGEX-4T1由本實驗室保存。E.coli BL21(DE3)菌株和E.coli DH5α菌株購自天根生物技術公司。
1.3 主要試劑
限制性內切酶、無縫拼接試劑均購自寶生物工程(大連)有限公司。PCR體系采用 GoTaq@G2 Green Master Mix購自美國 Promega 公司。ECL (Enhanced chemiluminescent method )底物顯色劑和BCA(二喹啉甲酸)蛋白定量分析試劑盒購自美國Thermo公司。GST(Glutathione S-transferase)Trap FF 純化柱購自德國GE公司。抗GST單克隆抗體購自美國CST公司。佐劑購自北京博奧龍免疫技術有限公司。HRP標記的抗鼠IgG抗體購自美國CST公司。
1.4 病毒基因及引物設計
基于研究組獲得的猴源GII.17NoV基因組的P結構域核苷酸序列,根據大腸桿菌密碼子表達的偏好性對P結構域核苷酸序列進行了優化,優化后的氨基酸序列沒有改變且對蛋白結構不造成影響。由北京唯尚立德生物科技有限公司技術人員進行優化并合成基因。
根據無縫拼接試劑盒的要求,設計P結構域及其變體特異性引物(美國Invitrogen公司合成)。
P-RGD: 上游引物5′-T CTGGTTCCGCGTGGATCCTCTAAAACCAAACC-3′;
下游引物(1) 5′-GCAGAAGCAGTCACCACGGCAGTCGCACTGCGCACGACGG-3′;
(2) 5′-CAGTCAGTCACGATGCGGCCGCTTAGCAGAAGCAGTCACCAC-3′。
P ΔR: 上游引物5′-TCTGGTTCCGCGTGGATCCTCTAAAACCAAACC-3′;
下游引物5′-CAGTCAGTCACGATGCGGCCGCTTACCCATTCCCGGTGC-3′
1.5 重組質粒的構建
為了便于后續的研究, 設計P結構域引物時, 加入了一段編碼RGD的核苷酸序列, 稱之為P-RGD。去掉P結構域C端富含精氨酸的部分得到P結構域變體, 稱之為PΔ R。用限制性內切酶BamH I和Not I酶切表達載體pGEX-4T1。通過無縫拼接試劑盒分別將純化的PCR目的片段與線性化的載體進行連接。連接產物轉化感受態E.coli DH5α。鑒定為陽性的克隆經測序確認。測序正確的質粒轉化E.coli BL21(DE3),挑取含目的質粒菌株進行誘導表達或凍存保種。
1.6 P結構域及其變體的誘導、表達和純化
過夜培養菌體以1∶50轉接入新鮮含抗生素的LB培養基繼續培養,待吸光值A600達到約0.5時,加入終濃度為0. 5 mmol/L的異丙基-β-D-硫代半乳糖苷(IPTG),于22℃、220 r/min過夜誘導培養。次日,收集菌體,超聲破碎,通過考馬斯亮藍染色鑒定蛋白表達形式。采用GST親和柱純化目的蛋白,然后通過超濾濃縮的方法更換緩沖液。牛凝血蛋白酶切割GST標簽,再用GST親和柱去除GST獲得不含標簽的目的蛋白,BCA蛋白定量試劑盒和考馬斯亮藍染色分別檢測蛋白濃度和純度。1.7 表達蛋白的抗原性檢測
以40 μg蛋白輔以相等體積的佐劑免疫8周齡BABL/c小鼠。免疫完成后2周通過眼球采血獲得小鼠血清。用酶聯免疫吸附方法(ELISA)做血清學效價分析,以樣品A450值與陰性對照A450值的比值(P/N)大于2判定樣品為陽性。以免疫后小鼠血清(1∶1 000)作為一抗, 辣根過氧化酶(HRP)標記的鼠抗IgG(1∶5 000)為二抗,進行免疫印跡分析蛋白的抗原性。
2 結果
2.1 P結構域及其變體原核表達載體的構建
P結構域(P-RGD)及P結構域變體(PΔ R)結構示意如圖1A所示。以合成的基因為模板, 用P-RGD和PΔR特異性引物進行PCR擴增。電泳結果表明,得到了預期大小約1 kb的目的片段(圖1B)。核苷酸測序結果表明, P-RGD基因片段大小為957 bp,PΔR為945 bp,與預期核苷酸序列一致。
2.2 P結構域及其變體的原核表達
P結構域及其變體的重組質粒表達后經SDSPAGE電泳和考馬斯亮藍染色分析,結果表明,沒有進行密碼子優化的基因,幾乎檢測不到其對應的蛋白表達(圖2A)。而根據大腸桿菌表達的密碼子偏好對其核苷酸序列進行優化后,與未進行誘導的對照相比,在相對分子質量為60 000Da的位置有明顯表達的蛋白條帶,與預期分子量相符。P-RGD以可溶性蛋白和包涵體兩種形式存在,而PΔR以可溶性蛋白為主(圖2B)。
2.3 P結構域及其變體蛋白的純化和鑒定
P結構域及其變體蛋白通過GST親和柱進行純化后,SDS-PAGE電泳和考馬斯亮藍染色分析顯示,2個蛋白在預期60 000Da的位置都有比較單一的條帶(圖3A)。進一步用抗GST單克隆抗體通過免疫印跡法進行了分析,確認純化得到的蛋白為GST融合蛋白(圖3B)。
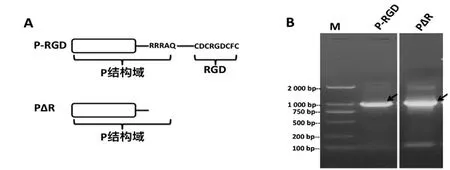
圖1 P結構域及其變體的PCR擴增
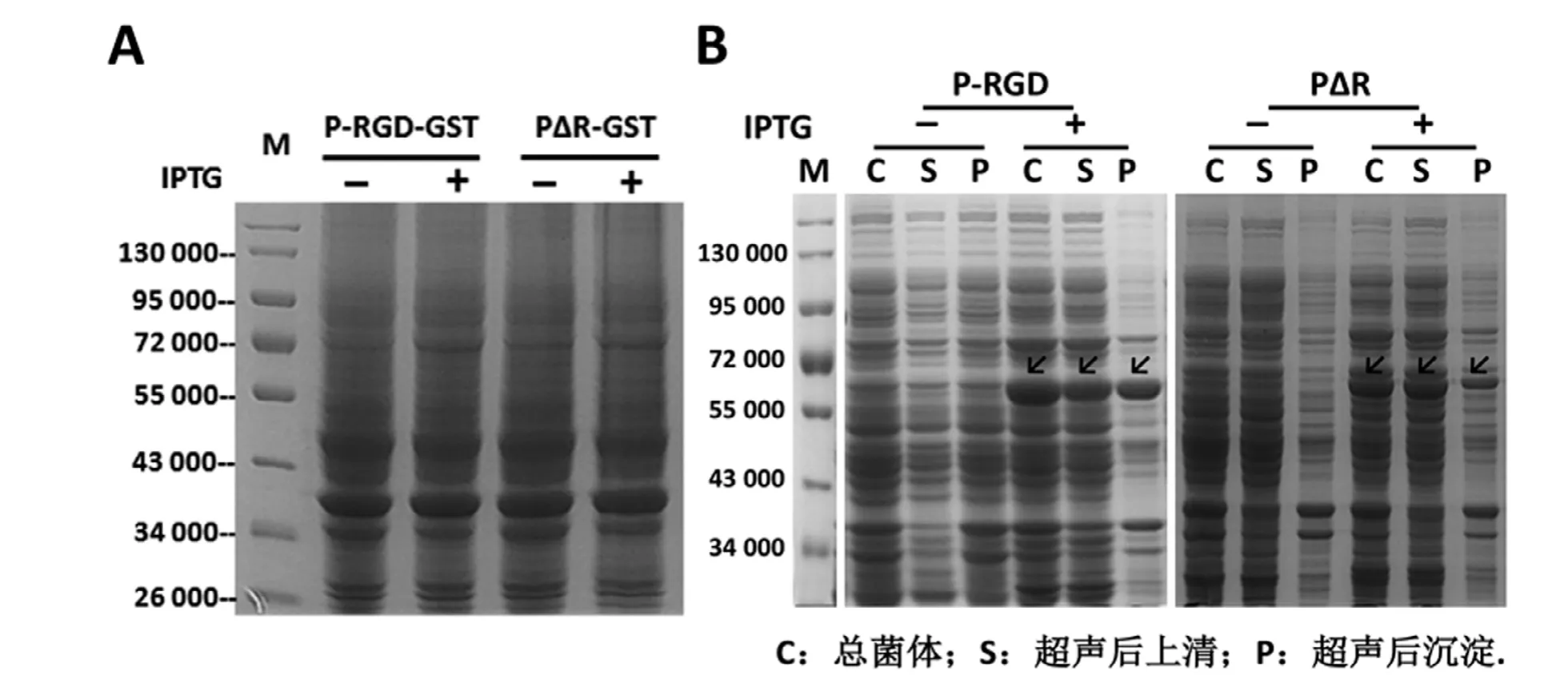
圖2 P結構域及其變體的原核表達
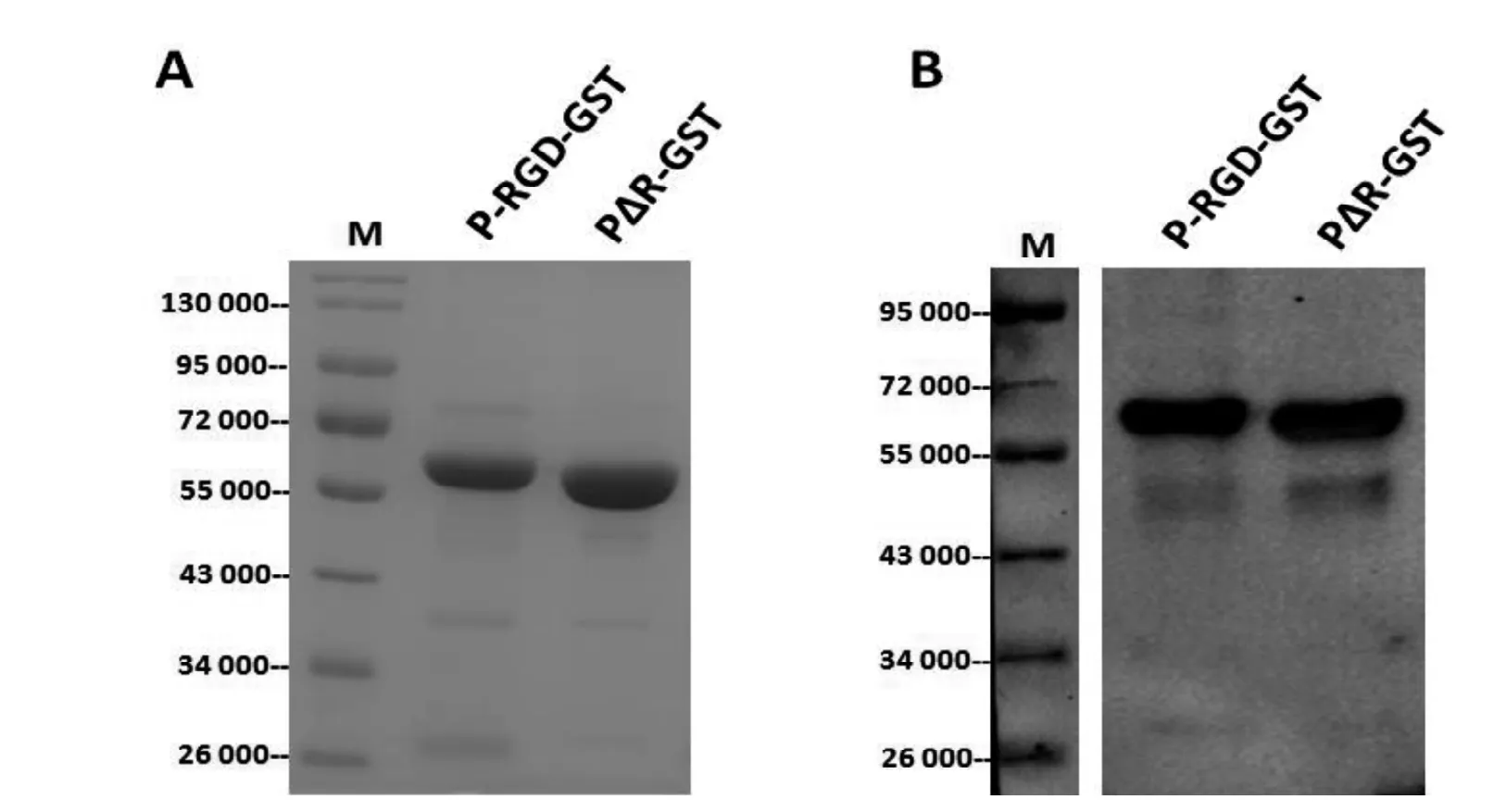
圖3 P結構域及其變體蛋白的純化和鑒定
2.4 P結構域及其變體蛋白的抗原性
純化得到的GST融合蛋白經牛凝血蛋白酶切割后,再次經GST親和柱除去GST標簽得到不含GST的目的蛋白(圖4A)。用該蛋白免疫小鼠制備相應的抗血清。經免疫印跡分析顯示, 盡管P-RGD誘導的抗體還含有抗GST的成分,但是P-RGD和PΔR與免疫后血清有特異的反應,說明純化蛋白具有抗原性(圖4B)。ELISA檢測結果表明,我們所獲得的血清效價均可達到1∶32 000(圖5)。
3 討論
盡管NoV性胃腸炎在大部分病人通常僅引起輕微癥狀,病程較短,且一般可自愈,但給生活帶來極大困擾,影響工作和軍人的戰斗力[16],尤其是對于兒童和免疫力低下或缺陷的人群,嚴重時可以導致死亡[4,5]。NoV的檢測和疫苗免疫是目前防治該病的有效措施。本研究通過原核系統成功地表達和純化了猴源GII.17型NoV的P結構域及其變體,并且證明了這兩個蛋白具有很好的抗原性。
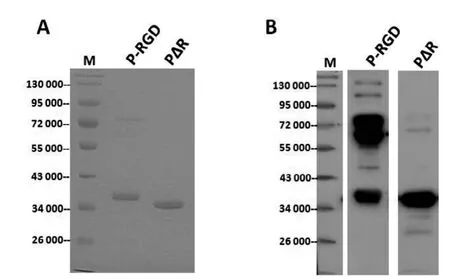
圖4 P結構域及其變體蛋白的抗原性分析
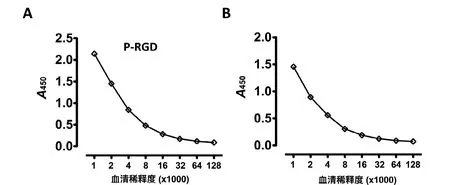
圖 5 抗P結構域及其變體血清效價測定
由于NoV目前無法在體外進行細胞培養[17],因此,對于NoV的致病機制和疫苗的研究都是通過表達病毒蛋白進行細胞外實驗研究。VP1是NoV的囊膜蛋白,在病毒與宿主的相互作用機制中起非常重要的作用,尤其是其突出區(P區)。P區在整個病毒粒子的最外面,是病毒與宿主細胞首先接觸的部位,也是誘導中和抗體的關鍵區域。因此,通過表達P區蛋白用于病毒致病機制和疫苗免疫機理研究[12,18]。本研究的病毒基因組來自于獼猴,表達的P區蛋白為研究猴NoV感染以及將來建立和評價非靈長類動物人NoV感染模型打下了堅實的基礎。P區蛋白在原核系統表達后,有時可以自行形成24聚體的納米顆粒,顯著增強其免疫原性。研究表明,在P結構域末端加一個RGD序列將有助于納米顆粒的形成[13]。另外,P結構域C端的精氨酸聚集區對于其與受體結合起重要作用[18]。因此,本研究在P結構域的C端加了一個RGD序列,并且還構建和表達了不含精氨酸聚集區的P結構域變體,為將來猴唾液酸結合實驗和其它病毒機制研究以及納米顆粒疫苗研發奠定了基礎。
原核表達系統是一個廉價和便捷的表達系統。然而,與真核表達系統相比,蛋白質的可溶性和翻譯后修飾是該系統的兩個不足之處[19]。本研究的P結構域與其變體蛋白的區別在于變體蛋白沒有RGD和精氨酸聚集序列,這2個序列可能通過影響蛋白的P結構域從而影響蛋白的可溶性。
總之,本研究獲得了具有較好抗原性的猴源GII.17型NoVP結構域及其變體蛋白, 為將來GII.17型NoV檢測方法、唾液酸結合實驗和疫苗等研究奠定了堅實的基礎。
[1] Patel MM, Widdowson MA, Glass RI, et al. Systematic literature review of role of noroviruses in sporadic gastroenteritis[J]. Emerg Infect Dis, 2008,14(8):1224-1231.
[2] Widdowson MA, Monroe SS, Glass RI. Are noroviruses emerging[J]. Emerg Infect Dis, 2005, 11(5):735-737.
[3] Goodgame R. Norovirus gastroenteritis[J]. Curr Infect Dis Rep, 2007, 9(2):102-109.
[4] Clark B, McKendrick M. A review of viral gastroenteritis[J]. Curr Opin Infect Dis, 2004,17(5):461-469.
[5] Gustavsson L, Andersson LM, Lindh M, Westin J. Excess mortality following community-onset norovirus enteritis in the elderly[J]. J Hosp Infect, 2011, 79(1):27-31.
[6] Chen H, Qian F, Xu J, et al. A novel norovirus GII.17 lineage contributed to adult gastroenteritis in Shanghai, China, during the winter of 2014-2015[J]. Emerg Microbes Infect, 2015, 4(11):e67.
[7] Gao Z, Liu B, Huo D, et al. Increased norovirus activity was associated with a novel norovirus GII.17 variant in Beijing, China during winter 2014-2015[J]. BMC Infect Dis, 2015, 15:574.
[8] de Graaf M, van Beek J, Vennema H, et al. Emergence of a novel GII.17 norovirus-End of the GII.4 era?[J]. Euro Surveill, 2015, 20(26):pi21178.
[9] Chao DY, Wei JY, Chang WF, Wang J, Wang LC. Detection of multiple genotypes of calicivirus infection in asymptomatic swine in Taiwan[J]. Zoonoses Public Health, 2012, 59(6): 434-44.
[10] Mattison K, Shukla A, Cook A, et al. Human noroviruses in swine and cattle[J]. Emerg Infect Dis, 2007, 13(8):1184-8.
[11] Caddy SL, de Rougemont A, Emmott E, et al. Evidence for human norovirus infection of dogs in the United kingdom[J]. J Clin Microbiol, 2015, 53(6):1873-1883.
[12] Tan M, Jiang X. The p domain of norovirus capsid protein forms a subviral particle that binds to histo-blood group antigen receptors[J]. J Virol, 2005, 79(22):14017-14030.
[13] Tan M, Fang P, Chachiyo T, et al. Noroviral P particle: structure, function and applications in virus-host interaction [J]. Virology, 2008, 382(1):115-123.
[14] 張賢群, 李震校. 動物諾如病毒[J]. 國外畜牧學-豬與禽. 2009, 29(6):39-42.
[15] 林健東, 楊北兵, 陳靜濃. 諾如病毒感染國內外研究進展[J]. 預防醫學論壇, 2010, 16(8):732-734.
[16] Robilotti E, Deresinski S, Pinsky BA. Norovirus[J]. Clin Microbiol Rev, 2015, 28(1):134-164.
[17] 吳瓊, 何玉林. 諾如病毒的研究進展[J]. 中國人獸共患病學報, 2014, 30(12):1245-51.
[18] Tan M, Meller J, Jiang X. C-terminal arginine cluster is essential for receptor binding of norovirus capsid protein[J]. J Virol, 2006, 80(15):7322-7331.
[19] Brondyk WH. Selecting an appropriate method for expressing a recombinant protein[J].Methods Enzymol, 2009, 463:131-147.
Expression, Purification and Antigenicity of P Domain and Its Variant of Monkey GII.17 Norovirus Genome
LIU Bo, LI Chao, TAO Yu-fen, LI Xin-tong, LIU Jian-sheng, HE Zhan-long, LIU Hong-qi
(Institute of Medical Biology, Chinese Academy of Medical Science and Peking Union Medical College, Kunming 650118, China)
ObjectiveTo express P domain and its variant of monkey GII.17 norovirus genome, purify protein and analyze antigenicity.MethodsThe gene of P domain was synthesized, following designation based on the nucleotide sequence that was obtained from monkey GII.17 norovirus genome and bias of E. coli. PCR with these specific primers was performed to amplify P domain and make its variant, followed by cloning into prokaryotic expression vector via in-Fusion ligation. Protein expression was induced by IPTG, purified through GST affinity column and analyzed by Coomassie staining, immunoblot and ELISA assay.ResultsSequencing results showed that P domain and its variant were successfully cloned into the expression vector. Analysis of SDS-PAGE revealed that P domain was observed in both the supernatant and pellet, and its variant was mostly expressed in the supernatant. The expressed and purified proteins were further confirmed by immunoblot analysis via the anti-GST antibody. The results of immunoblot analysis and ELISA assay indicated the good antigenicity of the proteins. The ELISA titers of antibodies induced by these proteins were 1∶32000.ConclusionThe P domain and its variant of monkey GII.17 norovirus genome were successfully expressed. The antibodies were obtained after immunization of mice with these two proteins. The findings of this study pave the way for the development of viral detection kit, viral identification and assay of virus-receptor binding.
Monkey; Norovirus genome; P domain; Protein expression; Antigenicity
Q95-33
A
1674-5817(2016)05-0334-06
10.3969/j.issn.1674-5817.2016.05.002
2016-06-20
云南省應用基礎研究計劃項目(2013FZ143); 醫學生物學研究所重點項目(2014IMB03ZD); 云南省創新團隊(2015HC027)
劉 波(1990-), 女, 碩士研究生, 研究方向: 感染和免疫學。E-mail: LIUBO@imbcams.com.cn
*2014級碩士研究生
劉紅旗, 博士研究生, E-mail: lhq@Imbcams.com.cn

