豬繁殖與呼吸綜合征病毒M基因的原核表達
楊秀芬,榮 俊,李國攀
(長江大學生命科學學院,湖北荊州434025;長江大學生物醫藥研究所,湖北荊州434025)
黃巧珍
(浙江諾倍威生物技術有限公司,浙江 杭州 310000)
?
豬繁殖與呼吸綜合征病毒M基因的原核表達
楊秀芬,榮 俊,李國攀
(長江大學生命科學學院,湖北荊州434025;長江大學生物醫藥研究所,湖北荊州434025)
黃巧珍
(浙江諾倍威生物技術有限公司,浙江 杭州 310000)
[摘要]根據豬繁殖與呼吸綜合征病毒(PRRSV)M基因序列設計2對引物,通過PCR擴增得到了PRRSV M基因的全長片段和N-末端截短67個氨基酸序列的MNd67基因片段,分別將這些片段插入到表達質粒pET-28a(+)的多克隆位點上構建重組表達質粒,PCR、酶切及測序鑒定表明,成功構建了2種重組表達質粒(pET28a-PRRSV M和pET28a-PRRSV MNd67)。重組質粒轉化到E.coli BL21(DE3)后利用α-乳糖誘導其表達,SDS-PAGE電泳分析表明,E.coli BL21(DE3)/ pET28a-PRRSV MNd67成功表達分子質量為14ku的重組蛋白,而E.coli BL21(DE3)/pET28a-PRRSV M未見明顯的表達蛋白。試驗結果表明已成功表達截短的PRRSV M蛋白,可為PRRSV診斷抗原和疫苗研究奠定基礎。
[關鍵詞]豬生殖與呼吸綜合征病毒;M蛋白;原核表達
豬繁殖與呼吸綜合征(Porcine reproductive and respiratory syndrome,PRRS)是由豬繁殖與呼吸綜合征病毒(PRRS virus,PRRSV)引起的一種高度接觸性傳染病,臨床表現主要以妊娠母豬流產、早產、產死胎和木乃伊胎等繁殖障礙和仔豬呼吸困難為特征[1]。我國于1996年發現該病[2],其后廣泛地流行于全國各地[3],并成為我國養豬生產中主要疫病之一。2006年以來,我國出現和流行以Nsp2編碼區缺失30個氨基酸為分子特征的高致病性PRRSV,感染豬群出現高發病率和高死亡率,給我國養豬業造成了巨大的經濟損失[4,5]。
PRRSV是動脈炎病毒科、動脈炎病毒屬、單股正鏈RNA病毒。其基因組全長約15kb,含有9個開放閱讀框(ORFs),ORF1a和ORF1b編碼蛋白聚合酶,ORF2~7 分別編碼結構蛋白GP2a、GP2b、GP3、GP4、GP5、M和N蛋白[6]。其中M蛋白分子量為18~19ku,為III型跨膜蛋白,且是非糖基化蛋白,由1個3次連續的疏水性跨膜區、13~18個氨基酸的胞外區和81~87個氨基酸的胞內區構成[7]。在PRRSV結構蛋白中,M蛋白的氨基酸序列在歐洲型和美洲型毒株之間最為保守,氨基酸同源性為78%~81%[8]。豬在感染PRRSV約10d后,可檢測到針對 M 蛋白的特異性抗體。感染細胞中的 M 蛋白與 GP5 在細胞內質網上形成異源二聚體,這種結構在病毒的組裝和釋放中起重要作用[9]。此外,M 蛋白內部可以形成以二硫鍵結合的同型二聚體,這可能與病毒的感染力有關[10]。M 蛋白免疫原性較強,可以誘導機體產生中和抗體,且是引起細胞免疫應答最強的蛋白[11]。因此,M蛋白在PRRSV血清學診斷和疫苗開發領域有很好的應用前景。本研究通過設計特異性PCR引物對M蛋白進行全基因和截短表達的研究,使截短的M蛋白在大腸桿菌中獲得表達,以為PRRSV診斷和疫苗研究奠定基礎。
1材料與方法
1.1cDNA、質粒和試劑
PRRSV cDNA、原核表達質粒pET-28a(+)由長江大學生命科學學院動物科學實驗室保存,pMD-18T 載體購自大連寶生物工程有限公司,E.coliDH5α、BL21(DE3)化學感受態細胞購自全式金生物技術有限公司,ExTaq DNA聚合酶、dNTPs、EcoRⅠ、XhoⅠ、T4 DNA連接酶購自大連寶生物工程有限公司,Trans2K Plus DNA Marker 、ProteinRuler I購自全式金生物技術有限公司,小量質粒提取試劑盒、膠回收試劑盒購自杭州愛思進生物技術有限公司,抗PRRSV陽性血清由浙江諾倍威生物技術有限公司質量管理部提供,HRP標記的羊抗豬IgG抗體購自KPL公司,其他試劑均為進口分裝或國產分析純。
1.2方法
1.2.1引物的設計與合成
根據GenBank收錄的PRRSV(AF046869)株M基因序列設計引物。引物序列見表1。其中5’-端下劃線部分是附加的酶切位點,上游引物為EcoRⅠ,下游引物為XhoⅠ。所有引物由北京三博遠志生物技術有限責任公司合成。
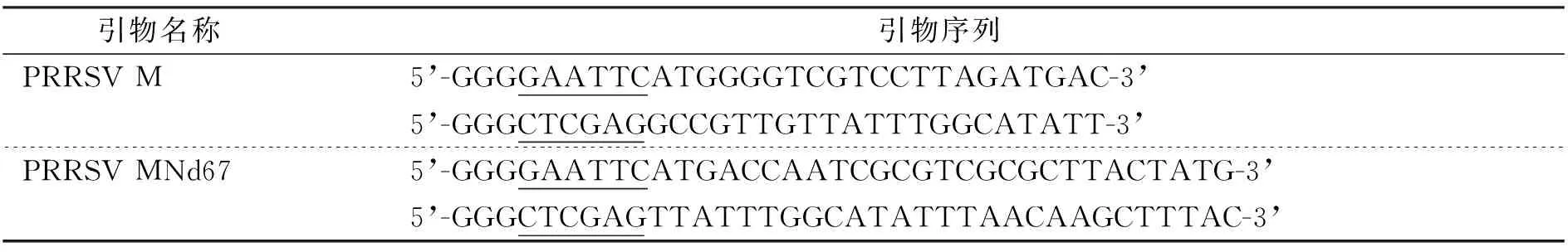
表1 PRRSV M基因引物列表
1.2.2目的基因的PCR擴增
以PRRSV cDNA為模板,使用上述引物PCR擴增M全序列和MNd67片段。反應條件均為:94℃5min;94℃45s,64℃45s,72℃45s,35個循環;72℃10min。擴增產物經1%瓊脂糖凝膠電泳觀察結果,并切膠回收并純化目的片段。
1.2.3重組表達載體的構建
純化后的目的片段連接至pMD-18T載體,轉化到DH5α化學感受態細胞,涂布于加有Amp的LB平板上培養。挑取單個菌落進行菌落PCR鑒定,選取陽性轉化菌提取質粒連同表達質粒pET-28a(+)分別用EcoRⅠ+XhoⅠ雙酶切,回收目的片段與載體片段,在T4DNA連接酶作用下16℃連接過夜,連接產物轉化至DH5α化學感受態細胞,涂布于加有Kan的平板上培養。挑取單個菌落進行菌落PCR鑒定,選取陽性轉化菌提取質粒并做雙酶切鑒定,酶切鑒定正確的重組質粒送往上海生工公司測序,構建的重組表達質粒分別命名為pET28a-PRRSV M及pET28a-PRRSV MNd67。
1.2.4目的基因的表達
將上述重組質粒轉化到BL21(DE3)化學感受態細胞中,其轉化菌分別命名為E.coliBL21(DE3)/pET28a-PRRSV M和E.coliBL21(DE3)/ pET28a-PRRSV MNd67。挑取單個菌落接種于LB培養基中培養10~12h,進行菌落PCR鑒定。將鑒定為陽性的菌株按1%轉接到LB培養基中,37℃振蕩培養,當D600nm值為0.8~1.0時,加入0.6mol/L α-乳糖至終濃度為30mmol/L,誘導5~6h, 離心收集菌體。
1.2.5表達蛋白的SDS-PAGE鑒定與Western blot分析
用0.02mol/L pH7.4 PBS重懸菌體并用超聲波破碎,分別收集破碎后的全菌液、上清液及沉淀。取破碎后的全菌液和上清液分別進行SDS-PAGE電泳,檢測重組蛋白的表達情況。對表達蛋白進行Western blot分析,以1∶100稀釋的抗PRRSV陽性血清為一抗,1∶8000稀釋的HRP標記的羊抗豬IgG抗體為二抗,用DAB溶液顯色并觀察結果。
2結果與分析
2.1目的基因片段的擴增
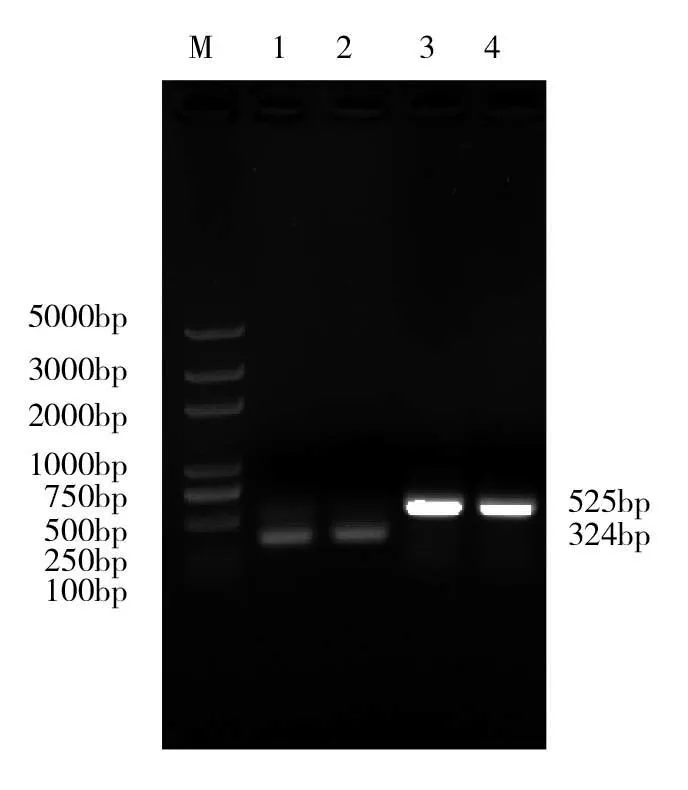
M:Trans2K Plus DNA Marker;1~2:PRRSVMNd67;3~4:PRRSV M全基因圖1 目的基因的擴增結果
PCR產物經瓊脂糖凝膠電泳分析,發現在525bp和324bp處有特異性DNA擴增條帶(圖1),與理論擴增產物長度相符。
2.2重組質粒鑒定結果
重組質粒pET28a-PRRSV M和pET28a-PRRSV MNd67分別經EcoRⅠ+XhoⅠ雙酶切鑒定,酶切產物經1%瓊脂糖凝膠電泳,分別顯示2條帶且與載體和目的片段的大小相符(圖2)。DNA測序結果與實驗設計的序列一致,顯示基因序列無堿基的插入與缺失,表明已正確構建了重組質粒pET28a-PRRSV M和pET28a-PRRSV MNd67。
2.3SDS-PAGE與Western blot分析結果
含有各重組表達載體的陽性菌經α-乳糖誘導表達,SDS-PAGE電泳分析發現,E.coliBL21(DE3)/pET28a-PRRSV M未見明顯的蛋白表達帶,E.coliBL21(DE3)/ pET28a-PRRSV MNd67在分子量大小為14ku處可見明顯表達帶,與預期大小相符,表達蛋白少量可溶(圖3)。表達產物Western blot檢測,未出現明顯雜交條帶。
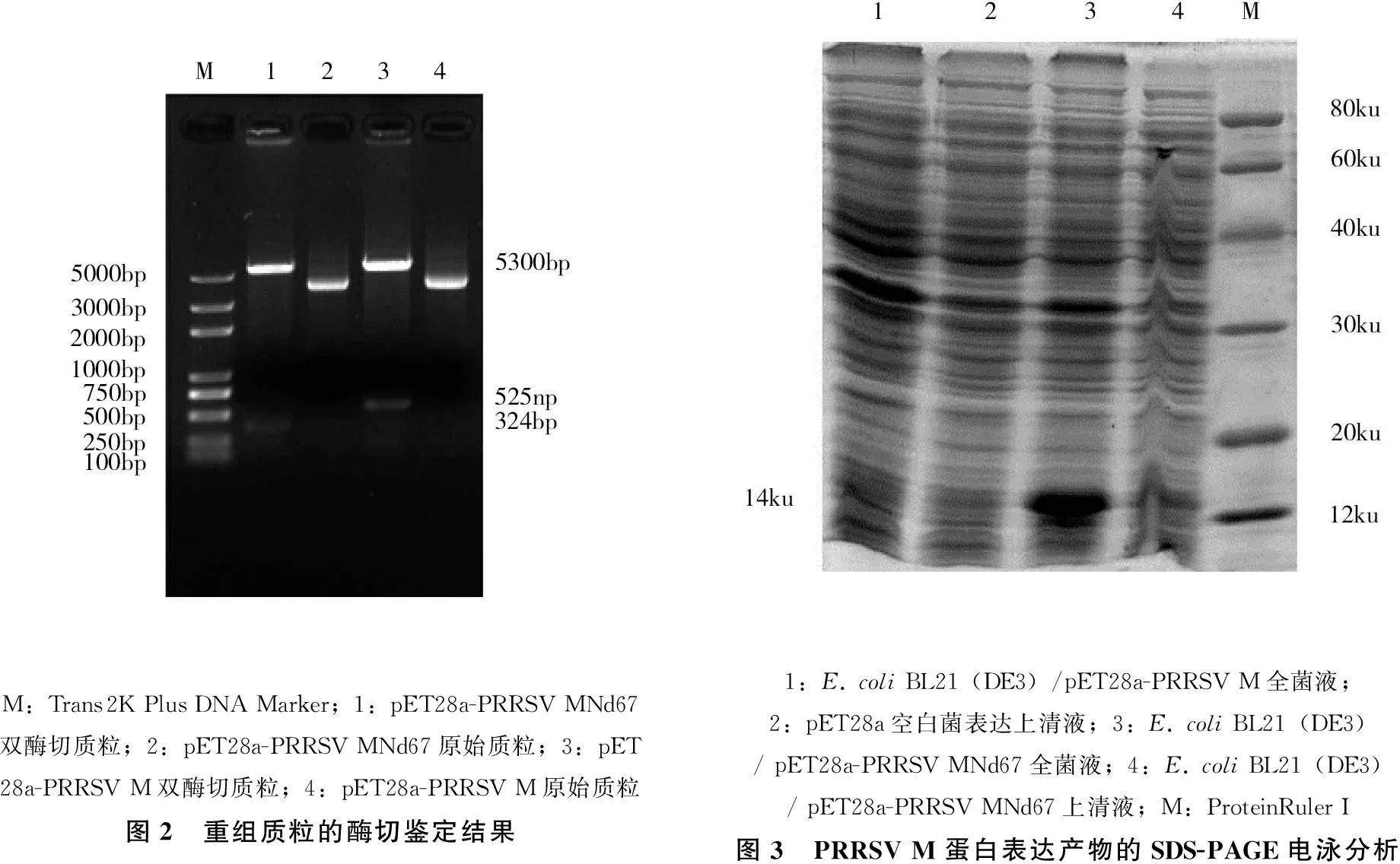
M:Trans2KPlusDNAMarker;1:pET28a-PRRSVMNd67雙酶切質粒;2:pET28a-PRRSVMNd67原始質粒;3:pET28a-PRRSVM雙酶切質粒;4:pET28a-PRRSVM原始質粒圖2 重組質粒的酶切鑒定結果1:E.coliBL21(DE3)/pET28a-PRRSVM全菌液;2:pET28a空白菌表達上清液;3:E.coliBL21(DE3)/pET28a-PRRSVMNd67全菌液;4:E.coliBL21(DE3)/pET28a-PRRSVMNd67上清液;M:ProteinRulerI圖3 PRRSVM蛋白表達產物的SDS-PAGE電泳分析
3討論
膜蛋白的表達一直是大腸桿菌表達系統應用的難點,許多膜蛋白由于疏水性氨基酸含量較高,表達出來的蛋白錨定在細胞膜上,從而對膜造成破壞導致細胞裂解,影響表達量。M蛋白為III型跨膜蛋白,是PRRSV囊膜基質蛋白,其N端含有3個疏水性比較高的跨膜區域,給其原核表達帶來不便。從國內外的報道來看,已有多種表達系統用于表達重組M蛋白,均未獲得理想結果。有報道稱對ORF6基因進行改造,去除N端疏水區域后理論上對表達產物的抗原性不會產生太大影響,并且有利于M蛋白的表達量的提高。已有的研究成果以及在線跨膜區預測軟件和抗原表位預測軟件顯示M蛋白N端的3個疏水性跨膜區位于氨基酸序列前100位,幾乎所有抗原表位都位于氨基酸序列后100位[12]。戚亭等[13]去除了M蛋白N端疏水性較強的區域,表達了長約290bp PRRSV M融合蛋白,該蛋白仍然能夠與抗PRRSV豬陽性血清發生特異性反應。鄧靜等[14]去除全部的編碼疏水性跨膜區的核苷酸序列,對M蛋白從第104個氨基酸序列到C-端第4個氨基酸序列擴增,截短后的M基因獲得了表達,且表達的M蛋白部分可溶、部分為包涵體,Western blot檢測有明顯雜交帶。
本研究同時表達PRRSVM全蛋白和N-端截短67個氨基酸的PRRSV M蛋白。結果表明,全長的M蛋白誘導后未見明顯表達,N端截短67個氨基酸的M蛋白誘導后表達了分子質量約為14ku的重組蛋白,且SDS-PAGE檢測顯示該重組M蛋白部分可溶,這與鄧靜等的[14]研究結果相符。但是截短表達的M蛋白Western blot檢測未見明顯雜交帶,可能解釋的原因一是Western blot使用的一抗血清為PRRSV 多克隆抗血清,未經純化,效價較低;二是M蛋白主要引起機體的細胞免疫,而誘導機體產生的中和抗體的量有限,Western blot不易檢出,這些都有待后續進一步研究。綜上所述,本研究成功表達了截短的PRRSV M 蛋白,為PRRSV診斷抗原和疫苗研究奠定了基礎。
[參考文獻]
[1]Rossow K D.Porcine reproductive and respiratory syndrome [J].Veterinary Pathology Online, 1998,35:1~20.
[2]郭寶清,陳章水,劉文興,等.從疑似 PRRS 流產胎兒分離PRRSV的研究[J].中國畜禽傳染病,1996,(2):1~5.
[3]Gao Z Q,Guo X,Yang H C.Genomic characterization of two Chinese isolates of porcine respiratory and reproductive syndrome virus[J].Archives of virology,2004,149:1341~1351.
[4]Zhou L,Yang H.Porcine reproductive and respiratory syndrome in China[J].Virus research, 2010,154:31~37.
[5]An T Q,Tian Z J,Xiao Y,etal. Origin of highly pathogenic porcine reproductive and respiratory syndrome virus,China[J].Emerging Infectious Diseases,2010,16:365~367.
[6]Madsen K G,Hansen C M,Madsen E S,etal.Sequence analysis of porcine reproductive and respiratory syndrome virus of the American type collected from Danish swine herds [J].Archives of virology,1998,143:1683~1700.
[7]Meulenberg J J,Petersen-Den Besten A,De Kluyver E P,etal. Characterization of proteins encoded by ORFs 2 to 7 of Lelystad virus[J].Virology,1995,206:155~163.
[8]Dea S,Gagnon C A,Mardassi H,etal.Antigenic variability among North American and European strains of porcine reproductive and respiratory syndrome virus as defined by monoclonal antibodies to the matrix protein[J].Journal of clinical microbiology,1996,34:1488~1493.
[9]Mardassi H,Massie B,Dea S.Intracellular synthesis,processing,and transport of proteins encoded by ORFs 5 to 7 of porcine reproductive and respiratory syndrome virus[J].Virology,1996, 21:98~112.
[10]Faaberg K S, Even C,Palmer G A,etal.Disulfide bonds between two envelope proteins of lactate dehydrogenase-elevating virus are essential for viral infectivity[J].Journal of virology,1995,69:613~617.
[11]Bautista E M,Suarez P,Molitor T W.T cell responses to the structural polypeptides of porcine reproductive and respiratory syndrome virus[J].Archives of virology,1999,144:117~134.
[12]袁明銘.豬繁殖與呼吸綜合征M基因的原核表達與間接ELISA方法的建立[D].成都:四川農業大學,2013.
[13]戚亭,崔尚金,張超范.截短的豬生殖與呼吸綜合征病毒 M 基因的原核表達[J].中國獸醫科學,2008,38(6):457~460.
[14]鄧靜,袁明銘,文心田,等.豬繁殖與呼吸綜合征病毒 M 基因的截短表達及間接 ELISA 檢測方法的建立[J].中國獸醫科學,2014(7):734~741.
[收稿日期]2016-03-03
[作者簡介]楊秀芬(1988-),女,碩士生,研究方向為基因工程疫苗。通信作者:榮俊,496281344@qq.com。
[中圖分類號]Q786
[文獻標識碼]A
[文章編號]1673-1409(2016)09-0046-04
[引著格式]楊秀芬,榮俊,李國攀,等.豬繁殖與呼吸綜合征病毒M基因的原核表達[J].長江大學學報(自科版) ,2016,13(9):46~49.

