基于認知圖式的化學教學設計
白青
摘 要:認知圖式是抽象的認知結構,用來解決復雜抽象的問題。教學設計是教師專業能力的核心。化合價是基本的化學用語。本文基于化學教學設計的認知圖式,呈現化合價教學設計。
關鍵詞:認知圖式;教學設計;化合價
中圖分類號:TQ050文獻標志碼:A文章編號:2095-9214(2016)06-0072-01
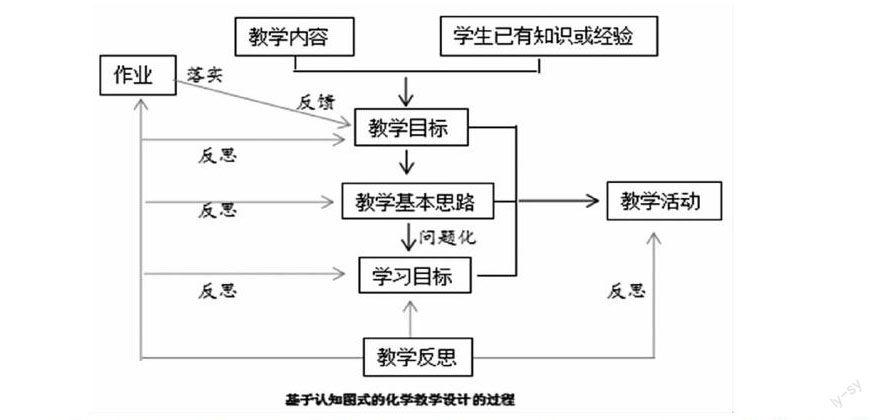
1.基于認知圖式的化學教學設計結構
“認知圖式”由皮亞杰提出,是用來應付特定情境的認知結構。梁永平教授將教師的教學認知圖式分為要素性、內容類型、具體內容3個層次[1]。化學教學設計是指化學教師根據教學目的、化學教學內容和學生實際情況,分析教學問題、設計解決方案、評價方案、修正方案的一個系統的過程。梁永平教授將要素性教學認知圖式分為以下8個環節:[2]
2.基于認知圖式的化學教學設計案例——“化合價”教學設計
(1)教學內容分析(WWHW模型[3])
1) 課題內容知識是什么?
①化合價定義、表示及規律②常見元素和原子團的化合價③化合價的應用。
2)課題知識的價值是什么?
①化合價是基本化學用語,也是氧化還原反應的基礎;②利用化合價能夠正確書寫化學式;③加深對原子結構的掌握。
3)課題知識是如何產生的?
科學家長期探索得出。
4)課題知識為什么是合理的?
由化合價推導出的化學式與實驗測定結果一致。
(2)學生知識或經驗分析。已有知識:學習了離子符號、原子結構示意圖及其穩定結構,熟悉常見物質的化學式。認識誤區:認為化學式中原子個數比沒有規律。待學習和深化:①化合價概念、表示及規律②常見元素的化合價③化合價應用。
(3)教學目標設計。通過講述化合價發展史,讓學生體會化合價的本質,并形成實事求是的科學態度。通過多媒體展示NaCl的微觀構成過程,學生討論交流,掌握化合價規律以及常見元素的化合價。
教學重點:①化合價概念、表示及規律;②常見元素的化合價③化合價應用。 教學難點:化合價概念的建立。
(4)作業設計(理解性、掌握性、評價性作業)
化合價的應用→人教版九年級上冊化學課本88-89頁習題:2(4)、3、4、5、6。
評價性作業:從C-O-Mg+N+K+1五種元素中選擇適當的元素,組成一種符合要求的物質,并用化學式填空:單質 ,非金屬氧化物 ,由三種元素組成的化合物 。
(5)教學基本思路的形業
片段一:學生熟悉的化學式→不同物質組成元素個數比不同→化合價概念→化合價概念史,了解化合價是元素的一種性質。
片段二:NaCl的微觀構成過程→由原子結構推導元素的化合價,理解元素化合價的來源,得出具體概念。
片段三:邊讀邊寫→區分化合價與離子符號的表示方法,準確掌握化合價的表示。
片段四:解讀課本案例→做游戲(扮演元素找朋友),掌握由化合價推化學式的應用;并用化合價規律檢驗所形成的化學式是否正確。
(6)學生學習主題設計
主題一:化合價概念的本質是什么?主題二:為什么該種元素是這個化合價?主題三:如何表示化合價?主題四:哪些元素間可以組成純凈物?
(7)教學活動的設計
主題一:化合價的本質是什么?
[師]列出化學式HCl、H2O、 Fe2O3,讓學生觀察其組成元素個數比。
[生]不同。
[師]每種純凈物只有一個化學式,科學上通過實驗測定,初中階段用化合價推求。
[師]17世紀,定比定律(化合物的組成有其特定定律)被廣為接受。1857年,弗蘭克蘭用“原子數”“親和力單位”表示元素的化合力—化合價的基礎思想已形成。1867年凱庫勒首次使用“化合價”一詞,開始被普遍應用。直到1991年,“化合價”開始在書本中被引用。
[生]概念的由來漫長、嚴謹。
[師]科學是需要實事求是的。化合價是元素的一種性質,是原子間在相互化合時原子的數目關系。
主題二:為什么該種元素是這個化合價?
[師]多媒體展示NaCl的微觀構成過程(Na原子結構示意圖 、Cl原子結構示意圖 )。化學反應中,原子為達到8電子穩定狀態,必得失電子。Na原子與Cl原子化合時,Na原子失去一個e—,顯+1價;Cl原子得到一個e—,顯-1價。
[生]原子結構決定化合價。
[師]把原子在化學反應中能夠提供(獲得)電子的數目,定為該元素的化合價數值;若提供電子,化合價顯正價;若獲得電子,化合價顯負價。
主題三:如何表示化合價?
[師]化合價的表示是在元素符號正上方標明電量和電性,用“+n(-n)”表示(n為具體數值)。如,Mg顯+2價,即
[師]邊讀邊寫出氧元素的化合價、離子符號并對比。
[生]化合價:“+(-)”在前,n在后,位于元素正上方。離子符號:n在前,“+(-)”在后,位于元素右上角。
[師]化合價的電量“1”不可省,而離子符號的電量“1”可省。
主題四:哪些元素間可以形成物質?
[師]思考H、Na、Cl、O元素能組成哪些化合物,找同學扮演H、Na、Cl、O原子,進行“找朋友”游戲構成化合物,其余同學分析“朋友組合”是否正確。
[生]找朋友。
[生]“朋友組合”是HCl、H2O、H2O2、NaCl。
[個別學生]還有Na2O。
(作者單位:山西師范大學)
參考文獻:
[1][2][3]梁永平.論化學教師教學認知的基本圖式[J].化學教育,2013(10):3-7.

