Vero細胞微載體放大培養技術研究
畢軍,王強,孫文
?
Vero細胞微載體放大培養技術研究
畢軍,王強,孫文
作者單位:430081 武漢科技大學醫學院(畢軍、王強);200080 上海聆海生物科技有限公司(畢軍);430207 武漢生物制品研究所有限責任公司(孫文)
目前,國內大部分疫苗企業仍采用傳統的轉瓶細胞培養工藝來生產病毒性疫苗,該方法存在細胞密度低、病毒滴度低、勞動強度大等缺點。20 世紀 70 年代,建立了微載體/生物反應器培養動物細胞的工藝[1],把懸浮培養和貼壁培養兩種培養工藝融合在一起,兼有兩者的優點,使得動物細胞工業化的大規模、高密度培養,以滿足生物技術發展的需要,而細胞微載體放大培養就是其中的關鍵技術之一[2]。
本文通過胰酶消化微載體上 Vero 細胞,實現了 5 L 到 50 L 生物反應器的放大培養,為后續更大規模的生物反應器培養 Vero 細胞,生產病毒性疫苗奠定基礎并積累經驗。
1 材料與方法
1.1材料
1.1.1細胞株Vero細胞,編號為 CCL-81,來自美國典型菌種保藏中心(ATCC)。
1.1.2微載體Cytodex-1 購于美國 GE Healthcare 公司,經 PBS 水化處理后使用。生物反應器應用中,微載體密度為 10 g/L。
1.1.3主要試劑細胞培養基 DMEM 購自美國 Gibco公司,加 8% ~ 10% 小牛血清,pH 7.0 ~ 7.2;細胞消化液為 0.25% 胰酶加 0.01% EDTA,其中胰酶購自美國 Gibco公司;EDTA 購自美國 Sigma 公司。
1.1.4主要設備C-Bio 型生物反應器為法國 Sysbiotech公司產品,工作體積 5 L 和 50 L。
1.2方法
1.2.15 L 生物反應器 Vero 細胞培養取 2 ~ 4 瓶生長良好的 10 L 轉瓶 Vero 細胞,加入細胞消化液,待細胞層松散、細胞圓縮時,加入細胞培養液,經充分搖勻分散、合并,制成細胞懸液。
以 2.0 × 105個/ml 的細胞密度接種于 5 L 生物反應器。補加細胞培養液至罐體工作體積(5 L)。設定控制溫度37 ℃、pH 7. 2、攪拌 40 ~ 50 r/min、溶氧 50% ~ 60% 進行灌流培養,灌流速度為 0 ~ 2 培養體積/d。每天取樣,檢測細胞密度和活率。
1.2.25 L 生物反應器細胞收獲微載體細胞匯合率達到80% 以上時,關閉生物反應器各控制參數,系統終止培養。待微載體細胞充分沉降后,排出培養液上清。加入含 EDTA 的 PBS(無 Ca2+、Mg2+)溶液,洗滌微載體細胞 3 次,每次清洗10 ~ 20 min。
漂洗后,加入細胞消化液消化微載體細胞。消化期間,取樣觀察,待 80% 細胞脫離微載體時,加入細胞培養液終止消化。同時打開攪拌,速度為 100 r/min。5 min 后,停止攪拌。待微載體沉降后,收集 Vero 細胞懸液。
1.2.350 L 生物反應器 Vero 細胞培養將收集的 Vero細胞懸液轉入至 50 L 生物反應器內。細胞接種密度,每1 個微載體對應有 5 個以上 Vero 細胞。補加細胞培養液至罐體工作體積(50 L)。設定控制溫度 37 ℃、pH 7.2、攪拌 40 ~ 60 r/min、溶氧 50% ~ 60% 進行灌流培養,灌流速度為 0 ~ 2 培養體積/d。每天取樣,檢測細胞密度和活率。
2 結果

表1 5 L 和 50 L 生物反應器中的細胞數量和密度
2.15 L 生物反應器 Vero 細胞培養
以 2.0 × 105個/ml 的細胞密度接種于 5 L 生物反應器中,培養 120 h 后,95% 以上微載體上細胞匯合度達到95% 以上,細胞密度可達到 9.5 × 106個/ml 左右(表1),有部分微載體之間出現細胞匯合及球連球(圖1)。此時,Vero 細胞已經貼滿微載體表面,細胞形態良好,細胞活率保持在 95% 以上,收集 Vero 細胞懸液(圖2),準備接種于 50 L 生物反應器。
細胞消化前,5 L 生物反應器內細胞總數為 4.75 × 1010個,經 PBS 漂洗和胰酶消化后,實際收集的細胞總數3.14 × 1010個(表1),Vero 細胞收獲率約為 66%,細胞活率約為 80%。
2.250 L 生物反應器 Vero 細胞培養
以 6.3 × 105個/ml的細胞密度接種 50 L 生物反應器中,培養 24 h 后,細胞密度為 4.3 × 105個/ml,較初始接種密度有明顯下降(表2)。培養 5 d 后,95% 以上微載體上細胞匯合度達到 95% 以上,細胞密度可達到 8.0 × 106個/ml 左右,有部分微載體之間出現細胞匯合及球連球(圖3)。此時,大部分微載體表面已經貼滿 Vero 細胞,細胞形態良好,細胞活率保持在 95% 左右。
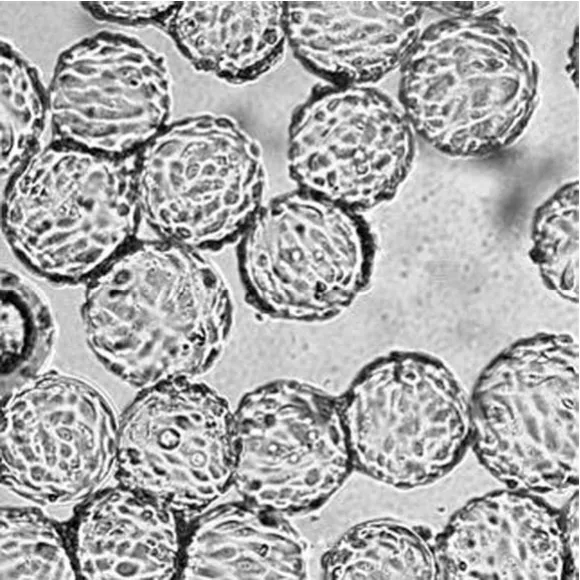
圖1 5 L 生物反應器中,Vero 細胞微載體貼壁生長 5 d時的形態
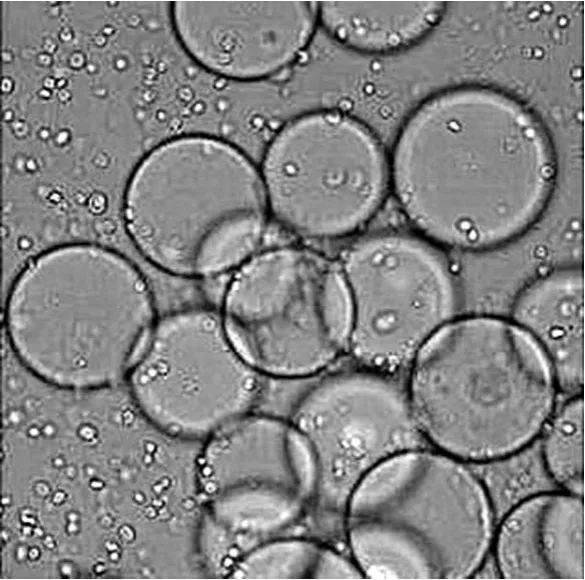
圖2 微載體上經胰酶消化后的 Vero 細胞
3 討論
細胞微載體的逐級放大工藝是工藝研究中的重點和難點。近年來我國對 Vero 細胞微載體放大技術的研究,主要以胰酶消化放大[3]和球轉球放大為主。球轉球逐級放大方式依賴于細胞和微載體的種類[4]。對于 Vero 細胞微載體培養,高活率細胞從微載體上脫落,形成游離細胞的可能性極小,細胞與微載體之間黏附緊密,球與球之間的碰撞接觸往往導致微載體間的黏連,且黏連后的微載體是很難分離的。另外還有細胞的轉移效率低、微載體利用率不高和細胞生長不同步等問題,使得球轉球的放大方式無法滿足大規模細胞制備的生產要求。

圖3 50 L 生物反應器中,Vero 細胞微載體貼壁生長 5 d時的形態
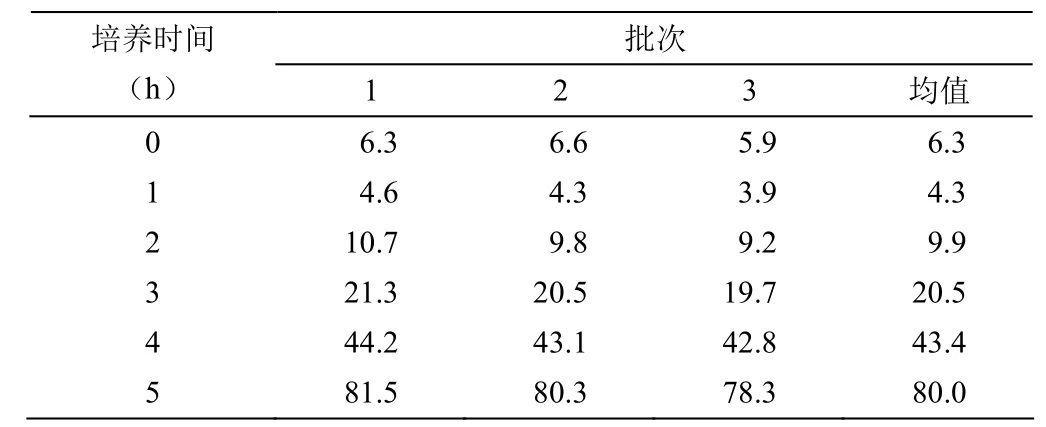
表2 50 L 生物反應器中不同批次的細胞密度(× 105個/ml)
利用胰酶將細胞從微載體上消化下來,可以獲得大量游離種子細胞。在漂洗和消化過程中,有約 1/3 的損失。經分析,其原因可能有:一是在漂洗過程中,微載體及細胞經攪拌與 PBS 充分混合,微載體上部分細胞因自身貼壁不牢固,在過程中會脫落或受損;二是在胰酶消化過程中,胰酶長時間作用在細胞表面,會造成部分細胞膜受損或破裂,從微載體上提前脫落;三是在液體的排放過程中,因攔截裝置未能有效地阻攔游離懸浮細胞,造成部分細胞流失。
在操作過程中存在如下問題:進行 PBS 換洗漂洗,因需篩網截流,液體排出速度較慢,時間較長,會損傷細胞,影響細胞活率。因細胞培養液中含有大量血清,經換洗后,仍有部分血清殘留,會中和部分胰蛋白酶,影響細胞消化效果。攔截篩網的過濾效率,會使胰酶作用細胞時間過長,造成細胞受損;另細胞懸浮中會有胰酶殘留,影響細胞活率和細胞貼壁能力。
于 50 L 反應器中培養 24 h 后,細胞密度為 4.3 × 105個/ml,較初始接種密度有明顯下降。其原因可能是在進行微載體細胞消化時,因胰酶消化作用時間過長,造成細胞膜受損、細胞活率下降、部分細胞的再貼壁能力下降,從而影響微載體上的可貼壁細胞數比初始接種時細胞數少。但已貼附在微載體上的細胞經短暫靜置和自我修復,適當延長細胞生長潛伏期后,即可重新恢復活率,進入細胞生長對數期。培養 5 d 后,細胞密度即可達到 8.0 × 106個/ml。
本研究實現了 5 L 到 50 L 生物反應器的 Vero 細胞微載體放大培養。也為后續由 50 L 生物反應器到 300 ~500 L 生物反應器的 Vero 細胞微載體放大培養奠定了基礎。采用微載體/生物反應器系統高密度培養 Vero 細胞,可以全面替代傳統的轉瓶培養工藝,利于提高疫苗質量、降低生產成本。利用微載體/生物反應器系統大規模、高密度培養技術和高滴度的病毒規模化培養工藝,建立疫苗生物反應器自動化生產技術平臺,可用于生產狂犬病疫苗、脊髓灰質炎病毒疫苗、輪狀病毒滅活疫苗、風疹疫苗、水痘疫苗、乙腦滅活疫苗等多種疫苗產品。
參考文獻
[1] Petiot E, Guedon E, Blanchard F, et al. Kinetic characterization of vero cell metabolism in a serum-free batch culture process. Biotechnol Bioeng, 2010, 107(1):143-153.
[2] Liu CC, Lian WC, Butler M, et al. High immunogenic enterovirus 71 strain and its production using serum-free microcarrier Vero cell culture. Vaccine, 2007, 25(1):19-24.
[3] Li W, Li ZP, Sun Y, et al. Preparation of purified Japanese encephalitis vaccine with Vero cells by using bioreactor. China J Biologicals, 2009, 22(6):591-592, 595. (in Chinese)李薇, 李振平, 孫燕, 等. 生物反應器制備Vero細胞乙型腦炎純化疫苗. 中國生物制品學雜志, 2009, 22(6):591-592, 595.
[4] Luo FS, Xiao Y, Yan JH, et al. Study on vero cell two-stage scale-up culture method. J Jilin Agric Uni, 2008, 30(6):801-804. (in Chinese)羅鳳山, 肖楊, 閆繼紅, 等. Vero細胞兩階段擴大培養工藝研究.吉林農業大學學報, 2008, 30(6):801-804.
·協會之窗·
DOI:10.3969/j.issn.1673-713X.2016.03.015
通信作者:畢軍,Email:bijun_cn@163.com
收稿日期:2015-12-14

