丹參多酚酸鹽對ApoE-/-小鼠主動脈壁細胞清道夫受體A和CD36 mRNA表達的影響
蔡學杰,高玉琪,李曉燕,陳英劍,梁 春,吳宗貴
?
丹參多酚酸鹽對ApoE-/-小鼠主動脈壁細胞清道夫受體A和CD36 mRNA表達的影響
蔡學杰,高玉琪*,李曉燕,陳英劍,梁春,吳宗貴
[摘要]目的觀察中藥丹參多酚酸鹽對ApoE基因敲除小鼠主動脈壁血管細胞清道夫受體A和CD36 mRNA表達的影響,探討丹參多酚酸鹽抗動脈粥樣硬化進展的作用機制。方法30只AopE基因敲除小鼠(4周齡,雄性)隨機分成4組,即模型組(腹腔注射生理鹽水,7只)、丹參多酚酸鹽60mg/kg組(7只)、丹參多酚酸鹽120mg/ kg組(8只)、丹參多酚酸鹽240mg/kg組(8只),正常對照組(C57BL/6J野生型小鼠)6只。高脂飲食喂養于24周末時處死各組動物,取主動脈根部連續切片,常規蘇木精-伊紅染色,觀察血管壁形態和脂質沉積情況,采用逆轉錄聚合酶鏈式反應對主動脈血管壁細胞清道夫受體A和CD36 mRNA表達進行定性和定量分析。結果ApoE基因敲除鼠動脈粥樣硬化斑塊內均可見明顯的SR-A和CD36mRNA表達,C57BL/6J小鼠正常血管內僅見少量表達;丹參多酚酸鹽(240mg/kg組)干預后,與模型組比較,ApoE基因敲除鼠動脈粥樣硬化斑塊內CD36 mRNA表達明顯減少,差異有統計學意義(P<0.05),而SR-A mRNA的表達未見明顯減少(P>0.05)。結論中藥丹參多酚酸鹽抗ApoE-/-鼠主動脈粥樣硬化可能與其下調CD36mRNA表達,減少巨噬細胞泡沫細胞的形成有關,而與SR-A無關。
[關鍵詞]丹參多酚酸鹽;ApoE基因敲除小鼠;清道夫受體;動脈粥樣硬化
清道夫受體(scarvenger,SR)是一類結構多樣化的糖蛋白受體家族,主要分布在巨噬細胞膜上。目前研究發現,清道夫受體與動脈粥樣硬化(atherosclerosis,AS)、細胞黏附、細胞增殖和細胞凋亡等密切相關[1],其中,清道夫受體A(SR-A)和清道夫受體B類中的CD36是吞噬氧化修飾的低密度脂蛋白,形成泡沫細胞的主要受體[2]。由于動脈粥樣硬化斑塊內存在大量激活的巨噬細胞,巨噬細胞吞噬氧化性脂蛋白轉變為泡沫細胞是AS斑塊形成的特征性改變和始動環節,因此將SR-A和CD36作為AS斑塊作用靶點的研究,目前成為一熱點。丹參多酚酸鹽(salvianolate,sal)是從傳統中藥丹參中采用現代科學工藝技術提取的水溶性有效成分,具有活血化瘀、抗氧化和抗氧自由基的作用[3],與AS的關系密切。本研究用RT-PCR方法觀察丹參多酚酸鹽對C57BL/6J ApoE基因敲除小鼠AS斑塊內SR-A和CD36 mRNA表達的影響,來深入探討丹參多酚酸鹽抗AS進展的作用機制,為丹參多酚酸鹽抗AS提供理論和實踐依據。
1 材料與方法
1.1動物與分組、主動脈AS模型的建立及給藥方法雄性4周齡C57BL/6J AopE基因敲除小鼠32只,普通飼料適應性喂養1周后給予高脂飲食(含2%膽固醇和5%的豬油,其余為普通飼料),繼續喂養4周,隨機處死2只,取主動脈根部,HE染色普通光鏡下觀察,確定已形成動脈粥樣硬化斑塊后,將其余30只ApoE基因敲除小鼠隨機分成4組,即模型組(僅腹腔注射生理鹽水,7只)、丹參多酚酸鹽60mg/kg組(7只)、丹參多酚酸鹽120mg/kg組(8只)、丹參多酚酸鹽240mg/kg組(8只),正常對照組(即C57BL/6J野生型小鼠6只)。應用上海綠谷制藥有限公司生產的中藥注射粉針劑:注射用丹參多酚酸鹽100mg,溶于0.9%的氯化鈉溶液10 ml中,按以上分組劑量給予丹參多酚酸鹽腹腔注射,每周5次,繼續喂養至24周。24周末時模型組、丹參多酚酸鹽60mg/kg組、丹參多酚酸鹽120mg/kg組、丹參多酚酸鹽240mg/kg組和正常對照組分別死亡1只、1只、2只、2只、1只。實驗動物均由北京大學實驗動物中心提供。
1.2動物處死和主動脈標本采集于實驗24周末取血后處死動物,取出主動脈,切取主動脈根部1cm;其余血管標本立即置于液氮中保存;部分標本于4%多聚甲醛磷酸鹽緩沖液固定后,常規石蠟包埋,做病理切片用。
1.3RT-PCR法檢測各組SR-A和CD36mRNA表達[4]稱取主動脈血管組織50mg,至玻璃勻漿器,加入TRIzol(Gibco BRL提取總mRNA試劑盒)1 ml,充分混勻并靜置后,吸出上清液置于EP離心管內,按試劑盒說明書提取總mRNA,并逆轉錄(Gibco BRL逆轉錄試劑盒)。分別取2μl cDNARNA為模板,各加入SR-A和CD36引物(終濃度均為1μmmol/L)進行PCR(總體積均為30μl)。SR-A和CD36引物序列和產物長度分別為:SR-A:上游5'-TAGGCACTT GGGATGTCTGA-3,下游5'-GTCCTCA ATTTGTATT GGT GCT -3',854 bp;CD36:上游5'-TGCTGGAGCTGTTATTGGTG-3',下游5'-AC AAACCTCCGTAAGAGTAC-3′,343 bp。PCR條件為:30℃變性10min,50℃退火30min,99℃延伸5min,共40個循環后50℃延伸5min。同時分別取2μl cDNA-RNA為模板,加入β-actin引物(終濃度均為1μmmol/L):上游5'-AACAGT CCGCCTA GAAG CAC-3',下游5'-CGT TGACAT CCG TAA AGACC -3',281 bp。PCR條件為:95℃變性5min,95℃退火10min,57℃延伸20 s,共40個循環后84℃延伸5min。擴增后行1.5%聚丙烯酰胺凝膠電泳,根據擴增產物分子量確定其是否為欲擴增的片段。利用凝膠成像系統進行拍照,用圖像分析儀以Quantity one軟件進行分析,測定電泳帶的平均吸光度值,計算SR-A、CD36分別與β-actin電泳帶的平均吸光度比值,分別表示SR-A和CD36mRNA水平。
1.4統計學處理及方法應用SPSS11.0統計軟件包進行統計學處理。實驗數據以(x±s)表示,兩組間比較用t檢驗,多組間比較采用完全隨機設計的方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1主動脈AS模型的病理改變C57BL/6J野生型小鼠飼養過程中死亡1只,喂食高脂飲食后,血管內膜光滑,未見動脈粥樣硬化斑塊形成;ApoE基因敲除鼠飼養過程中共死亡6只,高脂飼養12周后,均出現明顯的動脈粥樣硬化,粥樣斑塊內可見大量泡沫細胞及膽固醇結晶,內膜增厚,斑塊體積大。C57BL/6J野生型小鼠血管壁內,血管內膜光滑,無動脈粥樣硬化斑塊。丹參多酚酸鹽240mg/kg組干預后動脈粥樣斑塊較小,AS減輕。如圖1。

圖1 主動脈AS模型的病理改變(HE×100)
2.2丹參多酚酸鹽對各組SR-A mRNA和CD36m RNA表達的影響ApoE基因敲除小鼠AS斑塊內可見明顯的854 bp和343 bp片斷,為SR-A和CD36mRNA表達,C57BL/6J小鼠正常血管內僅見少量表達,說明AS斑塊血管能大量表達SR-A mRNA 和CD36mRNA,而正常血管壁表達SR-A mRNA和CD36mRNA量較少。丹參多酚酸鹽(60mg/kg組)和丹參多酚酸鹽(120mg/kg組),ApoE基因敲除鼠AS斑塊內CD36 mRNA表達與對照組比較,無明顯變化;丹參多酚酸鹽(240mg/kg組)處理后,ApoE基因敲除鼠AS斑塊內CD36 mRNA表達明顯減少,而丹參多酚酸鹽各組SR-A mRNA表達與對照組比較未見明顯減少,說明丹參多酚酸鹽能夠下調AS斑塊內CD36mRNA表達,而不影響SR-A mRNA的表達。見圖2、3和表1、2。

圖2 丹參多酚酸鹽對各組巨噬細胞SR-A mRNA的作用
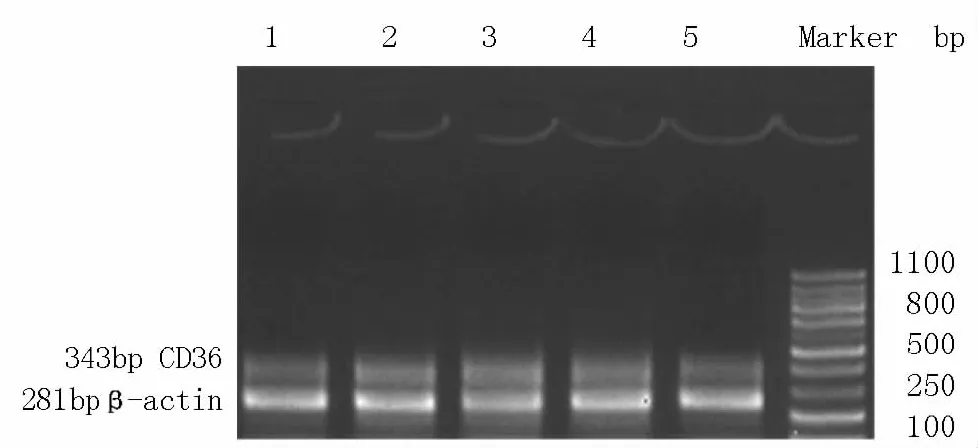
圖3 丹參多酚酸鹽對各組巨噬細胞CD36 mRNA的作用

表1 丹參多酚酸鹽對ApoE-/-小鼠動脈粥樣斑塊SR-A mRNA/β-actin mRNA比較(x±s)
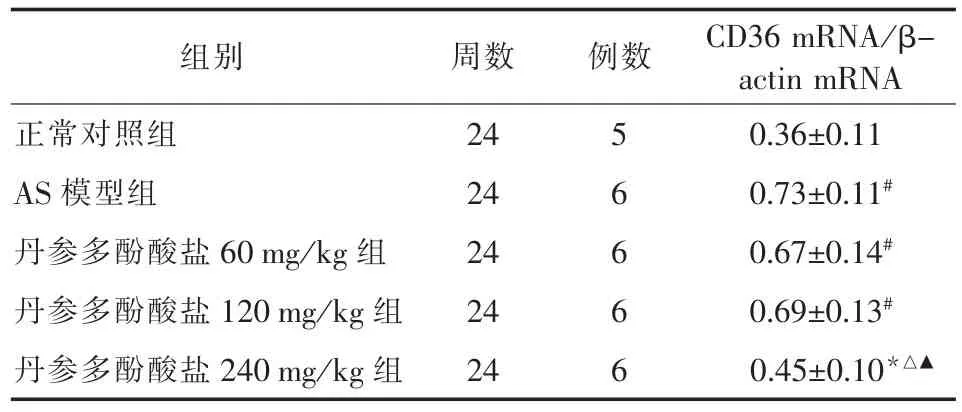
表2 丹參多酚酸鹽對ApoE-/-小鼠動脈粥樣硬化斑塊CD36 mRNA/β-actin mRNA比值比較(x±s)
3 討論
動脈粥樣硬化(atherosclerosis,AS)是一個復雜的病理過程,是多種因素共同作用的結果。通過清道夫受體吞噬變性低密度脂蛋白,形成泡沫細胞以及堆積造成血管壁上的脂質紋理,是AS形成早期的重要特征。其中SR-A和CD36是吞噬變性ox-LDL,形成泡沫細胞的主要受體。SR-A是巨噬細胞上識別ox-LDL,ac-LDL的特異性受體,Tsukamoto等發現SR-A在動脈粥樣硬化斑塊中高度表達,并且其配體ox-LDL也存在于斑塊中[5],修飾的LDL 于SR-A結合導致巨噬細胞中脂質的堆積,并且SR-A對LDL的攝取是無限制的,最終導致泡沫細胞形成,甚至斑塊破裂,而SR-A活性降低可減弱這一過程。CD36在體內的配基相當廣泛,參與多種生理過程,它是巨噬細胞表面主要的識別、內吞氧化ox-LDL的SR,參與了動脈粥樣硬化形成。Nakata等[6]通過尸檢發現的胸主動脈AS斑塊,脂質條紋,泡沫細胞都有CD36表達;免疫組化顯示CD36和SR-A在AS斑塊的不同部位表達不同,CD36陽性巨噬細胞-泡沫細胞主要分布在粥樣硬化斑塊核,而SR-A主要分布在斑塊核外圍,這種表達分布的不同,特別是富含脂質的巨噬細胞與CD36陽性巨噬細胞分布的一致提示了CD36在攝取ox-LDL,巨噬細胞轉化為泡沫細胞中發揮重要作用。實驗發現,在動脈血管損傷處有SR-A的表達,并隨著斑塊的進展SR-A表達量逐漸增多。Nakagawatoyama等于1995年報道用對比分析法分析人AS病變上CD36與SR-A的表達,結果顯示SR-A表達在動脈管腔附近,而CD36則在粥樣斑塊的巨噬細胞源性泡沫細胞附近有高表達。進一步研究發現,與SR-A不同,CD36識別的是OX-LDL中磷脂,而SR-A識別的是OX-LDL中的載脂蛋白部分[7,8]。
ApoE基因敲除鼠動物模型發現CD36及ApoE基因雙敲除小鼠,高脂餐喂養12周動脈損傷較ApoE基因敲除小鼠減少70%以上[9],繼續觀察20 及35周后,這種保護作用仍然存在[10]。進一步在此模型基礎上,采用致死量放療和干細胞移植的方法,觀察到只缺乏巨噬細胞CD36表達可以明顯減少AS的形成,主動脈樹斑塊面積減少88. 1%,由此可見巨噬細胞CD36缺失起到更主要的作用[11]。CD36的特異性配體EP80317可以減輕ApoE基因敲除小鼠AS損傷的形成[12]。上述均提示CD36在促進AS形成中的作用。
本研究發現ApoE基因敲除鼠AS斑塊內可見泡沫細胞聚集,呈圓形或橢圓形。ApoE基因敲除小鼠AS斑塊內可見明顯的854 bp和343 bp片斷,為SR-A和CD36 mRNA表達,C57BL/6J小鼠正常血管內僅見少量表達,說明AS斑塊血管能大量表達SR-A mRNA和CD36 mRNA,而正常血管壁表達SR-A mRNA和CD36 mRNA量較少。丹參多酚酸鹽(240mg/kg組)處理后,ApoE基因敲除鼠AS斑塊內CD36 mRNA表達明顯減少,而SR-A mRNA表達未見明顯減少,說明丹參多酚酸鹽能夠下調AS斑塊內CD36 mRNA表達,而不影響SR-A mRNA的表達,提示丹參多酚酸鹽可能主要通過下調AS斑塊內巨噬細胞吞噬ox-LDL的主要受體CD36 mRNA的表達,來減少核心部分的脂質堆積,尤其是膽固醇的沉積,減少泡沫細胞形成,而斑塊破裂與其所含的膽固醇量有關,從而起到穩定斑塊的作用,阻止動脈粥樣硬化的進一步發展,此可能是丹參多酚酸鹽在分子水平抗AS的作用機制之一。
丹參多酚酸鹽下調CD36表達的調控機制如何,目前尚不清楚,有報道ox-LDL被CD36識別,內吞入巨噬細胞后,部分酯鏈被切割產生9-HODE (hydroxyoctadecadienoic acid 9),13 -HODE(hy -droxyoc-tadecadienoic acid 13)等產物,它們作為過氧化物酶體增殖物激活受體(PPARγ)的配基激活PPARγ,進而使CD36的轉錄合成增加,增加的CD36則識別攝入更多ox-LDL,這就是CD36對ox-LDL攝取的正反饋機制假說[13]。體外實驗發現ox-LDL的主要成分CHOOE、LDL過氧化的主要產物HNE,分別通過PPARα和Nrf2上調CD36的轉錄與表達[14]。筆者推測丹參多酚酸鹽可能影響上述調控過程中的PPARγ和Nrf2,還需進一步研究證實。
參考文獻
[1]Freeman M,Ekkel Y,Rohrer L,et al. Expression of type I and type II bovine scavenger receptors in Chinese hamster ovary cells:lipid droplet accumulation and nonreciprocal cross competition by acetylated and oxidized low density lipoprotein[J]. Proc Natl Acad Sci USA,1991,88(11):4931-4935.
[2]Stachowska E,Baskiewicz M,Marchlewicz M,et al. Conjugated linoleic acids regulate concentration triglycerides and cholesterol of macrophages/foam cells by modulating of CD36 expression [J]. Acta Biochim Pol,2010,57(3):379-849.
[3]杜冠華,張均田.基礎醫學與臨床.丹參水溶性有效成分:丹酚酸研究進展[J]. 2000,20(5):394-398.
[4]Antonov AS,Kolodgie FD,Munn DH,et al. Regulation of macrophage foam cell formation by Vβ3 integrin[J]. Am J Pathol,2004,165(1):247-258.
[5]Tsukamoto K,Kinoshita M,Kojima K,et al. Synergically increased expression of CD36,CLA-1 and CD68,but not of SR-A and LOX-1,with the progression to foam cells from macrophages[J]. J Atheroscler Thromb,2002,9(1):57-64.
[6]Nakata A,Nakagawa Y,Nishida M,et al.CD36,a novel receptor for oxidized low-density lipoproteins,is highly expressed on lipid-laden macrophages in human atherosclerotic aorta[J]. Arterioscler Thromb Vasc Biol,1999,19(5):1333-1339.
[7]Nicholson A,Prieda S,Silverstein R. Oxidized LDL binds to CD36 on human monocyte-derived macrophages and transfectedcell lines. Evidence implicating the lipid moiety of the lipoprotein as the binding site[J]. Arterioscler Thromb,1995,15 (2):269-275.
[8]Boullier A,Gillotte K,Horkko S,et al. The binding of oxidized low density lipoprotein to mouse CD36 is mediated in part by oxidized phospholipids that are associated with both the lipid and protein moieties of the lipoprotein[J]. J Biol Chem,2000,275(13):9163-9169.
[9]Kunjathoor VV,Febbraio M,Podrez EA,et al. Scavenger receptors class A-I/II and CD36 are the principal receptors responsible for the uptake of modified low density lipoprotein leading to lipid loading in macrophages[J]. J Biol Chem,2002,277(51):49982-49988.
[10]Guy E,Kuchibhotla S,Silverstein R,et al. Continued inhibition of atherosclerotic lesion development in long term Western diet fed CD36 degrees / apoE degrees mice[J]. Atherosclerosis,2007,192(1):123-130.
[11]Febbraio M,Guy E,Silverstein RL. Stem cell transplantation reveals that absence of macrophage CD36 is protective against atherosclerosis[J]. Arterioscler Thromb Vasc Biol,2004,24(22):2333-2338.
[12]Marleau S,Harb D,Bujold K,et al. EP 80317,a ligand of the CD36 scavenger receptor,protects apolipoprotein E-deficient mice from developing atherosclerotic lesions[J]. Faseb J,2005,19(13):1869-1871.
[13]Jedidi I,CouturierM,Therond P,et al. Cholesteryl ester hydroperoxides increase macrophage CD36 gene expression via PPA Ralpha[J]. Biochem Biophys Res Commun,2006,351(3):733-738.
[14]Ishii T,Itoh K,Ruiz E,et al. Role of Nrf2 in the regulation of CD36 and stress protein expression in murine macrophages:activation by oxidatively modified LDL and 4-hydroxynonenal [J]. Circ Res,2004,94(5):609-616.
[2015-11-18收稿,2015-12-15修回]
[本文編輯:張鴻瑫]
藥學
The effects of salvianolate on ApoE -knockout mice's aortic wall cell SR -A and CD36 mRNA expression
CAI Xue-jie①,GAO Yü-qi,LI Xiao-yan,et al.①Department of Cardiology,Chinese PLA No. 456 Hospical,Jinan,Shandong 250031,China
[Abstract]Objective To observe the effects of salvianolate on Apo E-knockout mice's aortic wall cell SR-A and CD36 mRNA expression,and to explore the mechanism of salvianolate's anti-atherosclerotic progress. Methods The 30 AopE knockout mice(4 weeks old,male)were randomly divided into 4 groups,namely,the model group(normal saline,7mice),salvianolate 60mg/kg group(7 mice),salvianolate 120mg/kg group(8 mice),salvianolate 240mg/kg group(8 mice),normal control group(C57BL/6J wild-type mice,6). The each group of mice were killed after 24 weeks' high-fat diet. The aortic root serial sections were taken for routine hematoxy iineosin staining and observing vessel wall morphology and lipid deposition;reverse transcription polymerase chain reaction was used to analyse scavenger receptor A and CD36 mRNA expression on the aorta vascular wall cell in qualitative and quantitative analysis. Results The clear expression of SR-A and CD36mRNA in ApoE knockout mice atherosclerotic plaques were visible,in C57BL/6J mice with normal blood vessels only a small amount of expression was seen;After the intervention of Salvianolate(240mg/kg group),CD36 mRNA expression in ApoE knockout mice's atherosclerotic plaque was significantly reduced compared with model group. The difference was statistically significant(P<0.05),while there was no significant decrease in the SR no-A mRNA expression(P>0.05). ConclusionThe anti -atherosclerosis function of salvianolate may be associated with decreasing CD36mRNA expression and reducing macrophage foam cell formation,but not with SR-A.
[Key words]Salvianolate;ApoE-knockout mice;Scarvenger receptor;Atherosclerosis
[中圖分類號]R543.5
[文獻標志碼]A
DOI:10.14172/j.issn1671-4008.2016.05.020
[作者單位]250031山東濟南,解放軍456醫院(蔡學杰);濟南軍區總醫院心內科(高玉琪,李曉燕),實驗診斷科(陳英劍);200003上海,第二軍醫大學長征醫院心內科(梁春,吳宗貴)
[通訊作者]高玉琪,Email:why66390@126.com

