抑癌基因PTEN在食管鱗癌組織中的表達
馬瑞東,曾小飛,郭利明,郝 明(.成都醫學院第一附屬醫院,四川 成都 60500;.成都醫學院,四川 成都 60083)
抑癌基因PTEN在食管鱗癌組織中的表達
馬瑞東1,曾小飛1,郭利明1,郝 明2
(1.成都醫學院第一附屬醫院,四川 成都 610500;2.成都醫學院,四川 成都 610083)
目的 探討抑癌基因PTEN在食管鱗癌組織中的表達情況。方法 選取2015年1~12月我院胸外科食管癌手術切組織標本及癌組織2 cm以外的食管正常上皮組織各113例,采用免疫組化法檢測兩種組織中PTEN的表達情況。結果 與癌旁食管正常上皮組織相比,食管鱗癌組織中PTEN蛋白陽性表達率顯著降低 (P< 0.01);PTEN蛋白的陽性表達在不同分化程度、TNM分期以及是否有淋巴結轉移之間差異有統計學意義(P< 0.05);PTEN的陽性表達與腫瘤的惡性程度、淋巴結轉移以及TNM分期呈負相關(P< 0.05)。結論 食管鱗癌的發生發展可能與PTEN蛋白的低表達有關。
PTEN基因;免疫組織化學;食管鱗癌
目前食管癌在我國發病率較高,食管鱗狀細胞癌是其主要的病理類型,雖然手術以及放化療取得了一定的療效,但患者遠期效果較差,5年生存率低,為5%~45%[1]。食管癌的發病機制目前仍不清楚,原癌基因激活以及抑癌基因的缺失、失活以及突變可能與腫瘤的發生發展以及腫瘤轉移有關。磷酸酶及張力蛋白同源基因(PTEN)是近年來發現的一種抑癌基因,多個細胞內信號通路的轉導與它相關,惡性腫瘤的發生發展與它的異常表達關系密切[2]。本文采用免疫組化檢測食管鱗癌組織中PTEN蛋白的表達情況,從而了解PTEN蛋白表達與食管癌發生發展的關系。
1 對象與方法
1.1 研究對象 所有標本均取自2015年1~12月成都醫學院第一附屬醫院胸外科食管癌手術切組織標本。所有標本術后經病理學檢查證實為食管鱗癌,且術前未經過放化療。另外取原發灶組織以及癌組織2 cm以外的食管正常上皮組織(經病理檢查證實未見癌細胞)。共搜集標本226例,食管正常組織113例,食管鱗狀細胞癌標本113例,男85例,女28例,年齡43歲~72歲,中位年齡57歲;Ⅰ期29例、Ⅱ期57例、Ⅲ期27例;無淋巴結轉移37例,有淋巴結轉移76例;高分化22例、中分化39例、低分化52例。
1.2 研究方法 福爾馬林(10%)固定標本,經脫水和石蠟包埋后進行切片,再HE染色和免疫組化。常規脫蠟、水化、微波恢復抗原,然后進行染色(二甲基羥苯胺顯色+蘇木素復染),最后采用SP法檢測PTEN基因的表達情況。SP試劑盒以及鼠抗人PTEN抗體分別來自Zymed和Santa Cruz公司。嚴格按照說明書進行操作,分別設有陽性對照(已知食管鱗癌PTEN陽性標本)和陰性對照(PBS液代替一抗)。
1.3 結果判定 細胞核內棕黃色顆粒為PTEN蛋白陽性表達。以100個細胞/每個視野進行計數,隨機觀察5個高倍視野(×400);根據染色強度分別計0~3分:0~3分顏色分別為無著色、淡黃色、棕黃色以及棕褐色;再以陽性細胞所占比例計分,0~3分陽性細胞數分別為<5%、5%~25%、26%~50%、>50%,兩項得分相加,≥1分為陽性。
1.4 統計學方法 采用SPSS 20.0統計學軟件進行數據分析。計數資料比較采用卡方檢驗;兩變量的相關性行Sperman相關分析。P< 0.05為差異有統計學意義。
2 結果
2.1 PTEN在食管鱗癌以及癌旁正常組織的表達情況 食管鱗癌組織中PTEN陽性表達率顯著低于癌旁食管正常組織(P< 0.01),見表1。
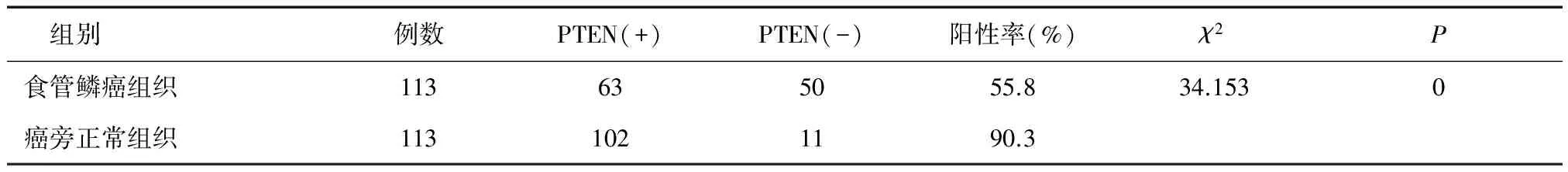
表1 PTEN在食管鱗癌與癌旁食管正常組織的表達情況
2.2 PTEN蛋白表達與食管鱗癌臨床及病理特征的關系 在本實驗中,在分化程度上,高分化組、中分化組、低分化組PTEN蛋白的陽性表達率分別為77.3%、61.5%、42.3%,高分化組PTEN陽性表達率最高(P< 0.05);與有淋巴結轉移組比較,PTEN蛋白的陽性表達率在無淋巴結轉移組中明顯升高(P< 0.05);在TNM分期方面,I期、Ⅱ期、Ⅲ期PTEN的陽性表達率分別為72.4%、57.9%、33.3%,I期PTEN的陽性表達率最高(P< 0.05),且隨著病理分期越晚,PTEN的陽性表達率越低。見表2。

表2 PTEN基因的表達與食管癌患者臨床病理特征之間的關系
注:分化程度、TNM分期為單向有序技術資料,采用CMH法進行分析;其他資料采用卡方檢驗
2.3 PTEN蛋白表達與食管鱗癌臨床及病理特征的相關性 PTEN的陽性表達與腫瘤的惡性程度、淋巴結轉移以及TNM分期呈負相關(P< 0.05);PTEN蛋白的陽性表達與其他臨床和病理特征無關系(P> 0.05),見表3。
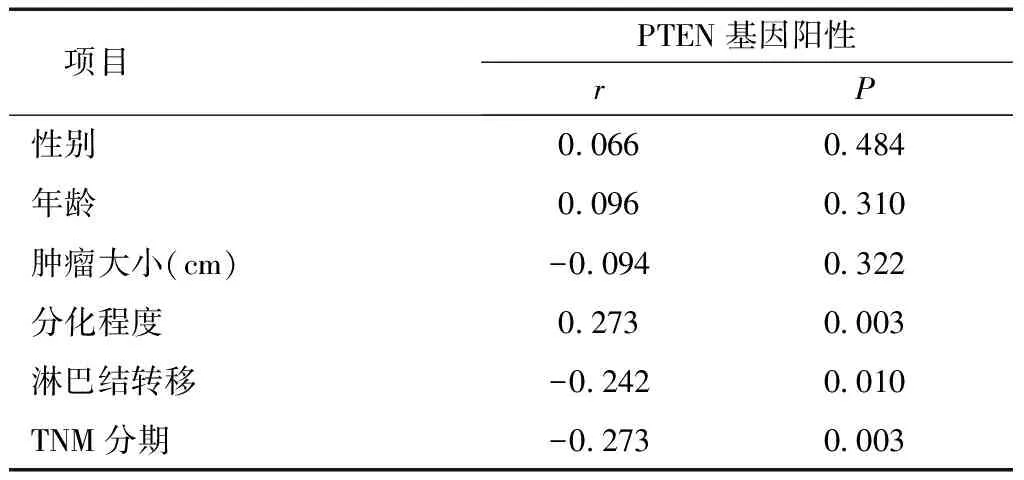
表3 PTEN蛋白表達與食管鱗癌臨床及病理特征的相關性
3 討論
1997年發現的抑癌基因PTEN不但具有抑癌作用,而且還具有磷酸酶活性[3];它能抑制腫瘤的增殖,影響腫瘤血管的生成以及加快腫瘤細胞的凋亡,最終抑制腫瘤細胞的發生和發展[4]。PTEN的抑癌機制主要通過以下途徑完成:①抑制腫瘤細胞周期和誘導腫瘤細胞凋亡:作為細胞內的第二信使的磷脂酰3,4,5-三磷酸肌醇(PIP3),它能促進細胞的生長和抑制細胞的凋亡,PTEN能使PIP3去磷酸化,從而影響PI3K/PKB/AKT信號途徑,導致細胞周期停滯[5];②抑制腫瘤細胞的浸潤和轉移:黏著斑激酶(FAK)調控著細胞凋亡,腫瘤的發生與該基因的激活有密切的聯系,抑制該基因的功能可加速細胞的凋亡[6]。PTEN可以通過去磷酸化使FAK失活,也可以通過抑制PI3K /AKT傳導通路來調控FAK,使之失活,從而使腫瘤細胞的生長、浸潤和轉移受到抑制[7]。③影響腫瘤血管的生成:腫瘤血管的生成與HIF1以及促血管生成素/血管緊張素2(Ang/Tie2)體系有著密切關系,HIF1是調控腫瘤血管生成非常重要的轉錄因子[8]。PTEN可以通過調控PI3K信號通路影響HIF1 信號來調控VEGF 的表達,腫瘤血管的生成受到影響[9]。PTEN也可以通過Ang/Tie-2體系影響血管內皮細胞的周期以及干預腫瘤血管的生成[10]。
PTEN蛋白的表達異常與多種惡性腫瘤相關[11],李亞楠等[12]報道,PTEN蛋白失活在非小細胞肺癌的發生發展有著重要的作用,并且可以用來評估患者的病情嚴重程度以及預后。有資料顯示[13,14],PTEN在乳腺癌中表達率較低,并與組織學分級、淋巴結轉移以及臨床預后相關。有文獻報道[5,15],PTEN蛋白的表達在肝癌組織以及骨肉瘤組織中顯著降低。
食管鱗狀細胞癌占食管癌的大多數,鱗癌來源于上皮組織,而PTEN蛋白在上皮細胞中廣泛表達,基因的突變、缺失以及甲基化是它失活的主要原因[16]。王建正等[17]報道,與癌旁食管正常組織相比,食管鱗癌組織的PTEN表達陽性率顯著降低,與本文結果一致,說明食管鱗癌的發生與PTEN蛋白的低表達有密切關系。本文對PTEN的表達與食管鱗癌患者的臨床及病理特征的關系進一步研究,結果發現,PTEN的表達與患者的性別、年齡以及腫瘤大小無關;與腫瘤的惡性程度以及腫瘤的病理分期相關,PTEN蛋白隨著分化程度的逐漸降低以及病理分期越晚表達越低;與無淋巴結轉移者相比,有淋巴結轉移者PTEN陽性表達率明顯下降;已上說明了食管鱗癌的發展可能與PTEN 蛋白的低表達有關,與相關文獻一致[17]。在本研究中,PTEN蛋白在腫瘤是否浸及肌層之間無差異,可能原因是大多數文獻浸潤深度以是否浸及食管外膜分組,而本文是以是否浸及食管肌層分組;也可能是本研究未浸及肌層病例數較少,造成結果的差異,還需擴大病例數量進一步研究。
食管鱗癌的發生和發展與PTEN蛋白的表達密切相關,它可以用來評估食管鱗癌惡性程度、病理分期以及淋巴結轉移情況等。對PTEN 在食管癌中的作用機制進行深入研究,為綜合治療食管癌提供新方法和依據。
[1] Zhu YH,Fu L,Chen LL,et al.Downregulation of the novel tumor suppressor DIRAS1 predicts poor prognosis in esophageal squamous cell carcinoma[J].Cancer Res,2013,73(7):2298-2309.
[2] 王帥,王洲.抑癌基因PTEN與食管癌關系的研究進展[J].中華腫瘤防治雜志,2013,20(8):627-631.
[3] 黃麗艷,王娜,湯黎明,等.PTEN基因表達對EC9706細胞增殖、侵襲、凋亡能力的影響[J].鄭州大學學報(醫學版),2013,48(1):16-20.
[4] Liu H,Huang X,Liu X,et al.miR-21 promotes human nucleus pulposus cell proliferation through PTEN/AKT signaling[J].Int J Mol Sci,2014,15(3):4007-4018.
[5] 吳金柱,蔡衛華,顧春燕,等.抑癌基因FN 及PTEN 在肝細胞肝癌中的表達及臨床意義探討[J].中國普外基礎與臨床雜志,2015,22(7):822-826.
[6] Chetram MA,Don-Salu-Hewage AS,Hinton CV.ROS enhances CXCR4-mediated functions through inactivation of PTEN in prostate cancer cells[J].Biochem Biophys Res Commun,2011,410(2):195-200.
[7] 趙紅霞.PTEN與腫瘤的相關性研究進展[J].武漢大學學報(醫學版),2014,35(1):155-159.
[8] Sonveaux P,Copetti T,De Saedeleer CJ,et al.Targeting the lactate transporter MCT1 in endothelial cells inhibits lactate-induced HIF-1 activation and tumor angiogenesis[J].PLoS One,2012,7(3):e33418.
[9] 沈存思,范方田,陶麗,等.抑癌基因PTEN 與腫瘤血管生成研究進展[J].中國藥理學通報,2013,29(5):597-600.
[10] 顏曉靜,楊燁,高靜,等.基于PTEN信號通路的中藥抗腫瘤研究進展[J].中華中醫藥雜志,2015,30(9):3215-3218.
[11] 朱巧英,賈雪梅,陳玲,等.抑癌基因PTEN對人原代子宮內膜細胞凋亡及細胞周期的影響[J].南京醫科大學學報(自然科學版),2015,35(11):1533-1537.
[12] 李亞楠,王洪武.抑癌基因PTEN與非小細胞肺癌相關性研究進展[J].2014,中國肺癌雜志,2014,17(3):260-264.
[13] Elsamany S,Abdullah S.Triple-negative breast cancer:future prospects in diagnosis and management[J].Med Oncol,2014,31(2):834.
[14] 李新軍,王慶元,付麗梅,等.PTEN,p53 和EGFR 在乳腺癌不同分子亞型中的表達及其相關性[J].中南大學學報(醫學版),2015,40(9):973-978.
[15] 涂睿,劉孝橋.骨肉瘤組織中Survivin、PTEN 的表達及相關性研究[J].實用醫院臨床雜志,2014,11(5):194-196.
[16] 潘飛,尹航.PTEN 基因表達與食管鱗狀細胞癌浸潤轉移的關系[J].解放軍醫學院學報,2014,35(8):843-846.
[17] 王建正,馮笑山,周福有,等.食管癌組織中EGFR 和PTEN 蛋白的表達[J].腫瘤基礎與臨床,2013,26(2):100-103.
四川省衛生廳科研基金資助項目(編號:090117)
郝 明
R735.1
A
1672-6170(2016)05-0114-03
2016-05-26;
2016-06-30)

