絲瓜絡多糖對3T3-L1前脂肪細胞分化的影響*
劉紫萍, 李 菁△, 朱偉杰
(暨南大學1醫學院病理生理學系,2生命科學技術學院, 廣東 廣州 510632)
?
絲瓜絡多糖對3T3-L1前脂肪細胞分化的影響*
劉紫萍1,李菁1△,朱偉杰2
(暨南大學1醫學院病理生理學系,2生命科學技術學院, 廣東 廣州 510632)
[摘要]目的: 分離提純絲瓜絡多糖,觀察其對3T3-L1前脂肪細胞分化的影響,并探討其作用機制。方法:采用熱水浸提法和DEAE-cellulose柱層析法對絲瓜絡多糖進行初步分離和提純,并對分離組分進行紅外光譜分析。運用油紅O染色法,觀察絲瓜絡多糖對3T3-L1前脂肪細胞分化的影響,并通過RT-qPCR觀察3T3-L1前脂肪細胞分化時CCAAT增強子結合蛋白β(CCAAT/enhancer binding protein β,C/EBPβ)、過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptors γ,PPARγ)和CCAAT增強子結合蛋白α(C/EBPα)mRNA的表達情況。結果:經DEAE-cellulose柱層析法分離得到2個多糖組分,絲瓜絡提取物Ⅰ(RLFⅠ)和絲瓜絡提取物Ⅱ(RLFⅡ),紅外光譜分析結果表明2個組分均為多糖類物質。RLFⅠ具有顯著抑制3T3-L1前脂肪細胞分化及甘油三酯合成的作用(P<0.05),RLFⅡ則無顯著效應。與對照組相比,RLFⅠ處理組3T3-L1前脂肪細胞C/EBPβ、PPARγ和C/EBPα的mRNA表達水平明顯降低(P<0.05)。結論:絲瓜絡多糖RLFⅠ具有顯著抑制3T3-L1前脂肪細胞分化的能力,其作用機制可能與下調脂肪細胞分化轉錄因子C/EBPβ、PPARγ和C/EBPα有關。
[關鍵詞]絲瓜絡; 3T3-L1前脂肪細胞; 細胞分化
絲瓜絡(Retinervusluffaefructus,RLF)是葫蘆科植物絲瓜老熟后去皮和去籽后的維管束,中藥方劑中常用于治療氣血阻滯的胸肋疼痛、筋骨酸痛、乳汁不通、乳癰中通、乳腺炎、水腫等。現代藥理學研究表明絲瓜絡具有心臟保護、抗炎、抗過敏、抗氧化、降血脂等功能[1-4]。多年來,天然絲瓜的藥用成分、藥用價值一直受到國內外學者的重視,我們前期研究發現絲瓜絡具有降脂、抑制體重增加和抗氧化的功能,但絲瓜絡調控脂代謝的分子機制尚不清楚。因此,本研究利用陰離子交換柱層析法分離提純絲瓜絡多糖,并觀察絲瓜絡多糖對3T3-L1前脂肪細胞分化的影響,為絲瓜絡藥用價值的深度開發和利用提供科學依據。
材料和方法
1材料、試劑與儀器
3T3-L1 前脂肪細胞株(中科院上海細胞庫);絲瓜絡(廣州康樂醫藥連鎖店);DEAE-cellulose(北京鼎國昌盛生物);3-異丁基-1-甲基黃嘌呤(3-isobutyl-1-methylxanthine, IBMX)、地塞米松(dexamethasone,Dex)、胰島素(insulin)和油紅O均購自Sigma;DMEM高糖培養基、胰蛋白酶(Gibco);胎牛血清(四季青);RNAiso Plus及RT-qPCR試劑盒(TaKaRa);引物由上海生工生物公司合成。T6新銳可見光分光光度計(北京普析通用儀器有限責任公司);傅里葉變換紅外光譜儀(BRVKER); CFX96實時熒光定量PCR儀(Bio-Rad)。
2方法
2.1絲瓜絡多糖的提取絲瓜絡去皮后60 ℃干燥,攪碎成粉末,備用。稱取絲瓜絡干粉1 kg,以1∶40料液比,90 ℃雙蒸水浸提6 h,過濾;濾液減壓濃縮,加入3倍體積的無水乙醇,混勻后4 ℃靜置過夜,1 800 ×g離心20 min取沉淀,依次用無水乙醇、丙酮洗滌沉淀,冷凍干燥,得粗多糖。
2.2苯酚-硫酸法測定絲瓜絡多糖含量用葡萄糖標準品按照苯酚-硫酸法配制標準液[5],于波長490 nm處測定吸光度值。以葡萄糖標準液濃度C(mg/L)為橫坐標,其A值為縱坐標,繪制葡萄糖標準曲線,并得到線性回歸方程y=0.053 6x+0.007 6,R2=0.999 6,線性范圍為0~25 mg/L。

2.3DEAE-cellulose柱層析分離粗多糖將DEAE-cellulose預處理后,裝柱(柱長30cm,直徑2.5cm),蒸餾水平衡3~5個柱體積。稱取100mg粗多糖,溶于10mL蒸餾水,0.45μm濾膜過濾后,上樣。先用300mL蒸餾水沖洗柱子,再用500mL0~1mol/LNaCl溶液梯度洗脫,最后用500mL1mol/LNaCl溶液沖洗。每10mL接1管,流速為1.0mL/min,采用苯酚-硫酸法檢測多糖含量。根據洗脫峰合并洗脫液,透析除鹽,減壓濃縮,冷凍干燥后,得到絲瓜絡提取物Ⅰ(RLFⅠ)和絲瓜絡提取物Ⅱ(RLFⅡ)。
2.4絲瓜絡多糖提取物紅外光譜分析分別取1mg的RLFⅠ和RLFⅡ樣品,干燥,與適量溴化鉀(KBr)粉末研磨混合均勻,壓片,采用紅外光譜儀于4 000~400cm-1范圍內掃描。
2.53T3-L1前脂肪細胞的培養及誘導分化以含10% 胎牛血清的DMEM作為基礎培養液,將3T3-L1前脂肪細胞置于37 ℃、5%CO2恒溫培養箱中培養,待細胞生長至不超過80%培養瓶時,傳代培養。誘導分化方法:取對數生長期的3T3-L1前脂肪細胞,以每孔2×104的密度接種于24 孔板,待細胞長滿孔底,換液后接觸抑制48h,開始加入誘導液A(0.5μmol/LIBMX、1nmol/LDex、10mg/Linsulin及含10% 胎牛血清的DMEM)培養48h,換誘導液B(10mg/Linsulin及含10% 胎牛血清的DMEM)培養48h,此后,每隔48h換基礎培養液繼續培養,直至約80%的前脂肪細胞分化成脂肪細胞。
2.6絲瓜絡多糖提取物對3T3-L1前脂肪細胞分化的影響取3T3-L1前脂肪細胞以每孔2×104的密度接種于24 孔板,按照2.5方法進行誘導分化。實驗分組為空白組:細胞不進行誘導分化,其它培養條件同陰性對照組;陰性對照組:細胞進行正常誘導分化;RLFⅠ組和RLFⅡ組:自誘導開始,分別加入終濃度為31.1mg/L、500mg/L和1 000mg/L的RLFⅠ,以及終濃度為250mg/L、500mg/L和1 000mg/L的RLFⅡ。
用油紅O染色觀察成熟脂肪細胞內甘油三酯的含量[6],油紅O具有很強脂溶性,能與甘油三酯結合。待細胞分化至第8天進行油紅O染色,拍照,并采用ImageJ軟件對脂肪細胞進行定量分析。異丙醇處理已染色細胞,將洗脫液的著色程度進行比色,570nm處檢測吸光度值,分析細胞的分化程度。
2.7RT-qPCR檢測脂肪分化相關轉錄因子水平的變化取3T3-L1前脂肪細胞以每孔1×105接種于6孔板,樣品處理方法同2.5,待分化至第8天,RNAisoPlus試劑抽提細胞總RNA,按試劑盒說明書對RNA進行純化,在紫外分光光度計上進行RNA定量,用A260/A280比值確定RNA的純度,認為比值在1.8~2.1之間符合純度要求。配置30μLRNA逆轉錄體系,逆轉錄合成cDNA后,以GAPDH為內參照,進行熒光定量PCR。PCR反應條件為95 ℃ 30s;95 ℃10s,60 ℃ 10s,72 ℃ 10s,40個循環。采用2-ΔΔCt法對PCR結果進行分析。引物序列見表1。
3統計學處理
數據以均數±標準差(Mean±SD)表示,用SPSS13.0軟件進行統計分析。多組間差異采用單因素方差分析,方差齊用SNK法,方差不齊用Tamhane’sT2法,以P<0.05為差異有統計學意義。
結果
1DEAE-cellulose柱層析分離粗多糖
上樣后,依次用蒸餾水、0~1 mol/L NaCl溶液和1 mol/L NaCl溶液沖洗層析柱,得到2個洗脫峰,收集合并洗脫液,透析,濃縮,冷凍干燥后,得到絲瓜絡提取物RLFⅠ和RLFⅡ。如圖1,峰1為蒸餾水洗脫峰,峰2為0~1 mol/L NaCl溶液的梯度洗脫峰,1 mol/L NaCl溶液洗脫時,未出現明顯的洗脫峰。
Figure 1.The DEAE-cellulose elution curve of polysaccharides from RLF. The saccharides contents were detected by phenol-sulfuric acid method. RLFⅠwas eluted by distilled water, and RLFⅡwas eluted by 0~1 mol/L NaCl solution.
圖1絲瓜絡多糖的DEAE-cellulose洗脫曲線
2絲瓜絡提取物的紅外光譜分析結果
多糖物質的特征吸收峰分布于3 600~3 200 cm-1、3 000~2 800 cm-1、1 400~1 200 cm-1和1 200~1 000 cm-1這4個吸收區域。3 600~3 200 cm-1為O-H伸縮振動峰,3 000~2 800 cm-1吸收峰由C-H伸縮振動引起,1 400~1 200 cm-1的吸收峰由C-H的變角振動引起,1 200~1 000 cm-1是C-O的伸縮振動峰。
RLFⅠ和RLFⅡ的紅外光譜結果如圖2顯示,在4個特征吸收區域都出現了吸收峰,說明RLFⅠ和RLFⅡ都是多糖類物質,都有O-H和C-H的伸縮振動峰。RLFⅠ在896.737 cm-1處有吸收峰說明含有 β-D-吡喃葡萄糖,RLFⅡ在1 100~1 010 cm-1和957.484 cm-1處均有吸收峰,說明RLFⅡ的單糖殘基存在吡喃環和呋喃環。
3油紅O染色法觀察RLF提取物對3T3-L1 前脂肪細胞分化的影響
3T3-L1前脂肪細胞加誘導液(0.5 μmol/L IBMX、1 nmol/L Dex和10 mg/L insulin)及RLFⅠ或RLFⅡ處理,第8天進行油紅O染色。如圖3~4所示,與NC組相比,RLF Ⅰ處理組的成熟脂肪細胞分化率和脂肪細胞內甘油三酯的聚集明顯下降,表明RLFⅠ具有抑制3T3-L1前脂肪細胞分化的功能。RLFⅡ處理的細胞與NC組相比,差異無統計學顯著性。
Figure 2.Infrared absorption spectrum of RLF I and RLF II.
圖2RLF的紅外吸收光譜圖
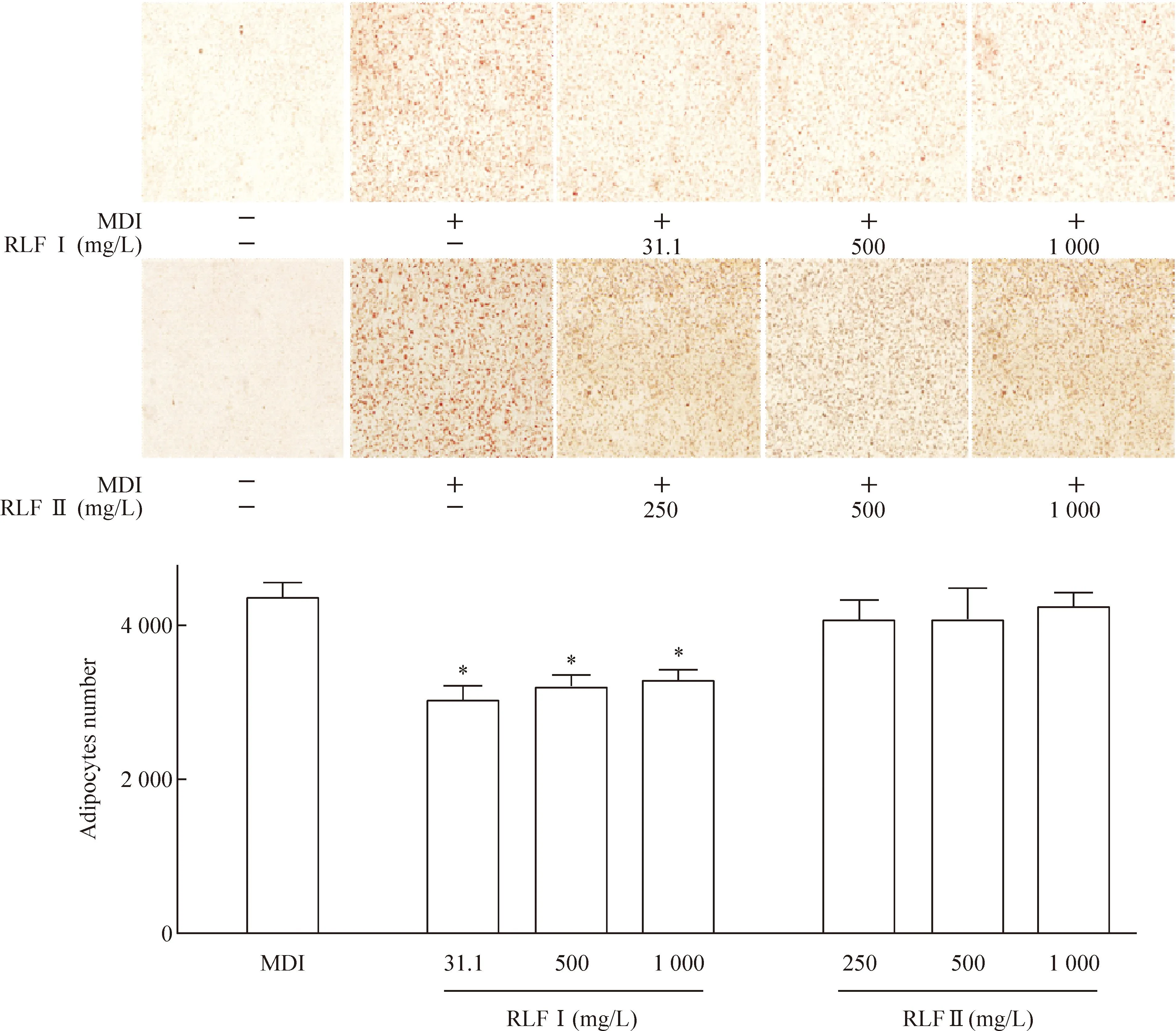
Figure 3.The effect of RLF on the differentiation of 3T3-L1 pre-adipocytes into adipocytes by MDI induction for 8 d (oil red O staining,×100). Mean±SD.n=5.*P<0.05vsMDI.
圖33T3-L1前脂肪細胞誘導分化第8天的油紅O染色觀察脂肪細胞分化率
Figure 4.Triglyceride contents in 3T3-L1 pre-adipocytes induced by MDI for 8 d. Mean±SD.n=3.*P<0.05vsMDI.
圖4RLFⅠ和 RLFⅡ對3T3-L1前脂肪細胞甘油三酯合成的影響
4RLFⅠ對脂肪細胞分化相關轉錄因子表達的影響
RT-qPCR 檢測結果見圖5。RLFⅠ處理 3T3-L1前脂肪細胞8 d后,脂肪細胞分化轉錄因子C/EBPβ、PPARγ和C/EBPα的mRNA表達量顯著降低,差異有統計學顯著性(P<0.05),表明RLFⅠ具有下調脂肪細胞分化過程中相關轉錄因子C/EBPβ、PPARγ和C/EBPα的作用。
Figure 5.The mRNA expression of C/EBPβ, PPARγ and C/EBPα in differentiated 3T3-L1 pre-adipocytes determined by RT-qPCR. Mean±SD.n=3.*P<0.05vsMDI.
圖5RLFⅠ對3T3-L1前脂肪細胞分化調控基因表達的影響
討論
肥胖癥是一種由遺傳因素、社會環境、個人行為等多種因素引起的慢性代謝性疾病,可誘發心臟病、2型糖尿病、阻塞性睡眠呼吸暫停等多種疾病,是全球最大的公眾健康問題之一。利用藥物防治肥胖,從而降低心腦血管等疾病的發病率,具有重要的臨床意義。
肥胖癥是由于體內能量的攝取和消耗不平衡,導致機體脂肪病理性堆積,從而引起機體組織功能障礙[7]。脂肪細胞的分化和脂肪的堆積與肥胖的發生和發展密切相關[8],控制脂肪細胞的增加(即控制前脂肪細胞分化為成熟脂肪細胞)和脂肪細胞內甘油三酯的過度聚集是治療肥胖的關鍵點,也是藥物作用的重要靶點[9-10]。本課題組前期研究發現絲瓜絡具有降脂、抑制體重增加和抗氧化的功能,但起作用的活性成分和分子機制尚未清楚。
絲瓜絡的化學成分有多肽、多糖、甙類(皂甙, 強心甙)、有機酸、蒽醌類、酚類、鞣質、黃酮、香豆素、萜內酯及生物堿等,其中多糖是絲瓜絡的主要成分之一,具較高的含量[11]。本研究利用熱水浸提法和DEAE-cellulose柱層析法提取分離得到RLFⅠ和 RLFⅡ,紅外光譜分析確定這2個組份均為多糖類物質,并發現RLFⅠ中有吡喃環,RLFⅡ中存在吡喃環和呋喃環。多糖類物質具有抗腫瘤、免疫抑制、降血糖、降血脂、抗輻射等生物活性[12-13]。目前關于絲瓜絡多糖的生物學效應研究較少,尚未見其參與調節脂質代謝方面的報道。
脂肪細胞的分化是伴隨著嚴密組織性的有絲分裂過程。3T3-L1前脂肪細胞分化成脂肪細胞的過程中,甘油三酯水平顯著升高,可根據油紅O染色測定觀察到此變化。本實驗結果顯示:RLFⅠ處理后,成熟脂肪細胞分化率明顯下降,脂肪細胞甘油三酯的合成顯著減少,表明RLFⅠ具有抑制3T3-L1前脂肪細胞分化效應。RLFⅡ對3T3-L1前脂肪細胞分化則無顯著效應。隨后,本研究觀察了RLFⅠ對3T3-L1前脂肪細胞分化相關調控基因的影響。
脂肪細胞的分化過程由復雜的轉錄因子網絡調控。主要包括過氧化物酶體增殖物激活受體γ(PPARγ)和CCAAT增強子結合蛋白家族(C/EBPs)兩類轉錄因子。在分化早期,轉錄因子C/EBPβ首先被激活,在分化后期,相繼激活PPARγ和C/EBPα,PPARγ和C/EBPα協同調控下游分化基因,促進脂肪合成[14]。有研究發現C/EBPβ敲除的小鼠存在輕度的脂肪組織發育缺陷。成熟脂肪基因組研究表明,在終末分化階段,PPARγ 和C/EBPα占全部基因的60%。PPARγ是維持脂肪細胞終末分化的關鍵轉錄因子,敲除PPARγ后,這些分化細胞不能持續[15]。因此,可特異性調控轉錄因子C/EBPβ、PPARγ和C/EBPα表達的醫藥植物已成為治療肥胖的目標[16-17]。本研究發現,在脂肪細胞分化過程中,RLFⅠ處理組C/EBPβ、PPARγ 和C/EBPα的mRNA表達量顯著降低。500 mg/L的RLFⅠ對C/EBPβ的影響最明顯,31.1 mg/L和500 mg/L的RLFⅠ對PPARγ 和C/EBPα mRNA下調作用最顯著。
本研究結果表明,絲瓜絡多糖提取物RLFⅠ具有脂代謝調控作用,RLFⅠ抑制3T3-L1前脂肪細胞分化的分子機制,可能是C/EBPβ基因表達下調,脂肪分化啟動功能缺陷;PPARγ和C/EBPα基因表達下調,不能維持脂肪細胞的終末分化,最終減少脂肪細胞的合成。因此,絲瓜絡多糖對于肥胖的防治具有一定應用價值和臨床意義。
[參考文獻]
[1]熊淑玲,方乍浦,曾憲儀. 絲瓜化學成分的分離與鑒定[J]. 中國中藥雜志, 1994, 19(4): 233-234.
[2]關穎,李菁,朱偉杰, 等. 絲瓜絡對小鼠心肌缺血性損傷的預防效應[J]. 中國病理生理雜志, 2006, 22(1):68-71.
[3]潘永勤,李菁,朱偉杰, 等. 絲瓜降血脂及抗氧化作用的實驗研究[J]. 中國病理生理雜志, 2008, 24(5):873-877.
[4]李小玲,李菁,朱偉杰,等. 絲瓜絡對高脂血癥小鼠 LDL-R 基因表達的影響[J]. 中國病理生理雜志, 2009, 25(6):1156-1159.
[5]DuBois M, Gilles KA, Hamilton JK, et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem, 1956, 28(3): 350-356.
[6]Kwak DH, Lee JH, Song KH, et al. Inhibitory effects of baicalin in the early stage of 3T3-L1 preadipocytes differentiation by down-regulation of PDK1/Akt phosphorylation[J]. Mol Cell Biochem, 2014, 385(1-2):257-264.
[7]Jou PC, Ho BY, Hsu YW, et al. The effect ofMonascussecondary polyketide metabolites, monascin and ankaflavin, on adipogenesis and lipolysis activity in 3T3-L1[J]. J Agric Food Chem, 2010, 58(24):12703-12709.
[8]Feve B. Adipogenesis: cellular and molecular aspects[J]. Best Pract Res Clin Endocrinol Metab, 2005, 19(4):483-499.
[9]Jeon T, Hwang SG, Hirai S, et al. Red yeast rice extracts suppress adipogenesis by down-regulating adipogenic transcription factors and gene expression in 3T3-L1 cells[J]. Life Sci, 2004, 75(26):3195-3203.
[10]Blüher M. The distinction of metabolically ‘healthy’ from‘unhealthy’obese individuals[J]. Curr Opin Lipidol, 2010, 21(1):38-43.
[11]黎炎,李文嘉,王益奎,等. 絲瓜絡化學成分分析[J]. 西南農業學報, 2011, 24(2):529-534.
[12]Yang W, Zhang H, Ji M, et al. Antitumor effect of a po-lysaccharide isolated fromPhellinuspullusas an immunostimulant[J]. Biomed Rep, 2016, 4(3):361-364.
[13]Qian L, Zhou Y, Ma JX. Hypolipidemic effect of the polysaccharides fromPorphyrayezoensis[J]. Int J Biol Macromol, 2014, 68:48-49.
[14]Feige JN, Auwerx J. Transcriptional coregulators in the control of energy homeostasis[J]. Trends Cell Biol, 2007, 17(6):292-301.
[15]Cristancho AG, Lazar MA. Forming functional fat: a growing understanding of adipocyte differentiation[J]. Nat Rev Mol Cell Biol, 2011, 12(11):722-734.
[16]Picard F, Kurtev M, Chung N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J]. Nature, 2004, 429(6993):771-776.
[17]Rayalam S, Della-Fera MA, Baile CA. Phytochemicals and regulation of the adipocyte life cycle[J]. J Nutr Biochem, 2008, 19(11):717-726.
(責任編輯: 林白霜,羅森)
Effects of Retinervus luffae fructus polysaccharides on differentiation of 3T3-L1 pre-adipocytes
LIU Zi-ping1, LI Jing1, ZHU Wei-jie2
(1DepartmentofPathophysiology,SchoolofMedicine,2SchoolofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China.E-mail:tlijing62@126.com)
[KEY WORDS]Retinervusluffaefructus; 3T3-L1 pre-adipocytes; Cell differentiation
[ABSTRACT]AIM: To observe the influence of polysaccharides extracted fromRetinervusluffaefructus(RLF) on the differentiation of 3T3-L1 pre-adipocytes and to investigate its mechanism. METHODS: DEAE-cellulose column was used to isolate and purify RLF. The effect of RLF polysaccharides on 3T3-L1 pre-adipocyte differentiation was determined by oil red O staining. The effect of RLF on the mRNA expression of differentiation-related factors C/EBPβ, PPARγ and C/EBPα was detected by RT-qPCR. RESULTS: Two components of polysaccharides named as RLFⅠand RLFⅡ were acquired by DEAE-cellulose column and identified as polysaccharides by infrared absorption spectrum. RLFⅠsignificantly reduced the differentiation of 3T3-L1 pre-adipocytes into the adipocytes and the content of triglyceride in the cells (P<0.05). No obvious effect of RLFⅡ was observed. Compared with control group, the mRNA levels of C/EBPβ, PPARγ and C/EBPα in RLFⅠgroup remarkably down-regulated (P<0.05). CONCLUSION: RLFⅠsignificantly inhibits 3T3-L1 pre-adipocyte differentiation into adipocytes. The mechanism might be related to the down-regulation of differentiation-associated factors C/EBPβ, PPARγ and C/EBPα.
[文章編號]1000- 4718(2016)06- 1071- 06
[收稿日期]2016- 03- 11[修回日期] 2016- 04- 29
*[基金項目]廣東省中醫藥管理局資助項目(No. 20112108);國家中醫藥管理局三級實驗室開放課題基金資助項目
通訊作者△Tel: 020-85220253; E-mail: tlijing62@126.com
[中圖分類號]R363
[文獻標志碼]A
doi:10.3969/j.issn.1000- 4718.2016.06.019

