Orexin-A對肥胖抵抗大鼠和高脂飲食誘導肥胖大鼠攝食和自由活動的影響*
彭曉燕, 張海鑫, 郭菲菲, 孫向榮, 公衍玲, 徐 珞△
(1青島大學醫學院病理生理教研室,山東 青島266021; 2吉林大學第二醫院,吉林 長春 130021;3青島科技大學化工學院,山東 青島266021)
Orexin-A對肥胖抵抗大鼠和高脂飲食誘導肥胖大鼠攝食和自由活動的影響*
彭曉燕1,張海鑫2,郭菲菲1,孫向榮1,公衍玲3,徐珞1△
(1青島大學醫學院病理生理教研室,山東 青島266021;2吉林大學第二醫院,吉林 長春 130021;3青島科技大學化工學院,山東 青島266021)
[摘要]目的: 探討肥胖抵抗(OR)大鼠、高脂飲食誘導肥胖(DIO)大鼠及正常SD大鼠的攝食量和自由活動量的差異及食欲肽(orexin-A)在其中的作用。方法: 分別于OR、DIO和SD大鼠下丘腦頭端外側區(rLHa)埋置套管,經套管注射不同劑量(0、31.25、62.5、125和250 pmol)的orexin-A,觀察大鼠2 h內攝食量和自由活動情況;采用real-time PCR檢測下丘腦和rLHa prepro-orexin、orexin-A受體(OX1R)和 orexin-B受體(OX2R)的 mRNA表達;采用放射免疫分析法檢測下丘腦和rLHa OX1R和OX2R的蛋白含量。結果: rLHa微量注射orexin-A可顯著增加OR、DIO和SD大鼠的攝食量(P<0.05);rLHa微量注射orexin-A后,OR和SD大鼠的自由活動量比DIO大鼠顯著增高(P<0.05)。OR大鼠rLHA OX1R和OX2R的mRNA及蛋白表達均明顯高于DIO和SD大鼠(P<0.05)。結論: 下丘腦orexin-A參與肥胖和正常大鼠能量代謝調控,其中對OR大鼠的調控效應最佳。
[關鍵詞]肥胖抵抗大鼠; 飲食誘導肥胖大鼠; 攝食; 自由活動量; 食欲肽A
食欲肽A(orexin-A,OXA)是一種參與攝食和覺醒功能的神經肽,主要表達于下丘腦外側區、背外側部及穹窿周區[1-3]。Orexin神經元呈輻射狀分布在大腦的各個區域,并通過不同機制調控覺醒和攝食行為[2, 4]。Orexin神經元可投射至黑質中支配紋狀體的多巴胺能神經元,后者是調節自由活動的關鍵。有文獻報道,orexin缺乏時大鼠的自由活動量和攝食量同時減少,但體重明顯增加,表明大鼠自由活動量的變化對體重的影響大于能量攝入[2-3]。雄性SD大鼠長期喂飼高能量飲食后,可表現出不同的體重增加模式,大約50%大鼠體重顯著增長,稱之為飲食誘導肥胖(diet-induced obese,DIO)大鼠;而另一半體重保持不變的為肥胖抵抗(obesity-resistant,OR)大鼠。OR大鼠雖然攝食量增加,但其體重可維持相對狀態,可能與其活動量明顯增多有關[5]。目前對調控DIO和OR大鼠自由活動量的中樞機制仍不清楚。本研究擬采用下丘腦頭端外側區(rostral lateral hypothalamic area,rLHa)微量注射OXA的方法,觀察大鼠的攝食量和自由運動量改變及機制。
材料和方法
1實驗動物
成年雄性SD大鼠,體質量220~250 g,月齡2~4個月,由青島市藥物檢驗所提供。置于室溫(25±2) ℃,12 h晝夜循環光照條件下飼養。自由攝食、飲水。所有動物實驗均符合“青島大學實驗動物保護和使用管理方法”。
2實驗儀器及試劑
大鼠腦立體定位儀(Scientifica);ANY-maze視頻分析系統(Stoelting);orexin-A(Sigma)。
3實驗方法
3.1DIO大鼠和OR大鼠模型的建立[6]選取成年雄性SD大鼠312只,其中214只給予高能量飲食(配方為80%基礎飼料,10%蛋黃粉,10%豬油)喂養8周,其余98只大鼠給予正常動物飼料喂養8周,造模期間所有大鼠均自由飲水。實驗結束后,大鼠麻醉下腹主動脈取血,檢測體重、血脂、血清瘦素和胰島素水平,以體重比正常組大鼠增加15%且Lee′s指數比正常組增加1.5%作為肥胖大鼠建模指標,共99只OR大鼠和103只DIO大鼠制備成功。
3.2rLHa埋置套管大鼠在戊巴比妥鈉(50 ng/kg)麻醉下行外科手術。參照Paxinos和Watson腦圖譜,將大鼠置于腦立體定位儀,在rLHa植入一同芯套管(定位:前囟后2.2 mm,旁開1.9 mm,深7.3 mm),并固定于顱骨表面。術后7 d進行實驗。
3.3大鼠自由活動量檢測采用Any-maze視頻分析系統監測并記錄大鼠自由活動。將大鼠置于1 m×1 m×1.5 m自由活動測量箱內,箱內安裝可記錄大鼠自由活動情況的視頻攝像機。實驗結束后將圖像傳入計算機并自動分析,統計大鼠在箱內0~2 h的活動距離。
3.4Real-time PCR實驗DIO、OR和SD大鼠各10只,隨機分為2組,大鼠斷頭取腦,參照Paxinos-Watson大鼠腦圖譜分離下丘腦(5只)或rLHa(5只),迅速加入1 mL冰凍TRIzol勻漿。用Trizol reagent方法提取總RNA,NanoORop紫外線分光光度計測定總mRNA濃度和純度。
取1 μL總RNA,以Oligo (dT)為引物,按試劑盒說明書行逆轉錄反應,以生成的ss-cDNA為模板,然后加入TaqDNA聚合酶以及prepro-orexin、orexin-A受體(orexin-A receptor,OX1R)和orexin-B受體(orexin-B receptor,OX2R)特異性引物,β-actin作為內參照。擴增反應用SYBR GreenⅠ定量PCR試劑盒和5700型定量PCR儀完成。擴增條件:95 ℃ 1 min;95 ℃ 30 s;60 ℃(preproorexin)或59 ℃(OX1R/OX2R)20 s;72 ℃ 15 s;40個循環。隨后觀察該PCR產物的熔解曲線[94 ℃ 0 s,84 ℃(OX1R)、82 ℃(OX2R)或79 ℃(prepro-orexin)15 s,94 ℃ 0 s;溫度變化速度為0.1 ℃/s],并由電腦自動分析系統進行定量分析。Real-time PCR引物由上海生工合成,引物序列見表1。
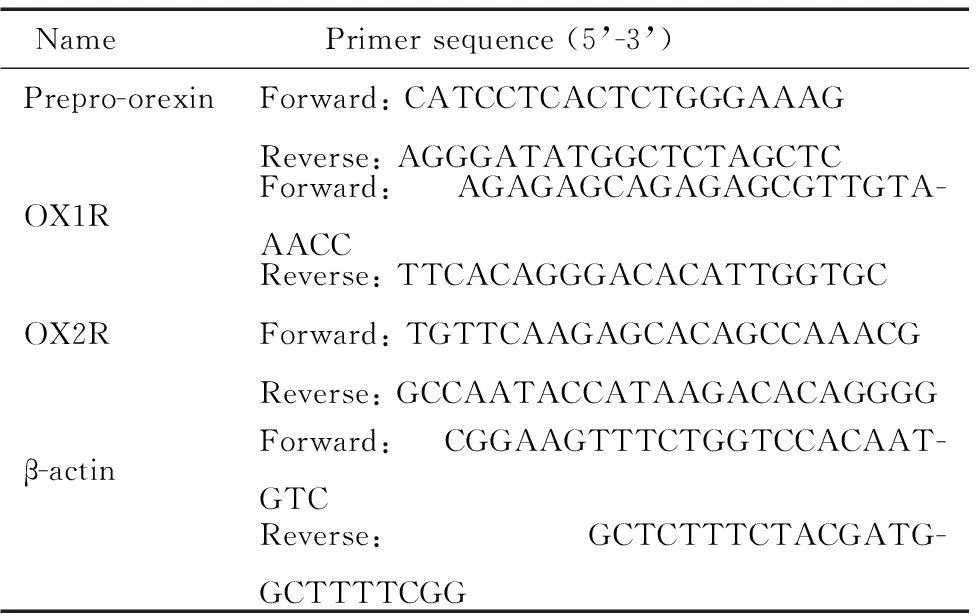
表1 引物序列
3.5放射免疫法檢測OX1R 和OX2R DIO、OR和SD大鼠各18只進行放射免疫測定。放射免疫試劑盒由Phoenix提供,大鼠腦區內OX1R 和OX2R的提取和放免檢測嚴格按說明書進行操作。首先配制OX1R 或OX2R標準液(將OX1R 或OX2R標準品用PBS緩沖液稀釋成每100 μL分別含2.5、5、10、20、40、80、160、320、640和1 280 pg);OX1R 或OX2R抗血清用PBS稀釋至1∶8 000(OX1R 或OX2R純品和抗OX1R 或OX2R兔血清均為Sigma產品)。動物實驗完畢,迅速斷頭取腦,將腦置于煮沸的生理鹽水中煮5 min;吸干、分離下丘腦(9只)或下丘腦背外側核(9只)、稱質量,加1 mol/L鹽酸1.0 mL制成勻漿,室溫下靜置100 min。然后加1 mol/L氫氧化鈉1 mL中和,4 000 r/min離心20 min,取上清液測定。測定程序:各管加[125I]-OX1R 或[125I]-OX2R 100 μL,抗OX1R 或OX2R血清100 μL。樣品管加100~200 μL,標準管加OX1R 或OX2R 100 μL,最后以磷酸緩沖液補足總反應體積為500 μL;4 ℃冰箱內孵育24 h;各管加1∶3羊抗兔血清100 μL,繼續孵育24 h,4 000 r/min離心20 min,棄上清液。測沉淀物的CPM,根據同批測定管的OX1R 或OX2R競爭抑制曲線,求取每mg組織中OX1R或OX2R的含量。
3.6Orexin-A對大鼠攝食量和自由活動量的影響將DIO、OR和SD大鼠分別隨機分為2組(每組7只),實驗組大鼠rLHa分別微量注射0.5 μL orexin-A(31、25、62.5、125和250 pmol);對照組大鼠下丘腦背外側核注射0.5 μL生理鹽水,給藥后1 h和2 h測定大鼠攝食量。
大鼠自由活動量檢測前,先將大鼠在測量箱內適應140 min。DIO、OR和SD大鼠隨機分為2組(每組7只),實驗組大鼠rLHa微量注射0.5 μL orexin-A(31.25、62.5、125和250 pmol);對照組大鼠下丘腦背外側核注射0.5 μL NS,注射后1 h和2 h監測大鼠自由活動。
4統計學處理
用SPSS 18.0和Prism 5.0統計學軟件進行數據處理。數據以均數±標準差(mean±SD)表示,兩個獨立樣本組間均數比較采用t檢驗,多組間均數差異采用單因素方差分析(one-way ANOVA),方差分析后各組均數間兩兩比較采用q檢驗(SNK法)。以P<0.05為差異有統計學意義。
結果
1rLHa注射OXA對大鼠攝食量的影響
DIO、OR或SD大鼠rLHa分別微量注射NS以及31.25、62.5、125和250 pmol OXA,觀察大鼠0~2 h攝食量,結果見表2。
分析0~1 h攝食量可見OR大鼠的攝食量明顯多于DIO大鼠和SD大鼠(P<0.05);DIO大鼠的攝食量與SD大鼠差異無統計學意義。與NS組相比,rLHa注射高劑量(62.5、125和250 pmol)OXA可顯著促進各組大鼠的攝食量(P<0.05);但高劑量組之間大鼠攝食量的差異無統計學意義,且注射相同高劑量OXA(62.5、125或250 pmol)時,OR大鼠的攝食量明顯大于DIO大鼠和SD大鼠(P<0.05)。
分析1~2 h的攝食量可見,與NS組相比,rLHa注射不同劑量OXA (31.25、62.5、125和250 pmol), DIO、OR和SD大鼠攝食量的差異無統計學意義。rLHa注射相同劑量OXA時,OR大鼠和DIO大鼠的攝食量之間的差異無統計學意義,但OR大鼠的攝食量顯著大于SD大鼠(P<0.05);DIO大鼠的攝食量顯著大于SD大鼠(P<0.05)。結合0~1 h數據可推測,OXA對攝食量的作用在0~1 h內逐漸達到峰值,在1~2 h逐漸下降。
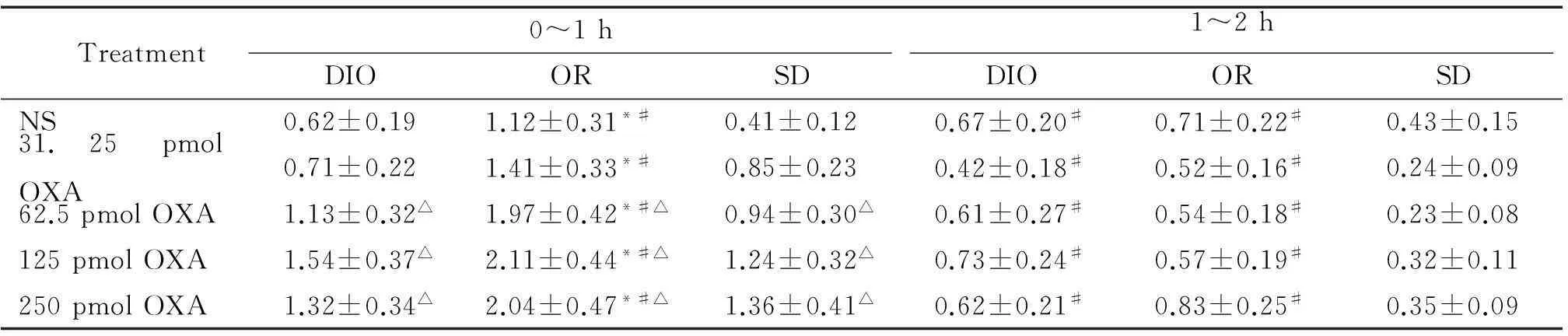
表2 rLHa注射OXA對DIO、OR和SD大鼠攝食量的影響
*P<0.05vsDIO rats with the same treatment;#P<<0.05vsSD rats with the same treatment;△P<0.05vsNS.
2rLHa注射OXA對大鼠自由活動量的影響
DIO、OR和SD大鼠經rLHa分別注射NS以及31.25、62.5、125和250 pmol OXA,觀察大鼠0~2 h活動量,結果見圖1。
分析0~1 h的自由活動量可見OR大鼠的活動量明顯多于DIO大鼠和SD大鼠(P<0.05)。與對照組相比,rLHa注射高劑量(62.5、125和250 pmol)OXA可顯著促進各組大鼠的活動量(P<0.05);但高劑量組之間大鼠活動量的差異無統計學意義,且注射相同高劑量OXA(62.5、125或250 pmol)時,OR大鼠的活動量明顯大于DIO大鼠和SD大鼠(P<0.05)。
分析1~2 h的自由活動量可見,與對照組相比,rLHa注射不同劑量OXA (31.25、62.5、125和250 pmol), DIO、OR和SD大鼠活動量的差異無統計學意義。rLHa注射相同劑量OXA時,DIO大鼠和SD大鼠的活動量并無顯著差異,但OR大鼠活動量大于DIO大鼠和SD大鼠(P<0.05)。結合0~1 h數據可推測,OXA對自由活動量的影響在0~1 h內逐漸達到峰值,在1~2 h逐漸下降。

Figure 1. The effect of OXA injection in rLHa on spontaneous physical activity of DIO, OR and SD rats. Mean±SD.n=7.*P<0.05vsDIO rats with the same treatment;#P<0.05vsSD rats with the same treatment;△P<0.05vsNS.
圖1rLHa注射OXA對DIO、OR和SD大鼠自由活動量的影響
3下丘腦和rLHa prepro-orexin、OX1R和OX2R 的mRNA表達
OR大鼠rLHa OX1R和OX2R的mRNA表達均顯著高于DIO大鼠和OR大鼠(P<0.05);但3種大鼠rLHa的prepro-orexin以及下丘腦prepro-orexin、OX1R和OX2R的 mRNA表達均無顯著差異,見表3。

表3 下丘腦和rLHa prepro-orexin、OX1R和OX2R mRNA的表達
*P<0.05vsSD rats;#P<0.05vsDIO rats.
4下丘腦和rLHa OX1R和OX2R蛋白表達的改變
放射免疫分析結果顯示,OR大鼠rLHa的 OX1R和OX2R含量均顯著高于DIO大鼠和SD大鼠(P<0.05);DIO大鼠rLHa 的OX1R和OX2R明顯高于SD大鼠(P<0.05),但DIO、OR和SD大鼠的整個下丘腦內OX1R和OX2R的表達均無顯著差異,見表4。
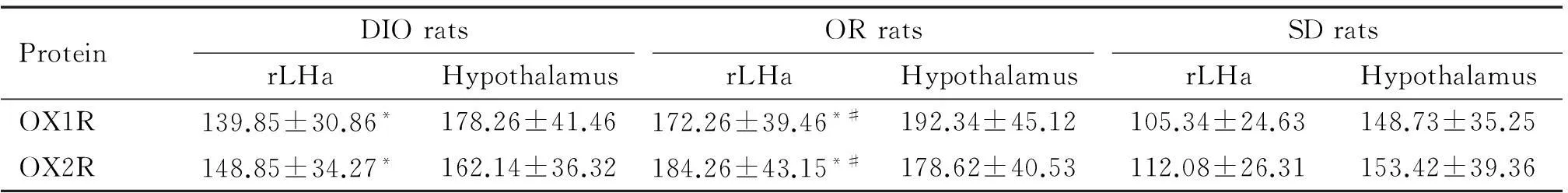
表4 下丘腦和rLHa OX1R和OX2R蛋白的含量
*P<0.05vsSD rats;#P<0.05vsDIO rats.
討論
為探討DIO及OR大鼠攝食行為和自由活動的差異,我們選擇正常SD大鼠作為參照。本實驗大鼠于rLHa注射OXA引起的攝食行為與之前學者們[3, 7-8]的研究結果基本一致,都證實了在中樞OXA促進大鼠的自由活動[7, 9-10]和能量消耗[11-12]。此外,本研究發現,OXA誘導大鼠攝食量的增加主要體現于0~1 h攝食量的增加;而OXA誘導的自由活動量增加主要體現在0~2 h階段,即由OXA誘發的單位時間段內的攝食量及自由活動量變化不同,可能是攝食和自由活動的調節通過2種不同的作用通路。此外,OR大鼠rLHa OX1R 和OX2R的 mRNA含量明顯高于DIO大鼠,推測rLHa注射相同劑量OXA后OR大鼠活動量大于DIO和SD大鼠的原因可能是OXA通過rLHa的OX1R和OX2R信號因子發揮作用。
本研究實驗數據顯示,與DIO和SD大鼠相比,OR大鼠具有較大的基礎自由活動量,且注射相同劑量OXA,OR大鼠有著更高的攝食量和自由活動量。但OR大鼠對OXA反應敏感的作用機制現還不清楚,可能是OR大鼠下丘腦OXA受體表達量較高,為了驗證這個假設,我們檢測了OR及DIO大鼠下丘腦OX1R 和OX2R的mRNA表達水平。結果發現,OR大鼠rLHa內OX1R 和OX2R 的mRNA表達均比DIO大鼠顯著增多,提示OXRs的增加和OXA引起攝食量和自由活動量的增加是同步進行的,OX1R和OX2R這2種受體亞型均有可能參與攝食及自由活動的調節過程。此外我們還測定了整個下丘腦的prepro-orexin和OXRs的mRNA表達水平,以判斷orexins在DIO和OR大鼠的表達是否相同。結果顯示DIO和OR大鼠下丘腦prepro-orexin和OXRs的mRNA表達水平差異無統計學意義,我們推測下丘腦內有多種食欲肽,雖各種食欲肽的mRNA表達有顯著差異,但總體水平相當。
此外,放射免疫研究顯示OR大鼠rLHa 的OX1R和OX2R含量明顯高于DIO和SD大鼠,而整個下丘腦區域的OX1R或OX2R含量無顯著差異,與rLHa區OXRs的mRNA和蛋白表達結果一致。本研究發現OR和DIO大鼠之間自由活動量的差異可能是導致其體重變化的重要因素之一[7]。有文獻報道,DIO和OR大鼠對OXA誘導攝食和能量代謝效應的差異可能與中樞單胺類神經遞質[13]、瘦素[14-15]以及胰島素[16]功能活動有關,但具體機制不清。
[參考文獻]
[1]Kukkonen JP, Leonard CS. Orexin/hypocretin receptor signalling cascades[J]. Br J Pharmacol, 2014, 171(2):314-331.
[2]Gao XB, Horvath T. Function and dysfunction of hypocretin/orexin: an energetics point of view[J]. Ann Rev Neurosci, 2014, 37:101-116.
[3]Sakurai T, Amemiya A, Ishii M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4):573-585.
[4]Hoyer D, Jacobson LH. Orexin in sleep, addiction and more: is the perfect insomnia ORug at hand? [J]. Neuropeptides, 2013, 47(6):477-488.
[5]Zink AN, Perez-Leighton CE, Kotz CM. The orexin neuropeptide system: physical activity and hypothalamic function throughout the aging process[J]. Front Syst Neurosci, 2014, 8:211.
[6]徐姝迪,鄭玉建,丁紅,等. 高脂飼料誘導肥胖大鼠模型的方法研究[J]. 現代預防醫學, 2012, 39(2):294-295.
[7]Perez-Leighton CE, Billington CJ, Kotz CM. Orexin modulation of adipose tissue[J]. Biochim Biophys Acta, 2014, 1842(3):440-445.
[8]Sakurai T. Roles of orexins in the regulation of body weight homeostasis[J]. Obesity Res Clin Pract, 2014, 8(5):e414-e420.
[9]Zhang XY, Yu L, Zhuang QX, et al. Central functions of the orexinergic system[J]. Neurosci Bull, 2013, 29(3):355-365.
[10]Mieda M, Sakurai T. Overview of orexin/hypocretin system[J]. Prog Brain Res, 2012, 198:5-14.
[11]Baimel C, Bartlett SE, Chiou LC, et al. Orexin/hypocretin role in reward: implications for opioid and other addictions[J]. Br J Pharmacol, 2015, 172(2): 334-348.
[12]Tsuneki H, Sasaoka T. Hypothalamic orexin system regulates energy and glucose metabolism[J]. Nihon Yakurigaku Zasshi, 2013, 142(6):316-317.
[13]Hassanain M, Levin BE. Dysregulation of hypothalamic serotonin turnover in diet-induced obese rats[J]. Brain Res, 2002, 929(2):175-180.
[14]How JM, Pumpa TJ, Sartor DM. The circulatory and renal sympathoinhibitory effects of gastric leptin are altered by a high fat diet and obesity[J]. Auton Neurosci, 2013, 177(2):95-100.
[15]Scarpace PJ, Zhang Y. Leptin resistance: a prediposing factor for diet-induced obesity[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 296(3):R493-R500.
[16]Olea E, Agapito MT, Gallego-Martin T, et al. Intermittent hypoxia and diet-induced obesity: effects on oxidative status, sympathetic tone, plasma glucose and insulin levels, and arterial pressure[J]. J Appl Physiol, 2014, 117(7): 706-719.
(責任編輯: 陳妙玲, 羅森)
Effects of orexin-A on food intake and spontaneous physical activity in obesity-resistant rats and high-fat diet-induced obese rats
PENG Xiao-yan1, ZHANG Hai-xin2, GUO Fei-fei1, SUN Xiang-rong1, GONG Yan-ling3, XU Luo1
(1DepartmentofPhysiology,QingdaoUniversityMedicalCollege,Qingdao266021,China;2TheSecondHospitalofJilinUniversity,Changchun130021,China;3CollegeofChemicalEngineering,TsingtaoUniversityofScience&Technology,Qingdao266021,China.E-mail:xu.luo@163.com)
[ABSTRACT]AIM: To investigate the differences of food intake and spontaneous physical activity (SPA) among obesity-resistant (OR) rats, diet-induced obese (DIO) rats and normal Sprague-Dawley (SD) rats and the role of orexin-A in these processes. METHODS: The rostral lateral hypothalamic area (rLHa) catheter was implanted into the OIO, OR, and SD rats. Orexin A at doses of 0, 31.25, 62.5, 125 and 250 pmol was injected through the catheter. The SPA and food intake were measured and recorded for 2 h after injection. The mRNA expression of prepro-orexin, orexin-A receptor (OX1R) and orexin-B receptor (OX2R) in the rLHa and hypothalamus of OR, DIO and SD rats was detected by real-time PCR. The protein expression of OX1R and OX2R in the hypothalamus and rLHa of the rats was measured by radioimmunoassay. RESULTS: A small-dose injection of orexin-A into rLHa significantly increased the food intake in all the rats. Orexin A-induced SPA had significant differences, showing that the OR and SD rats had the higher motion than the DIO rats. The mRNA and protein levels of OX1R and OX2R in the rLHa of OR rats were significantly higher than those in DIO and SD rats. CONCLUSION: Hypothalamic orexin-A participates in the regulation of energy metabolism in obese and normal rats, in which the regulatory effect on OR rats is the best.
[KEY WORDS]Obesity-resistant rats; Diet-induced obese rats; Food intake; Spontaneous physical activity; Orexin-A
[文章編號]1000- 4718(2016)01- 0046- 05
[收稿日期]2015- 06- 25[修回日期] 2015- 10- 27
*[基金項目]國家自然科學基金資助項目(No. 81270460;No. 81470815;No. 81500414);山東省優秀中青年科學家科研獎勵基金資助項目(No. BS2014YY009);青島市公共領域科技支撐計劃(No.14-2-3-3-nsh)
通訊作者△Tel: 0532-82991713; E-mail: xu.luo@163.com
[中圖分類號]R363
[文獻標志碼]A
doi:10.3969/j.issn.1000- 4718.2016.01.008

