探討ⅢA-N2期NSCLC原發瘤體與N2淋巴結及外周血中EGFR基因突變的差異性
李喆 郭建峰 楊楊 劉延風 許瑞彬 戎鐵華 張蘭軍
?
·臨床研究與應用·
探討ⅢA-N2期NSCLC原發瘤體與N2淋巴結及外周血中EGFR基因突變的差異性
李喆①郭建峰①楊楊①劉延風①許瑞彬①戎鐵華②張蘭軍②
摘要目的:探討ⅢA-N2期非小細胞肺癌(non-small cell lung cancer,NSCLC)原發瘤體、N2淋巴結及外周血中表皮生長因子受體基因(epidermal growth factor receptor,EGFR)突變狀況是否存在差異性,從基因層面為目前所提倡的“個體化醫療”提供一些有價值的參考指標。方法:用突變富集—液相芯片法檢測中山大學腫瘤防治中心及延安大學附屬醫院2014年11月至2015年11月間手術切除并經病理證實49例病理分期為ⅢA-N2期的NSCLC原發瘤體、N2淋巴結及外周血中EGFR基因19號及21號外顯子突變狀況,并對檢測結果整理分析。結果:49例患者中,有18例(36.7%)從原發瘤體中檢測出EGFR基因突變,11例(22.4%)從N2淋巴結中檢測出EGFR基因突變,而從外周血中僅有2例(4.1%)檢測出EGFR基因突變;其中9例僅有原發瘤體中EGFR基因突變,2例僅有N2淋巴結中EGFR基因突變;而外周血中檢測出EGFR基因突變的2例,同時也在原發瘤體及N2淋巴結中檢測出EGFR基因突變。結論:在NSCLC原發瘤體及轉移淋巴結中EGFR基因突變狀況存在一定的差異性;在ⅢA-N2期NSCLC患者外周血中,EGFR基因突變檢出率較低。以上結果提示腫瘤在轉移過程中從分子水平上可能已經發生改變,存在一定的差異性,為今后EGFR-TKIs治療NSCLC乃至于其他針對基因靶點的個體化治療提供有價值的思考。
關鍵詞非小細胞肺癌表皮生長因子受體基因突變突變富集—液相芯片
肺癌目前已成為全球惡性腫瘤相關死亡的首要原因,特別是在一些大城市[1]。在肺癌中,非小細胞肺癌(non-small cell lung cancer,NSCLC)是最常見的病理類型,約占80%左右[2]。表皮生長因子受體基因(epiclermal growth factor receptor,EGFR)突變的晚期NSCLC患者從EGFR-TKIs治療中獲益,開創了NSCLC靶向治療的新時代[3-4],目前服用EGFR-TKIs治療晚期NSCLC的必要前提是檢測EGFR基因是否存在突變。雖然EGFR基因突變的類型很多,但大多數集中在19號外顯子的缺失和21號外顯子的L858R錯義突變上,并且容易出現在亞裔、女性、不吸煙、腺癌的患者中[5-6];而具有這些臨床特性的患者也被證實能更好的從EGFR-TKIs治療中獲益[7]。然而,并不是每一例患者都能從EGFR-TKIs治療中獲益,即便是他的EGFR基因是突變的。這就表明,EGFR基因突變不僅與一些臨床特性存在關聯性,更有可能與分子水平存在異質性。對于大多數服用EGFR-TKIs治療的患者來說,雖然他們已是被證實轉移的晚期病例,但所用來檢測EGFR基因突變的標本卻是原發瘤體。EGFR基因突變狀況在腫瘤原發灶和轉移淋巴結及遠處轉移灶之間是否存在一致性呢?一些學者研究發現NSCLC原發灶與轉移淋巴結間有相當一部分存在EGFR突變不一致性,不一定原發灶有EGFR突變轉移淋巴結就一定突變,淋巴結有EGFR突變原發灶亦有可能沒有突變[8]。也有不少研究組織在晚期NSCLC患者外周血液中檢出相當比例的EGFR突變[9-10]。在本研究中,用突變富集-液相芯片法檢測中山大學腫瘤醫院中心及延安大學附屬醫院2014年11月至2015年11月間49例病理分期為ⅢA-N2期的NSCLC原發瘤體、N2淋巴結及外周血中EGFR基因19號及21號外顯子突變狀況,并對檢測結果進行整理及分析。
1 材料與方法
1.1病例資料
收集中山大學腫瘤防治中心及延安大學附屬醫院2014年11月至2015年11月間手術切除并經病理證實且分期為ⅢA-N2期的49例患者的NSCLC原發瘤體、N2淋巴結、術前外周血標本及完整病例資料。所有患者術前均未行任何抗腫瘤治療(包括化療、靶向治療及放療)。這些患者的中位年齡為57.6(36~74)歲,其中71.4%(35/49)為男性。所有患者的病理分型均按照世界衛生組織(WHO)的標準進行劃分,其中腺癌41例(83.7%),鱗癌8例(16.3%)。49例患者中,有30例曾經有吸煙史占61.2%,剩余19例占38.8%未曾吸煙。
1.2EGFR基因突變檢測
本研究與廣州益善生物技術有限公司合作,用突變富集-液相芯片技術對所有標本進行EGFR基因19、21外顯子突變檢測。組織樣本首先用DNA提取試劑盒進行DNA抽提,以抽提好的DNA為樣本,首先通過多重PCR獲得各基因外顯子上含有常見等位基因型的基因片段,PCR反應體系為水13.8 μL,5× PCR緩沖液10 μL,25 mM MgCl24 μL,dNTP混合液2 μL,各基因外顯子引物混合液10 μL,DNA聚合酶0.2 μL,樣品10 μL,PCR反應條件為52℃退火溫度30循環;然后將PCR產物經核酸外切酶酶切及堿性磷酸酶水解,去除多余的引物和dNTP,反應體系為核酸外切酶0.5 μL,堿性磷酸酶0.5 μL,2×緩沖液10 μL,PCR產物9 μL,37℃酶切水解反應2 h;產物再以等位基因特異引物延伸(allele specific primer extension,ASPE)引物上的特異性序列特異的識別各等位基因型,并形成延伸產物(Product),ASPE反應體系為水7.8 μL,10×PCR緩沖液2 μL,25 mM MgCl20.5 μL,dNTP(不含dCTP)混合液1 μL,生物素標記的dCTP 0.5 μL,各等位基因型引物混合液5 μL,DNA聚合酶0.2 μL,酶切水解產物3 μL,ASPE反應條件為56℃退火溫度30循環;ASPE引物上的Tag序列與聚苯乙烯微球上的Anti-Tag序列特異結合,即雜交反應,雜交反應體系為微球12 μL,雜交液33 μL,ASPE產物5 μL,雜交體系經95℃變性3 min,37℃雜交30 min后加入25 μL SA-PE工作液,繼續37℃反應10 min,用Luminex 200系統分析每個樣品的熒光值。
1.3統計學分析
采用Χ2檢驗分析EGFR基因突變與各臨床特征之間的關系;Spearman秩相關系數(Spearman's ρ)被用來判斷原發瘤體與N2淋巴結中EGFR基因突變之間是否存在關聯性,檢驗方法為Pearson's correlation test,當Spearman's P≥0.70時兩者被認為存在較強關聯性。在所有統計學分析中,以P<0.05為差異具有統計學意義。
2 結果
2.1病例臨床特征
所納入的49例患者中位年齡57.6(36~74)歲,35例為男性,占71.4%;有吸煙史的患者30例(61.2%);腺癌41例(83.7%),鱗癌8例(16.3%)。所有患者均行肺癌根治術(原發瘤體肺葉完整切除+縱隔淋巴結清掃),并經術后病理證實為NSCLC且分期為ⅢA-N2期。所有患者術前均未行任何抗腫瘤治療(包括化療、靶向治療及放療)(表1)。
2.249例患者原發瘤體和N2淋巴結及外周血中EGFR基因突變情況
所有標本均采用突變富集-液相芯片法檢測EGFR基因19、21外顯子是否存在突變。其中原發瘤體中EGFR基因突變檢出率為36.7%(18/49),N2淋巴結檢出率為22.4%(11/49),外周血中為4.1%(2/49)。在檢出EGFR基因突變的原發瘤體中,19外顯子片段缺失突變及21外顯子氨基酸置換突變均占50%(9:9);而在EGFR基因突變的N2淋巴結中,19及21外顯子突變比例為6:5;在所檢出EGFR基因突變的2例外周血標本中,均為21外顯子氨基酸置換突變(表2)。

表1 49例患者臨床特征Table 1 Patients'characteristics
2.3分析比較EGFR基因突變在原發瘤體和N2淋巴結及外周血中的差異性
在配對的原發瘤體與N2淋巴結中,EGFR基因突變存在22.4%(11/49)的差異:9例(18.4%)原發瘤體中存在突變,而N2淋巴結中未檢出;2例(4.1%)N2淋巴結中存在EGFR基因突變,卻在原發瘤體中未檢出。用Pearson's correlation test進行分析,EGFR基因在原發瘤體與N2淋巴結中的突變狀況無明顯統計學上關聯性(Spearman's P=0.503,P<0.001)。然而,外周血中檢測出EGFR基因突變的2例,同時也在原發瘤體及N2淋巴結中檢測出突變。
2.4EGFR基因突變與患者臨床特征之間的關系
采用Χ2檢驗分析EGFR基因突變與各臨床特征之間的關系,發現在原發瘤體檢出的EGFR基因突變與女性(P=0.001)、不吸煙者(P=0.002)之間存在統計學上的相關性;突變雖然在腺癌中的檢出率高于鱗癌(41.5%vs.12.5%),但是卻與腺癌沒有表現出明顯統計學上的相關性(P=0.229)。在N2淋巴結中檢出的RGFR基因突變與不吸煙這一臨床特征之間存在統計學上的相關性(P=0.001),與其他臨床特征無關。
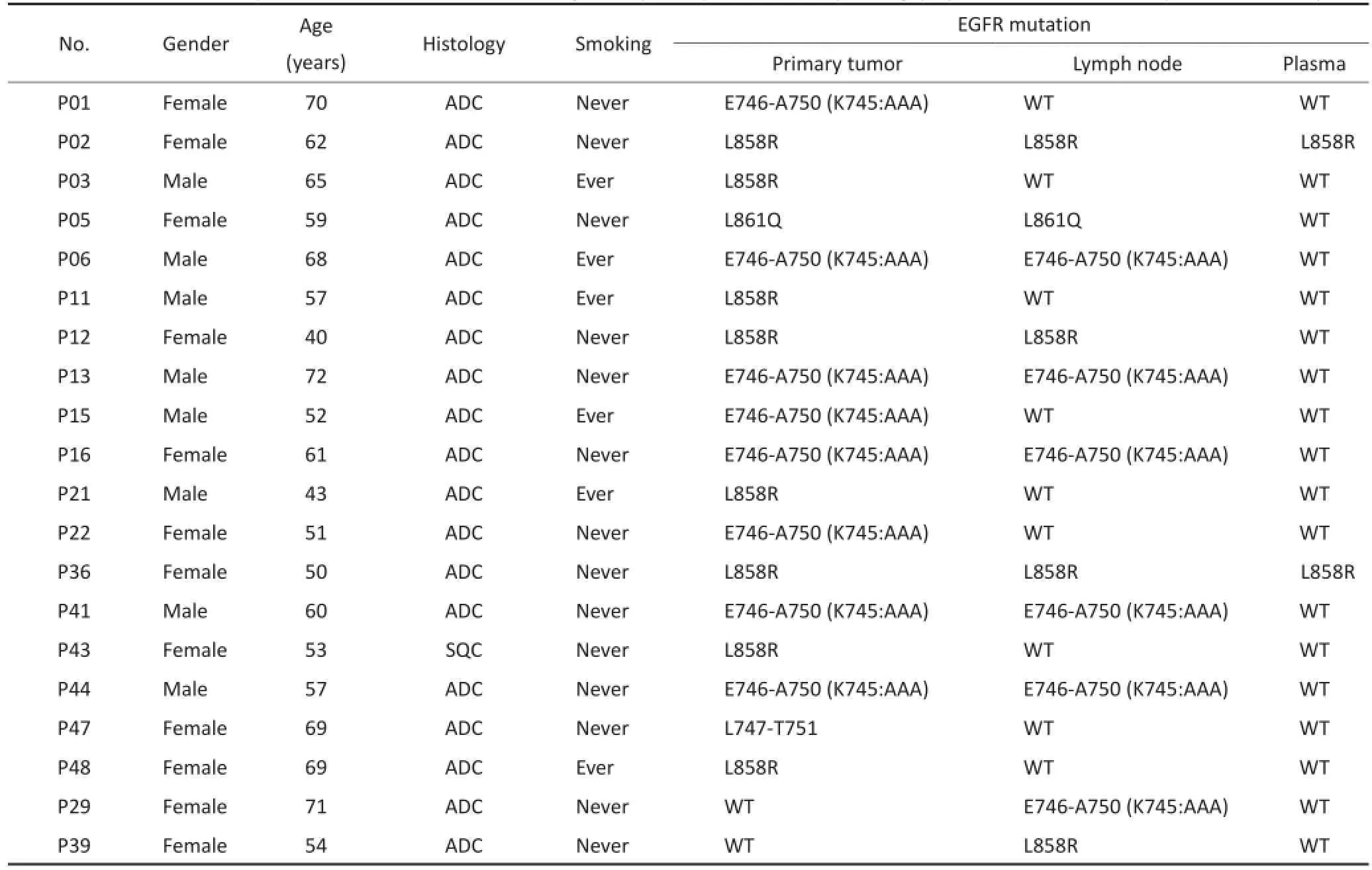
表2 EGFR基因在原發瘤體與N2淋巴結外周血中突變情況Table 2 Mutations in the tyrosine kinase domain of the EGFR gene in primary tumor,corresponding lymph node metastasis and plasma DNA samples
3 討論
本研究采用突變富集-液相芯片法對配對的NSCLC原發腫瘤組織、N2淋巴結及外周血標本中EGFR基因突變情況進行比較分析,發現EGFR基因在同一例患者NSCLC原發瘤體、N2淋巴結及外周血中存在一定的差異性。Park等[8]首先報道應用DNA直接測序法和定量的異源雙鏈分析法檢測EGFR基因在101例配對的NSCLC原發灶與轉移淋巴結中的突變狀態,發現腫瘤細胞轉移至淋巴結后并不是像原發瘤體一樣具有相同的EGFR基因突變。Schmid等[11]用直接雙向測序法對96例配對的肺腺癌原發灶與轉移淋巴結中的EGFR/KRAS/BRAF突變狀態進行檢測分析,發現這些基因在腺癌原發瘤體與周圍轉移淋巴結中突變狀態存在一定的不一致性。Chang等[12]用免疫組織化學法和DNA直接測序法對56例配對的NSCLC原發灶與轉移淋巴結中的p53及EGFR基因表達及突變情況進行檢測分析,發現NSCLC原發灶與轉移淋巴結之間p53及EGFR基因狀態存在明顯的不一致性。Sun等[13]對80例配對的NSCLC原發灶與轉移淋巴結中的KRAS及EGFR基因突變狀態用直接測序法進行檢測分析,發現華人NSCLC患者原發瘤體與周圍轉移淋巴結中KRAS及EGFR基因突變狀態存在相當比例的異質性。Bai等[9]對230例晚期NSCLC患者的配對組織和血漿中EGFR突變情況用變性高效液相色譜技術(DHPLC)進行檢測分析,結果顯示組織標本和外周血的一致性為78%,而以組織標本檢測為金標準,外周血EGFR突變檢測的假陽性為18.8%,假陰性20.2%。外周血EGFR突變預示良好的療效與無病進展生存期。這是迄今為止樣本量最大的一組報道,提示外周血檢測具有可行性。其后續研究在樣本量達到800例時,2種標本的一致性仍近70%。Massuti等[14]對著名的SLOG研究進行的回顧性外周血游離DNA檢測分析,發現350例晚期NSCLC中,164例有配對的外周血標本中EGFR突變的一致性為59.1%(97/164),假陰性率為40.9%,且無假陽性。
目前對EGFR基因突變進行檢測的方法很多,包括直接測序法、DHPLC法(變性高效液相色譜法)、ARMS法(突變特異性擴增系統)、突變富集-液相芯片技術、熒光標記PCR產物法以及PCR taqman分析法等。雖然直接測序法被廣泛的用來檢測RGFR基因突變,且在容易產生假陰性的腫瘤細胞少于30%的標本中還可以被用來檢測突變[15],但是此法靈敏度較低,不適合檢測福爾馬林固定和石蠟包埋標本中一些基因的體細胞突變情況,也不能檢測血漿樣本[16]。廣州益善生物技術有限公司所采用的突變富集-液相芯片技術的靈敏度非常高,達到0.1%[17],可用來檢測NSCLC患者血清或血漿中游離DNA的體細胞突變情況。在本研究中,與廣州益善生物技術有限公司合作用突變富集-液相芯片技術檢測NSCLC患者原發瘤體、轉移淋巴結及外周血標本中EGFR基因突變狀況。
對腫瘤異質性的研究清楚地表明在多種人類腫瘤細胞群中存在廣泛的細胞遺傳學、基因遺傳學及表觀遺傳學上的變化[18],腫瘤細胞群在不同轉移部位的異質性也被發現[19]。
本研究采用突變富集-液相芯片技術檢出的EGFR突變狀況至少可以說明NSCLC轉移后的癌細胞在基因層面不一定能與原發瘤體保持一致性。雖然之前提到的3項研究顯示NSCLC原發腫瘤組織與外周血中EGFR突變率一致性較高,而本研究的一致性只有11.1%(2/18),原因可能是本研究所選用的為手術的ⅢA-N2期的NSCLC患者標本。除此在不同組織中EGFR突變狀態存在差異外,EGFR突變易發生在女性、腺癌、不吸煙者的NSCLC患者中,與臨床病理特征密切相關。
盡管本研究與之前的部分研究不一致,但EGFR基因突變在原發瘤體與轉移灶之間的異質性研究結果也能為針對EGFR基因的靶向治療提供一些思考,對于在靶向治療前基因檢測標本的選擇,特別是EGFR基因突變在原發瘤體與轉移灶之間的差異是否影響EGFR-TKI治療的效果有待進一步的研究。
參考文獻
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2]Govindan R,Page N,Morgensztern D,et al.Changing epidemiology of small-cell lung cancer in the United States over the last 30 years:Analysis of the surveillance,epidemiologic,and end results database[J].J Clin Oncol,2006,24(28):4539-4544.
[3]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib[J].N Engl J Med,2004,350(21):2129-2139.
[4]Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[5] Janne PA,Engelman JA,Johnson BE.Epidermal growth factor receptor mutations in non-small-cell lung cancer:implications for treatment and tumor biology[J].J Clin Oncol,2005,23(14):3227-3234.
[6]Mitsudomi T,Kosaka T,Yatabe Y.Biological and clinical implications of EGFR mutations in lung cancer[J].Int J Clin Oncol,2006,11(13):190-198.
[7] Shepherd FA,Rodrigues Pereira J,Ciuleanu T,et al.Erlotinib in previously treated non-small-cell lung cancer[J].N Engl J Med,2005,353(2):123-132.
[8] Park S,Holmes-Tisch AJ,Cho EY,et al.Discordance of molecular biomarkers associated with epidermal growth factor receptor pathway between primary tumors and lymph node metastasis in nonsmall cell lung cance[J].J Thor Oncol Offic Public Int Associ Study Lung Cuncer,2009,4(4):809-815.
[9]Bai H,Mao L,Wang HS,Zhao J,et al.Epidermal growth factor receptor mutations in plasma DNA samples predict tumor response in Chinese patients with stagesⅢB toⅣnon-small-cell lung cancer [J].J Clin Oncol,2009,27(16):2653-2659.
[10]Li XF,Ren RX,Ren SX,et al.Peripheral Blood for Epidermal Growth Factor Receptor Mutation Detection in Non-Small Cell Lung Cancer Patients[J].Transl Oncol,2014,7(3):341-348.
[11]Schmid K1,Oehl N,Wrba F,et al.EGFR/KRAS/BRAF mutations in primary lung adenocarcinomas and corresponding locoregional lymph node metastases[J].Clin Cancer Res,2009,15(14):4554-4560.
[12]Chang YL,Wu CT,Shih JY,et al.Comparison of p53 and epidermal growth factor receptor gene status between primary tumors and lymph node metastases in non-small cell lung cancers[J].Ann Surg Oncol,2011,18(2):543-550.
[13]Sun L,zhang Q,Luan H,et al.Comparison of KRAS and EGFR gene status between primary non-small cell lung cancer and local lymph node metastases:implications for clinical practice[J].José Garcia De Castro Valdés,2012,102(36):971-984.
[14]Massuti B,Morán T,Porta R,et al.Multicenter prospective trial of customized Erlotinib for advanced non-small cell lung cancer (NSCLC)patients(p)with epidermal growth factor receptor(EGFR)mutations:Final results of the Spanish Lung Cancer Group(SLCG) trial[J].J Clin Oncol(Meeting Abstracts),2009,27(15s):8023.
[15]Fan X,Furnari FB,Cavenee WK,et al.Non-isotopic silver-stained SSCP is more sensitive than automated direct sequencing for the detection of PTEN mutations in a mixture of DNA extracted from normal and tumor cells[J].Int J Oncol,2001,18(15):1023-1026.
[16]Tsuchihashi Z,Dracopoli NC.Progress in high throughput SNP genotyping methods[J].Pharmacogenomics J,2002,2(2):103-110.
[17]Wu S,Zhu Z,He J,et al.A novel mutant-enriched liquidchip technology for the qualitative detection of somatic mutations in KRAS gene from both serum and tissue samples[J].Clin Chem Lab Med,2010,48(8):1103-1106.
[18]Takahashi K,Kohno T,Matsumoto S,et al.Clonality and heterogeneity of pulmonary blastoma from the viewpoint of genetic alterations:a case report[J].Lung cancer,2007,57(1):103-108.
[19]Gallegos Ruiz MI,van Cruijsen H,Smit EF,et al.Genetic heterogeneity in patients with multiple neoplastic lung lesions:a report of three cases[J].J Thorac Oncol,2007,2(1):12-21.
(2016-03-25收稿)
(2016-05-025修回)
(編輯:楊紅欣校對:孫喜佳)
Epidermal growth factor receptor mutations in primary tumors,N2 lymph nodes,and plasma samples in Chinese patients with stageⅢA-N2 non-small cell lung cancer
Zhe LI1,Jianfeng GUO1,Yang YANG1,Yanfeng LIU1,Ruibin XU1,Tiehua RONG2,Lanjun ZHANG2
Correspondence to:Lanjun ZHANG;E-mail:zhlanj@mail.sysu.edu.cn
1Department of Thoracic Surgery,Yan'an University Affiliated Hospital,Yan'an 716000,China;2Department of Thoracic Surgery,State Key Laboratory of Oncology in South China,Sun Yat-Sen University Cancer Center,Guangzhou 510060,China
AbstractObjective:Mutations in epidermal growth factor receptor(EGFR)can predict tumor response to tyrosine kinase inhibitors (TKIs)in non-small cell lung cancer(NSCLC).However,not all cases of NSCLC with EGFR mutations can respond well;thus,discovering the heterogeneity of NSCLC at the molecular level is necessary.This study aimed to determine the discrepancy in EGFR mutations in primary tumors,N2 lymph nodes,and plasma samples.Methods:Primary tumors,N2 lymph nodes,and plasma samples obtained from 49 patients with stageⅢA-N2 NSCLC were analyzed for EGFR mutations in exons 19 and 21 by using mutant-enriched liquidchip technology.Results:In 49 patients,we detected 18(36.7%)EGFR mutations in primary tumors,11(22.4%)mutations in N2 lymph nodes,and 2(4.1%)mutations in plasma samples.Eleven(22.4%)cases showed discordance in EGFR mutations between primary tumors and N2 lymph nodes.In nine cases,EGFR mutations were detected only in primary tumors,whereas EGFR mutations were detected only in N2 lymph nodes in two cases.In addition,EGFR mutations were detected in the plasma samples of two patients,who also carry mutations in their primary tumors.Conclusion:A considerable proportion of NSCLC cases showed discrepancy in EGFR mutations between primary tumors and N2 lymph nodes.In addition,the detection rate of EGFR mutations was lower in plasma samples obtained from patients with stage IIIA-N2 NSCLC.All of the results indicated tumor heterogeneity at the molecular level during metastasis,and this heterogeneity may have implications during treatment with TKIs.
Keywords:non-small cell lung cancer,epidermal growth factor receptor,gene mutation,mutant-enriched liquidchip technology
doi:10.3969/j.issn.1000-8179.2016.12.347
作者單位:①延安大學附屬醫院胸外科(陜西省延安市716000);②中山大學腫瘤防治中心胸科,華南腫瘤學國家重點實驗室
通信作者:張蘭軍zhlanj@mail.sysu.edu.cn
作者簡介
李喆專業方向為胸部腫瘤臨床與實驗研究。E-mail:shuangjixiu@126.com

·讀者·作者·編者·

