33例兒童非傷寒沙門菌腸炎臨床分析及耐藥監測
蔡和花 李樺 王慧 楊莉莉
(1.成都市第三人民醫院暨重慶醫科大學附屬成都第二臨床學院兒科,四川 成都 610031;2.成都市第三人民醫院暨重慶醫科大學附屬成都第二臨床學院檢驗科,四川 成都 610031)
?
33例兒童非傷寒沙門菌腸炎臨床分析及耐藥監測
蔡和花1李樺1王慧1楊莉莉2△
(1.成都市第三人民醫院暨重慶醫科大學附屬成都第二臨床學院兒科,四川 成都610031;2.成都市第三人民醫院暨重慶醫科大學附屬成都第二臨床學院檢驗科,四川 成都610031)
摘要目的:探討兒童非傷寒沙門菌腸炎臨床特征、血清型及耐藥性。方法:對我院2012年11月至2015年11月經糞便培養確診為非傷寒沙門菌腸炎的33例患兒進行回顧性分析,探討其臨床特征、血清分型、耐藥性等。結果:本組病例發病以嬰幼兒多見,發病季節多集中在5-10月,所有患兒均有腹瀉,且大部分以腹瀉起病,其中28例患者伴發熱,血清型以腸炎沙門菌、鼠傷寒沙門菌為主(39.39%;36.36%)。美洛培南、亞胺培南幾乎無耐藥發生,腸炎沙門菌及鼠傷寒沙門菌對三代頭孢菌素產生不同程度耐藥(分別為7.69%和16.67%)。部分感染患兒經頭孢噻肟(13例),頭孢曲松 (11例)治療效果良好。9例難治性患兒升級抗生素或聯合用藥治療后療效尚滿意。結論:糞便培養是確診非傷寒沙門菌性腸炎的重要方法,結合藥敏試驗選擇敏感抗生素治療,可取得良好效果。
關鍵詞:非傷寒沙門菌;耐藥性;兒童;鼠傷寒;腸炎沙門菌
沙門菌感染是全球社區獲得性細菌性腸炎的主要原因,也是兒童腹瀉的主要病因[1]。由于該細菌的廣泛分布、多藥耐藥性以及對環境的適應性及耐受性強等特點,使得沙門菌感染不易得到很好的控制[2]。非傷寒沙門菌(Non-typhoid salmonella,NTS)感染是指除傷寒、副傷寒沙門菌以外的沙門菌引起的感染,是沙門菌感染的主要類型,臨床上主要表現為胃腸炎及菌血癥。本文回顧分析2012年11月至2015年11月經糞便培養確診為非傷寒沙門菌腸炎患兒的臨床及實驗室資料,探討其臨床特征、血清分型、耐藥情況等。
1臨床資料和方法
1.1研究對象
收集2012年11月至2015年11月,在我院兒科住院經糞便培養證實為非傷寒沙門菌腸炎的33例兒童患者,所有患兒同時行血培養檢查。男性17例,女性16例;中位年齡1歲3月(9月-12歲)。分析其臨床、實驗室資料。
1.2儀器與試劑
全自動血培養儀購自法國Bio-Merieux公司;Microscan96全自動細菌鑒定分析儀購自美國德靈公司;血平板、麥康凱平板、SS平板購自重慶龐通公司。
1.3細菌分離鑒定及藥敏試驗
細菌培養、分離及鑒定按照《全國臨床檢驗操作規程》第3版進行操作。藥敏試驗使用Microscan96全自動細菌藥敏儀,按照美國臨床實驗室標準化協會(CLSI)(2012年)標準進行判斷。
1.4統計學分析
采用SPSS 16.0軟件進行數據分析。對不同血清型抗生素耐藥率采用 Fisher確切概率法,P<0.05為差異有統計學意義。
2結果
2.1一般臨床特征
共收集33例大便培養陽性的非傷寒沙門菌感染患兒,其中2例血培養亦陽性。男性17例,女性16例。發病年齡小于1歲12例(36.36%,12/33),1-5歲18例(54.55%,18/33)5-10歲2例(6.06%,2/33),11-15歲1例(3.03%,1/33)。中位年齡1歲3月(9月-12歲)。5-10月份發病率(72.73%,24/33)高于11-次年4月份(27.27%,9/33)。33例患兒發病初期和(或)病程中均有腹瀉,大便性狀多變,可為水樣便、蛋花湯樣便、粘液便、膿血便等。其中28例(84.85%,28/33)合并有發熱。其他癥狀包括腹痛6例(18.18%,6/33),不同程度脫水6例(18.18%,6/33),驚厥4例(12.12%,4/33),電解質紊亂7例(21.21%,7/33)。約半數患兒合并腸道菌群失調,7例合并呼吸道感染(21.21%,7/33)。所有病例均給予靜脈途徑抗感染治療(多為第三代頭孢菌素),其中7例因對第三代頭孢菌素耐藥,2例合并其他系統疾病,根據藥敏換藥(美洛培南或亞胺培南等)或聯合抗感染,治療后臨床癥狀均緩解。但耐藥菌株中部分患兒病程遷延、病情反復。中位住院時間13天(5-21天),中位退熱時間4天(1-6天),中位大便成形時間8天(3-15天)。23例一般情況恢復,大便成形,至少2次復查大便培養陰性后出院;10例靜脈輸液療程不足,病情好轉自動出院,其中6例出院后繼續口服藥物序貫治療。
2.2血清分型
33株非傷寒沙門菌分離自33例感染患兒,其中3例患兒大便培養同時分離出念珠菌(白色念珠菌、熱帶念珠菌、光滑念珠菌各1例)。經細菌分離鑒定,主要的血清型為腸炎沙門菌(39.39%,13/33),鼠傷寒沙門氏菌(36.36%,12/33),其次分別為:都柏林沙門氏菌3例(9.09%,3/33),湯卜遜沙門菌2例(6.06%,2/33),斯坦利沙門氏菌1例(3.03%,1/33),莫斯科沙門菌1例(3.03%,1/33),利物浦沙門氏菌1例(3.03%,1/33)。各血清型分布及構成比見表1。

表1 33例非傷寒沙門菌血清型分布及構成比
2.3大便常規、白細胞計數及CRP水平
所有患兒大便常規均有不同程度白細胞、膿細胞、紅細胞。在發病后(使用抗生素前)均采集標本行血常規、CRP檢查。中位白細胞計數12.2×109·L-1(4.6-29.3×109·L-1),大于20×109·L-1有3例,(10-19.9)×109·L-1有17例,12例在正常范圍,見表2。大部分患兒中性粒細胞比例增高,見表3。中位CRP水平23mg/L(1.0-180 mg·L-1)。4例患兒CRP明顯增高(大于100 mg·L-1),3例患兒CRP在正常范圍(<5 mg·L-1)。

表2 33例非傷寒沙門菌感染患兒血白細胞計數分布

表3 33例非傷寒沙門菌感染患兒血中性粒細胞比例分布
2.4藥敏試驗
33株非傷寒沙門菌的藥敏結果顯示:頭孢噻肟耐藥7株(21.21%,7/33),頭孢曲松耐藥7株(21.21%,7/33),1株對哌拉西林他唑巴坦耐藥(3.03%,1/33),2株對阿莫西林/棒酸、替卡西林/棒酸耐藥(6.06%,2/33),尚未發現對亞胺培南、美洛培南、左旋氧氟沙星耐藥的菌株,見表4。腸炎沙門菌與鼠傷寒沙門氏菌對同種抗生素耐藥率相似,通過Fisher確切概率法,所有抗生素耐藥性二者差異無統計學意義。其他類型的非傷寒沙門菌耐藥率較高,但由于菌株不同且例數少,未行統計學分析。
3討論
非傷寒沙門菌腸炎主要發生在2歲以下兒童[3],1歲以內嬰兒發病率比普通人群高達10倍[4]。而5歲以下兒童的發病率高于5-15歲[5]。這些差異與血清型無關。在西方國家,1歲以內嬰兒發病率最高[6]。我們的研究中,90.91%發生于5歲以下兒童,但1歲以內嬰兒發病率小于1-5歲。可能與家長對嬰兒飲食衛生較注意,其室外活動較1-5歲兒童少,感染機會更少有關。非傷寒沙門菌感染主要由食源性傳播,也可通過接觸感染動物或院內暴露感染[7]。不同年齡兒童感染率的差異可能與生活方式、飲食、外界環境的不同,以及與貓及其他爬行動物接觸的多少等因素有關[8]。
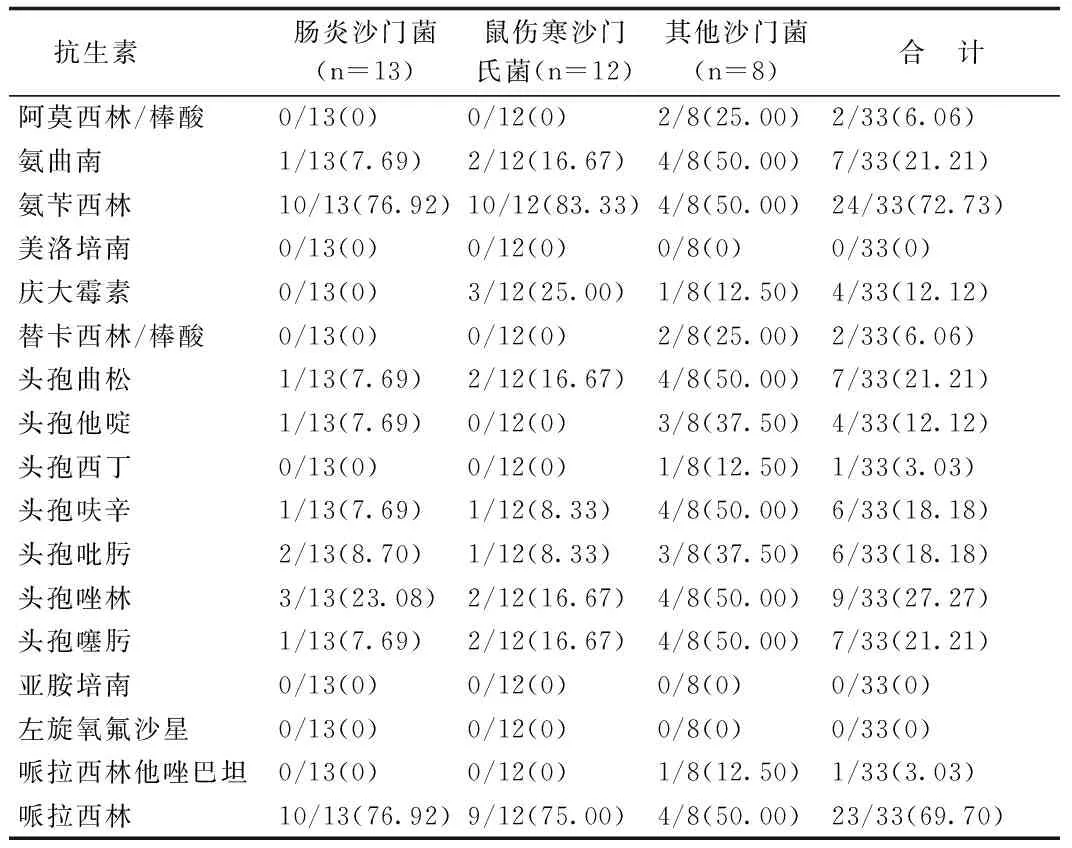
表4 33株非傷寒沙門菌對抗生素的耐藥率(%)
有研究表明,9-11月份是非傷寒沙門菌感染的發病高峰[9]。也有研究提出發病高峰在5-10月份[10]。而在本研究中,發病季節性集中在7-10月。這些區別可能與地域差異有關。本研究中外周血象白細胞不同程度增高或正常,大部分患兒CRP增高,表明外周血象無特異性診斷價值。有研究表明CRP明顯增高(大于100 mg·L-1)的患兒發生并發癥的幾率更高,多需給予經驗性抗菌治療[11]。非傷寒沙門菌感染性胃腸炎臨床主要表現為急性發熱,畏寒,惡心,嘔吐,腹痛及腹瀉[12],本研究中最常見的癥狀為腹瀉、發熱,部分患兒有嘔吐、腹痛。腸炎沙門菌感染臨床表現與傷寒相似,包括發熱、腹痛等,與其他非傷寒沙門菌感染相比,平均發病年齡更大[10]。這與我們的的研究結果一致。鼠傷寒沙門菌好發于嬰幼兒,易在其他疾病基礎上發病,對抗菌藥物的耐藥性高于其他沙門菌[4]。但我們的研究中,鼠傷寒沙門菌耐藥性與腸炎沙門菌差異無統計學意義,可能與樣本量小有關。值得一提的是,在體外實驗中,各型非傷寒沙門菌對二代頭孢菌素、頭霉素、氨基糖苷類抗生素的耐藥率較低,但臨床療效差,不推薦使用。體內外差異相關機制有待進一步大樣本多中心研究。
近年來,沙門菌對抗菌藥物耐藥性越來越嚴重,已經成為國內外研究者最為關心的問題。由于沙門菌感染是人畜共患病,為預防、治療疾病和促進畜禽生長,抗生素廣泛添加到動物飼料中,亦可能致使沙門菌耐藥性不斷上升[13]。在33例患兒中共6例患兒大便培養出多藥耐藥菌株,腸炎沙門菌、鼠傷寒沙門菌、莫斯科沙門菌、都柏林沙門菌、伊魯幕沙門菌各1株。該6例患兒中僅1例單用頭孢噻肟臨床效果良好未換藥,治愈出院。其他患兒均因病程遷延換敏感抗生素或聯合用藥,最終4例臨床癥狀緩解。有1例大便常規陰性后停用抗生素,僅使用微生態制劑、腸粘膜保護劑等輔助藥物治療,雖反復大便培養陽性,最終臨床癥狀緩解。耐藥菌株中,除莫斯科沙門菌、鼠傷寒沙門菌反復多次大便培養仍陽性外,其他均達到連續2次大便培養陰性的出院標準。大便培養不能轉陰的原因可能與年齡因素、癥狀性感染、長時間的抗生素治療等有關。所以臨床上在有力的敏感抗生素治療后效果仍欠佳時,或許可考慮停藥觀察。有研究表明,鼠傷寒沙門菌排菌時間較其他菌株更長[14]。5歲以下兒童中位排泄時間約7周,其中18%在6個月時大便培養仍可陽性;5歲以上兒童中位排泄時間3-4周,僅0.3%在6月時培養呈陽性[14]。
非傷寒沙門菌持續排菌超過1年稱為慢性攜菌狀態[15],在5歲以下兒童發生率為2.6%,5歲以上發生率為0.3%[14]。抗菌藥物一般不推薦用于簡單的非傷寒沙門菌感染的治療。因為抗菌藥物的應用可能抑制腸道正常菌群,延長沙門氏菌的排泄,有增加慢性攜菌狀態的風險[16]。本研究中部分患者培養出念珠菌,可能由于廣譜抗生素,導致腸道菌群失調,使得念珠菌大量繁殖所致。然而,一些研究表明,抗感染治療可改善臨床癥狀,促進疾病更快地恢復[17]。對于社區獲得性細菌感染性腹瀉,在培養結果出來以前開始經驗性抗菌治療可減少1-2天的病程[18]。由此可見,臨床上可在補液、微生態制劑、腸粘膜保護劑等輔助治療基礎上,積極監測病原菌,科學、合理使用抗菌藥物,以減少多重耐藥現象,從而更好地預防和控制非傷寒沙門菌感染。
參考文獻
1Todd EC. Epidemiology of foodborne diseases: a worldwide review[J]. World Health Stat Q, 1997, 50(1-2): 30-50.
2Chen HM, Wang Y, Su LH, et al. Nontyphoid salmonella infection: microbiology, clinical features, and antimicrobial therapy[J]. Pediatr Neonatol, 2013, 54(3): 147-152.
3Olsen SJ, Bishop R, Brenner FW, et al. The changing epidemiology of salmonella: trends in serotypes isolated from humans in the United States, 1987-1997[J]. J Infect Dis, 2001, 183(5): 753-761.
4Cui S, Li J, Sun Z, et al. Characterization of Salmonella enterica isolates from infants and toddlers in Wuhan, China[J]. J Antimicrob Chemother, 2009, 63(1): 87-94.
5Park JH, Lee TJ. Clinical manifestations of salmonellosis in children during the last 12 years: a single institution experience[J]. Korean J Pediatr Infect Dis, 2013, 20(1): 1-8.
6Jones TF, Ingram LA, Fullerton KE, et al. A case-control study of the epidemiology of sporadic Salmonella infection in infants[J]. Pediatrics, 2006, 118(6): 2380-2387.
7Haeusler GM, Curtis N. Non-typhoidal Salmonella in children: microbiology, epidemiology and treatment[J]. Adv Exp Med Biol, 2013, 764(2): 13-26.
8Younus M, Wilkins MJ, Davies HD, et al. Case-control study of disease determinants for non-typhoidal Salmonella infections among Michigan children[J]. BMC Res Notes, 2010, 3(1): 1-9.
9Chae SJ, Lee DY. Prevalence and charateristics of Salmonella spp. in Korea, 2013. Public health weekly report[R]. Cheongju: Korea Centers for Disease Control and Prevention, 2014, 7: 385-390.
10Park HK, Rhie K, Yeom JS, et al. Differences in clinical and laboratory findings between group D and non-group D non-typhoidal salmonella gastroenteritis in Children[J]. Pediatr Gastroenterol Hepatol Nutr, 2015, 18(2): 85-93.
11Tsai MH, Huang YC, Lin TY, et al. Reappraisal of parenteral antimicrobial therapy for nontyphoidal Salmonella enteric infection in children[J]. Clin Microbiol Infect, 2011, 17(2): 300-305.
12Hammack T. Salmonella species. In: Lampel K A, ed. Bad bug book e handbook of foodborne pathogenic microorganisms and natural toxins. 2nd ed[M]. Washington DC: Food and Drug Administration, 2012, 12-6.
13Angulo FJ, Johnson KR, Tauxe RV, et al. Origins and consequences of antimicrobial-resistant nontyphoidal Salmonella: implications for the use of fluoroquinolones in food animals[J]. Microb Drug Resist, 2000, 6(1): 77-83.
14Buchwald DS, Blaser MJ. A review of human salmonellosis: II. Duration of excretion following infection with nontyphi Salmonella[J]. Rev Infect Dis, 1984, 6(3): 345-356.
15Corrado ML, Dupont HL, Cooperstock M, et al. Evaluation of new anti-infective drugs for the treatment of chronic carriage of Salmonella. Infectious diseases society of America and the food and drug administration[J]. Clin Infect Dis, 1992, 15 Suppl 1: S259-S262.
16Zulfiqar AB. Nontyphoidal salmonellosis. In: Kliegman RM, ed. Nelson textbook of pediatrics. 19th ed[M]. Philadelphia: Elsevier Saunders, 2011, 948-958.
17Mattila L, Peltola H, Siitonen A, et al. Short-term treatment of traveler's diarrhea with norfloxacin: a double-blind, placebo-controlled study during two seasons[J]. Clin Infect Dis, 1993, 17(4): 779-782.
18Dryden MS, Gabb RJ, Wright SK. Empirical treatment of severe acute community-acquired gastroenteritis with ciprofloxacin[J]. Clin Infect Dis, 1996, 22(6): 1019-1025.
Clinical analysisand antibacteria agent resistance monitoring of 33 cases of children with non-typhoid salmonella enteritis
CaiI He-hua1, Li Hua1, Wang Hui1, Yang Li-li2△
(1.Department of pediatrics; 2. Clinical laboratory, Chengdu Second Affiliated Hospital,Chongqing Medical University (Third People's Hospital of Chengdu), Sichuan Chengdu 610031)
AbstractObjective:To investigate the clinical characteristics, serotype and antibacteria agent resistance of non-typhoid salmonella enteritis in children. Methods: Thirty-three children patients diagnosed as non-typhoid salmonella (NTS) enteritis through stool cultures between November 2012 and November 2015 in our hospital were analyzed retrospectively, to explore the clinical characteristics, serotype and antibacteria agent resistance, etc. Results: The majority of cases were infants and young children. The seasonality of NTS enteritis was summer and autumn (May to October). All patients had diarrhea and most patient onset of diarrhea. Twenty-eight cases had fever. S. Enteritidis (39.39%) and S.Typhimurium (36.36%) were two main serotypes which isolated from cases. There was no strain resistance to meropenem and imipenem. We found that S. Enteritidis and S.Typhimurium exhibited varying resistance to the third-generation cephalosporin. Antimicrobial susceptibility tests of S. Enteritidis and S.Typhimurium detected resistance to the third-generation cephalosporin was 7.69% and 16.67%, respectively. Some infected children had good therapeutic effects with cefotaxime (13 cases) or ceftriaxone (11 cases). 9 refractory cases got satisfactory curative effect through upgrade antibiotics or combination therapy. Conclusion: Stool culture is an important method to confirm NTS enteritis. Taking the results of sensitivity test into consideration to select sensitive antibiotics could be effective.
Key Words:Non-typhoid salmonella; antibicteria ageut resistance; Children; Salmonella typhimurium; Salmonella enteritidis
作者簡介:蔡和花,女,醫師,主要從事兒科臨床診治工作, Email:37285717@qq.com。 △通訊作者:楊莉莉,女,副主任檢驗師,主要從事臨床微生物檢驗工作,Email:13668293235@163.com。
(收稿日期:2016-2-1)

