氧化苦參堿體外抑制胰腺星狀細胞激活和p38-MAPK mRNA表達
許威 陳凱 向曉輝 夏時海
?
·論著·
氧化苦參堿體外抑制胰腺星狀細胞激活和p38-MAPK mRNA表達
許威陳凱向曉輝夏時海
300162天津,武警后勤學院附屬醫院肝膽胰脾中心(消化二科)
【摘要】目的驗證氧化苦參堿(OM)在體外對胰腺星狀細胞(PSC)激活的抑制作用,探討其作用機制。方法觀察經不同濃度OM干預后大鼠PSC細胞株LTC-14在轉化生長因子β1(TGF-β1)誘導激活后的增殖能力,應用ELISA法檢測細胞超氧化物歧化酶(SOD)水平,用實時定量PCR法檢測細胞絲裂原激活蛋白激酶p38(p38-MAPK) mRNA表達量。結果對照組及0.1、0.5、1、2、5 g/L OM干預30 min后再加8 μg/L TGF-β1誘導組(OM組)細胞在培養12 h后的細胞增殖分別為1.51±0.08、1.50±0.07、1.15±0.04、1.15±0.04、1.08±0.06、1.08±0.10,0.5 g/L以上的OM組低于對照組,差異有統計學意義(P值均為0.000)。對照組、TGF-β1組及0.5、1 g/L OM組培養12 h后LTC-14細胞SOD的水平分別為0.087±0.005、0.073±0.004、0.085±0.010、0.086±0.007,各組間差異無統計學意義;p38-MAPK mRNA表達量分別為1.000±0.000、1.979±0.505、0.606±0.111、0.303±0.159,TGF-β1組顯著高于對照組(P=0.002),兩個OM組均低于TGF-β1組(P值均為0.000),但兩個OM組間差異無統計學意義(P=0.208)。結論OM體外能夠抑制PSC的激活,其作用機制可能是通過抑制p38-MAPK mRNA表達實現的。
【關鍵詞】氧化苦參堿;胰腺星狀細胞;激活;氧化應激;p38-MAPK
Fund program: National Natural Science Foundation of China(81173393);Tianjin Science and Technology Commission(12JCZDJC25500, 15JCQNJC45600);Innovative Team of Logistics University of the Chinese People′s Armed Police Forces(WHTD201310);Seed Fund of Affiliated Hospital of Logistics University of the Chinese People′s Armed Police Forces(FYM201114);Doctor′s Initial Fund of Logistics University of the Chinese People′s Armed Police Forces(WHB201515)
慢性胰腺炎(CP)以胰腺纖維化為主要病理特征,胰腺星狀細胞(pancreatic stellate cell,PSC)的激活是胰腺纖維化的關鍵過程[1]。有研究證實,氧化苦參堿(oxymatrine,OM)對肝臟等器官的纖維化有明顯的治療作用并已用于臨床[2],其作用機制可能是抑制肝星狀細胞的增殖。本課題組前期研究證實,OM能減輕CP大鼠的胰腺纖維化[3-4],但具體機制不明。本研究通過體外細胞實驗觀察OM對PSC激活的影響,探討氧化應激和絲裂原激活蛋白激酶p38(p38 mitogen-activated protein kinase,p38-MAPK)是否參與該過程。
材料與方法
一、材料及試劑
永生化的大鼠胰腺星狀細胞株LTC-14由德國Rostock大學醫院Jaster教授惠贈[5]。OM、MTT購于 Sigma公司。IMDM培養基購于Hyclone公司。胎牛血清購于Gibco公司。PCR逆轉錄試劑盒、實時定量PCR試劑盒購自北京全式金公司。超氧化物歧化酶(SOD) ELISA試劑盒購于德國IBL公司。
二、MTT法檢測PSC增殖狀況
LTC-14細胞復蘇后常規培養、傳代。取對數生長期細胞,以每孔103個細胞接種于96孔板,分別加入4、8、12、16、20 μg/L的TGF-β1,以不加TGF-β1的細胞為對照組,每組設3個復孔。分別培養6、12、24 h,加入MTT 5 mg/ml,繼續培養4 h后終止培養,甩盡培養液,加入150 ml DMSO,震蕩10 min,上酶標儀測每孔在570 nm波長處的吸光度值(A570值),篩選有效誘導PSC增殖的最小TGF-β1干預濃度及干預時長。
同樣取對數生長期細胞接種96孔板,分別加入0.1、0.5、1、2、5 g/L OM,以不加OM的細胞作為對照組,每孔設3個復孔。培養30 min后加入上述實驗篩選出的最小TGF-β1干預濃度培養6、12、24 h,加MTT繼續培養4 h,測各孔A570值,篩選抑制PSC增殖的最佳OM干預濃度及干預時長。
三、ELISA法檢測細胞SOD水平
按試劑盒說明書要求稀釋標準品后加入96孔板,取對數生長期細胞接種96孔板,根據上述實驗獲得的最佳OM干預濃度及干預時長處理30 min后用最小濃度TGF-β1誘導細胞(OM組),同時設單加TGF-β1的TGF-β1組及不加任何處理的對照組,每組設3個復孔。封板膜后37℃溫育30 min,棄培養液,用試劑盒里包含的洗滌液重復洗滌5次,每孔加入酶標試劑50 μl,37℃溫育30 min,洗滌5次,每孔先后加入顯色劑A和B各50 μl,輕輕振蕩混勻,37℃避光顯色10 min,加終止液50 μl終止反應,上酶標儀測各孔A450值。
四、實時PCR法檢測細胞p38-MAPK mRNA表達
查詢相關文獻和GenBank,用primer5.0軟件設計p38-MAPK引物,正義序列5′-CAGGAGCTGAACAAGACCGT-3′,反義序列5′-CCTGTAGGTCCTTTTGGCGT-3′,產物200 bp;內參β-actin正義序列5′-AGATCCTGACCGAGCGTGGC-3′,反義序列5′-CCAGGGAGGAAGAGGATGCG-3′,產物200 bp,由上海生工生物工程有限公司合成。采用Trazol抽提各組細胞總RNA,定量后逆轉錄為cDNA,按試劑盒說明書步驟應用 SYBR染料法在ABI7500實時PCR儀上擴增,繪制溶解和擴增曲線。通過儀器自帶軟件獲取Ct值,按公式2-ΔΔCt計算mRNA表達量。
五、統計學處理
結果
一、PSC增殖的變化
誘導PSC增殖的最小TGF-β1濃度為8 μg/L,誘導時間為12 h(表1)。
在OM干預30 min后以8 μg/L TGF-β1誘導LTC-14細胞。當誘導時間為6 h時各組細胞增殖水平差異無統計學意義(P=0.739);誘導時間為12、24 h、且OM濃度在0.5 g/L以上時細胞的增殖均低于對照組和0.1 g/L OM組(P值分別為0.000、0.001),而0.5 g/L以上的各OM組之間差異無統計學意義(表2)。
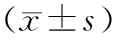
表1 不同濃度TGF-β1誘導后PSC的A570值
注:與對照組比較,aP<0.01;與4 g/L組比較,bP<0.01
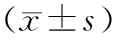
表2 不同濃度OM干預后PSC的A450值
注:與對照組比較,aP<0.01;與0.1 g/L組比較,bP<0.01
二、細胞SOD水平及變化
對照組、TGF-β1組及0.5、1 g/L OM組干預12 h后LTC-14細胞SOD的A450值分別為0.087±0.005、0.073±0.004、0.085±0.010、0.086±0.007,各組間差異無統計學意義(P=0.095)。
三、細胞p38-MAPK mRNA表達的變化
對照組、TGF-β1組及0.5、1 g/L OM組干預12 h后LTC-14細胞p38-MAPK mRNA表達量分別為1.000±0.000、1.979±0.505、0.606±0.111、0.303±0.159。TGF-β1組顯著高于對照組(P=0.002),兩個OM干預組均顯著低于TGF-β1組(P=0.000),但兩個OM干預組間差異無統計學意義(P=0.208)。
討論
苦參系藥用豆科槐屬植物苦參的干燥根,性寒味苦,始載于我國最早的藥學文獻《神農本草經》。隨著分離提取技術的進步,發現在苦參、苦豆子、廣豆根中存在同一類以OM為代表的生物堿。OM化學分子式為C15H24N2O2,分子質量為282,是苦參型生物堿的主要活性成分,有多方面的藥理作用,如抗菌、抗炎、抗風濕、抗腫瘤、抗過敏、免疫及生物反應調節作用等[6]。近年大量的實驗和臨床研究結果表明OM具有明顯的抗器官纖維化作用,如抗肝纖維化、抗皮膚纖維化和抗腎間質纖維化等,其中以抗肝纖維化研究較為深入。本課題組前期研究也證實OM具有抗胰腺纖維化的作用[3-4],結合近年研究報道的PSC激活在胰腺纖維化中的重要角色,故推測OM很可能是通過抑制PSC的激活以實現抗胰腺纖維化的作用。PSC激活的重要標志就是增殖能力明顯增強,本研究結果顯示,0.5 g/L以上的OM干預PSC 12 h以上能夠顯著抑制TGF-β1所激活的PSC的增殖,表明OM體外能夠抑制PSC激活。
氧化應激是PSC激活的重要機制。在慢性酒精性胰腺炎纖維化區可見脂質過氧化產物,并觀察到激活的PSC。體外實驗證實乙醇能夠激活PSC,其機制可能與細胞內氧化應激有關[7]。體內實驗證實,應用乙醇后胰腺細胞內出現氧化應激是胰腺損傷的早期反應。OM有可能通過降低氧化應激水平來抑制PSC激活。本研究結果顯示,OM 干預后LTC-14細胞SOD水平未發生顯著變化,說明OM抑制PSC激活的作用不是通過抑制氧化應激反應實現的。
近年對PSC激活的分子機制進行了一些研究。MAPKs是一類細胞內廣泛分布的具有絲氨酸/蘇氨酸殘基的蛋白激酶,有4種MAPKs,其中ERK1/ERK2、JNK1/JNK2、p38-MAPK最具代表性。McCarroll等[8]研究發現,乙醇和乙醛能夠增加PSC提取液中ERK1/2、JNK、p38-MAPK的表達,用這3種激酶的特異性抑制劑干預后只有p38-MAPK的特異性抑制劑能抑制PSC的α-SMA表達,提示p38-MAPK途徑介導了乙醇和乙醛誘導的PSC激活。Masamune等[9]研究也有類似結果。本研究結果顯示,TGF-β1刺激PSC后p38-MAPK mRNA水平較對照組增高,OM干預則降低p38-MAPK mRNA水平,提示OM可能通過抑制p38-MAPK的轉錄來抑制PSC的激活。
(志謝感謝香港浸會大學卞兆祥教授和天津中醫藥大學商洪才教授對本工作的幫助!)
參考文獻
[1]Apte M, Pirola R, Wilson J. The fibrosis of chronic pancreatitis: new insights into the role of pancreatic stellate cells[J]. Antioxid Redox Signal, 2011, 15(10): 2711-2722.DOI:10.1089/ars.2011.4079.
[2]Mao YM, Zeng MD, Lu LG, et al. Capsule oxymatrine in treatment of hepatic fibrosis due to chronic viral hepatitis: a randomized, double blind, placebo-controlled, multicenter clinical study[J]. World J Gastroenterol, 2004, 10(22): 3269-3273.DOI: 10.3748/wjg.v10.i22.3269.
[3]蘇麗婷, 夏時海, 鄭永青. 轉化生長因子β1Ⅱ型受體在大鼠慢性胰腺炎中的表達及氧化苦參堿對其的影響[J]. 世界華人消化雜志, 2011,19(2): 121-125.
[4]王昱良, 鄭永青, 夏時海, 等. 氧化苦參堿對慢性胰腺炎胰腺組織中Ⅰ型膠原及α-SMA的影響[J]. 世界華人消化雜志, 2010, 18(13):1331-1336.DOI: 10.3969/j.issn.1009-3079.2010.13.006.
[5]Tsang SW, Zhang H, Lin C, et al. Rhein, a natural anthraquinone derivative, attenuates the activation of pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis[J]. PloS One, 2013, 8(12): e82201.DOI:10.1371/journal.pone.0082201.
[6]李屹, 張麗楠, 楊磊. 苦參堿藥理作用研究進展[J]. 實用中醫藥雜志, 2012, 28(5): 423-424. DOI: 10.3969/j.issn.1004-2814.2012.05.061.DOI:10.3969/j.issn.1004-2814.2012.05.061.
[7]Apte MV, Phillips PA, Fahmy RG, et al. Does alcohol directly stimulate pancreatic fibrogenesis? Studies with rat pancreatic stellate cells[J]. Gastroenterology, 2000, 118(4): 780-794.DOI:10.1016/S0016-5085(00)70148-X.
[8]McCarroll JA, Phillips PA, Park S, et al. Pancreatic stellate cell activation by ethanol and acetaldehyde: is it mediated by the mitogen-activated protein kinase signaling pathway[J]? Pancreas, 2003, 27(2): 150-160.DOI:10.1097/00006676-200308000-00008.
[9]Masamune A, Kikuta K, Satoh M, et al. Alcohol activates activator protein-1 and mitogen-activated protein kinases in rat pancreatic stellate cells[J]. J Pharmacol Exp Ther, 2002, 302(1): 36-42.DOI:10.1124/jpet.302.1.36.
(本文編輯:呂芳萍)
Oxymatrine suppressed the activation of pancreatic stellate cells and p38-MAPK mRNA expression in vitro
XuWei,ChenKai,XiangXiaohui,XiaShihai.
SecondDepartmentofGastroenterology,AffiliatedHospitalofLogisticsUniversityoftheChinesePeople′sArmedPoliceForces,Tianjin300162,China
【Abstract】ObjectiveTo clarify whether oxymatrine(OM) could suppress the activation of pancreatic stellate cells (PSC) and explore the potential molecular mechanism. MethodsThe proliferation of PSC line LTC 14 being activated by TGF-β1 with OM treatment at different concentrations (OM group) was measured. SOD level was determined by ELISA and p38-MAPK mRNA was determined by real-time PCR. ResultsThe proliferation of PSC in the control group, 0.1, 0.5, 1, 2, 5 g/L OM group was (1.51±0.08), (1.50±0.07), (1.15±0.04), (1.15±0.04), (1.08±0.06), and (1.08±0.10), respectively. The level of the control group was lower than the groups where the concentration of OM reached or exceeded 0.5mg/ml (all P=0.000). SOD level of LTC 14 cells in the control group, TGF-β1 group, 0.5 and 1 g/L OM group was (0.087±0.005), (0.073± 0.004), (0.085±0.010), and (0.086±0.007), respectively. No statistically significant difference existed among the groups (P=0.095). The p38-MAPK mRNA expression of PSC in the control group, TGF-β1 group, 0.5, and 1 g/L OM group was (1.000±0.000), (1.979±0.505), (0.606±0.111), and (0.303±0.159), respectively. The p38-MAPK mRNA level of TGF-β1 group was higher than that of the control group (P=0.002), and that of 0.5 mg/ml OM group and 1 mg/ml OM group was lower that of TGF-β1 group (P=0.000), while no statistical difference was found between 0.5 mg/ml OM group and 1 mg/ml OM group. ConclusionsOM could suppress the activation of PSC in vitro and the suppression of p38-MAPK mRNA expression may be involved.
【Key words】Oxymatrine;Pancreatic stellate cell;Activation;p38-MAPK
DOI:10.3760/cma.j.issn.1674-1935.2016.03.010
通信作者:夏時海,Email:xshhcx@sina.com
基金項目:國家自然科學基金面上項目(81173393);天津市自然科學基金項目(12JCZDJC25500、15JCQNJC45600);武警后勤學院創新團隊基金項目(WHTD201310);武警后勤學院附屬醫院科研種子基金面上項目(FYM201114);武警后勤學院博士啟動金項目(WHB201515)
Corresponding author:Xia Shihai, Email: xshhcx@sina.com
(收稿日期:2015-08-11)

