射頻消融治療胰腺癌的薈萃分析
陳煒 林金燦 栗華
?
·短篇論著·
射頻消融治療胰腺癌的薈萃分析
陳煒林金燦栗華
350108福州,福建中醫藥大學研究生院(陳煒);廈門大學附屬第一醫院(林金燦、栗華)
隨著科學技術的發展,射頻、微波、光動力等微創治療以及生物靶向和免疫治療在腫瘤治療中日漸成熟。射頻消融(radiofrequency ablation,RFA)是在CT和超聲的引導下將電極針插入靶組織,通過射頻發生器發出射頻波,導致病灶組織局部高溫變性、凝固壞死。目前關于射頻消融術在胰腺癌應用的研究較多[1-3],但術后療效仍有異議。為進一步明確RFA治療胰腺癌的療效,本文對此進行薈萃分析。
一、資料與方法
1.文獻檢索: 采用“pancreatic carcinoma”、“pancreatic cancer”、“pancreatic neoplasms”和“radiofrequency”等主題詞檢索Cochrane Library、PubMed和Embase三大外文數據庫,檢索截止日為2015年11月20日,并查閱部分文獻全文。
2.納入及排除標準:納入標準為(1)臨床明確診斷或病理診斷為胰腺癌;(2)為Ⅲ期、Ⅳ期、不可切除、進展期或晚期胰腺癌;(3)以射頻消融為主要治療方法;(4)有詳細描述的臨床特征以及相關臨床數據。排除標準為(1)包含有胰腺其他良性腫瘤的文獻;(2)射頻療法未涉及到胰腺癌;(3)胰腺癌治療未涉及射頻消融;(4)病例數少于15個;(5)綜述性文獻;(6)動物實驗或其他非臨床研究;(7)無全文的摘要,未提供詳述的臨床特征或所需的臨床數據,無法進行質量評價等文獻。
3.文獻篩選及質量評價:兩名研究者采用盲法獨立閱讀文獻,并嚴格遵照既定的納入和排除標準進行篩選。當文獻存在爭議時,由第三名研究者或共同研討決定。所有文獻采用紐卡斯爾-渥太華量表(The Newcastle-Ottawa Scale,NOS)進行文獻質量評價。該量表包括研究人群選擇、可比性、暴露評價或結果評價3大塊內容,共8個給分條目9個給分點,滿分為9分。
4.文獻資料提取:設計文獻資料提取量表,內容包括文獻第一作者、患者的年齡和性別分布、納入研究的病例數、對照組的干預方法、術后并發癥、生存期等。
二、結果
1.一般資料:通過主題詞共檢索到相關文獻1 419篇,按排除標準排除后,最終納入7篇文獻進行薈萃分析[4-10]。該7篇文獻均為回顧性文獻(表1)。
2.文獻質量評價:7篇文獻NOS量表評分在3~7分之間, 6分及以上者文獻3篇,6分以下文獻4篇,文獻質量中等(表2)。失分主要在對照組設置、研究的前瞻性以及結果測定方法等方面。
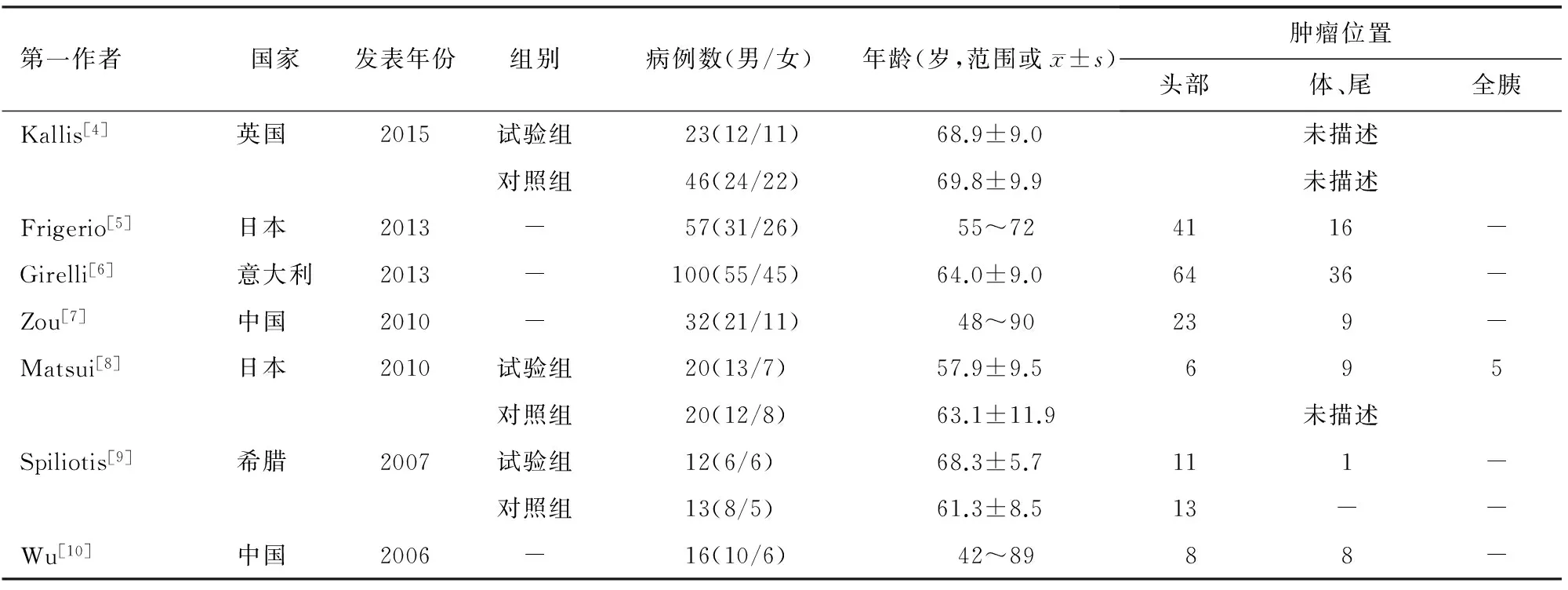
表1 納入文獻的一般資料
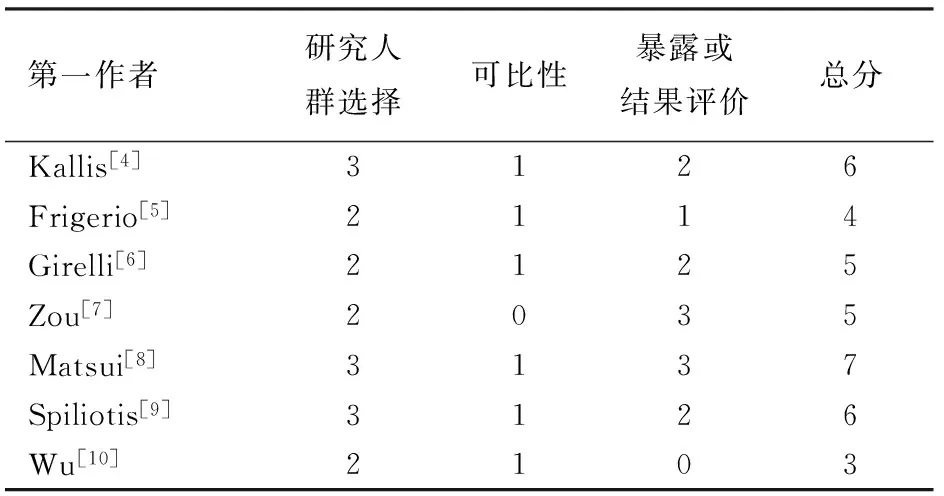
表2 納入文獻的NOS量表評價(分)
3.胰腺癌射頻消融治療的療效:納入的7篇文獻均為回顧性文獻,未檢索到隨機對照試驗。雖然7篇文獻均評價了射頻治療在胰腺癌治療中的應用價值,但方法學上有一定差異,多為射頻治療與其他方法,包括支架置入、放化療、姑息手術等的綜合應用,存在臨床異質性和方法學異質性。不同的治療方法在療效獲益方面可能存在決定性的作用,合并分析產生報告偏倚和發表偏倚,因此,本次文獻評價改用描述性評價。
4.術后并發癥和死亡率:7篇文獻中共有6篇報道了射頻治療術后并發癥的發生情況[5-10],發生率在10.6%~43.8%,主要包括射頻治療、手術治療,以及系統相關并發癥。局部并發癥主要表現為急性胰腺炎、胰瘺、胰腺囊腫形成,鄰近器官的急性胃腸炎、胃潰瘍、十二指腸潰瘍、十二指腸損傷、小腸出血、門靜脈血栓形成以及淋巴瘺、短暫的膽汁漏、黃疸、膽囊窩積液、急性腎衰竭等。其他并發癥還包括膿毒血癥、肺炎、腹腔積液、肝功能不全、偽膜性腸炎。僅有3篇文獻獨立報告了與RFA相關的術后并發癥,發生率在3.1%~15%[5-7],其中胰瘺2例,十二指腸損傷1例,門靜脈血栓形成4例,急性胰腺炎4例,十二指腸潰瘍1例,腹腔積液2例,淋巴瘺1例。
6篇文獻描述了術后死亡率[5-10]。Girelli等[6]報道3例(3%),死亡原因分別是肝功能衰竭、重度急性胰腺炎、十二指腸出血。Matsui等[8]報道2例(10%),死因分別為急性消化道出血和膿毒血癥。Wu等[10]報道4例(25%),其中3例因急性消化道大出血死亡,可能因門靜脈內血栓形成,門靜脈內壓力增加破裂出血所致;另一例死因未描述。3篇文獻無術后死亡病例[5,7,9]。
5.患者生存期:6篇文獻報告了RFA相關的生存期中位數在3~30個月[4-9],其中1篇文獻報告的患者生存期中位數在3個月[8],1篇文獻為226 d[4],余4篇文獻為18個月以上,最長達38個月。Matsui等[8]報道40例胰腺癌患者,20例行剖腹射頻消融治療,20例行內科治療,兩組生存期中位數均為3個月,但射頻治療組在研究終點時仍有2例患者存活。Spiliotis等[9]報道25例患者,12例接受RFA聯合姑息手術,13例僅接受姑息手術治療,兩組平均生存時間分別為33個月和13個月,且Ⅲ期胰腺癌患者生存期較Ⅳ期胰腺癌患者明顯改善。
討論目前外科手術仍是胰腺癌的根治方法。然而,在確診時許多胰腺癌處在Ⅲ期、Ⅳ期,無法行根治性切除,主要的治療方法是通過外科旁路或放置膽管支架等姑息手術引流膽汁和胰液,并聯合放療、化療,以達到減輕患者疼痛,改善生活質量,延長生存周期的目的。射頻消融是在CT或B超引導下,經開腹、腹腔鏡或經皮穿刺,電極針到達靶組織,通過交變電流方向變化,使腫瘤組織中離子振蕩產熱,腫瘤組織凝固變性,從而殺滅腫瘤細胞。射頻消融的體積大小與組織內熱傳導、局部血流情況、電極針類型有關,普通電極針最大毀損直徑可達16 mm[11]。1995年Rossi等[12]詳細論述了射頻消融在肝癌患者中的應用,此后在腎臟、肺、乳腺等實體腫瘤中也得到廣泛應用[13-17]。王亞光[18]報道,兔肝癌模型經RFA后,肝癌組織明顯呈現充血出血帶、熱凝固帶和針刀碳化帶,局部腫瘤細胞出現核固縮、凝固、碎裂,針道外周充血、出血區出現巨噬細胞、中性粒細胞浸潤。此外,RFA局部高溫也促進腫瘤細胞凋亡。腫瘤壞死邊緣區凋亡指數在術后12 h達到高峰,術后1周有所下降,但仍高于對照組[19]。Wissniowski等[20]報道,射頻治療后局部腫瘤組織T淋巴細胞增加,增強機體的抗腫瘤作用。
由于隨機對照研究的缺乏可產生抽樣偏倚和選擇偏倚。本薈萃分析又僅檢索三大英文數據庫,未檢索國內以及國外其他語種的文獻,也可產生一定的抽樣偏倚。納入的7篇文獻中,Kallis等[4]未報告相應的術后并發癥發生率和死亡率,Wu等[10]雖報告了術后死亡率和并發癥發生率,但未隨訪,無患者術后的生活質量和生存期資料,存在失訪偏倚和報告偏倚。由于醫學倫理的要求,患者及家屬享有對疾病的知情權,而外科醫師在手術前必須充分了解患者的病情資料,手術時必須核對患者身份,因此,無法針對患者及外科醫師實施真正的盲法,可能產生一定的實施偏倚。此外,3篇文獻的部分患者已經發生其他臟器轉移[4,8,10],研究中腫瘤大小、位置不同,各個研究中心儀器設備不同,電極針的型號、質量存在差異,可能產生研究內偏倚和混雜偏倚。因此,應用本次系統評價結果時必須謹慎評估。
在納入的4篇患者生存期中位數在18個月以上的文獻中,治療策略分別是先短程化療聯合RFA[5]、RFA聯合放化療[6]、RFA聯合125I放療[7]、RFA聯合姑息手術[9]。近期的一項研究采用RFA聯合支架置入,對照組僅支架置入,二者生存期中位數為226 d及123.5 d[4]。Matsui等[8]采用剖腹單獨行RFA治療,對照組行內科治療,二者中位生存期均僅3個月,無顯著差異。對比上述6篇文獻,單獨應用RFA對患者生存期改善有限,聯合放化療、姑息性手術、支架置入等綜合治療方法可能使患者生存效益得到最大改善。文獻共報道9例死亡病例[6,8,10],消化道出血是主要的死亡原因。Wu等[10]分析3例消化道出血的原因均為腫瘤毗連門靜脈,射頻消融時高溫導致門靜脈血栓形成,門靜脈內壓力增加破裂出血,因而指出電極針與胰周血管5 mm的距離并不能避免損傷血管,需要進一步的研究證實。
總之,單獨應用RFA治療胰腺癌對患者生存期的改善有限,RFA聯合放化療、姑息手術等綜合治療可能使患者受益更大,目前RFA治療胰腺癌尚未成熟,需要系統、規范的隨機對照試驗和多中心的前瞻性研究進行驗證。
參考文獻
[1]Fegrachi S, Besselink MG, van Santvoort HC, et al. Radiofrequency ablation for unresectable locally advanced pancreatic cancer: a systematic review[J]. HPB(Oxford), 2014, 16(2):119-123. DOI: 10.1111/hpb.12097.
[2]Pezzilli R, Serra C, Ricci C, et al. Radiofrequency ablation for advanced ductal pancreatic carcinoma: is this approach beneficial for our patients? A systematic review[J]. Pancreas, 2011, 40(1):163-165. DOI: 10.1097/MPA.0b013e3181eab751.
[3]Carrafiello G, Laganà D, Ianniello A, et al. Post-radiofrequency ablation syndrome after percutaneous radiofrequency of abdominal tumours: one centre experience and review of published works[J]. Australas Radiol, 2007, 51(6):550-554.DOI: 10.1111/j.1440-1673.2007.01871.x.
[4]Kallis Y, Phillips N, Steel A, et al. Analysis of endoscopic radiofrequency ablation of biliary malignant strictures in pancreatic cancer suggests potential survival benefit[J]. Dig Dis Sci, 2015, 60(11):3449-3455. DOI: 10.1007/s10620-015-3731-8. Epub 2015 Jun 3.
[5]Frigerio I, Girelli R, Giardino A, et al. Short term chemotherapy followed by radiofrequency ablation in stage III pancreatic cancer: results from a single center[J]. J Hepatobiliary Pancreat Sci, 2013, 20(6):574-577.DOI: 10.1007/s00534-013-0613-3.
[6]Girelli R, Frigerio I, Giardino A, et al. Results of 100 pancreatic radiofrequency ablations in the context of a multimodal strategy for stage III ductal adenocarcinoma[J]. Langenbecks Arch Surg, 2013, 398(1):63-69. DOI: 10.1007/s00423-012-1011-z.
[7]Zou YP, Li WM, Zheng F, et al. Intraoperative radiofrequency ablation combined with iodine seed implantation for unresectable pancreatic cancer[J]. World J Gastroenterol, 2010, 16(40):5104-5110. DOI: 10.3748/wjg.v16.i40.5104.
[8]Matsui Y, Nakagawa A, Kamiyama Y, et al. Selective thermocoagulation of unresectable pancreatic cancers by using radiofrequency capacitive heating[J]. Pancreas, 2000, 20(1):14-20.DOI:10.1097/00006676-2000010000-00002.
[9]Spiliotis JD, Datsis AC, Michalopoulos NV, et al. Radiofrequency ablation combined with palliative surgery may prolong survival of patients with advanced cancer of the pancreas[J]. Langenbecks Archives of Surgery, 2007, 392(1):55-60.DOI:10.1002/s00423-006-0098-5.
[10]Wu Y, Tang Z, Fang H, et al. High operative risk of cool-tip radiofrequency ablation for unresectable pancreatic head cancer[J]. J Surg Oncol, 2006, 94(5):392-395.
[11]Rossi S, Fornari F, Pathies C, et al. Thermal lesions induced by 480 KHz localized current field in guinea pig and pig liver[J]. Tumori, 1990, 76(1):54-57.
[12]Rossi S, Di Stasi M, Buscarini E, et al. Percutaneous radiofrequency interstitial thermal ablation in the treatment of small hepatocellular carcinoma[J]. Cancer J Sci Am, 1995, 1(1):73-81.
[13]Mirza AN, Fornage BD, Sneige N, et al. Radiofrequency ablation of solid tumors[J]. Cancer J, 2001, 7(2):95-102.
[14]Venbrux AC, Montague BJ, Murphy KP, et al. Image-guided percutaneous radiofrequency ablation for osteoid osteomas[J]. J Vasc Interv Radiol, 2003, 14(3):375-380.
[15]Anzai Y, Lufkin R, Desalles A, et al. Preliminary experience with MR-guided thermal ablation of brain tumors[J]. AJNR Am J Neuroradiol, 1995, 16(1):39-48.
[16]Hoffmann RT, Jakobs TF, Reiser MF, et al. Radiofrequency ablation of lung tumors and -metastases[J]. Der Radiologe, 2004, 44(4):364-369.
[17]Pawlik TM, Izzo F, Cohen DS, et al. Combined resection and radiofrequency ablation for advanced hepatic malignancies: results in 172 patients[J]. Ann Surg Oncol, 2003, 10(9):1059-1069.
[18]王亞光. 射頻消融對兔肝VX2腫瘤射頻靶區內不同區帶細胞損傷的實驗研究[D]. 安徽醫科大學, 2011.
[19]王笛樂, 沈世強, 章園. 射頻消融對兔肝癌模型細胞凋亡的影響[J]. 臨床外科雜志, 2004, 12(3):147-149.DOI: 10.3969/j.issn.1005-6483.2004.03.014.
[20]Wissniowski TT, H?nsler J, Neureiter D, et al. Activation of tumor-specific T lymphocytes by radio-frequency ablation of the VX2 hepatoma in rabbits[J]. Cancer Res, 2003, 63(19): 6496-6500.
(本文編輯:呂芳萍)
DOI:10.3760/cma.j.issn.1674-1935.2016.03.015
通信作者:栗華,Email: endohlihua@126.com
(收稿日期:2015-12-30)

