鈣對鹽脅迫下杜梨葉片抗氧化系統的影響
韓金龍+李慧++藺經++楊青松++常有宏
摘要:為探討外源鈣對鹽脅迫下杜梨葉片抗氧化系統的影響,以梨砧木杜梨幼苗為供試材料,在水培條件下,研究外源施加不同濃度的鈣對200 mmol/L NaCl脅迫下其葉片抗氧化酶活性、活性氧產生、膜質過氧化和抗氧化物質含量的影響。結果顯示:NaCl脅迫3 d后,杜梨葉片中超氧化物歧化酶(SOD)活性減弱,過氧化物酶(POD)、過氧化氫酶(CAT)、谷胱甘肽還原酶(GR)、谷胱甘肽過氧化物酶(GSH-Px)、抗壞血酸過氧化物酶(APX)的活性增強,活性氧(O-2 · 、H2O2)和丙二醛(MDA)大量積累,抗氧化物質谷胱甘肽(GSH)和抗壞血酸(AsA)合成下降。施加外源CaCl2能增強NaCl脅迫下杜梨葉片中SOD、POD、CAT、GR、GSH-Px、APX的活性,減少O-2 · 和H2O2的產生,降低脂質過氧化程度,提高GSH和AsA的含量,有效緩解鹽脅迫對杜梨葉片的過氧化傷害,其中以10 μmol/L CaCl2處理效果最為顯著。說明NaCl處理可對杜梨葉片造成氧化傷害,施加低濃度(5~10 μmol/L)CaCl2處理可緩解鹽脅迫對杜梨葉片抗氧化系統的影響。
關鍵詞:杜梨;鈣;鹽脅迫;活性氧;抗氧化酶
中圖分類號: S661.201文獻標志碼: A文章編號:1002-1302(2016)06-0245-03
收稿日期:2015-04-23
基金項目:國家自然科學基金(編號:31372051);江蘇省農業科技自主創新資金[編號:CX(14)5018]。
作者簡介:韓金龍(1989—),男,山西霍州人,碩士研究生,主要從事果樹逆境生理和分子生物學研究。E-mail:hjlong24@126.com。
通信作者:常有宏,研究員,碩士生導師,主要從事果樹育種和栽培生理研究。E-mail:cyh@jaas.ac.cn。土壤鹽漬化是影響農業生產與生態環境的一個重要因素。據不完全統計,世界上約有10億hm2鹽漬地,我國約占其中的3.75%,并且每年隨著次生鹽漬地的擴張,對我國的農業生產造成嚴重威脅[1]。植物在鹽脅迫下最直接的影響就是抑制其生長,嚴重時會造成滲透脅迫和離子脅迫,破壞其細胞結構和功能,甚至導致其死亡[2]。因此,如何更好地利用開發鹽漬地資源,已成為人們探討的熱點。而近些年,人們通過對外源緩沖劑研究的深入,已將其視為提高植物緩解鹽脅迫的重要手段。
鈣(calcium,Ca)是植物生長發育所必需的一種大量元素,在植物體內起著極其特殊的作用。它不僅能夠維持細胞壁、細胞膜和膜結合蛋白的穩定性,參與調節無機離子運輸,而且作為細胞內第二信使,能夠將胞外信息傳遞給胞內,從而引起一系列的生理生化變化。目前研究發現,當植物受到逆境脅迫時,植物體細胞內的游離鈣離子濃度會上升,并通過Ca2+與CaM結合,形成Ca2+-CaM復合體,再對逆境脅迫信號的感受、傳遞和響應,啟動一系列生理生化過程,以適應外界環境[3]。同時,外源施加鈣也能提高植物的抗寒性[4]、抗熱性[5]和抗鹽性[6]等多種抗性。本試驗對鹽脅迫下施加不同濃度鈣離子,分析其對杜梨葉片抗氧化系統的影響,旨在為緩解梨樹鹽脅迫提供理論依據。
梨是世界及我國主栽果樹之一。隨著土壤鹽漬化程度的不斷加劇,嚴重限制了梨產業的發展。梨樹主要靠嫁接來繁殖,選擇抗性強的砧木對嫁接苗的生長至關重要。杜梨(Pyrus betulaefolia Bunge)原產于中國,將其作為嫁接苗的砧木,能夠提高梨樹的耐鹽能力[7-8]。杜梨在鹽脅迫下,通過減少Na+在根中積累和向地上部運輸來適應逆境[9-10],但在高鹽脅迫下,植物仍能受到氧化脅迫等傷害[11]。本試驗對鹽脅迫下施加不同濃度鈣離子,分析其對杜梨葉片抗氧化系統的影響,旨在為緩解梨樹鹽脅迫提供理論依據。
1材料與方法
1.1植物材料培養和處理
將杜梨種子埋在濕沙中至于4 ℃溫度中,經3個月的低溫處理后,將有胚根幼苗移植于水培系統中(培養液為Hoagland 營養液,pH值5.8),并放置于光照培養箱中,每3 d更換1次培養液。培養條件如下:光照周期16 h/8 h(光照/黑暗),光照強度300 μmol/(m2·s),培養溫度(25 ± 0.5) ℃,空氣相對濕度60%~70%。待植株長至8葉1心時,選擇長勢一致的健壯幼苗,并用蒸餾水沖洗干凈,用含 200 mmol/L NaCl的Hoagland 營養液進行處理,并添加一定濃度的CaCl2母液,使其在水培系統中的濃度達到 0、5、10、50、100 μmol/L。以生長在不含NaCl和CaCl2的Hoagland 營養液中的植株作為對照。每個處理設3次重復,處理3 d后收集杜梨葉片,用于測定各種生理指標。
1.2測定指標及方法
1.2.1活性氧和丙二醛含量測定過氧化氫(H2O2)含量測定參照Patterson等的方法[12]。新鮮葉片用2 mL 預冷丙酮提取后,經5%硫酸鈦處理所生成的氧化物-鈦復合物黃色沉淀,用2 mmol/L H2SO4溶解后,在415 nm波長下比色測定,通過標準曲線計算葉片中H2O2含量。采用羥胺氧化法來測定超氧陰離子(O-2 · )的產生速率[13],單位為nmol/(g·min)。采用硫代巴比妥酸(TBA)法測定丙二醛(MDA)含量[14],單位為nmol/(g·min)。
1.2.2抗氧化酶活性測定蛋白質含量的測定采用考馬斯亮藍法[15];超氧化物歧化酶(superoxide dismutase,SOD)活性的測定采用氮藍四唑(nitroblue tretrazolium chloride,NBT)光氧化還原法,以抑制 NBT 光氧化還原50%的酶量為1個酶活性單位[16];過氧化物酶(peroxidase,POD)活性的測定采用愈創木酚法[16],以1 min內D470 nm值變化0.01為1個酶活性單位;過氧化氫酶(catalase,CAT)活性的測定參照Aebi的方法[17],以1 min內D240 nm值變化0.1為1個酶活性單位;利用紫外分光光度法測定谷胱甘肽還原酶(glutathione reductase,GR)的活性,以 340 nm處的吸光度變化為NADPH的消耗量,計算GR活性[18];谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性采用黃愛纓等的方法[19]測定,以每毫克蛋白質1 min使反應體系中GSH濃度降低1 μmol/L為1個活性單位(扣除非酶促反應)。參照Nakano等的方法[20]來測定抗壞血酸過氧化物酶(ascorbic acid peroxidase,APX)的活性,以1 min內D290 nm值變化0.1為1個酶活性單位。
1.2.3抗氧化物質含量總谷胱甘肽(glutathione,GSH)含量采用5,5-二巰基-2-硝基苯酸(5,5-dithiobis-2-nitrobenoic acid,DTNB)法[21] 測定;抗壞血酸(ascorbic acid,AsA)含量采用分光光度法測定,在紅菲咯啉存在的條件下,AsA所還原的亞鐵離子與其反應形成紅色螯合物,通過測定D534 nm來計算AsA含量[22]。
1.3數據分析
采用Excel 2007、SPSS 16.0軟件對試驗數據進行分析和制作表格,并運用LSD法進行多重比較。
2結果與分析
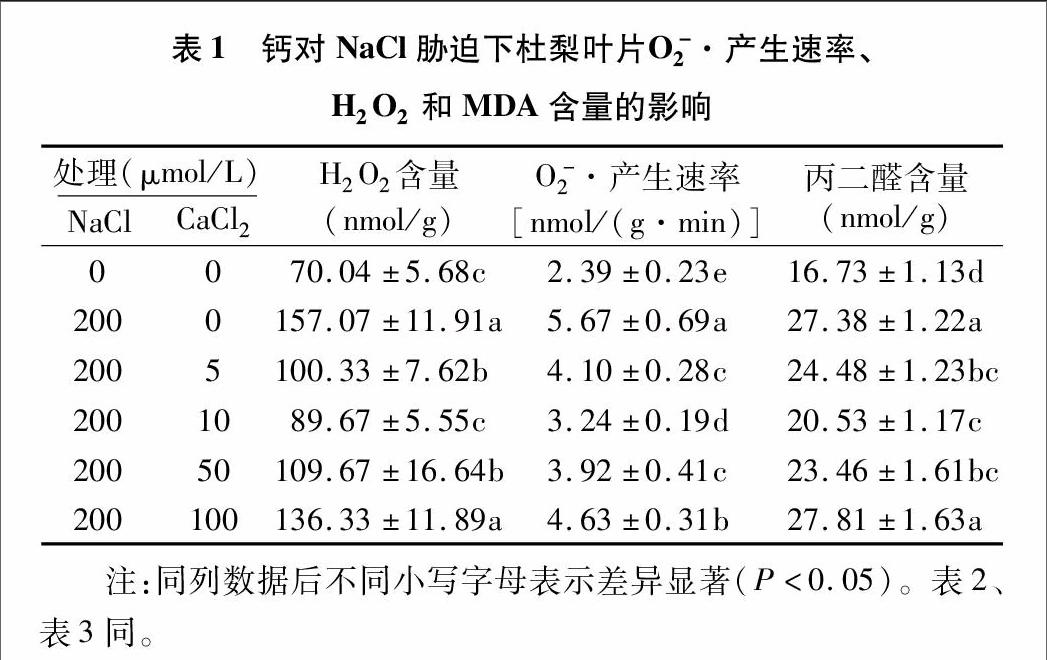
2.1鈣對鹽脅迫下杜梨葉片活性氧和MDA含量的影響
由表1可以看出,在鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中超氧陰離子(O-2 · )的產生速率是對照的2.37倍,H2O2、MDA的含量分別是對照的2.24、1.64倍,這會造成植株葉片細胞活性氧代謝系統失去平衡,發生膜脂過氧化。施加5 ~ 100 μmol/L CaCl2后,O-2 · 的產生速率、H2O2和MDA的含量均隨著CaCl2濃度的增加呈現先下降后升高的趨勢。當CaCl2為5 ~ 10 μmol/L時,O-2 · 的產生速率、H2O2含量、MDA的含量顯著降低(降低27.6%~42.8%、36.1%~42.9%、10.6%~25.0%),且10 μmol/L CaCl2處理組中,上述3個指標最低(表1)。然而,當CaCl2為50~100 μmol/L 時,反而會刺激活性氧的積累(O-2 · 產生速率和H2O2含量增加),加劇膜質過氧化(MDA積累)。
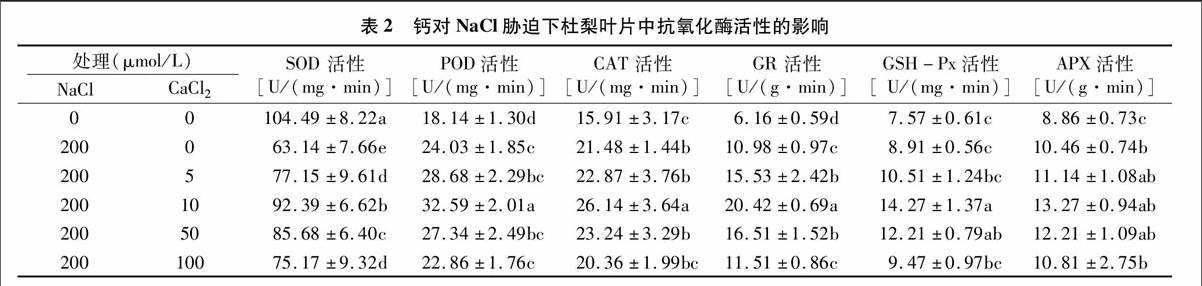
2.2鈣對鹽脅迫下杜梨葉片抗氧化酶活性的影響
由表2可知,鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中超氧化物歧化酶(SOD)活性顯著降低(僅為對照的60.4%),而過氧化物酶(POD)、過氧化氫酶(CAT)、谷胱甘肽還原酶(GR)、谷胱甘肽過氧化物酶(GSH-Px)、抗壞血酸過氧化物酶(APX)活性均有不同程度升高(為對照的1.18~1.78倍)。這表明NaCl脅迫可輕微誘導杜梨葉片中POD、CAT、GR、GSH-Px、APX活性增強,卻抑制SOD的活性。施加5 ~ 100 μmol/L CaCl2后,抗氧化酶的活性均隨著CaCl2濃度的增加呈先增強后減弱的趨勢。當CaCl2為 10 μmol/L 時,抗氧化酶(除APX)的活性較鹽脅迫下差異最明顯(為鹽脅迫下的1.21~1.46倍)。然而,當CaCl2為50~100 μmol/L 時,抗氧化酶(除APX、GSH-Px)的活性較10 μmol/L CaCl2處理又顯著降低,且100 μmol/L CaCl2處理與鹽脅迫下相比較,抗氧化酶活性差異不顯著。而當CaCl2為5 ~ 100 μmol/L時,APX的活性均沒有顯著差異,但均比對照顯著增強。
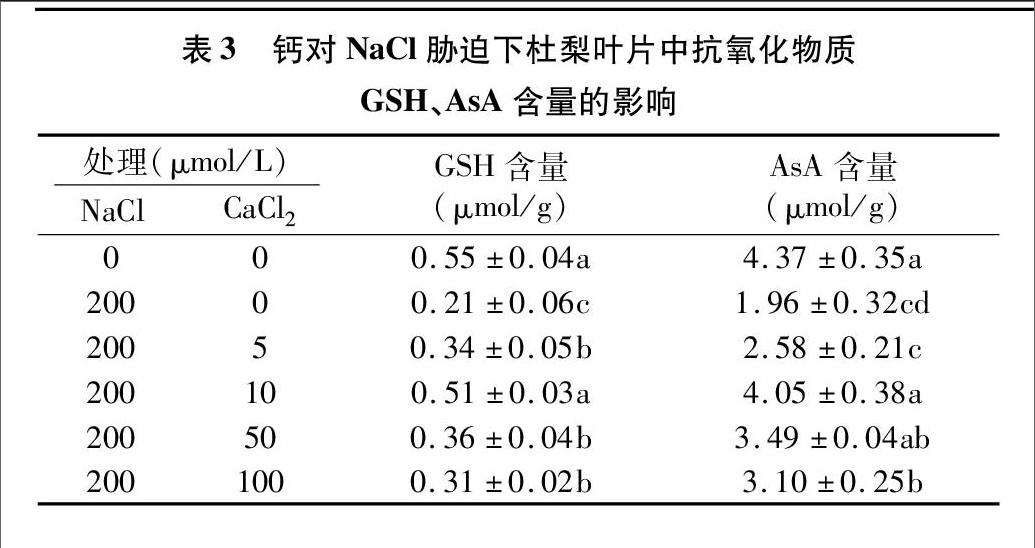
2.3鈣對鹽脅迫下杜梨葉片抗氧化物質含量的影響
由表3可知,鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中抗氧化物質GSH、AsA含量顯著降低(僅為對照的382% ~ 44.9%),嚴重影響植株自身清除自由基的能力。施加5 ~ 100 μmol/L CaCl2后,抗氧化物質含量隨著CaCl2濃度的增加呈現先增加后減少的趨勢。當CaCl2為5~100 μmol/L 時,GSH的含量較鹽脅迫下均顯著提高,其中以CaCl2為10 μmol/L時差異最顯著,含量為鹽脅迫下的2.43倍。AsA的含量隨著CaCl2濃度的升高呈現先升高后降低的趨勢,其中當CaCl2為10~100 μmol/L 時,AsA的含量較鹽脅迫下均顯著提高,且在10 μmol/L時差異最顯著,含量為鹽脅迫下的2.07倍。
3結論與討論
鹽脅迫會引起植物體內發生一系列生理生化的變化,影響植物的正常生理調節。鈣是植物生長發育的必需元素,當植物處于鹽脅迫時,細胞內的鹽離子與Ca2+的吸收形成競爭作用,使得Ca2+不能被充分利用,導致植物細胞對Ca2+的緊缺。鹽脅迫對植物體的傷害,主要是通過對質膜完整性和鈣信號轉導系統的破壞[23-24],而添加一定濃度的外源鈣能夠有效緩解鹽脅迫對其帶來的傷害[25]。這可能是因為添加外源鈣不僅能夠補充植物體本身所需的鈣元素,而且能夠增加質膜的穩定性,恢復鈣信號轉導系統,同時維持細胞內的離子平衡。而鈣是一種膜保護劑,能夠穩定膜上的蛋白質,降低質膜透性,維持細胞內的離子區域化,使得植物細胞內的各種生理代謝正常進行,從而提高植物的耐鹽性。
高濃度的鈣對植物體的影響則截然相反。有研究表明,高濃度的Ca2+能夠降低植物的葉綠素含量和光合強度,同時對水稻幼苗的生長產生抑制作用[26]。這可能是因為過多的鈣離子積累會打破細胞內原有的營養平衡,對植物細胞造成新的離子毒害,迫使細胞產生滲透脅迫等不利于植物生長的因素。同時,高濃度的Ca2+還會引起細胞內的Ca2+濃度變化,進而在細胞內產生一系列生理生化的變化,造成膜損傷等傷害[27]。另外,雖然Ca2+與Na+的生物功能不同,但是它們的化學性質卻有很多相似性,在吸收過程中會形成競爭關系,而且離子過量對植物的傷害都是一樣的。本試驗中添加的CaCl2在為杜梨幼苗提供了所需要的Ca2+的同時,也過量積累了NaCl脅迫中的Cl-·,加劇了植物的鹽脅迫。
本試驗結果表明,鹽脅迫下,杜梨葉片中O-2 · 產生速率、H2O2含量和MDA含量均顯著增加;同時SOD活性降低,卻在不同程度上刺激了POD、CAT、GR、GSH-Px、APX的活性,使它們的活性增強;但抗氧化物質GSH、AsA的含量顯著降低。而在添加5、10、50、100 μmol/L CaCl2后,它們的含量或者活性都呈一定的變化規律,且在CaCl2濃度為 10 μmol/L 時,活性氧的含量降至最低水平,有效緩解了膜脂過氧化,同時所有抗氧化酶的活性達到最高水平,抗氧化物質的含量與對照條件下差異不顯著,因此,鹽脅迫對杜梨葉片帶來的氧化損傷也是最低的。可能是因為當CaCl2濃度為 5 μmol/L 或10 μmol/L 時,植物對鈣離子吸收增多,吸收到的鈣離子能與細胞膜上的相關物質結合,維持細胞膜的穩定性,降低膜透性,避免吸收更多的Na+;同時Ca2+通過對細胞內離子區域化作用,將胞內多余的Na+區隔開,從而保證細胞內各種代謝正常進行,對提高植物的耐鹽性有一定的作用。當CaCl2濃度為50 μmol/L或100 μmol/L時,植物細胞內Ca2+含量增多,可能對植物細胞造成了新的離子傷害,使得活性氧含量上升,膜脂過氧化加劇,抗氧化酶的活性減弱,同時抗氧化物質含量也顯著降低。這表明單純的鈣處理對植物緩解鹽脅迫的能力是有限的,其具體原因還有待進一步研究。
綜上所述,200 mmol/L鹽脅迫能對杜梨葉片造成很大程度的氧化傷害,而施加低濃度(5~10 μmol/L)CaCl2可以有效緩解這些傷害,這可能與Ca2+在植物中能夠維持細胞膜穩定性,具有離子區域化作用,作為細胞內第二信使調節植物生理代謝等作用有關。
參考文獻:
[1]章文華. 植物的抗鹽生理和鹽害的防治[J]. 植物生理學通訊,1997,33(6):479.
[2]Parida A K,Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[3]Braam J,Davis R W. Rain-,wind-,and touch-induced expression of calmodulin and calmodulin-related genes in Arabidopsis[J]. Cell,1990,60(3):357-364.
[4]張燕,方力,李天飛,等. 鈣對低溫脅迫的煙草幼苗某些酶活性的影響[J]. 植物學通報,2002,19(3):342-347.
[5]張建霞,李新國,孫中海. 外源鈣對柑橘抗熱性的相關生理生化指標的影響[J]. 華中農業大學學報,2005,24(4):397-400.
[6]朱曉軍,梁永超,楊勁松,等. 鈣對鹽脅迫下水稻幼苗抗氧化酶活性和膜脂過氧化作用的影響[J]. 土壤學報,2005,42(3):453-459.
[7]Okubo M,Sakuratani T. Effects of Sodium chloride on survival and stem elongation of two Asian pear rootstock seedlings[J]. Scientia Horticulturae,2000,85(1/2):85-90.
[8]Matsumoto K,Tamura F,Chun J P,et al. Enhancement in salt tolerance of Japanese pear by using Pyrus betulaefolia rootstock[J]. Hortic Res,2007,6(1):47-52.
[9]Okubo M,Furukawa Y,Sakuratani T. Growth,flowering and leaf properties of pear cultivars grafted on two Asian pear rootstock see dlings under NaCl irrigation[J]. Scientia Horticulturae,2000,85(1/2):91-101.
[10]Matsumoto K,Chun J P,Tamura F,et al. Salt tolerance in Pyrus species is linked to levels of Na and Cl translocation from roots to leaves[J]. Journal of the Japanese Society for Horticultural Science,2006,75(5):385-391.
[11]Wu Q S,Zou Y N. Adaptive responses of birch-leaved pear (Pyrus betulaefolia) seedlings to salinity stress[J]. Notulae Botanicae Horti Agrobotanici Cluj:Napoca,2009,37(1):133-138.
[12]Patterson B D,Macrae E A,Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(Ⅳ)[J]. Analytical Biochemistry,1984,139(2):487-492.
[13]Elstner E F,Heupel A. Inhibition of nitrite formation from hydroxylammoniumchloride:a simple assay for superoxide dismutase[J]. Analytical Biochemistry,1976,70(2):616-620.
[14]李合生. 植物生理學實驗技術指導[M]. 北京:高等教育出版社,2001.
[15]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[16]Ma C,Wang Z Q,Kong B B,et al. Exogenous trehalose differentially modulate antioxidant defense system in wheat callus during water deficit and subsequent recovery[J]. Plant Growth Regulation,2013,70(3):275-285.
[17]Aebi H. Catalase in vitro[J]. Methods in Enzymology,1984,105:121-126.
[18]Ali B,Tao Q J,Zhou Y F,et al. 5-Aminolevolinic acid mitigates the cadmium-induced changes in Brassica napus as revealed by the biochemical and ultra-structural evaluation of roots[J]. Ecotoxicology and Environmental Safety,2013,92:271-280.
[19]黃愛纓,吳珍齡. 水稻谷胱甘肽過氧化物酶的測定法[J]. 西南農業大學學報,1999,21(4):24-27.
[20]Nakano Y,Asada K. Hydrogen peroxide is scanvenged by ascorbated specific peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology,1981,22(5):867-880.
[21]Anderson M E. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods in Enzymology,1985,113:548-555.
[22]Law M Y,Charles S A,Halliwell B.Glutathion and scorbic acid in spinach (Spinacia oleracea) chloroplast.The effect of hydrogen peroxide and of paraquat[J]. Journal of Biochemistry,1983,253:109-116.
[23]Cramer G R,Luchli A,Polito V S. Displacement of Ca by Na from the plasmalemma of root cells:a primary response to salt stress[J]. Plant Physiology,1985,79(1):207-211.
[24]Lynch J,Polito V S,Luchli A. Salinity stress increases cytoplasmic ca activity in maize root protoplasts[J]. Plant Physiology,1989,90(4):1271-1274.
[25]Ben A N,Megdiche W,Jiménez A,et al. The effect of calcium on the antioxidant systems in the halophyte Cakile maritima under salt stress[J]. Acta Physiologiae Plantarum,2010,32(3):453-461.
[26]周焱. Ca2+對水稻幼苗生長的影響[J]. 貴州師范大學學報:自然科學版,2002,20(3):12-14.
[27]王勛陵,陳鑫陽,魯曉云. 鈣對臭氧傷害小麥的防護作用[J]. 西北植物學報,1993,13(3):163-169.
韓金龍 李慧 藺經 楊青松 常有宏



摘要:為探討外源鈣對鹽脅迫下杜梨葉片抗氧化系統的影響,以梨砧木杜梨幼苗為供試材料,在水培條件下,研究外源施加不同濃度的鈣對200 mmol/L NaCl脅迫下其葉片抗氧化酶活性、活性氧產生、膜質過氧化和抗氧化物質含量的影響。結果顯示:NaCl脅迫3 d后,杜梨葉片中超氧化物歧化酶(SOD)活性減弱,過氧化物酶(POD)、過氧化氫酶(CAT)、谷胱甘肽還原酶(GR)、谷胱甘肽過氧化物酶(GSH-Px)、抗壞血酸過氧化物酶(APX)的活性增強,活性氧(O-2 · 、H2O2)和丙二醛(MDA)大量積累,抗氧化物質谷胱甘肽(GSH)和抗壞血酸(AsA)合成下降。施加外源CaCl2能增強NaCl脅迫下杜梨葉片中SOD、POD、CAT、GR、GSH-Px、APX的活性,減少O-2 · 和H2O2的產生,降低脂質過氧化程度,提高GSH和AsA的含量,有效緩解鹽脅迫對杜梨葉片的過氧化傷害,其中以10 μmol/L CaCl2處理效果最為顯著。說明NaCl處理可對杜梨葉片造成氧化傷害,施加低濃度(5~10 μmol/L)CaCl2處理可緩解鹽脅迫對杜梨葉片抗氧化系統的影響。
關鍵詞:杜梨;鈣;鹽脅迫;活性氧;抗氧化酶
中圖分類號: S661.201文獻標志碼: A文章編號:1002-1302(2016)06-0245-03
收稿日期:2015-04-23
基金項目:國家自然科學基金(編號:31372051);江蘇省農業科技自主創新資金[編號:CX(14)5018]。
作者簡介:韓金龍(1989—),男,山西霍州人,碩士研究生,主要從事果樹逆境生理和分子生物學研究。E-mail:hjlong24@126.com。
通信作者:常有宏,研究員,碩士生導師,主要從事果樹育種和栽培生理研究。E-mail:cyh@jaas.ac.cn。土壤鹽漬化是影響農業生產與生態環境的一個重要因素。據不完全統計,世界上約有10億hm2鹽漬地,我國約占其中的3.75%,并且每年隨著次生鹽漬地的擴張,對我國的農業生產造成嚴重威脅[1]。植物在鹽脅迫下最直接的影響就是抑制其生長,嚴重時會造成滲透脅迫和離子脅迫,破壞其細胞結構和功能,甚至導致其死亡[2]。因此,如何更好地利用開發鹽漬地資源,已成為人們探討的熱點。而近些年,人們通過對外源緩沖劑研究的深入,已將其視為提高植物緩解鹽脅迫的重要手段。
鈣(calcium,Ca)是植物生長發育所必需的一種大量元素,在植物體內起著極其特殊的作用。它不僅能夠維持細胞壁、細胞膜和膜結合蛋白的穩定性,參與調節無機離子運輸,而且作為細胞內第二信使,能夠將胞外信息傳遞給胞內,從而引起一系列的生理生化變化。目前研究發現,當植物受到逆境脅迫時,植物體細胞內的游離鈣離子濃度會上升,并通過Ca2+與CaM結合,形成Ca2+-CaM復合體,再對逆境脅迫信號的感受、傳遞和響應,啟動一系列生理生化過程,以適應外界環境[3]。同時,外源施加鈣也能提高植物的抗寒性[4]、抗熱性[5]和抗鹽性[6]等多種抗性。本試驗對鹽脅迫下施加不同濃度鈣離子,分析其對杜梨葉片抗氧化系統的影響,旨在為緩解梨樹鹽脅迫提供理論依據。
梨是世界及我國主栽果樹之一。隨著土壤鹽漬化程度的不斷加劇,嚴重限制了梨產業的發展。梨樹主要靠嫁接來繁殖,選擇抗性強的砧木對嫁接苗的生長至關重要。杜梨(Pyrus betulaefolia Bunge)原產于中國,將其作為嫁接苗的砧木,能夠提高梨樹的耐鹽能力[7-8]。杜梨在鹽脅迫下,通過減少Na+在根中積累和向地上部運輸來適應逆境[9-10],但在高鹽脅迫下,植物仍能受到氧化脅迫等傷害[11]。本試驗對鹽脅迫下施加不同濃度鈣離子,分析其對杜梨葉片抗氧化系統的影響,旨在為緩解梨樹鹽脅迫提供理論依據。
1材料與方法
1.1植物材料培養和處理
將杜梨種子埋在濕沙中至于4 ℃溫度中,經3個月的低溫處理后,將有胚根幼苗移植于水培系統中(培養液為Hoagland 營養液,pH值5.8),并放置于光照培養箱中,每3 d更換1次培養液。培養條件如下:光照周期16 h/8 h(光照/黑暗),光照強度300 μmol/(m2·s),培養溫度(25 ± 0.5) ℃,空氣相對濕度60%~70%。待植株長至8葉1心時,選擇長勢一致的健壯幼苗,并用蒸餾水沖洗干凈,用含 200 mmol/L NaCl的Hoagland 營養液進行處理,并添加一定濃度的CaCl2母液,使其在水培系統中的濃度達到 0、5、10、50、100 μmol/L。以生長在不含NaCl和CaCl2的Hoagland 營養液中的植株作為對照。每個處理設3次重復,處理3 d后收集杜梨葉片,用于測定各種生理指標。
1.2測定指標及方法
1.2.1活性氧和丙二醛含量測定過氧化氫(H2O2)含量測定參照Patterson等的方法[12]。新鮮葉片用2 mL 預冷丙酮提取后,經5%硫酸鈦處理所生成的氧化物-鈦復合物黃色沉淀,用2 mmol/L H2SO4溶解后,在415 nm波長下比色測定,通過標準曲線計算葉片中H2O2含量。采用羥胺氧化法來測定超氧陰離子(O-2 · )的產生速率[13],單位為nmol/(g·min)。采用硫代巴比妥酸(TBA)法測定丙二醛(MDA)含量[14],單位為nmol/(g·min)。
1.2.2抗氧化酶活性測定蛋白質含量的測定采用考馬斯亮藍法[15];超氧化物歧化酶(superoxide dismutase,SOD)活性的測定采用氮藍四唑(nitroblue tretrazolium chloride,NBT)光氧化還原法,以抑制 NBT 光氧化還原50%的酶量為1個酶活性單位[16];過氧化物酶(peroxidase,POD)活性的測定采用愈創木酚法[16],以1 min內D470 nm值變化0.01為1個酶活性單位;過氧化氫酶(catalase,CAT)活性的測定參照Aebi的方法[17],以1 min內D240 nm值變化0.1為1個酶活性單位;利用紫外分光光度法測定谷胱甘肽還原酶(glutathione reductase,GR)的活性,以 340 nm處的吸光度變化為NADPH的消耗量,計算GR活性[18];谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性采用黃愛纓等的方法[19]測定,以每毫克蛋白質1 min使反應體系中GSH濃度降低1 μmol/L為1個活性單位(扣除非酶促反應)。參照Nakano等的方法[20]來測定抗壞血酸過氧化物酶(ascorbic acid peroxidase,APX)的活性,以1 min內D290 nm值變化0.1為1個酶活性單位。
1.2.3抗氧化物質含量總谷胱甘肽(glutathione,GSH)含量采用5,5-二巰基-2-硝基苯酸(5,5-dithiobis-2-nitrobenoic acid,DTNB)法[21] 測定;抗壞血酸(ascorbic acid,AsA)含量采用分光光度法測定,在紅菲咯啉存在的條件下,AsA所還原的亞鐵離子與其反應形成紅色螯合物,通過測定D534 nm來計算AsA含量[22]。
1.3數據分析
采用Excel 2007、SPSS 16.0軟件對試驗數據進行分析和制作表格,并運用LSD法進行多重比較。
2結果與分析
2.1鈣對鹽脅迫下杜梨葉片活性氧和MDA含量的影響
由表1可以看出,在鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中超氧陰離子(O-2 · )的產生速率是對照的2.37倍,H2O2、MDA的含量分別是對照的2.24、1.64倍,這會造成植株葉片細胞活性氧代謝系統失去平衡,發生膜脂過氧化。施加5 ~ 100 μmol/L CaCl2后,O-2 · 的產生速率、H2O2和MDA的含量均隨著CaCl2濃度的增加呈現先下降后升高的趨勢。當CaCl2為5 ~ 10 μmol/L時,O-2 · 的產生速率、H2O2含量、MDA的含量顯著降低(降低27.6%~42.8%、36.1%~42.9%、10.6%~25.0%),且10 μmol/L CaCl2處理組中,上述3個指標最低(表1)。然而,當CaCl2為50~100 μmol/L 時,反而會刺激活性氧的積累(O-2 · 產生速率和H2O2含量增加),加劇膜質過氧化(MDA積累)。
2.2鈣對鹽脅迫下杜梨葉片抗氧化酶活性的影響
由表2可知,鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中超氧化物歧化酶(SOD)活性顯著降低(僅為對照的60.4%),而過氧化物酶(POD)、過氧化氫酶(CAT)、谷胱甘肽還原酶(GR)、谷胱甘肽過氧化物酶(GSH-Px)、抗壞血酸過氧化物酶(APX)活性均有不同程度升高(為對照的1.18~1.78倍)。這表明NaCl脅迫可輕微誘導杜梨葉片中POD、CAT、GR、GSH-Px、APX活性增強,卻抑制SOD的活性。施加5 ~ 100 μmol/L CaCl2后,抗氧化酶的活性均隨著CaCl2濃度的增加呈先增強后減弱的趨勢。當CaCl2為 10 μmol/L 時,抗氧化酶(除APX)的活性較鹽脅迫下差異最明顯(為鹽脅迫下的1.21~1.46倍)。然而,當CaCl2為50~100 μmol/L 時,抗氧化酶(除APX、GSH-Px)的活性較10 μmol/L CaCl2處理又顯著降低,且100 μmol/L CaCl2處理與鹽脅迫下相比較,抗氧化酶活性差異不顯著。而當CaCl2為5 ~ 100 μmol/L時,APX的活性均沒有顯著差異,但均比對照顯著增強。
2.3鈣對鹽脅迫下杜梨葉片抗氧化物質含量的影響
由表3可知,鹽脅迫(200 μmol/L NaCl)處理3 d后,杜梨葉片中抗氧化物質GSH、AsA含量顯著降低(僅為對照的382% ~ 44.9%),嚴重影響植株自身清除自由基的能力。施加5 ~ 100 μmol/L CaCl2后,抗氧化物質含量隨著CaCl2濃度的增加呈現先增加后減少的趨勢。當CaCl2為5~100 μmol/L 時,GSH的含量較鹽脅迫下均顯著提高,其中以CaCl2為10 μmol/L時差異最顯著,含量為鹽脅迫下的2.43倍。AsA的含量隨著CaCl2濃度的升高呈現先升高后降低的趨勢,其中當CaCl2為10~100 μmol/L 時,AsA的含量較鹽脅迫下均顯著提高,且在10 μmol/L時差異最顯著,含量為鹽脅迫下的2.07倍。
3結論與討論
鹽脅迫會引起植物體內發生一系列生理生化的變化,影響植物的正常生理調節。鈣是植物生長發育的必需元素,當植物處于鹽脅迫時,細胞內的鹽離子與Ca2+的吸收形成競爭作用,使得Ca2+不能被充分利用,導致植物細胞對Ca2+的緊缺。鹽脅迫對植物體的傷害,主要是通過對質膜完整性和鈣信號轉導系統的破壞[23-24],而添加一定濃度的外源鈣能夠有效緩解鹽脅迫對其帶來的傷害[25]。這可能是因為添加外源鈣不僅能夠補充植物體本身所需的鈣元素,而且能夠增加質膜的穩定性,恢復鈣信號轉導系統,同時維持細胞內的離子平衡。而鈣是一種膜保護劑,能夠穩定膜上的蛋白質,降低質膜透性,維持細胞內的離子區域化,使得植物細胞內的各種生理代謝正常進行,從而提高植物的耐鹽性。
高濃度的鈣對植物體的影響則截然相反。有研究表明,高濃度的Ca2+能夠降低植物的葉綠素含量和光合強度,同時對水稻幼苗的生長產生抑制作用[26]。這可能是因為過多的鈣離子積累會打破細胞內原有的營養平衡,對植物細胞造成新的離子毒害,迫使細胞產生滲透脅迫等不利于植物生長的因素。同時,高濃度的Ca2+還會引起細胞內的Ca2+濃度變化,進而在細胞內產生一系列生理生化的變化,造成膜損傷等傷害[27]。另外,雖然Ca2+與Na+的生物功能不同,但是它們的化學性質卻有很多相似性,在吸收過程中會形成競爭關系,而且離子過量對植物的傷害都是一樣的。本試驗中添加的CaCl2在為杜梨幼苗提供了所需要的Ca2+的同時,也過量積累了NaCl脅迫中的Cl-·,加劇了植物的鹽脅迫。
本試驗結果表明,鹽脅迫下,杜梨葉片中O-2 · 產生速率、H2O2含量和MDA含量均顯著增加;同時SOD活性降低,卻在不同程度上刺激了POD、CAT、GR、GSH-Px、APX的活性,使它們的活性增強;但抗氧化物質GSH、AsA的含量顯著降低。而在添加5、10、50、100 μmol/L CaCl2后,它們的含量或者活性都呈一定的變化規律,且在CaCl2濃度為 10 μmol/L 時,活性氧的含量降至最低水平,有效緩解了膜脂過氧化,同時所有抗氧化酶的活性達到最高水平,抗氧化物質的含量與對照條件下差異不顯著,因此,鹽脅迫對杜梨葉片帶來的氧化損傷也是最低的。可能是因為當CaCl2濃度為 5 μmol/L 或10 μmol/L 時,植物對鈣離子吸收增多,吸收到的鈣離子能與細胞膜上的相關物質結合,維持細胞膜的穩定性,降低膜透性,避免吸收更多的Na+;同時Ca2+通過對細胞內離子區域化作用,將胞內多余的Na+區隔開,從而保證細胞內各種代謝正常進行,對提高植物的耐鹽性有一定的作用。當CaCl2濃度為50 μmol/L或100 μmol/L時,植物細胞內Ca2+含量增多,可能對植物細胞造成了新的離子傷害,使得活性氧含量上升,膜脂過氧化加劇,抗氧化酶的活性減弱,同時抗氧化物質含量也顯著降低。這表明單純的鈣處理對植物緩解鹽脅迫的能力是有限的,其具體原因還有待進一步研究。
綜上所述,200 mmol/L鹽脅迫能對杜梨葉片造成很大程度的氧化傷害,而施加低濃度(5~10 μmol/L)CaCl2可以有效緩解這些傷害,這可能與Ca2+在植物中能夠維持細胞膜穩定性,具有離子區域化作用,作為細胞內第二信使調節植物生理代謝等作用有關。
參考文獻:
[1]章文華. 植物的抗鹽生理和鹽害的防治[J]. 植物生理學通訊,1997,33(6):479.
[2]Parida A K,Das A B. Salt tolerance and salinity effects on plants:a review[J]. Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[3]Braam J,Davis R W. Rain-,wind-,and touch-induced expression of calmodulin and calmodulin-related genes in Arabidopsis[J]. Cell,1990,60(3):357-364.
[4]張燕,方力,李天飛,等. 鈣對低溫脅迫的煙草幼苗某些酶活性的影響[J]. 植物學通報,2002,19(3):342-347.
[5]張建霞,李新國,孫中海. 外源鈣對柑橘抗熱性的相關生理生化指標的影響[J]. 華中農業大學學報,2005,24(4):397-400.
[6]朱曉軍,梁永超,楊勁松,等. 鈣對鹽脅迫下水稻幼苗抗氧化酶活性和膜脂過氧化作用的影響[J]. 土壤學報,2005,42(3):453-459.
[7]Okubo M,Sakuratani T. Effects of Sodium chloride on survival and stem elongation of two Asian pear rootstock seedlings[J]. Scientia Horticulturae,2000,85(1/2):85-90.
[8]Matsumoto K,Tamura F,Chun J P,et al. Enhancement in salt tolerance of Japanese pear by using Pyrus betulaefolia rootstock[J]. Hortic Res,2007,6(1):47-52.
[9]Okubo M,Furukawa Y,Sakuratani T. Growth,flowering and leaf properties of pear cultivars grafted on two Asian pear rootstock see dlings under NaCl irrigation[J]. Scientia Horticulturae,2000,85(1/2):91-101.
[10]Matsumoto K,Chun J P,Tamura F,et al. Salt tolerance in Pyrus species is linked to levels of Na and Cl translocation from roots to leaves[J]. Journal of the Japanese Society for Horticultural Science,2006,75(5):385-391.
[11]Wu Q S,Zou Y N. Adaptive responses of birch-leaved pear (Pyrus betulaefolia) seedlings to salinity stress[J]. Notulae Botanicae Horti Agrobotanici Cluj:Napoca,2009,37(1):133-138.
[12]Patterson B D,Macrae E A,Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(Ⅳ)[J]. Analytical Biochemistry,1984,139(2):487-492.
[13]Elstner E F,Heupel A. Inhibition of nitrite formation from hydroxylammoniumchloride:a simple assay for superoxide dismutase[J]. Analytical Biochemistry,1976,70(2):616-620.
[14]李合生. 植物生理學實驗技術指導[M]. 北京:高等教育出版社,2001.
[15]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[16]Ma C,Wang Z Q,Kong B B,et al. Exogenous trehalose differentially modulate antioxidant defense system in wheat callus during water deficit and subsequent recovery[J]. Plant Growth Regulation,2013,70(3):275-285.
[17]Aebi H. Catalase in vitro[J]. Methods in Enzymology,1984,105:121-126.
[18]Ali B,Tao Q J,Zhou Y F,et al. 5-Aminolevolinic acid mitigates the cadmium-induced changes in Brassica napus as revealed by the biochemical and ultra-structural evaluation of roots[J]. Ecotoxicology and Environmental Safety,2013,92:271-280.
[19]黃愛纓,吳珍齡. 水稻谷胱甘肽過氧化物酶的測定法[J]. 西南農業大學學報,1999,21(4):24-27.
[20]Nakano Y,Asada K. Hydrogen peroxide is scanvenged by ascorbated specific peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology,1981,22(5):867-880.
[21]Anderson M E. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods in Enzymology,1985,113:548-555.
[22]Law M Y,Charles S A,Halliwell B.Glutathion and scorbic acid in spinach (Spinacia oleracea) chloroplast.The effect of hydrogen peroxide and of paraquat[J]. Journal of Biochemistry,1983,253:109-116.
[23]Cramer G R,Luchli A,Polito V S. Displacement of Ca by Na from the plasmalemma of root cells:a primary response to salt stress[J]. Plant Physiology,1985,79(1):207-211.
[24]Lynch J,Polito V S,Luchli A. Salinity stress increases cytoplasmic ca activity in maize root protoplasts[J]. Plant Physiology,1989,90(4):1271-1274.
[25]Ben A N,Megdiche W,Jiménez A,et al. The effect of calcium on the antioxidant systems in the halophyte Cakile maritima under salt stress[J]. Acta Physiologiae Plantarum,2010,32(3):453-461.
[26]周焱. Ca2+對水稻幼苗生長的影響[J]. 貴州師范大學學報:自然科學版,2002,20(3):12-14.
[27]王勛陵,陳鑫陽,魯曉云. 鈣對臭氧傷害小麥的防護作用[J]. 西北植物學報,1993,13(3):163-169.

