不同鎘濃度處理下水稻植株鎘含量變化及其鎘調控相關基因表達分析
周全 王宏 張迎信 董青 孟帥 曹立勇 邵國勝 沈希宏
(中國水稻研究所, 杭州 310006; *通訊聯系人, E-mail: shaoguosheng@caas.cn; xihongshen@126.com)
?
不同鎘濃度處理下水稻植株鎘含量變化及其鎘調控相關基因表達分析
周全王宏張迎信董青孟帥曹立勇邵國勝*沈希宏*
(中國水稻研究所, 杭州 310006;*通訊聯系人,E-mail:shaoguosheng@caas.cn;xihongshen@126.com)
ZHOUQuan,WANGHong,ZHANGYingxin,etal.Changesincadmiumconcentrationinriceplantsunderdifferentcadmiumlevelsandexpressionanalysisofgenesretatedtocadmiumregulation.ChinJRiceSci, 2016, 30(4): 380-388.
周全, 王宏, 張迎信, 等. 不同鎘濃度處理下水稻植株鎘含量變化及其鎘調控相關基因表達分析. 中國水稻科學, 2016, 30(4): 380-388.
摘要:以地上部鎘含量不同的秈稻和粳稻品種各6個為材料,采用水培試驗,設置6個鎘濃度,研究了不同濃度鎘處理對不同水稻品種植株生長、鎘含量和相關重金屬轉運蛋白基因表達水平的影響。結果表明,鎘脅迫對水稻生長有抑制作用,表現為苗高、地上部干物質量和葉綠素含量下降。在不同鎘濃度處理下,植株根部和地上部的鎘含量存在顯著的基因型差異,植株中鎘從根部向地上部的轉運可能是水稻品種間以及秈粳亞種間地上部鎘含量差異的主要原因,根部鎘的吸收量影響較小。在0.50到2.00 mg/kg的高鎘處理梯度間,部分水稻品種地上部出現鎘積累飽和現象(鎘含量增加較少,部分水稻品種地上部鎘含量甚至顯著降低);在此鎘濃度處理下,OsNRMAP1、OsIRT2和OsNAS2的表達水平顯著上調,這可能與植株對鎘的吸收調節作用相關。
關鍵詞:水稻; 鎘; 基因型; 植株生長; 基因表達
鎘(Cd)作為有毒重金屬,主要通過食物鏈進入人體,對人類的健康產生危害。鎘在農田土壤中的污染,通常是由成土母質鎘含量高、污水灌溉、污泥農用、含鎘磷肥和含鎘農藥的施用引起的[1-3]。近年來,我國南方由于農田重金屬鎘污染或成土母質高鎘等因素,多省份發生了嚴重稻米鎘污染事件,如何控制稻米鎘污染已是十分迫切需要解決的問題[4]。
研究和生產實踐均已表明,水稻對鎘的吸收與積累存在明顯的基因型差異[5-7],同時這些差異也與土壤重金屬污染程度、氣候環境和土壤環境密切相關。比如,據調查,浙江省一些水稻品種籽粒鎘含量為0.1~0.4mg/kg[8]。He等[9]研究發現,在參試的38個中國長江下游地區的水稻品種中,糙米鎘含量為0.06~0.99mg/kg;Liu等[10]對來自不同區域的52個水稻品種的鎘積累特性進行了比較,發現其稻米鎘含量為0.22~2.86mg/kg。鎘主要通過根系細胞膜的二價金屬轉運蛋白而被水稻吸收,從而進入植株體內。OsNRAMP家族蛋白(如OsNRAMP1、OsNRAMP5)[11,14]、ZIP家族轉運蛋白(如OsIRT1、OsIRT2)[15]、OsHMA2[16-17]等均具有很強的鎘轉運功能。而OsHMA3位于液泡膜上,可將胞質中的鎘泵入液泡,不僅對根系鎘向地上部的轉運具有調控作用,而且對植株的鎘耐性具有重要作用[18];OsLCT1則參與植株節點韌皮部的鎘運輸,對籽粒鎘積累具有重要的調控作用[19,20]。
二價金屬離子如Fe2+、Mn2+、Zn2+等對植株鎘吸收與轉運都具有調控作用。這種調控作用主要表現在兩個方面,一是通過調控具有鎘轉運作用的轉運蛋白基因的表達水平,進而調控鎘吸收和轉運能力;二是這些金屬離子對Cd2+的吸收與轉運過程產生競爭作用。邵國勝等[21]發現鐵處理濃度上升可顯著降低水稻植株的鎘積累,這主要是因為鐵濃度上升降低了水稻根系鎘吸收能力,從而導致根系和地上部鎘含量均大幅降低。脫氧麥根酸(MAs)對三價鐵具有螯合作用,參與根系鐵的吸收等過程。Cheng等[22]發現,脫氧麥根酸前體尼克酰胺氨基轉移酶基因(NAAT)發生突變直接影響脫氧麥根酸的合成,抑制水稻根系對鐵的吸收,導致植株產生缺鐵現象;而缺鐵會誘導根系金屬離子吸收相關基因表達水平的提高,進而促進鎘的吸收。同時也有研究發現,脫氧麥根酸處理有利于抑制根系的鎘吸收。OsNAS2作為脫氧麥根酸前體合成中的一個重要酶,也參與了鐵吸收與轉運的調控[23]。
大量研究表明,隨著鎘濃度的提高,水稻植株鎘吸收和積累量也隨之增加[24-26]。然而我們前期的研究表明,在一定鎘濃度下,植株鎘吸收和積累水平確實隨著鎘濃度的提高而增加,但進一步提高鎘濃度,不論是根系還是地上部的鎘濃度卻出現了下降趨勢。本研究選用了前期已經驗證稻草(不含籽粒)鎘含量差異顯著的秈稻和粳稻材料各6份進行了多水平鎘梯度處理,以進一步驗證此現象并初步從鎘轉運相關基因表達水平上對此加以解析。
1材料與方法
1.1材料與處理
前期水培苗期水稻(鎘濃度為1.00mg/kg),篩選出地上部Cd含量高(日本晴、鄂宜105)、中(武運粳7號、嘉45)、低(丙814、矮輻粳)水平共6個粳稻品種和地上部Cd含量高(臺中1號、粳秈89)、中(萬利秈、輻品36)、低(9311、舟903)水平共6個秈稻品種作為本研究供試材料。
2015年6月在杭州市富陽區中國水稻研究所試驗基地,將12個供試材料的種子浸泡在10%的H2O2溶液中消毒30min,再用去離子水沖洗干凈。浸種催芽后播于經稀硫酸處理的沙床,15d后移植至裝有營養液的黑色不透明塑料桶中,塑料桶容積為4.5L,每桶種7穴,每穴3株,用樹脂塑料板分隔各穴,海綿固定(營養液按照國際水稻研究所的配方配制)。預培養14d后進行Cd脅迫處理,共設0.00,0.01,0.10,0.50,1.00和2.00mg/kg6個Cd處理,每個處理重復3次,以CdSO4為Cd源,培養液每3d更換1次,并用HCl和NaOH調節pH至5.0。
于Cd處理15d后測定各個品種不同處理下植株的葉綠素含量(SPAD法)和苗高,其中,葉綠素含量的測定樣本量為9,苗高樣本量為12。對植株取樣,一部分用于根部和地上部重金屬Cd、Mn、Cu、Zn、Fe含量的測定;另一部分取根部保存于-80℃下,用于重金屬轉運蛋白相關基因的表達分析。
1.2重金屬含量測定及重金屬轉運系數
植株根系用0.1mol/L的鹽酸短暫浸洗后,用蒸餾水沖洗2次以去除根表面附著元素。而后將植株分為根部和地上部兩部分,于105℃下殺青1h,并于70℃下烘干至恒重,稱取根部和地上部干物質量。粉碎成粉后經HNO3-H2O2消煮,利用全譜直讀電感耦合等離子發射光譜儀(ICP-AES)測定Cd,Mn,Cu,Zn,Fe含量。
Zhou等[1]用重金屬轉運系數(TF)來判定不同水稻品種重金屬積累和轉運的能力,本研究以莖葉重金屬含量與根部重金屬含量之比來衡量不同水稻品種重金屬Cd由根向地上部轉運能力(TFrs)。
1.3水稻重金屬轉運蛋白基因表達分析
水稻根系總RNA采用天根RNAprepPure植物總RNA提取試劑盒提取,用TOYOBO定量反轉錄試劑盒逆轉錄為cDNA。實時定量PCR體系按照TaKaRa的SYBRPremixExTaqTMⅡ定量試劑盒的要求配制,并用LightCycler480 定量PCR儀(Roche)進行分析,反應步驟如下:95℃下預變性30s; 95℃下變性5s,57℃下退火30s,72℃下延伸30s,共40個循環;熔解曲線分析, 95℃下5s,60℃下1min,95℃下 0s; 50℃下降溫30s。以OsActin基因作為內參基因,采用2-△△Ct法估算各個Cd處理下根系樣品中重金屬轉運蛋白基因的表達水平。所用基因引物均能單擴增其各自的基因,且熔解曲線均為單峰,引物序列見表1。其中,OsIRT2,OsNAS2和OsZIP4引物序列參照Lee等[27]的研究。
表1內參及重金屬轉運蛋白基因引物序列
Table1.Sequencesoftheprimersofreferenceandheavymetaltransportergenes.
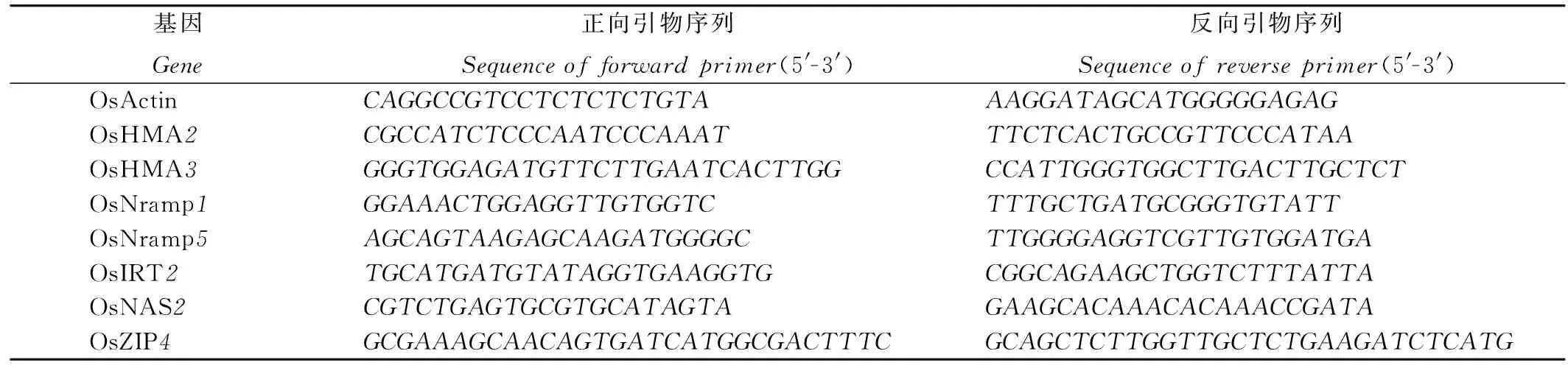
基因Gene正向引物序列Sequenceofforwardprimer(5'-3')反向引物序列Sequenceofreverseprimer(5'-3')OsActinCAGGCCGTCCTCTCTCTGTAAAGGATAGCATGGGGGAGAGOsHMA2CGCCATCTCCCAATCCCAAATTTCTCACTGCCGTTCCCATAAOsHMA3GGGTGGAGATGTTCTTGAATCACTTGGCCATTGGGTGGCTTGACTTGCTCTOsNramp1GGAAACTGGAGGTTGTGGTCTTTGCTGATGCGGGTGTATTOsNramp5AGCAGTAAGAGCAAGATGGGGCTTGGGGAGGTCGTTGTGGATGAOsIRT2TGCATGATGTATAGGTGAAGGTGCGGCAGAAGCTGGTCTTTATTAOsNAS2CGTCTGAGTGCGTGCATAGTAGAAGCACAAACACAAACCGATAOsZIP4GCGAAAGCAACAGTGATCATGGCGACTTTCGCAGCTCTTGGTTGCTCTGAAGATCTCATG
表2不同Cd濃度處理對12個水稻品種苗高的影響(平均數±標準差)
Table2.EffectsofdifferentCdlevelsonplantheightof12ricecultivars(Mean±SD).
cm
*P<0.05;**P<0.01。不同小寫字母表示處理間在0.05水平上差異顯著(新復極差法,n=9)。
*P<0.05;**P<0.01.Differentlowercaselettersindicatesignificantdifferenceamongtreatmentsat0.05levelbySSR(n=9).
1.4數據分析
采用Excel進行數據統計,用SPSS19.0軟件進行方差分析,Duncan新復極差法檢驗處理間差異。
2結果與分析
2.1Cd脅迫對水稻生長的影響
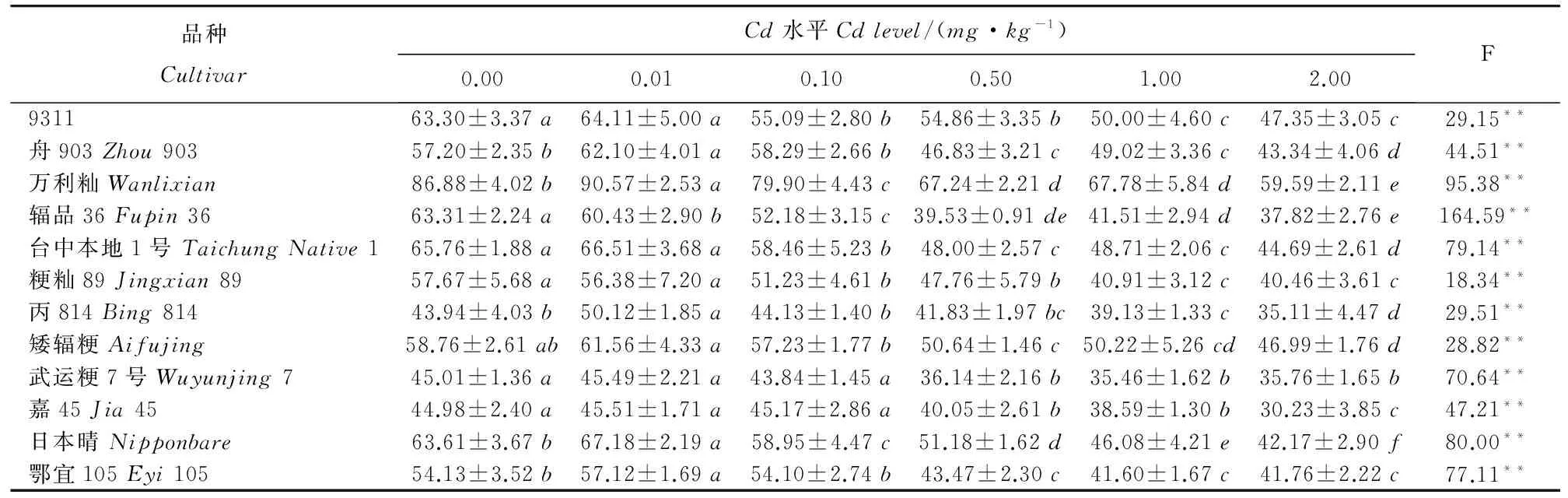
0.01mg/kg低Cd水平促進了10個水稻品種的生長(表2)。其中,5個品種與對照相比差異顯著;隨著Cd處理濃度的提高,Cd處理對水稻生長表現為抑制作用。在0.10mg/kgCd處理下時,有10個品種苗高已經顯著下降;當Cd處理≥0.50mg/kg時,12個水稻品種苗高均顯著下降。
Cd處理對植株地上部干物質量的影響與苗高相似。由圖1可見,在0.01mg/kg低Cd處理下,大部分品種的地上部干物質量均有所增加。不同水稻品種的干物質量受Cd處理濃度的影響程度不同,如日本晴和舟903在0.01、0.10、0.50mg/kg鎘處理下與對照相比干物質量變化不大,而9311和臺中本地1號的干物質量隨Cd處理濃度的變化波動較大。
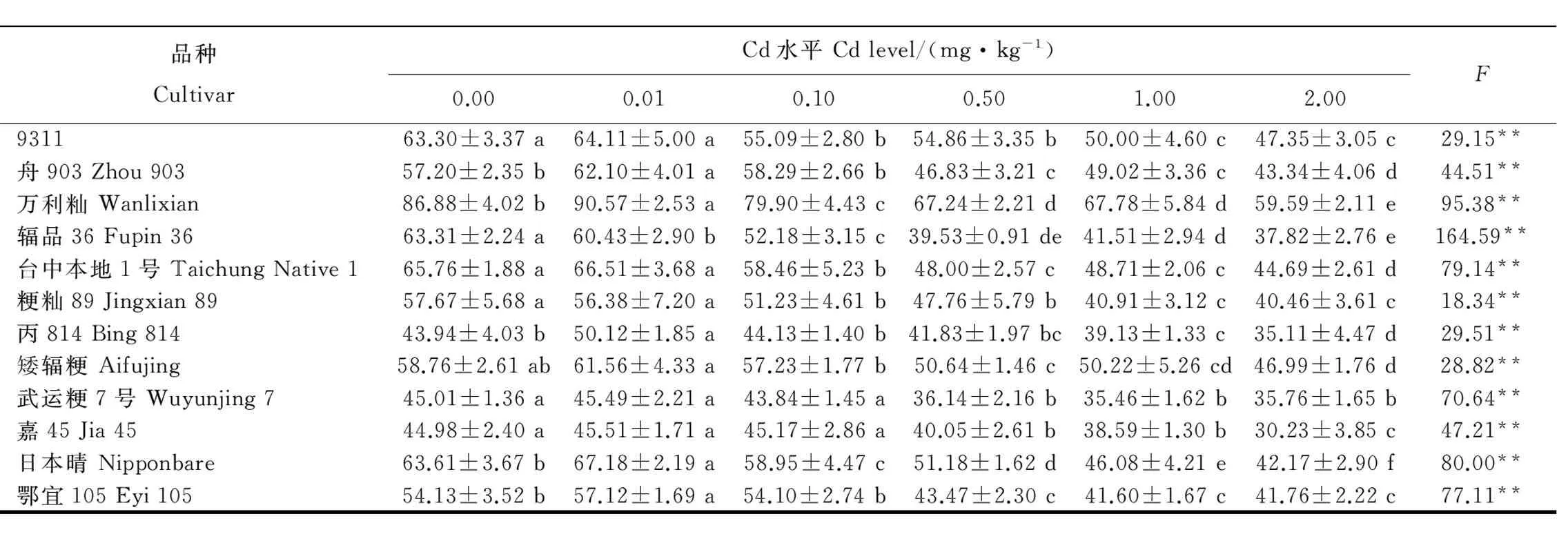
在0.01和0.10mg/kgCd處理下,除9311和日本晴外,其余10個水稻品種的葉綠素含量與對照相比,無顯著差異。在2.00mg/kgCd處理下,12個水稻品種植株葉片葉綠素含量與對照相比均顯著下降(表3),但降幅不如苗高明顯(6.62%~11.83%)。
表3不同Cd濃度處理對12個水稻品種葉片葉綠素含量(SPAD值)的影響(平均數±標準差)
Table3.EffectsofdifferentCdlevelsonchlorophyllcontent(SPADvalue)inleavesof12ricecultivars(Mean±SD).
品種CultivarCd水平Cdlevel/(mg·kg-1)0.000.010.100.501.002.00F931143.66±3.67a41.93±4.04ab39.75±3.05bc39.46±2.31bc38.97±2.01c38.49±3.46c4.75**舟903Zhou90340.48±1.83a38.92±1.29a39.59±2.10ab39.01±1.64ab37.38±2.82b37.35±2.33b4.32**萬利秈Wanlixian38.39±2.43a38.79±3.95a37.15±2.32ab36.81±2.39ab35.36±3.36b34.90±4.30b2.83*輻品36 Fupin3638.17±1.40a36.48±1.51abc37.72±4.06ab37.54±2.48ab35.63±2.81bc35.18±2.13c2.69*臺中本地1號TaichungNative141.84±1.86a41.24±5.15ab39.33±3.46ab38.03±2.54c39.68±2.83ab38.68±2.58bc2.49*粳秈89Jingxian8938.98±3.15a38.48±3.50a38.68±2.33a36.58±3.07ab34.86±1.20b34.50±3.13b5.94**丙814Bing81441.32±1.23a39.47±2.63ab39.95±1.59ab38.49±1.43b39.55±1.99ab38.01±4.06b2.90*矮輻粳Aifujing44.42±1.46a43.73±1.82ab43.63±2.04ab41.78±2.74bc41.80±2.50bc41.01±3.07bc4.12**武運粳7號Wuyunjing741.24±1.78a40.91±2.42a40.49±2.22a38.13±2.67b37.93±2.90b36.76±2.74b6.80**嘉45Jia4540.65±1.89a41.79±2.53a40.22±1.72a37.88±2.56b37.63±3.06b36.15±3.18b8.58**日本晴Nipponbare41.83±1.82a41.08±3.28ab39.56±1.55bc40.60±2.01ab40.08±0.90ab38.20±2.14c4.44**鄂宜105Eyi10540.05±1.91a40.76±1.60a39.64±2.20a37.80±2.10b37.11±2.23b37.40±2.19b6.81**
*P<0.05;**P<0.01。不同小寫字母表示處理間在0.05水平上差異顯著(新復極差法,n=12)。
*P<0.05,**P<0.01.Differentlowercaselettersindicatesignificantdifferenceamongtreatmentsat0.05levelbySSR(n=12).
總體上看,0.01mg/kg的低濃度Cd處理對水稻生長有一定的促進作用,表現為苗高增長、干物質量增大,對葉綠素含量影響不大;而0.10mg/kg以上的高濃度Cd處理對水稻生長表現出抑制作用,表現為苗高降低、干物質量減少,并且當Cd處理濃度達到2.00mg/kg時,葉綠素含量均顯著下降。
2.2植株Cd含量
12個品種根部與地上部Cd含量的測定與前期篩選的結果相似。從不同濃度Cd處理結果來看,在鎘濃度為0.00到0.50mg/kg范圍內,12個水稻品種地上部和根部Cd含量都隨著Cd濃度的提高而顯著增加(圖2)。然而,在高濃度Cd處理(0.50~2.00mg/kg)下,12個水稻品種植株地上部或者根部Cd含量增加較少甚至顯著降低。12個水稻品種間植株地上部Cd濃度存在顯著差異,而這種差異不僅與根部Cd濃度相關,還與Cd從根部到地上部的轉運速率相關。從表4可以看出,不同水稻品種莖葉中Cd含量與根系鎘含量之比(TFrs)存在顯著的品種間差異。分析發現,在0.50、1.00和2.00mg/kgCd處理下秈粳亞種間Cd的TFrs差異顯著(P<0.05),整體上粳稻Cd的TFrs較小。
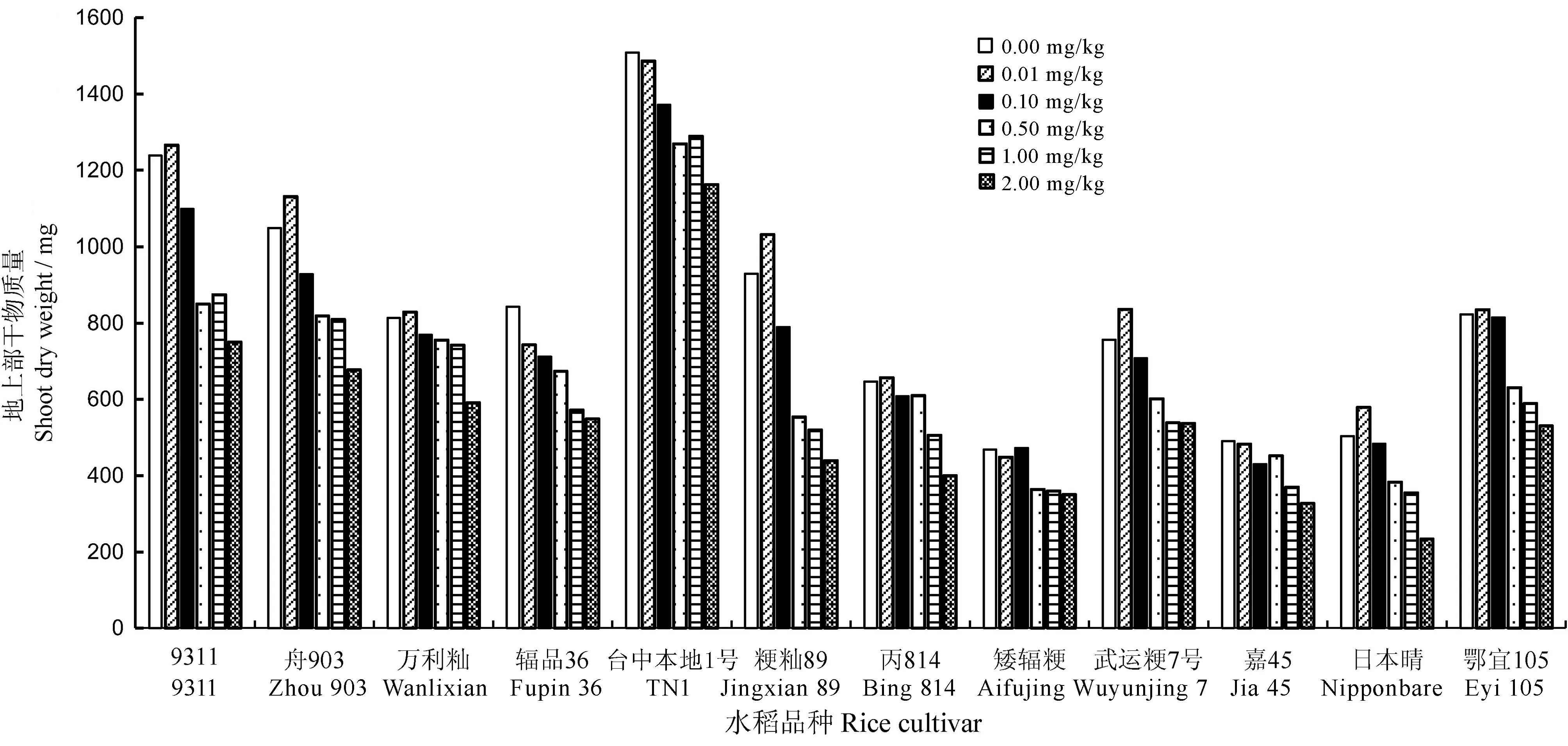
圖1不同Cd濃度處理對12個水稻品種地上部干物質量的影響
Fig. 1.EffectsofdifferentCdlevelsonshootdryweightof12ricecultivars.
2.3Cd積累相關轉運蛋白基因表達分析
選取了12個代表性的水稻品種對7個鎘積累相關的重金屬轉運蛋白基因在苗期水培Cd梯度處理下的表達特征進行了分析(圖3)。其中OsNRAM1、OsNRAMP5、OsIRT2和OsZIP4參與水稻根系Cd、Fe、Mn、Zn的吸收; OsHMA2參與Cd和Zn從根部向地上部的轉運,OsHMA3通過將Cd區隔化在液泡中減少Cd向地上部的轉運;而OsNAS2主要參與植株體內Fe和其他金屬的平衡。結果發現OsNRAMP1、OsIRT2和OsNAS2這3個基因在對照以及0.01和0.10mg/kg的低Cd處理下表達量變化不顯著且表達量很低,但是在高Cd處理(0.50~2.00mg/kg)下被大量誘導表達,并且不同品種間表達水平存在顯著差異。與OsNRAMP1、OsIRT2和OsNAS2相比,OsHMA2、OsHMA3、OsNRAMP5和OsZIP4在對照以及0.01和0.10mg/kg的低Cd處理下便具有較高的表達水平,并且隨著Cd處理濃度的變化其表達量變化的趨勢因品種而異,但變幅遠不如OsNRAMP1、OsIRT2和OsNAS2。

圖2不同濃度Cd處理下12個水稻品種植株地上部和根系Cd含量
Fig. 2.ConcentrationsofCdintherootsandshootsof12ricecultivarstreatedwithCdatdifferentlevels.
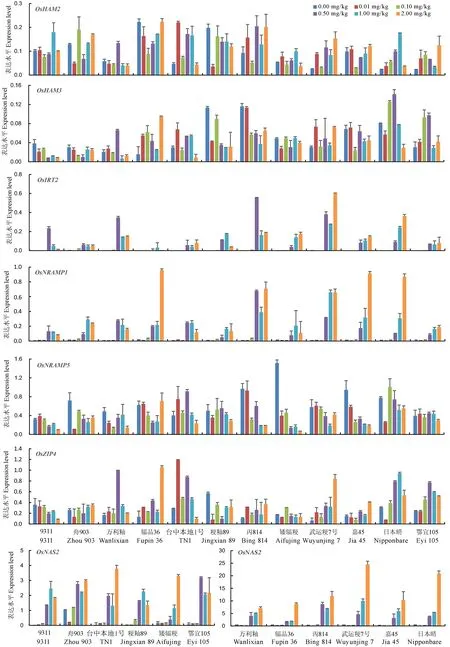
圖3不同Cd處理下12個水稻品種根部重金屬轉運蛋白基因的實時定量表達分析
Fig. 3.Real-timePCR-basedexpressionlevelsofheavymetaltransportergenesinrootsof12ricecultivarsunderdifferentCdtreatments.
表4不同Cd濃度處理下12個水稻品種重金屬Cd的轉運系數TFrs
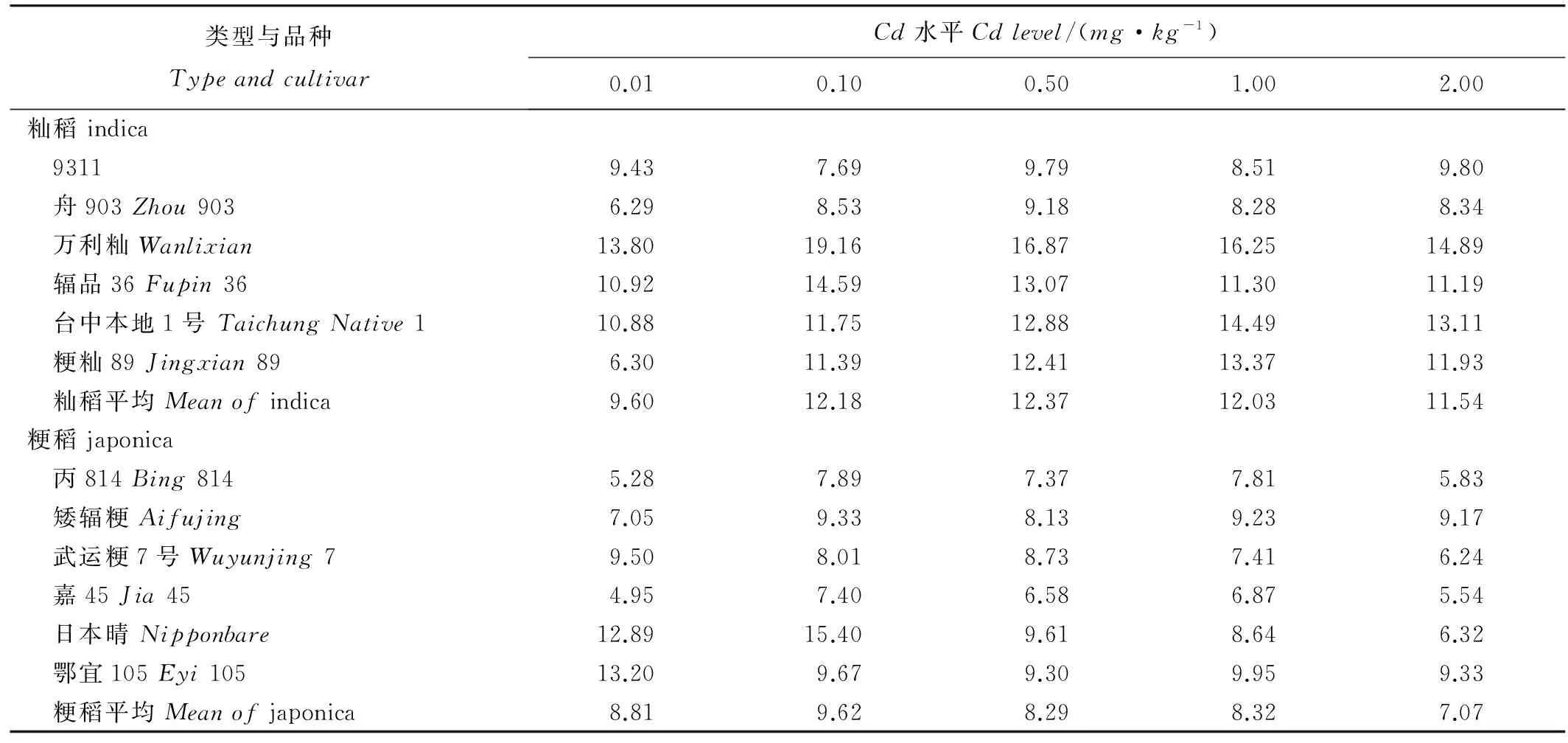
Table 4. TFrs of Cd of 12 rice cultivars under different Cd levels. %
3討論
植株在鎘脅迫下通常表現為生長矮小和葉片失綠[28]。而本研究發現,0.01mg/kg低Cd水平處理對大多數水稻品種的生長有一定的促進作用,這與邵國勝等[24]在0.10μmol/L鎘處理下觀察到的現象一致。在高Cd處理(0.50~2.00mg/kg)下,水稻植株對Cd的耐性表現出了顯著的品種間差異,其中,輻品36耐性最差,在2.00mg/kgCd處理下苗高和干物質量與對照相比分別降低了40.26%和52.70%,而武運粳7號耐性較好,分別降低了20.55%和25.28%。
在水稻中,有關鎘吸收積累的品種間差異的研究國內外已有不少報道,并且以往許多研究都以根系Cd吸收能力來解釋不同生態型、品種以及株系間地上部Cd積累的差異[29-32]。而本研究發現,秈稻品種臺中本地1號和舟903在高Cd處理(0.50~2.00mg/kg)下根系Cd含量雖然差異不顯著,但臺中本地1號地上部的Cd濃度卻極顯著高于舟903;而Cd轉運系數最高的秈稻品種萬利秈與轉運系數最低的粳稻品種嘉45相比,在高Cd處理(0.50~2.00mg/kg)下雖然嘉45根系中Cd含量極顯著高于萬利秈,但地上部中嘉45的Cd含量卻極顯著低于萬利秈。這表明Cd由根部向地上部的轉運能力(莖葉重金屬含量與根部重金屬含量之比)才是決定部分水稻秈粳品種地上部Cd積累的關鍵過程,這與Uraguchi等[33]最新的研究結果一致,而且本研究還表明亞種間不同品種地上部Cd積累差異也是由該過程引起的。
本研究發現,在高Cd處理(0.50~2.00mg/kg)下,12個水稻品種植株地上部或者根部Cd含量增加較少甚至部分品種Cd含量反而顯著降低,這種水稻植株對Cd吸收飽和的現象可能是植株對非必需元素Cd吸收的自我調節,即當植株中Cd含量上升到一定濃度時,植株為了減少Cd的毒害作用,可能通過分泌絡合物來降低有效態的Cd及其移動性,也可能通過調節相關轉運蛋白的活性來降低對Cd的轉運。如在本研究中發現的OsNRAMP1、OsIRT2和OsNAS2在高Cd處理下被大量誘導表達可能與植株對Cd的吸收調節作用相關,然而是否存在這種調節方式,尚需進一步研究。此外,還可能存在Cd的外排蛋白,當體內Cd上升到一定水平時可將部分Cd排出體外,如在水稻根系中已發現砷的外排蛋白[34]。
參考文獻:
[1]ZhouH,ZengM,ZhouX,etal.Heavymetaltranslocationandaccumulationinironplaquesandplanttissuesfor32hybridrice(Oryza sativaL.)cultivars. Plant & Soil, 2015, 386(1/2): 317-329.
[2]KikuchiT,OkazakiM,ToyotaK,etal.Theinput-outputbalanceofcadmiuminapaddyfieldofTokyo. Chemosphere, 2007, 67(5): 920-927.
[3] 王英英, 錢蜀, 鄧星亮. 成都平原西部農業土壤中金屬元素分布特征研究. 三峽環境與生態, 2012, 34(5): 11-14, 18.
WangYY,QianS,DengXL.InvestigationintoheavymetalsdistributioninthefarmlandsoilsinthewesternofChengduplain. Environ Ecol Three Gorg, 2012, 34(5): 11-14, 18. (inChinese)
[4] 詹杰, 魏樹和, 牛榮成. 我國稻田土壤鎘污染現狀及安全生產新措施. 農業環境科學學報, 2012, 31(7): 1257-1263.
ZhanJ,WeiSH,NiuRC.AdvancesofcadmiumcontaminatedpaddysoilresearchandnewmeasureofitssafeproductioninChina:Areview. J Agro-Environ Sci, 2012, 31(7): 1257-1263. (inChinesewithEnglishabstract)
[5] 甄燕紅, 成顏君, 潘根興, 等. 中國部分市售大米中Cd,Zn,Se的含量及其食物安全評價. 安全與環境學報, 2008, 8(1): 119-122.
ZhenYH,ChengYJ,PanGX,etal.Cd,ZnandSecontentsofthepolishedricesamplesfromsomeChineseopenmarketsandtheirrelevancetofoodsafety. J Safe Environ, 2008, 8(1): 119-122. (inChinesewithEnglishabstract)
[6]LiuJ,ZhuQ,ZhangZ,etal.Variationsincadmiumaccumulationamongricecultivarsandtypesandtheselectionofcultivarsforreducingcadmiuminthediet. J Sci Food Agric, 2005, 85: 147-153.
[7]LiuJ,QianM,CaiG,etal.UptakeandtranslocationofCdindifferentricecultivarsandtherelationwithCdaccumulationinricegrain. J Hazard Mater, 2007, 143(1): 443-447.
[8] 胡培松. 土壤有毒重金屬鎘毒害及鎘低積累型水稻篩選與改良. 中國稻米, 2004, 14(3): 165-169.
HuPS.Cadmiumdetoxificationinsoilandbreedingofnewricewithlesscadmiumaccumulation. China Rice, 2004, 14(3): 165-169. (inChinese)
[9]HeJ,ZhuC,RenY,etal.Genotypicvariationingraincadmiumconcentrationoflowlandrice. J Plant Nutr Soil Sci, 2006, 169(5): 711-716.
[10]LiuJ,ZhuQ,ZhangZ,etal.Variationsincadmiumaccumulationamongricecultivarsandtypesandtheselectionofcultivarsforreducingcadmiuminthediet. J Sci Food&Agric, 2005, 85(1): 147-153.
[11]TakahashiR,IshimaruY,SenouraT,etal.TheOsNRAMP1irontransporterisinvolvedinCdaccumulationinrice. J Exp Bot, 2011, 62(14): 4843-4850.
[12]TakahashiR,IshimaruY,NakanishiH,etal.RoleoftheirontransporterOsNRAMP1incadmiumuptakeandaccumulationinrice. Plant Signal & Behav, 2011, 6(11): 1813-1816.
[13]SasakiA,YamajiN,YokoshoK,etal.Nramp5isamajortransporterresponsibleformanganeseandcadmiumuptakeinrice. Plant Cell, 2012, 24(5): 2155-2167.
[14]IshikawaS,IshimaruY,IguraM,etal.Ion-beamirradiation,geneidentification,andmarker-assistedbreedinginthedevelopmentoflow-cadmiumrice. Proc Natl Acad Sci, 2012, 109(47): 19166-19171.
[15]NakanishiH,OgawaI,IshimaruY,etal.IrondeficiencyenhancescadmiumuptakeandtranslocationmediatedbytheFe2+transportersOsIRT1andOsIRT2inrice. Soil Sci &Plant Nutr, 2006, 52(4): 464-469.
[16]YamajiN,XiaJ,Mitani-UenoN,etal.PreferentialdeliveryofzinctodevelopingtissuesinriceismediatedbyP-typeheavymetalATPaseOsHMA2. Plant Physiol, 2013, 162(2): 927-939.
[17]TakahashiR,IshimaruY,ShimoH,etal.TheOsHMA2transporterisinvolvedinroot-to-shoottranslocationofZnandCdinrice. Plant, Cell & Environ, 2012, 35(11): 1948-1957.
[18]MiyadateH,AdachiS,HiraizumiA,etal.OsHMA3,aP1B-typeofATPaseaffectsroot-to-shootcadmiumtranslocationinricebymediatingeffluxintovacuoles. New Phytol, 2011, 189(1): 190-199.
[19]UraguchiS,KamiyaT,SakamotoT,etal.Low-affinitycationtransporter(OsLCT1)regulatescadmiumtransportintoricegrains. Proc Natl Acad Sci, 2011, 108(52): 20959-20964.
[20]UraguchiS,KamiyaT,ClemensS,etal.CharacterizationofOsLCT1,acadmiumtransporterfromindicarice(Oryza sativa). Physiol Plant, 2014, 151(3): 339-347.
[21]ShaoG,ChenM,WangW,etal.Ironnutritionaffectscadmiumaccumulationandtoxicityinriceplants. Plant Growth Regul, 2007, 53(1): 33-42.
[22]ChengL,WangF,ShouH,etal.MutationinnicotianamineaminotransferasestimulatedtheFe(II)acquisitionsystemandledtoironaccumulationinrice. Plant Physiol, 2007, 145(4): 1647-1657.
[23]InoueH,HiguchiK,TakahashiM,etal.Threericenicotianaminesynthasegenes, OsNAS1, OsNAS2,andOsNAS3areexpressedincellsinvolvedinlong-distancetransportofironanddifferentiallyregulatedbyiron. Plant J, 2003, 36(3): 366-381.
[24]邵國勝,MuhammadJH, 章秀福, 等. 鎘脅迫對不同水稻基因型植株生長和抗氧化酶系統的影響. 中國水稻科學, 2004, 18(3): 239-244.
ShaoGS,MuhammadJH,ZhangXF,etal.Effectsofcadmiumstressonplantgrowthandantioxidativeenzymesystemindifferentricegenotypes. Chin J Rice Sci, 2004, 18(3): 239-244. (inChinesewithEnglishabstract)
[25]何俊瑜, 任艷芳, 朱誠, 等. 鎘脅迫對不同水稻品種種子萌發, 幼苗生長和淀粉酶活性的影響. 中國水稻科學, 2008, 22(4): 399-404.
HeJY,RenYF,ZhuC,etal.Effectsofcadmiumstressonseedgermination,seedlinggrowth,andamylaseactivitiesinrice. Chin J Rice Sci, 2008, 22(4): 399-404. (inChinesewithEnglishabstract)
[26]覃都, 陳銘學, 周蓉, 等. 錳-鎘互作對水稻生長和植株鎘, 錳含量的影響. 中國水稻科學, 2010, 24(2): 189-195.
QinD,ChenMX,ZhouR,etal.Effectsofinteractionbetweenmanganeseandcadmiumonplantgrowthandcontentsofcadmiumandmanganeseinrice. Chin J Rice Sci, 2010, 24(2): 189-195. (inChinesewithEnglishabstract)
[27]LeeS,PerssonDP,HansenTH,etal.Bio-availablezincinriceseedsisincreasedbyactivationtaggingofnicotianaminesynthase. Plant Biotechnol J, 2011, 9(8): 865-873.
[28]DasP,SamantarayS,RoutGR.Studiesoncadmiumtoxicityinplants:Areview. Environ Pollut, 1997, 98(1): 29-36.
[29]HartJJ,WelchRM,NorvellWA,etal.Characterizationofcadmiumbinding,uptake,andtranslocationinintactseedlingsofbreadanddurumwheatcultivars. Plant Physiol, 1998, 116(4): 1413-1420.
[30]HartJJ,WelchRM,NorvellWA,etal.Characterizationofcadmiumuptake,translocationandstorageinnear‐isogeniclinesofdurumwheatthatdifferingraincadmiumconcentration. New Phytol, 2006, 172(2): 261-271.
[31]ZhaoFJ,HamonRE,LombiE,etal.CharacteristicsofcadmiumuptakeintwocontrastingecotypesofthehyperaccumulatorThlaspi caerulescens. J Exp Bot, 2002, 53(368): 535-543.
[32]ChanDY,HaleBA.DifferentialaccumulationofCdindurumwheatcultivars:Uptakeandretranslocationassourcesofvariation. J Exp Bot, 2004, 55(408): 2571-2579.
[33]UraguchiS,MoriS,KuramataM,etal.Root-to-shootCdtranslocationviathexylemisthemajorprocessdeterminingshootandgraincadmiumaccumulationinrice. J Exp Bot, 2009, 60(9): 2677-2688.
[34]ZhaoFJ,McGrathSP,MehargAA.Arsenicasafoodchaincontaminant:mechanismsofplantuptakeandmetabolismandmitigationstrategies. Ann Rev Plant Biol, 2010, 61: 535-559.
收稿日期:2016-02-29; 修改稿收到日期: 2016-04-21。
基金項目:公益性行業(農業)科研專項(201403015); 國家自然科學基金資助項目(31571616); 中國農業科學院(協同)創新工程資助項目; 國家863計劃資助項目(2014AA10A603-15)。
中圖分類號:Q945.48; S511.01
文獻標識碼:A
文章編號:1001-7216(2016)04-0380-09
ChangesinCadmiumConcentrationinRicePlantsUnderDifferentCadmiumLevelsandExpressionAnalysisofGenesRetatedtoCadmiumRegulation
ZHOUQuan,WANGHong,ZHANGYing-xin,DONGQing,MENGShuai,CAOLi-yong,SHAOGuo-sheng*,SHENXi-hong*
(China National Rice Research Institute, Hangzhou 310006, China;*Corresponding author, E-mail: shaoguosheng@caas.cn; xihongshen@126.com)
Abstract:Using six indica and six japonica cultivars, differed in cadmium concentrations in the above-ground parts, the growth, heavy metal contents and expression levels of heavy metal transporter related genes were studied in a hydroponic experiment at six cadmium levels. Cadmium stress reduced plant height, shoot dry weight and chlorophyll content in rice leaves, inhibiting rice growth. Significant difference in cadmium content in rice roots and shoots among rice cultivars were found under different cadmium treatments, and the results showed that root-to-shoot translocation may be a key process that determine the difference in cadmium contents between rice cultivars and subspecies, while cadmium absorption by roots had little effect. At various cadmium levels (from 0.50 to 2.00 mg/kg), saturation of cadmium accumulation in rice shoots were found in some cultivars that cadmium content stopped increasing or even decreased. Besides, the expression levels of OsNRMAP1,OsIRT2 and OsNAS2 were significantly increased at such cadmium treatment, which might be attributed to the regulation of rice plants.
Key words:rice; cadmium; genotype; plant growth; gene expression

