益生菌對大鼠酒精性肝損傷的保護作用及機制研究
梁 惠,呂 銳,傅 泳,周治彤,劉 穎,周曉彬,王文成,劉 曼,馬愛國
(1. 青島大學醫學院醫學營養研究所,山東 青島 266021;2. 青島大學醫學院病原生物學實驗室,山東 青島 266071;3. 江南大學食品科學與工程,江蘇 無錫 214122;4. 青島大學醫學院細胞與分子生物學實驗室,山東 青島 266071;5. 青島大學醫學院流行病學和衛生統計學教研室,山東 青島 266021 )
?
益生菌對大鼠酒精性肝損傷的保護作用及機制研究
梁惠1,呂銳2,傅泳1,周治彤3,劉穎4,周曉彬5,王文成1,劉曼1,馬愛國1
(1. 青島大學醫學院醫學營養研究所,山東 青島266021;2. 青島大學醫學院病原生物學實驗室,山東 青島266071;3. 江南大學食品科學與工程,江蘇 無錫214122;4. 青島大學醫學院細胞與分子生物學實驗室,山東 青島266071;5. 青島大學醫學院流行病學和衛生統計學教研室,山東 青島266021 )
目的探討益生菌對大鼠酒精性肝損傷的保護作用。方法建立酒精性肝損傷模型,同時以碧悠益生菌發酵乳5×108CFU·kg-1·d-1灌胃干預,持續8周。HE染色觀察各組大鼠肝組織病理學改變;透射電鏡觀察肝及小腸組織超微結構變化;酶法檢測血清轉氨酶及ALP活力;ELISA法檢測血清DAO和D-LA水平;免疫組化法檢測小腸組織FOXO4表達情況;16S rDNA高通量測序進行糞便腸道菌群結構分子生態學分析。結果益生菌干預使酒精誘導的肝脂肪變性得到明顯緩解,肝及小腸組織超微結構亦得到不同程度改善,其病理學評分明顯降低(P<0.05);同時,血清ALT、AST、ALP、DAO和D-LA水平均明顯下降,小腸FOXO4表達明顯提高(P<0.05)。益生菌干預在腸道菌群菌門、菌屬水平均較酒精模型組有不同程度改變,豐度最高的前20個菌屬與正常對照組一致率達到90%,對恢復腸道菌群多樣性及豐度正常狀態具有一定調節作用。結論益生菌對大鼠酒精性肝損傷具有一定保護作用,其作用機制可能與益生菌糾正腸道菌群結構紊亂,修復腸道屏障功能,改善腸道內環境有關。
益生菌;酒精性肝損傷;腸道屏障功能;腸道菌群;16S rDNA高通量測序;分子生態學
長期過量酒精攝入可導致肝功能異常和肝纖維化,而“肝腸軸”的存在,使腸道微生態紊亂及腸道屏障功能破壞成為酒精性肝損傷重要發病機制之一[1-2]。益生菌制劑是一類能促進腸道菌群生態平衡,對宿主健康有益的活體微生物制劑。1994年,Nanji[3]等首先發現乳酸菌Lactobacillus GG干預能夠緩解酒精灌胃大鼠內毒素血癥和肝損傷。此后,越來越多的證據表明,補充益生菌對酒精性損傷具有明顯改善作用[4-5]。但目前從腸道菌群結構分子生態學角度系統探討益生菌調節腸道菌群,改善酒精性肝損傷作用機制研究鮮有報道。本實驗以碧悠益生菌發酵乳為干預物,觀察其對大鼠酒精性肝損傷改善效果,同時采用Illumina宏基因組高通量測序技術[6]對腸道菌群16S rDNA進行測序分析,系統探討益生菌調節腸道菌群,改善酒精性肝損傷分子生態學作用機制。
1 材料與方法
1.1主要試劑及儀器碧悠益生菌發酵乳,包含嗜熱鏈球菌、保加利亞乳桿菌及乳雙歧桿菌,其含量為1×1011CFU·L-1,由達能乳品銷售(上海)有限公司提供;兔抗FOXO4多克隆抗體(北京博奧森生物技術有限公司);DAO、D-LA ELISA檢測試劑盒(上海迪奧生物科技有限公司);細菌基因組DNA提取試劑盒(QIAgen)。腸道菌群基因組DNA樣品16S rDNA高通量測序,委托上海生工生物工程股份有限公司完成。JEM1200EX透射電鏡(JEOL);BioPhotometer plus6132型核酸蛋白檢測儀(Eppendorf)。
1.2動物模型建立及分組SPF級♂ Wistar大鼠,體質量180~220 g,青島市藥品檢驗所提供,動物合格證號:SCXK(魯)20090007。適應性喂養1周后,隨機分為3組。正常對照組給予生理鹽水灌胃,持續8周;酒精模型組給予56°紅星二鍋頭灌胃,5.5 mL·kg-1·d-11周+7.5 mL·kg-1·d-11周+8.0 mL·kg-1·d-11周+9.0 mL·kg-1·d-11周+11 mL·kg-1·d-14周;益生菌干預組給予5×108CFU·kg-1·d-1灌胃,1 h后給予56°紅星二鍋頭灌胃,劑量同酒精模型組,持續8周。末次灌胃后,采用代謝籠收集各組大鼠糞便各3~5粒,-80 ℃凍存備用。腹主動脈取血,摘取肝及小腸組織用于后續實驗。
1.3肝組織病理學觀察取肝組織(0.9 cm×0.9 cm×0.5 cm),體積分數為0.1的中性甲醛固定,常規石蠟包埋、切片,HE染色,中性樹膠封片,光學顯微鏡下觀察各組大鼠肝組織形態學改變。
1.4肝臟及小腸組織超微結構觀察將肝臟及腸組織(1 mm3)分別于體積分數為0.025的戊二醛固定4 h,0.1 mol·L-1磷酸緩沖液漂洗,體積分數為0.01的鋨酸固定1 h。磷酸緩沖液漂洗,丙酮逐級脫水,環氧樹脂包埋,50~70 nm厚度切片,體積分數為0.03的醋酸雙氧鈾和檸檬酸鉛染色,透射電鏡觀察。
1.5肝臟功能血清學指標檢測采用賴氏法檢測各組大鼠血清谷丙轉氨酶(ALT)和谷草轉氨酶(AST)活力,采用微量酶標法檢測血清堿性磷酸酶(ALP)活力,操作步驟嚴格按試劑盒說明書進行。
1.6腸黏膜屏障功能血清學指標檢測采用ELISA實驗檢測血清二胺氧化酶(DAO)和D-乳酸(D-LA)水平,操作步驟嚴格按試劑盒說明書進行。
1.7免疫組化實驗檢測小腸組織中FOXO4表達按照免疫組化SP試劑盒說明書對小腸組織切片進行免疫組化染色。每組切片隨機選取50個視野,采用Simple PCI圖像分析系統,于光學顯微鏡下觀察小腸組織中叉頭樣轉錄因子O4(FOXO4)表達情況。對所測定組織的背底進行光密度值(OD)檢測,定出標準作為參考值;通過手動選擇陽性細胞及陽性區域,計算機數據自動統計系統計算出所測細胞平均光密度值。FOXO4表達陽性細胞以細胞核染色出現棕黃色顆粒為判斷標準,OD值越大,表明FOXO4陽性表達越強。
1.8糞便腸道菌群16S rDNA高通量測序稱取100 mg糞便樣品,采用細菌基因組DNA提取試劑盒獲得腸道菌群基因組DNA,將濃度及純度檢測合格的DNA樣品送至上海生工生物工程股份有限公司,對16S rDNA V3~V4區域進行高通量測序,測序平臺為Illumina Miseq 2×300,引物為341F,805R。使用Qiime、Muscle 3.8.31、MEGAN 5.7.1、RDP classifier、fasttree 2.1.3等多種軟件對測序結果進行系統的腸道菌群結構分子生態學分析。
2 結果
2.1益生菌干預對大鼠肝臟組織病理學改變的影響結果顯示,正常對照組大鼠肝小葉結構清晰,肝索呈放射狀排列,肝細胞亦無明顯脂肪變性。酒精模型組大鼠肝細胞腫脹,出現明顯脂肪變性,胞質空泡化,可見炎性細胞浸潤和壞死,其病理學評分較正常對照組明顯升高(P<0.05)。益生菌干預組大鼠肝臟脂肪變性較酒精模型組明顯得到改善,肝索排列較為整齊,組織結構趨向正常,肝臟病理學評分較酒精模型組明顯降低(P<0.05)。見Tab 1,Fig 1。
2.2益生菌干預對大鼠肝臟組織超微結構的影響結果顯示,正常對照組肝細胞核呈圓形或橢圓形,核膜完整,核仁清晰,線粒體形態正常,嵴結構清晰,粗面內質網結構正常,核糖體豐富,少見脂滴。酒精模型組肝細胞核呈不規則形,核膜不規則或模糊,脂滴增多。線粒體腫脹變形,嵴結構模糊,粗面內質網腫脹斷裂,排列紊亂。益生菌干預組肝細胞核形態趨于正常,核膜完整,胞質脂滴數量減少,線粒體結構基本正常,病變明顯減輕,粗面內質網退化與排列紊亂程度有所改善。見Fig 2。
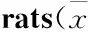
Tab 1 Effect of probiotics on pathological observation of liver tissue in ±s)
*P<0.05vscontrol group;#P<0.05vsalcohol group
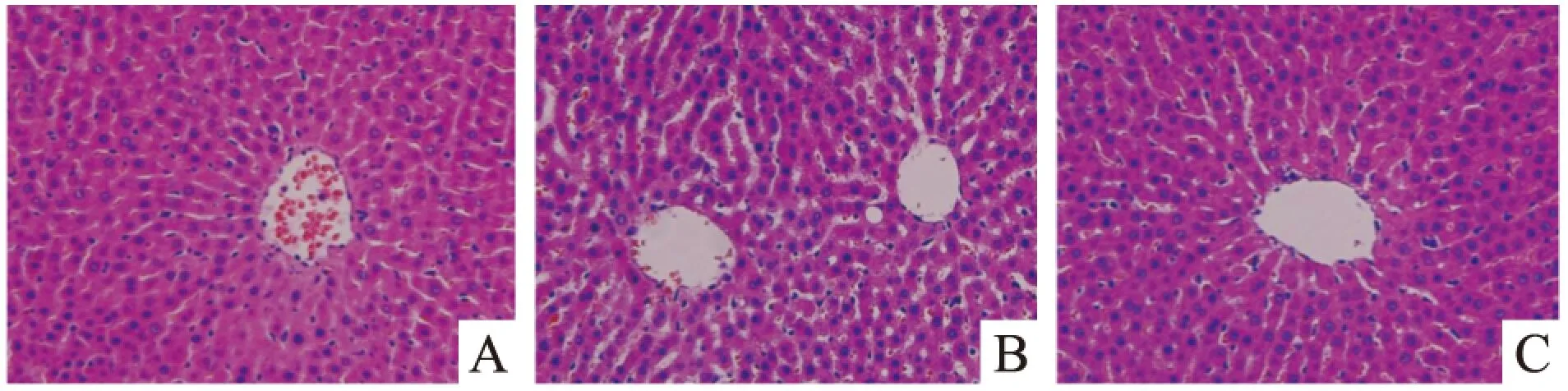
Fig 1 Pathological observation of liver tissue by HE staining in rats(×400)
A:Control;B:Alcohol;C:Probiotics
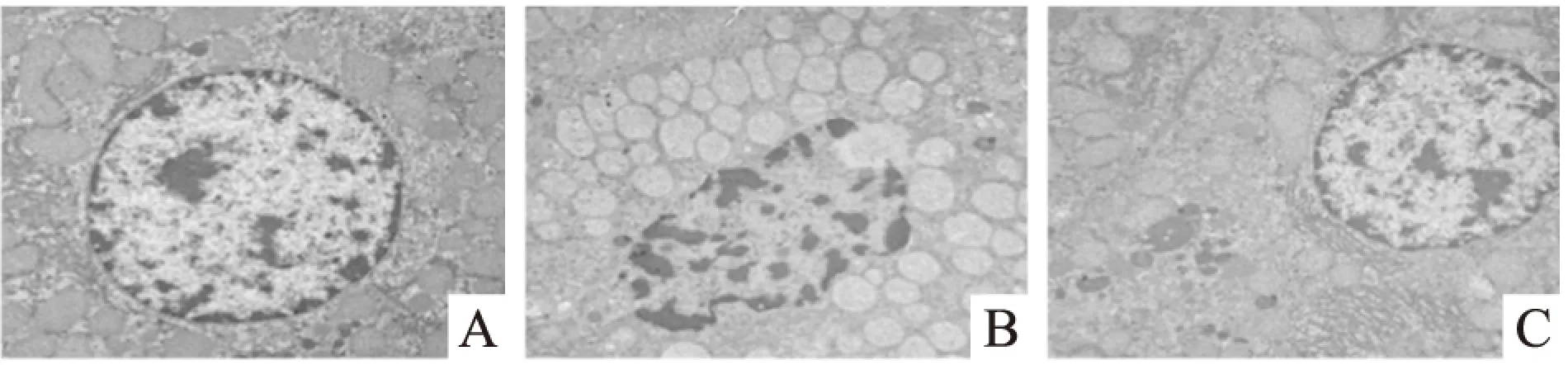
Fig 2 Transmission electron microscopy of liver in rats
A:Control;B:Alcohol;C:Probiotics
2.3益生菌干預對大鼠小腸組織超微結構的影響結果顯示,正常對照組小腸上皮柱狀細胞排列整齊,小腸絨毛豐富,細胞間緊密連接結構完整清晰。酒精模型組出現小腸微絨毛排列稀疏,緊密連接腫大等病理改變。益生菌干預組小腸柱狀上皮及微絨毛排列情況均得到不同程度改善,緊密連接腫脹減輕。見Fig 3。
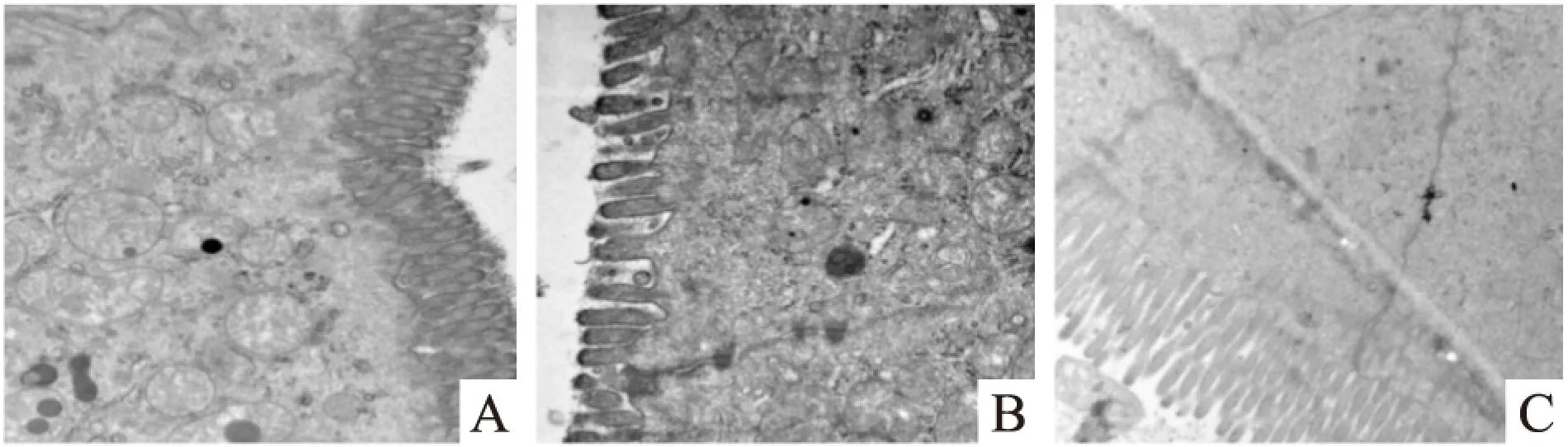
Fig 3 Transmission electron microscopy of small intestine in rats
A:Control;B:Alcohol;C:Probiotics
2.4益生菌干預對大鼠肝臟功能的影響結果顯示,酒精模型組大鼠血清ALT、AST及ALP水平均明顯上升,分別為正常對照組的1.4、1.3和1.4倍(P<0.05)。益生菌干預組ALT、AST及ALP水平均較酒精模型組明顯降低(P<0.05)。見Tab 2。
Tab 2Effect of probiotics on serum ALT,
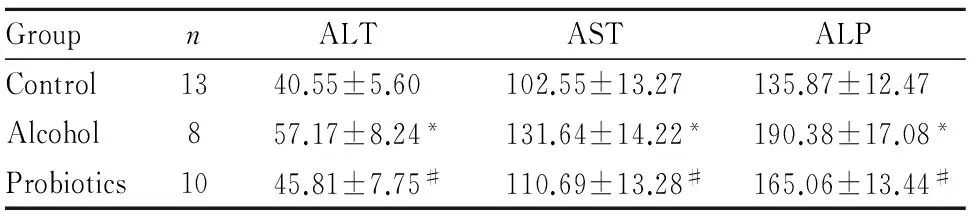
GroupnALTASTALPControl1340.55±5.60102.55±13.27135.87±12.47Alcohol857.17±8.24*131.64±14.22*190.38±17.08*Probiotics1045.81±7.75#110.69±13.28#165.06±13.44#
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.5益生菌對大鼠血清中DAO及D-LA水平的影響結果顯示,酒精模型組大鼠血清中DAO及D-LA水平明顯升高,均達到正常對照組的1.3倍(P<0.05);補充益生菌后大鼠血清中DAO及D-LA水平分別較酒精模型組明顯降低了20.2%和23.6%(P<0.05)。見Tab 3。
Tab 3 Changes of plasma DAO and
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.6益生菌對大鼠小腸組織FOXO4表達的影響結果顯示,酒精模型組FOXO4表達明顯減少,達到正常對照組的50.0%,益生菌干預組FOXO4表達則較酒精模型組明顯提高了38.5%(P<0.05)。見Fig 4,Tab 3。

Fig 4 Expression of FOXO4 in small intestine detected by immunohistochemistry(×400)
A:Control;B:Alcohol;C:Probiotics
2.7糞便腸道菌群16S rDNA高通量測序分析
2.7.1測序概況各組樣品共獲得453 467條高質量標簽序列,在97%相似性水平下對序列進行聚類分析,共產生91 104條OTU序列。分析結果顯示,各組間標簽序列及OTU序列數目有所差別,但差異均無顯著性(P>0.05)。見Tab 4。
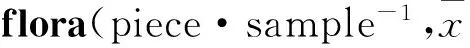
Tab 4 Comparison of sequence number in fecal intestinal ±s)
同時,本實驗以OTU數據為計算依據構建VENN圖進行菌群多樣性定性分析。結果顯示,酒精模型組與正常對照組的共有OTU序列為1 956條,而益生菌干預組與正常對照組的共有序列則為2 061條;同時,酒精模型組的OTU中有46.7%在其他組中沒有出現,而正常對照組和益生菌干預組的這一數值分別是54.1%和52.9%。提示酒精損傷后大鼠腸道菌群多樣性可能受到了一定影響,益生菌補充對恢復腸道菌群正常狀態具有一定調節作用。見Fig 5。
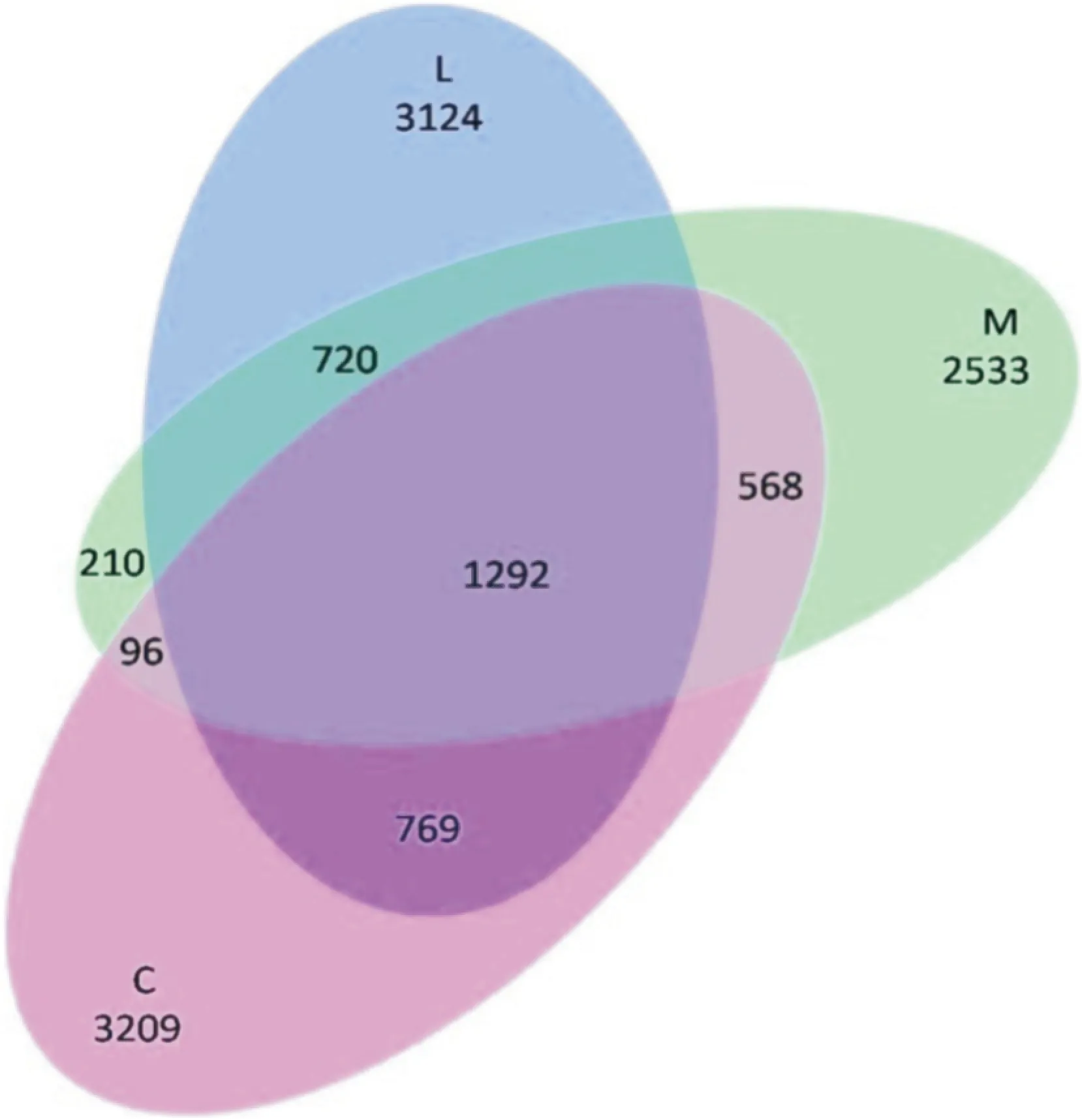
Fig 5 Qualitative analysis of intestinal microbial flora diversity among groups
C:Control;M:Alcohol;L:Probiotics
2.7.2Alpha多樣性分析Alpha多樣性反映的是單個樣品內部的物種多樣性,包括ACE指數、chaol指數、coverage、shannon指數和Simpson指數等。本實驗對所有樣品alpha多樣性進行計算,并做出相應稀疏曲線圖。
2.7.2.1菌群豐度評估通過ACE指數和Chao1指數等評估各組樣品菌群豐度。結果顯示,酒精損傷后腸道菌群豐度有所降低,益生菌對恢復菌群豐度具有一定調節作用,但各組間差異均未見顯著性(P>0.05)。見Tab 5,Fig 6。
2.7.2.2菌群多樣性分析通過shannon指數和Simpson指數評估各組樣品菌群多樣性。結果顯示,酒精損傷使腸道菌群多樣性有所降低,而益生菌對恢復菌群多樣性具有一定調節作用,但各組間差異均未見顯著性(P>0.05)。見Tab 5,Fig 6。
2.7.2.3樣品文庫覆蓋率評估為衡量樣本取樣深度,進行Coverage指數和稀疏性曲線分析。結果表明,隨著測序量的增加,還會有新的物種出現。但各組樣本Coverage指數均趨近于85 %,提示測序深度已經基本能夠覆蓋該微生物群落中絕大多數細菌。分析結果還顯示,在測序量較低(<500)時,各組樣本Shannon指數均明顯上升,隨著測序量的擴大,Shannon指數逐漸變緩并最終均達到平臺期,Shannon指數均趨近于7.0,Simpson指數多小于0.006,表明多樣性已基本達到飽和,均勻度較高,可用于后續分析。見Tab 5,Fig 6。
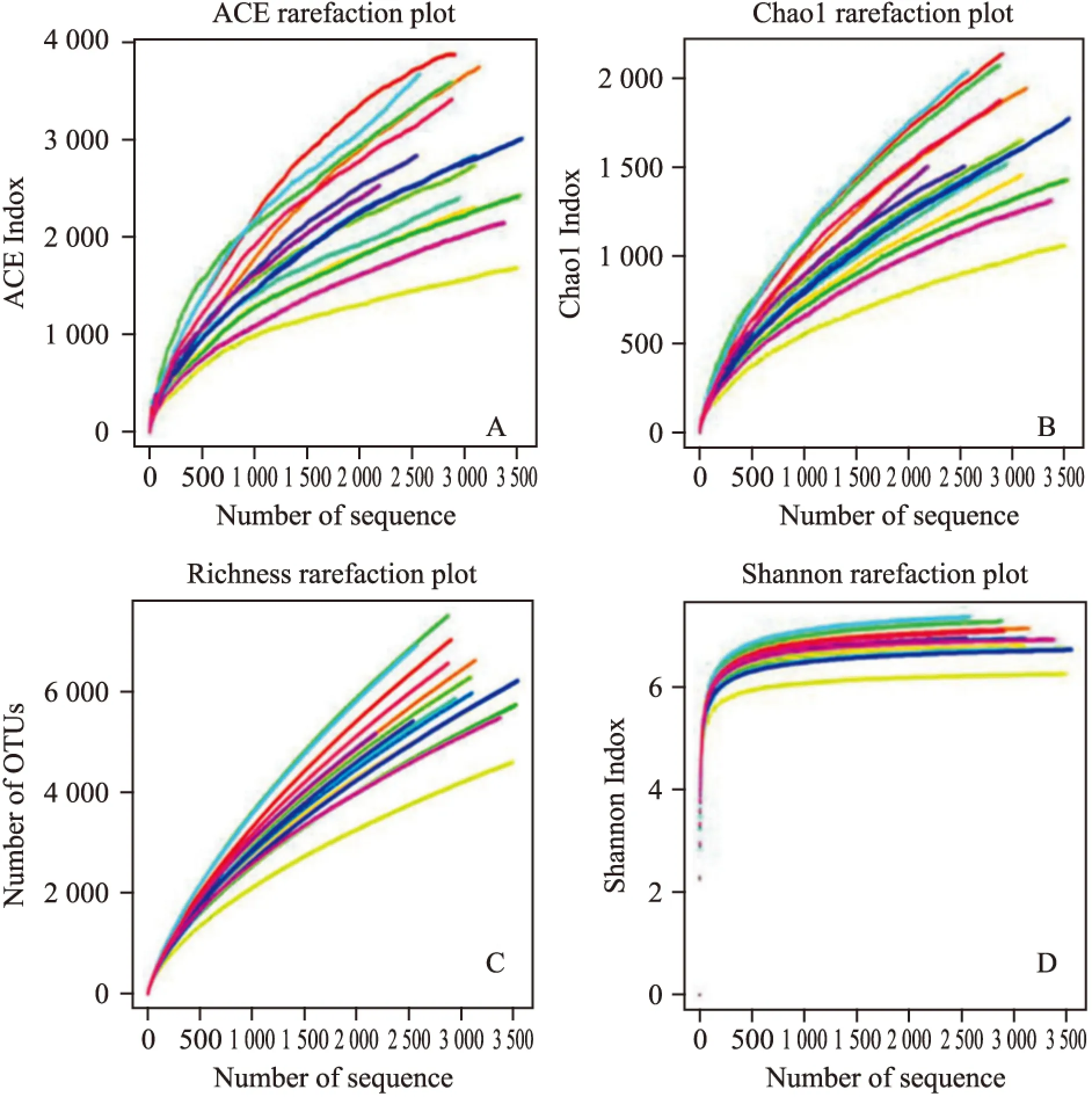
Fig 6 Alpha analysis of intestinal microbial flora among groups
A:ACE rarefaction plot;B:Chao1 rarefaction plot;C:Richness rarefaction plot;D:Shannon rarefaction plot
2.7.3腸道菌群菌門水平豐度分析結果發現,各組大鼠腸道菌群主要分屬11個菌門,其最優勢菌門均為厚壁菌門(firmicutes)、擬桿菌門(bacteroidetes)和變形菌門(proteobacteria)。酒精模型組腸道菌群中厚壁菌門數量較正常對照組明顯減少,而擬桿菌門數量明顯增多(P<0.05);益生菌干預后,厚壁菌門數量較酒精模型組增加,而擬桿菌門數量有所減少,但差異均未見顯著性(P>0.05)。非優勢菌門中,酒精模型組柔膜菌門(tenericutes)和迷蹤菌門(elusimicrobia)數量與正常對照組比較明顯增高,而益生菌干預組迷蹤菌門數量則較酒精模型組明顯降低(P<0.05)。變形菌門及其余非優勢菌門在各組間差異均未見顯著性或含量微乎其微(P>0.05)。見Tab 6。
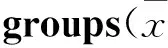
Tab 5 Alpha diversity of intestinal microbial flora among ±s)

Tab 6 Analysis of intestinal microbial flora among groups in phylum ±s)
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.7.4腸道菌群菌屬水平豐度分析結果顯示,正常對照組檢測到約170個菌屬,酒精模型組約為154個菌屬,益生菌干預組約為164個菌屬,分別較正常對照組減少了9.4%和3.5%。酒精模型組豐度最高的前20個菌屬與正常對照組一致率僅為75%,且各菌屬豐度亦較正常對照組有較大差別。益生菌干預組豐度最高的前20個菌屬與正常對照組一致率達到90%,且其中大部分菌屬的豐度構成比較酒精模型組更接近于正常對照組。各組大鼠腸道菌群豐度前20位菌屬分布見Fig 7。
3 討論
腸道菌群是人體在長期進化過程中形成的腸道正常微生物群,它們按一定數量和比例分布在腸道不同節段與部位,對宿主發揮機械屏障、生物屏障、免疫屏障等重要生理作用。長期過量飲酒可使腸道微生物群的組成和分布發生紊亂[7-8],細菌易位、部分革蘭陰性菌(G-)過度繁殖均可造成腸道黏膜屏障的完整性破壞及功能障礙,促使內毒素、氨、硫醇等腸源性毒物過度產生并滲漏入血,經門靜脈進入肝臟后,最終導致和加重酒精性肝損傷狀況[9-10]。因此,維持腸道微生態穩定,恢復腸黏膜屏障功能,對防治酒精性肝損傷具有重要意義[11]。
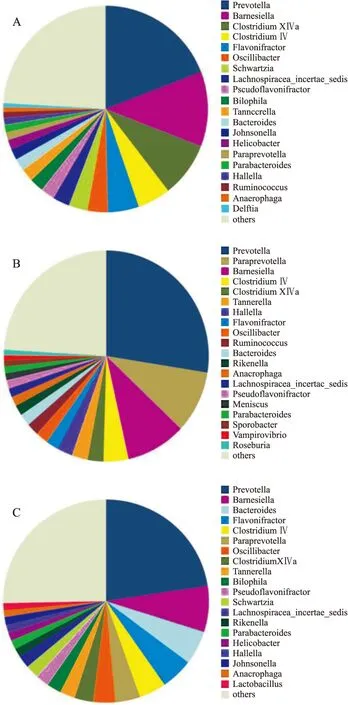
Fig 7 Analysis of intestinal microbial flora among groups in genus level
A:Control;B:Alcohol;C:Probiotics
研究表明,合理攝入活性益生菌制劑,對腸道菌群失調具有良好的改善、修復作用。2001年,我國衛生部公布了雙歧桿菌(bifidobacterium)、乳酸桿菌(lactobacillus)、嗜熱鏈球菌( streptococcus thermophilus )等3類共計9種可用于保健食品的益生菌名單。本實驗采用包含以上3類益生菌的碧悠發酵乳作為干預物,研究其對酒精性肝損傷及腸道屏障功能的改善效果。結果顯示,益生菌對酒精攝入導致的肝組織損傷具有一定保護作用,與相關報道一致[4-5,12-13]。D-LA是細菌發酵的代謝產物,DAO是哺乳動物腸黏膜上層絨毛細胞中具有高度活性的細胞內酶,二者在腸黏膜細胞遭到破壞時均可釋放入血,從而成為腸道屏障功能檢測血清學敏感評價指標。FOXO4是叉頭框蛋白轉錄因子O亞家族的一員,研究表明,腸黏膜組織中FOXO4表達降低與腸黏膜屏障功能障礙密切相關[14]。本實驗檢測結果顯示,補充益生菌可明顯改善小腸組織超微結構損傷狀況,血清D-LA和DAO水平明顯降低,FOXO4表達則明顯增多,表明益生菌干預對酒精攝入引起的腸道黏膜屏障破壞具有一定修復作用。
為了進一步探討益生菌改善腸道屏障功能,緩解肝組織損傷的作用機制是否與其對腸道菌群的調節作用有關,本研究采用16S rDNA高通量測序技術對大鼠糞便腸道菌群結構進行了系統的分子生態學分析。16S rDNA是編碼原核生物核糖體小亞基rRNA(16S rRNA)相對應的DNA序列。由于16S rDNA能夠較好體現不同菌屬之間的差異,故而作為細菌分類學研究最有用的“分子鐘”而被普遍使用[6]。本實驗測序結果表明,酒精誘導使腸道菌群多樣性及菌門、菌屬豐度均受到一定影響,主要表現為:① OTU、VENN、Shannon指數等多樣性評價指標均較正常對照組降低;② 厚壁菌門及擬桿菌門等優勢菌門、柔膜菌門及迷蹤菌門等非優勢菌門數量均較正常對照組差異具有顯著性;③ 正常對照組分布前3位的菌屬分別為普氏菌屬(Prevotella)、Barnesiella菌屬和梭菌屬XlVa,而酒精模型組分布前3位的菌屬中,帕拉普氏菌屬(Paraprevotella)取代了Barnesiella菌屬位于第2位;④ 正常對照組分布于前20位的菌屬中施氏菌屬、嗜膽菌屬、螺桿菌屬(Helicobacter)、Johnsonella菌屬和代爾夫特菌屬(Delftia)在酒精模型組前20位菌屬分布中均未出現,取而代之的是理研菌屬(Rikenella)、新月菌屬(Meniscus)、Sporobacter菌屬、蝙蝠弧菌屬(Vampirovibrio)和羅氏菌屬(Roseburia)5種菌屬。補充益生菌對恢復腸道菌群正常狀態具有一定調節作用。主要表現為:① 各種多樣性評價指數均較酒精模型組更接近正常對照組;② 各優勢菌門數量與酒精模型組比較差異雖無顯著性,但均有所改善,更趨向于正常大鼠,且迷蹤菌門數量明顯降低至正常水平。③ 分布在前2位的菌屬與正常對照組一致;④ 分布在前20位的菌屬中,只有理研菌屬與酒精模型組一致而未出現在正常對照組中,而作為有益菌的乳桿菌屬(Lactobacillus)只出現在益生菌干預組。以上結果表明,酒精誘導使腸道菌群發生擾動,補充益生菌可能通過調節腸道菌群結構,有效改善腸道菌群紊亂狀況,修復腸黏膜屏障,減少內毒素等有毒物質滲漏入血,從而延緩酒精性肝損傷進程。
綜上所述,益生菌通過調節腸道微生態紊亂,改善腸道屏障功能,對大鼠酒精性肝損傷發揮保護作用。益生菌作為一種安全有效的活體微生物制劑,值得在酒精性肝損傷治療領域得到進一步推廣應用。
(致謝:本實驗在青島大學醫學院醫學營養研究所實驗室完成,感謝實驗室全體老師對本實驗的大力支持和幫助。)
[1]邱萍,李相,孔德松,等. 酒精性肝病發病機制研究的新進展[J]. 中國藥理學通報,2014,30(2):160-3.
[1]Qiu P, Li X, Kong D S, et al. Research progress on pathogenesis of alcoholic liver disease[J].ChinPharmacolBull, 2014, 30(2):160-3.
[2]Szabo G,Bala S. Alcoholic liver disease and the gut-liver axis[J].WorldJGastroenterol, 2010, 16(11):1321-9.
[3]Nanji A A, Khettry U, Sadrzadeh S M. Lactobacillus feeding reduces endotoxemia and severity of experimental alcoholic liver(disease)[J].ProcSocExpBiolMed,1994, 205(3):243-7.
[4]Chang B, Sang L, Wang Y,et al. The protective effect of VSL#3 on intestinal permeability in a rat model of alcoholic intestinal injury[J].BMCGastroenterol,2013,13:151.
[5]Komatsuzaki N,Shima J. Effects of live Lactobacillus paracasei on plasma lipid concentration in rats fed an ethanol-containing diet[J].BiosciBiotechnolBiochem,2012,76(2):232-7.
[6]Ong S H,Kukkillaya V U,Wilm A,et al. Species identification and profiling of complex microbial communities using shotgun Illuminasequencing of 16S rRNA amplicon sequences[J].PLoSOne,2013,8(4):e60811.
[7]Mutlu E A,Gillevet P M,Rangwala H, et al. Colonic microbiome is altered in alcoholism[J].AmJPhysiolGastrointestLiverPhysiol,2012,302(9):G966-78.
[8]Kavanaugh M J,Clark C, Goto M, et al. Effect of acute alcohol ingestion prior to burn injury on intestinal bacterial growth and barrier function[J].Burns,2005,31(3):290-6.
[9]Mutlu E, Keshavarzian A, Engen P,et al. Intestinal dysbiosis: a possible mechanism of alcohol-induced endotoxemia and alcoholic steatohepatitis in rats[J].AlcoholClinExpRes,2009,33(10):1836-46.
[10]吳夏飛,連娜琦,陸春風,等. 腸道菌群對慢性肝臟疾病影響的研究進展[J].中國藥理學通報,2013,29(12):1644-7.
[10]Wu X F, Lian N Q, Lu C F, et al. Research progress on effect of intestinal flora on chronic liver diseases[J].ChinPharmacolBull, 2013, 29(12):1644-7.
[11]Szabo G. Gut-liver axis in alcoholic liver disease[J].Gastroenterology,2015,148(1): 30-6.
[12]張波,魯曉嵐,宋亞華,等.腸道內環境在酒精性脂肪肝發病中的初始作用及益生菌的治療效果[J].中華肝臟病雜志,2012,20(11):848-52.
[12]Zhang B, Lu X L, Song Y H, et al. Changes in the intestinal microenvironment during development of alcoholic fatty liver disease and related effects of probiotic therapy[J].ChinJHepatol,2012,20(11):848-52.
[13]Wang Y, Kirpich I, Liu Y, et al.Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury[J].AmJPathol,2011,179(6): 2866-75.
[14]Chang B,Sang L,Wang Y,et al. The role of FoxO4 in therelationship between alcohol-induced intestinal barrier dysfunction and liver injury[J].IntJMolMed,2013,31(3):569-76.
Effects of probiotics on alcoholic liver injury in rats and its mechanisms
LIANG Hui1, LYU Rui2, FU Yong1, ZHOU Zhi-tong3, LIU Ying4,ZHOU Xiao-bin5,WANG Wen-cheng1, LIU Man1, MA Ai-guo1
(1.TheInstituteofHumanNutrition,MedicalCollegeofQingdaoUniversity,QingdaoShandong266021,China;2.LaboratoryofPathogenBiology,MedicalCollegeofQingdaoUniversity,QingdaoShandong266071,China;3.TheSpecialtyofFoodScienceandEngineering,JiangnanUniversity,WuxiJiangsu214122,China;4.LaboratoryofCellularandMolecularBiology,MedicalCollegeofQingdaoUniversity,QingdaoShandong266071,China;5.TeachingandResearchSectionEpidemicofDiseaseandHealthStatistics,MedicalCollegeofQingdaoUniversity,QingdaoShandong266021,China)
AimTo observe the protective effects of probiotics on alcoholic liver injury in rats.MethodsMale Wistar rats were randomly divided into the following three groups: control group, normal diet with normal (5×108CFU·kg-1·d-1) treatment group. Excluding the rats in the normal control group, the other animals were initially received intragastric administration with 56%(V/V) ethanol 5.5~11.0 mL·kg-1·day-1for 8 weeks. Then the rats’ faeces were collected, and the liver and the small intestine were obtained for pathologic and ultrastructural observation. Serum ALT, AST and ALP was measured by method of biochemistry. Serum DAO and D-LA was measured by enzyme linked immunosorbent assay. The expression of FOXO4 in small intestine was detected by immunohistochemistry. The intestinal flora genome DNA was extracted from faeces and the sequence of 16S rDNA was analyzed by high-throughput sequencing technologies.ResultsHepatic steatosis was obviously improved in probiotics treatment groups compared with ethanol-treated group, and the ultrastructural such as mitochondrial and rough endoplasmic reticulum pathological changes was significantly alleviated. The ultrastructural changes in intestinal were better in probiotics treatment group than in the ethanol-treated group. And ethanol-induced rats’ serum ALT, AST, ALP, D-LA and DAO levels showed a significant reduction in the probiotics treatment groups compared with the ethanol-treated group(P<0.05). The FOXO4 expression was increased obviously in the probiotics treatment groups compared with the ethanol-treated group(P<0.05). And the intestinal flora diversity was impacted after feeding alcohol, and probiotics had a certain regulative action in helping the intestinal flora back to normal state; At phylum level, the Firmicutes quantity was lower and the Bacteroidetes quantity was higher in ethanol-treated group than those in the control group(P<0.05), and the conditions were improved after supplementing probiotics. At genus level, the percent of genus abundance was similar to normal control group in the probiotics treatment groups compared with the ethanol-treated group.ConclusionProbiotics can relieve liver injury induced by alcohol in rats, and the mechanism may be related to the modulation of probiotics on the intestinal flora distribution and intestinal barrier.
probiotics; alcoholic liver disease; intestinal barrier; intestinal flora;16s rDNA high throughput sequencing;molecular ecology
2016-02-18,
2016-04-16
國家自然科學基金資助項目(No 81573137);達能營養中心膳食營養研究與宣教基金資助項目(No DIC2014-03); 青島大學創新型教學實驗室研究項目
梁惠(1964-),女,博士,教授,博士生導師,研究方向:醫學營養學,Tel:0532-82991503,E-mail:qdlianghui@126.com;馬愛國(1956-),男,博士,教授,博士生導師,通訊作者,E-mail:magfood@126.com
10.3969/j.issn.1001-1978.2016.07.021
A
1001-1978(2016)07-0991-07
R-332;R154;R322.45;R575.01;R975
網絡出版時間:2016-6-20 11:49網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.042.html