產胞外多糖植物乳桿菌的篩選及粗多糖的活性研究
馮小婉,夏永軍,王光強,艾連中*(上海理工大學醫療器械與食品學院,上海 200093)
?
產胞外多糖植物乳桿菌的篩選及粗多糖的活性研究
馮小婉,夏永軍,王光強,艾連中*
(上海理工大學醫療器械與食品學院,上海 200093)
摘 要:通過觀察乳酸菌菌落拉絲狀況并測定其胞外多糖(exopolysaccharide,EPS)的產量,篩選出1 株所產EPS黏性好、產量高的乳酸菌AR307,經鑒定為植物乳桿菌。為得到更多的胞外多糖,對植物乳桿菌AR307的發酵條件進行優化,確定其在發酵溫度32 ℃、發酵時間20 h條件下的產糖量為389 mg/L。在體外實驗中,所得胞外多糖具有抑制HT-29腫瘤細胞活性、降低血糖水平的作用。
關鍵詞:植物乳桿菌;發酵條件;胞外多糖
引文格式:
馮小婉, 夏永軍, 王光強, 等.產胞外多糖植物乳桿菌的篩選及粗多糖的活性研究[J].食品科學, 2016, 37(13): 125-129.
FENG Xiaowan, XIA Yongjun, WANG Guangqiang, et al.Screening of exopolysaccharide (EPS)-producing Lactobacillus plantarum and bioactivity of the EPS[J].Food Science, 2016, 37(13): 125-129.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201613022. http://www.spkx.net.cn
乳酸菌在食品工業中應用廣泛,除了具有維持胃腸道正常的微生態平衡、抑制病原菌的入侵與感染[1]、增強機體免疫力[2]、預防和抑制腫瘤發生[3]、降低膽固醇[4]以及抗氧化[5-6]等作用,乳酸菌胞外多糖因其獨特的物理特性及良好的流變學特性[7],并且安全無毒,已被開發利用。Surayot等[8]研究了乳酸菌 TISTR 1498所產胞外多糖的分子特征和摩爾質量對免疫調節活性的作用,摩爾質量低于7.0×103g/mol的胞外多糖(exopolysaccharide,EPS)能有效刺激RAW264.7細胞產生促炎介質,部分水解的EPS能通過調節mRNA刺激RAW264.7細胞產生大量NO和各種細胞因子。
乳酸菌胞外多糖是微生物適應環境的產物[9],但產量低,菌株穩定性差, 提取成本高,制約著大規模工業生產[10]。除與菌種的遺傳特性有密切關系外,培養基的成分(碳源和氮源)和生長環境(溫度、pH值、培養時間)等都會直接影響乳酸菌胞外多糖的分泌積累[11],且不同營養條件和環境條件下產生的多糖的化學結構和生理功能也有差異[12]。因此發酵條件的優化,主要包括培養基成分的優化和生長環境因素的優化。本實驗從實驗室已有菌株中篩選出1 株高產EPS的乳酸菌,并優化其產胞外多糖的發酵條件,制備并研究其胞外多糖活性。
1 材料與方法
1.1 菌株與試劑
菌株:上海理工大學食品生物技術研究所保藏的乳酸菌共10 株。
葡萄糖、淀粉、三氯乙酸、苯酚、濃硫酸、阿卡波糖、3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)、二甲基亞砜(dimethyl sulfoxide,DMSO)等均購于國藥化學試劑有限公司,為國產分析純。
1.2 儀器與設備
3-18K型高速冷凍離心機 德國Sigma公司;紫外分光光度計 上海美譜達儀器有限公司;LDZX-30FA型立式壓力蒸汽式滅菌鍋 上海申安醫療器械廠;多功能酶標儀 美國Molecular Devices公司。
1.3 方法
1.3.1 高產胞外多糖乳酸菌的篩選
1.3.1.1 菌落拉絲法初篩
取-80 ℃保存的10 株菌株,涂布于MRS瓊脂培養基中活化。觀察菌株在平板上的菌落形態,挑取黏稠且有明顯拉絲的單菌落,革蘭氏染色并做H2O2酶實驗,篩選出革蘭氏染色陽性、H2O2酶實驗陰性的菌株[13]。將菌株挑入MRS液體培養基培養18~24 h,4 ℃冰箱保藏。
1.3.1.2 粗多糖含量的測定
取20 mL發酵液,加1 mL質量分數為80%的三氯乙酸溶液,4 ℃靜置過夜。4 ℃、10 000×g離心20 min,取上清液,去離子水透析3 d,每8 h換水1 次。以葡萄糖為標準,采用苯酚-硫酸法[14]測定粗多糖含量。
1.3.2 菌株的鑒定
將篩選到的高產黏性多糖的優良菌株,采用16S rDNA序列分析方法[15]鑒定。將高產黏性多糖的菌株接入5 mL MRS液體培養基中,37 ℃過夜培養。10 000 r/min離心5 min,棄去上清液。用1 mL無菌水洗滌菌體1~2 次后收集菌體,采用十六烷基三甲基溴化銨(cetyltrimethyl ammonium bromide,CTAB)法提取乳酸菌DNA,并進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增。引物使用:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。將擴增成功的PCR產物,送于生工生物工程(上海)股份有限公司進行序列測定,最后把所得菌株的DNA序列信息輸入美國國家生物信息中心(National Center for Biotechnology Information,NCBI) 數據庫進行局部序列比對,用基本檢索工具(basic local alignment search tool,BLAST)進行分析。
1.3.3 發酵條件對菌株AR307產糖量的影響
1.3.3.1 發酵溫度對菌株產糖量的影響
將活化好的菌株AR307按體積分數3%的接種量分別接種于20 mL MRS液體培養基中,分別置于26、28、30、32、34、36、38 ℃條件下恒溫發酵24 h,以未接種的MRS液體培養基作為對照組,采用苯酚-硫酸法測不同溫度下發酵液多糖的含量。
1.3.3.2 發酵時間對菌株產糖量的影響
將活化好的菌株AR307按體積分數3%接種量接入MRS液體培養基中,32 ℃恒溫培養36 h,每隔4 h測定發酵液的EPS產量和活菌數。EPS產量采用苯酚-硫酸法測定,活菌數測定采用平板計數法。分別以EPS產量和活菌數對數值為縱坐標,發酵時間為橫坐標,得到菌株在MRS培養基中的生長曲線和發酵時間對菌株產糖量的影響。
1.3.4 粗多糖的制備
取發酵一定時間的發酵液,沸水浴10 min,使可降解多糖的酶失活。然后4 ℃、10 000×g離心20 min除去菌體和凝結蛋白,上清液添加質量分數為80%的三氯乙酸至終質量分數為4%,靜置過夜。4 ℃、10 000×g離心20 min除去沉淀蛋白,上清液濃縮后加體積分數95%乙醇至終體積分數為75%,4 ℃靜置20 h。4 ℃、10 000×g離心20 min,取沉淀去離子水溶解,4 ℃、10 000×g離心20 min去沉淀,上清液去離子水透析3 d,每8 h換水1 次,冷凍干燥得粗多糖[16]。
1.3.5 粗多糖的抗腫瘤活性測定
采用CCK-8法[17]測定粗多糖對腫瘤細胞HT-29的影響。96孔培養板每孔加入100 μL腫瘤細胞懸液和10 μL不同質量濃度(10、100、200、500、800、1 000 μg/mL)的粗多糖樣品,每個實驗組設4 個復孔,置于37 ℃,5% CO2飽和濕度下培養24 h。向每孔加入10 μL細胞計數試劑盒(cell counting kit-8,CCK-8)溶液,繼續培養4 h。培養結束后,用酶標儀測定450 nm波長處的吸光度。
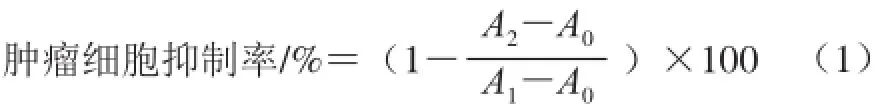
式中:A2為包含細胞、CCK溶液和藥物溶液的孔的吸光度;A0為包含培養基和CCK溶液而沒有細胞的孔的吸光度;A1為包含細胞、CCK溶液而沒有藥物溶液的孔的吸光度。
1.3.6 粗多糖的α-淀粉酶抑制作用
用1 mg/mL的DMSO分別配制不同質量濃度(25~800 μg/mL)的粗多糖和阿卡波糖。取不同質量濃度的上述2 種糖液各500 μL,加入500 μL α-淀粉酶(0.5 mg/mL),室溫放置10 min,然后加入500 μL、1 g/100 mL的淀粉反應10 min后,1 mL DNS試劑加入混合液沸水浴5 min。冷卻后,用蒸餾水稀釋定容至10 mL,于540 nm波長處測定吸光度[18]。
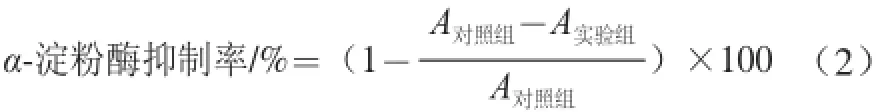
式中:A對照組為空白組吸光度;A實驗組為實驗組樣品的吸光度。
1.4 數據處理
每個實驗重復3 次,采用SPSS 17.0統計軟件對數據進行處理,實驗結果以±s表示。
2 結果與分析
2.1 產胞外多糖乳酸菌的篩選
產胞外多糖的菌株具有兩類菌落特征,一類是具有黏絲狀、黏稠狀和黏液狀的特征,另一類不具產黏特性[19]。實驗篩選的為具有產黏性多糖的菌株。如表1所示,從實驗室選取的10 株菌種,通過菌落拉絲法,結合粗多糖的產量,選取AR307進行后續的研究。
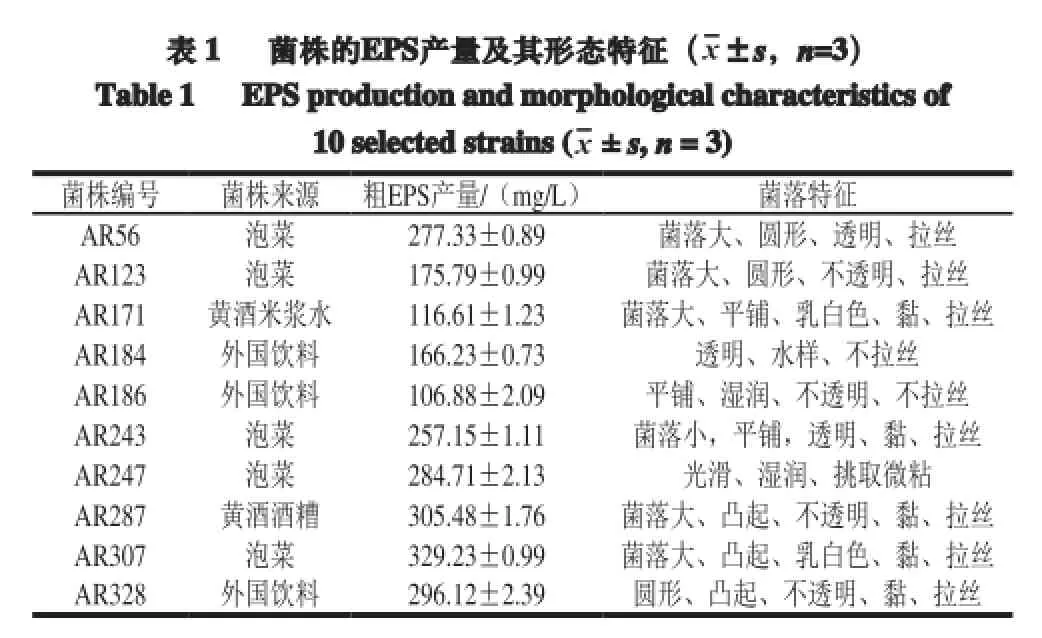
表 1 菌株的EPS產量及其形態特征(x±s,n=3)Table 1 EPSproductionandmorphological characteristics of10 selected strains (x± s,n= 3)菌株編號 菌株來源 粗EPS產量/(mg/L) 菌落特征AR56 泡菜 277.33±0.89 菌落大、圓形、透明、拉絲AR123 泡菜 175.79±0.99 菌落大、圓形、不透明、拉絲AR171 黃酒米漿水 116.61±1.23 菌落大、平鋪、乳白色、黏、拉絲AR184 外國飲料 166.23±0.73 透明、水樣、不拉絲AR186 外國飲料 106.88±2.09 平鋪、濕潤、不透明、不拉絲AR243 泡菜 257.15±1.11 菌落小,平鋪,透明、黏、拉絲AR247 泡菜 284.71±2.13 光滑、濕潤、挑取微粘AR287 黃酒酒糟 305.48±1.76 菌落大、凸起、不透明、黏、拉絲AR307 泡菜 329.23±0.99 菌落大、凸起、乳白色、黏、拉絲AR328 外國飲料 296.12±2.39 圓形、凸起、不透明、黏、拉絲
2.2 菌株鑒定結果
提取菌株AR307的基因組DNA,經PCR擴增后回收測序,根據16S rDNA核苷酸序列提交GenBank做BLAST分析,菌株AR307同源性最高的菌株為L.plantarum JCM 1149(NR117813),同源性為99%。由此可以推斷,菌株AR307與L.plantarum JCM 1149 屬于同一個種。依據形態特征、生理生化特征等微生物學特性[20]及其遺傳特性16S rDNA[21]將菌株AR307初步鑒定為L.plantarum。
2.3 發酵條件對菌株AR307產糖量的影響
2.3.1 發酵溫度對EPS產量的影響
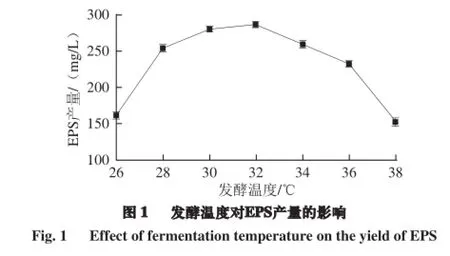
由圖1可知,發酵溫度在26~32 ℃時,EPS產量分別為(161.23±0.99)、(253.74±1.63)、(280.29±2.09)、(286.61±0.73) mg/L,EPS產量隨溫度升高而升高;而發酵溫度從34 ℃開始,EPS產量隨溫度升高而降低。因此,發酵溫度為32 ℃時,EPS產量最大,溫度過高或過低都會影響EPS的產量。
溫度通過影響蛋白質、核酸等生物大分子的結構和功能以及胞內酶的活性來影響微生物的生長、繁育和新陳代謝,不同的發酵溫度不僅影響乳酸菌的生長,還影響代謝產物的產量和質量[22]。Subudhi等[23]研究無色桿菌在37 ℃時生物絮凝效果達到77%,而溫度為50 ℃時其絮凝力降到38%,這是由于溫度過高、過低導致酶失活或者活性降低。馮美琴等[24]研究了植物乳桿菌胞外多糖發酵條件的優化,溫度是影響植物乳桿菌胞外多糖產量的主要因素之一,并且并不是在最適溫度時產量最高,這還與各菌株的特性有關,其優化植物乳桿菌發酵溫度為31 ℃時,產糖量達到425.16 mg/L。Gassm等[25]認為較低的接種溫度導致活菌數量緩慢增加,有利于延長乳酸菌的對數期和穩定期,從而提高如胞外多糖等次級代謝產物的產量。因此,選擇合適的菌株發酵溫度不僅促進植物乳桿菌的生長,還可以大大提高胞外多糖的產量。
2.3.2 發酵時間對EPS產量的影響
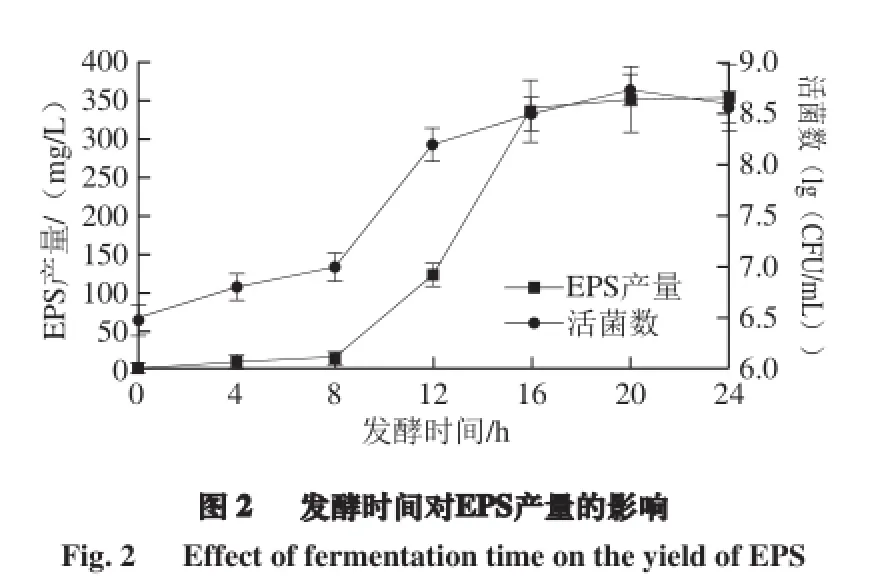
不同發酵時間EPS的產量以及植物乳桿菌AR307生長曲線見圖2。在一定的溫度條件下,發酵時間在0~16 h范圍內,EPS產量隨發酵時間的增加而不斷增加;在16~24 h范圍內,EPS產量趨于穩定。發酵時間在20 h左右時EPS產量達到最大,為(354.19±0.99) mg/L,在24 h時EPS產量基本不變。從生長曲線上來看,植物乳桿菌AR307的EPS產生始于菌體對數生長期,EPS 產量達到最大時,細菌的生物量也最大,延長發酵時間會使EPS發生降解,產量下降,這可能是多糖水解作用的結果。Li Dan等[26]研究了嗜熱鏈球菌05-34在培養16、24、30 h時的EPS產量,在24 h時其產糖量最高為94.31 mg/L,30 h時其EPS產量下降到61.32 mg/L。陳若雯等[27]對乳酸乳桿菌發酵生產胞外多糖的發酵條件進行了優化,發酵時間為胞外多糖產量的顯著影響因素之一,發酵時間23.18 h 時,乳酸乳桿菌胞外多糖實際產量可達3.910 g/L,發酵時間延長EPS顯著降低可能與酶降解或培養基物理參數的改變有關[28],這與本實驗的植物乳桿菌AR307發酵條件相符合。因此,選擇適宜的發酵時間對乳酸菌胞外多糖的分泌積累具有重要的影響。
2.4 粗多糖的制備及分析
將活化好的植物乳桿菌AR307接種到MRS液體培養基中32 ℃培養20 h即可制得發酵液。發酵結束后,發酵液黏稠且有拉絲現象。發酵液經煮沸、三氯乙酸除蛋白、醇沉后收集沉淀,沉淀用去離子水溶解、透析,冷凍干燥得到蓬松的、白色的粗多糖,稱質量大約每升發酵液含389 mg。Wang Ji等[29]從藏靈菇酸奶中篩選出植物乳桿菌YW11,并且提取胞外多糖的量為90 mg/L。馮美琴等[24]應用Plackett-Burman設計和響應面法進行植物乳桿菌胞外多糖發酵條件的優化,在蔗糖質量濃度34 g/L、接種量5%、發酵溫度31 ℃條件下發酵的植物乳桿菌胞外多糖產量達425.16 mg/L。Li Dan等[26]通過優化嗜熱鏈球菌05-34的發酵條件,EPS產量達到250 mg/L,比沒有優化發酵條件時EPS產量提高了4.2 倍,并且條件優化后其增大了EPS分子質量,從而改變了其流變性能。因此,通過優化植物乳桿菌AR307發酵條件,提高胞外多糖產量,對進一步研究EPS分子質量、結構、活性以及流變學具有重要意義。
2.5 粗多糖的抗腫瘤活性
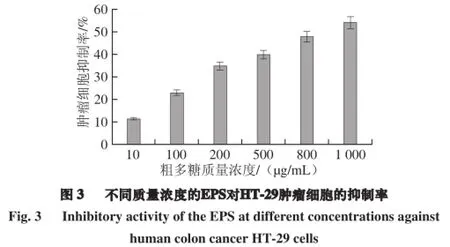
本實驗利用CCK-8法研究了植物乳桿菌AR307的胞外多糖在一定的質量濃度梯度(10~1 000 μg/mL)下對腫瘤細胞HT-29的抑制率。由圖3可知,隨著質量濃度的升高,抑制率不斷變大。培養24 h后,1 mg/mL EPS的HT-29細胞抑制率為(54.09~1.03)%。Wang Kun等[30]報道了植物乳桿菌70810發酵產生的胞外多糖c-EPS在600 μg/mL時培育72 h,對HT-29的抑制率達到88.34%。Liu Lei等[31]提取純化丹參多糖SMP-W1,并對其進行抗細胞增殖和抑制腫瘤生長的實驗,在質量濃度400 μg/mL 時SMP-W1就顯示較高的抑制肝癌細胞活性,因此其對機體具有很好的免疫調節活性。不同菌種產生的胞外多糖的抗腫瘤活性也不同,可能由于多糖的構造、摩爾質量、單糖組成等特性的不同。因此,需要進一步研究其結構特征,了解其活性機制。
2.6 粗多糖的降血糖作用
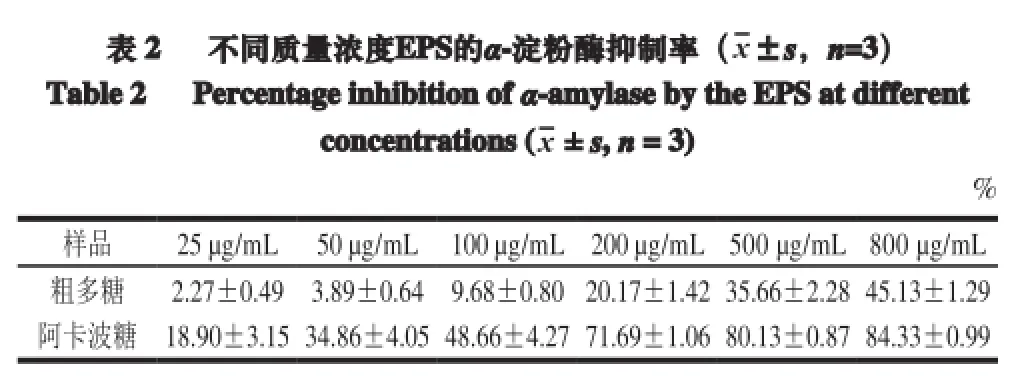
表 2 不同質量濃度EPS的a-淀粉酶抑制率(x±s,n=3)Table 2 Percentage inhibition ofa-amylaseby theEPSatdifferentconcentrations (x± s,n= 3)%樣品 25 μg/mL 50 μg/mL 100 μg/mL 200 μg/mL 500 μg/mL 800 μg/mL粗多糖 2.27±0.49 3.89±0.64 9.68±0.80 20.17±1.42 35.66±2.28 45.13±1.29阿卡波糖 18.90±3.15 34.86±4.05 48.66±4.27 71.69±1.06 80.13±0.87 84.33±0.99
由表2可知,植物乳桿菌AR307胞外多糖在一定劑量下表現出α-淀粉酶抑制活性,EPS質量濃度小于200 μg/mL時,α-淀粉酶抑制率均小于10%,而800 μg/mL EPS的抑制率為(45.13±1.29)%,約占同質量濃度阿卡波糖抑制率((84.33±0.99)%)的50%。Dilna等[32]研究了在質量濃度為100 μg/mL和800 μg/mL情況下,植物乳桿菌RJF4胞外多糖α-淀粉酶的抑制率分別為25%和40%,而相同質量濃度下阿卡波糖的抑制率分別為91.75%和98%。Sivashanmugam等[18]對印度塔樹葉提取物的降血糖作用進行體內外研究,體外實驗利用酶動力學研究α-淀粉酶和α-葡萄糖的抑制率;體內實驗研究提取物對鏈脲霉素誘導糖尿病小鼠的保護作用。結果表明植物乳桿菌RJF4胞外多糖具有一定降血糖作用,阿卡波糖作為一種常用藥物,降低飲食后血糖水平,抑制α-淀粉酶和α-葡萄糖,因此可作為檢查抗糖尿病特性的標準。
3 結 論
本實驗從實驗室保藏的10 株乳酸菌種篩選出1 株高產黏性胞外多糖的乳酸菌,經生理生化實驗及16S rDNA序列分析,該菌株被鑒定為植物乳桿菌,命名為AR307。在發酵溫度為32 ℃、發酵時間為20 h的最適條件下,AR307產生胞外多糖389 mg/L,其EPS具有抑制腫瘤,抑制α-淀粉酶、降低血糖水平的作用。該菌株可產生黏性活性多糖,因此還需對其胞外多糖的活性和結構進行近一步研究。
參考文獻:
[1] BECK B R, KIM D, JEON J.The effects of combined dietary probiotics Lactococcus lactis BFE920 and Lactobacillus plantarum FGL0001 on innate immunity and disease resistance in olive flounder (Paralichthys olivaceus)[J].Fish Shellfish Immunology, 2015, 42(1): 177-183.DOI:10.1016/j.f si.2014.10.035.
[2] DUARY R K, BHAUSAHE M A, BATISH V K, et al.Antiinflammatory and immunomodulatory efficacy of indigenous probiotic Lactobacillus plantarum LP91 in colitis mouse model[J].Molecular Biology Reports, 2012, 39(4): 4765-75.DOI:10.1007/s11033-011-1269-1.
[3] LADDA B, THEPAREE T, CHIMCHANG, et al.In vitro modulation of tumor necrosis factor α production in THP-1 cells by lactic acid bacteria isolated from healthy human infants[J].Anaerobe, 2015, 33: 109-116.DOI:10.1016/j.Anaerobe.2015.03.002.
[4] WANG S C, CHANG C K, CHAN S C, et al.Effects of lactic acid bacteria isolated from fermented mustard on lowering cholesterol[J].Asian Pacific Journal of Tropical Biomedicine, 2014, 4(7): 523-528.DOI:10.12980/ apjtb.4.201414b5.
[5] LIU J G, HOU C W, LEE S Y, et al.Antioxidant effects and UVB protective activity of Spirulina (Arthrospira platensis) products fermented with lactic acid bacteria[J].Process Biochemistry, 2011,46(7): 1405-1410.DOI:10.1016/j.Procbio.2011.03.010.
[6] KUDA T, KAWAHARA M, NEMOTO M, et al.In vitro antioxidant and anti-inflammation properties of lactic acid bacteria isolated from fish intestines and fermented fish from the Sanriku Satoumi region in Japan[J].Food Research International, 2014, 64: 248-255.DOI:10.1016/j.Foodres.2014.06.028.
[7] MENDE S, PETER M, BARTELS K, et al.Addition of purified exopolysaccharide isolates from S.thermophilus to milk and their impact on the rheology of acid gels[J].Food Hydroeolloids, 2013, 32: 178-185.DOI:10.1016/j.Foodhyd.2012.12.011.
[8] SURAYOT U, WANG J, SEESURIYACHAN P, et al.Exopolysaccharides from lactic acid bacteria: structural analysis,molecular weight effect on immunomodulation[J].International Journal of Biological Macromolecules, 2014, 68: 233-240.DOI:10.1016/j.Ijbiomac.2014.05.005.
[9] VUYST L D, VIN F D, VANINGELGEM F, et al.Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dariy Journal, 2001, 11(9): 687-707.DOI:10.1016/S0958-6946(01)00114-5.
[10] ARSKOLD E, SVENSSON M, GRAGE H, et al.Environmental influences on exopolysaccharide formation in Lactobacillus reuteri ATCC 55730[J].International Journal of Food Microbiology, 2007,116: 159-167.DOI:10.1016/j.ijfoodmicro.2006.12.010.
[11] HAJ-MUSTAFA M, ABDI R, SHEIKH-ZEINODDIN M.Statistical study on fermentation conditions in the optimization of exopolysaccharide production by Lactobacillus rhamnosus 519 in skimmed milk base media[J].Biocatalysis and Agricultural Biotechnology, 2015, 4(4): 521-527.DOI:10.1016 j.Bcab.2015.08.013.
[12] ALHUDHUD M, HUMPHREYS P, LAWS A.Development of a growth medium suitable for exopolysaccharide production and structural characterization by Bifidobacterium animalis ssp.lactis AD011[J].Microbiological Methods, 2014, 100(1): 93-98.DOI:10.1016/j.Mimet.2014.02.021.
[13] de ALMEIDA JúNIOR W L G, FERRARI í D S, de SOUZA J V,et al.Characterization and evaluation of lactic acid bacteria isolated from goat milk[J].Food Control, 2015, 53: 96-103.DOI:10.1016/ j.Foodcont.2015.01.013.
[14] MASUKE T, MINAMI A, IWASAKI N, et al.Carbohydrate analysis by a phenol-sulfuric acid method in microplate format[J].Analytical Biochemistry, 2005, 339(1): 69-72.DOI:10.1016/j.Ab.2004.12.001.
[15] 張潔, 徐桂花, 尤麗琴.16S rDNA序列分析法鑒定乳酸菌[J].農產品加工(創新版), 2009(4): 47-49.DOI:10.3969/ j.issn.1671-9646.2009.04.015.
[16] AI L Z, ZHANG H, GUO B H, et al.Preparation, partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J].Carbohydrate Polymers, 2008, 74(3): 353-357.DOI:10.1016/j.Carbpol.2008.03.004.
[17] 馬杉姍, 王世平, 連正興.藏靈菇嗜熱鏈球菌胞外多糖對人結腸癌細胞的增殖抑制[J].食品科學, 2008, 29(04): 405-408.
[18] SIVASHANMUGAM A T, CHATTERJEE T K.In vitro and in vivo antidiabetic activity of Polyalthia longifolia (Sonner.) Thw. leaves[J].Oriental Pharmacy and Experimental Medicine, 2013, 13(4): 289-300.DOI:10.1007/s13596-013-0118-2.
[19] RUAS-MADIEDO P, de los REYES-GAVILáN C G.Invited review: methods for the screening, isolation, and characterization of exopolysaccharides produced by lactic acid bacteria[J].Journal of Dairy Science, 2005, 88(3): 843-856.DOI:10.3168/jds.S0022-0302(05)72750-8.
[20] 凌代文, 冬秀珠.乳酸菌分類鑒定及實驗方法[M].北京: 中國輕工業出版社, 1998: 117-129.
[21] 涂宏鋼, 李存瑞, 巫慶華, 等.利用16S rRNA全長序列鑒定植物乳桿菌[J].乳業科學與技術, 2004, 27(2): 57-60.DOI:10.3969/ j.issn.1671-5187.2004.02.004.
[22] 熊素玉, 姚新奎, 譚小海.不同溫度及pH條件對乳酸菌生長影響的研究[J].新疆農業科學, 2006, 43(6): 533-538.
[23] SUBUDHI S, BISHT V, BATTA N, et al.Purification and characterization of exopolysaccharide bioflocculantproduced by heavy metal resistant Achromobacter xylosoxidans[J].Carbohydrate Polymers, 2016, 137: 441-451.DOI:10.1016/j.Carbpol.2015.10.066.
[24] 馮美琴, 邢家溧, 張琦.植物乳桿菌胞外多糖發酵條件的優化[J].食品科學, 2011, 32(23): 215-219.
[25] GASSM M, SCHMIDTAND K A, FRANK J F.Exopolysaccharide production from whey lactose by fermentation with Lactobacillus celbrueckill ssp.bulgaricus[J].Journal of Food Science, 1997, 62(1): 171-173; 207.DOI:10.1111/j.1365-2621.1997.tb04393.x.
[26] LI D, LI J, ZHAO F.The influence of fermentation condition on production and molecular mass of EPS produced by Streptococcus thermophilus 05-34 in milk-based medium[J].Food Chemistry, 2016,197: 367-372.DOI:10.1016/j.Foodchem.2015.10.129.
[27] 陳若雯, 李里, 段家彩.乳酸乳桿菌胞外多糖的發酵條件優化[J].食品與生物技術學報, 2010, 29(5): 770-776.
[28] MCKELLAR R C, GEEST J V, CUI W.Influence of culture and environmental conditions on the composition of exopolysaccharide produced by Agrobacterium radiobacter[J].Food Hydrocolloids, 2003,17: 429-437.DOI:10.1016/ S0268-005X(03)00030-4.
[29] WANG J, ZHAO X, TIAN Z, et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J].Carbohydrate Polymers, 2015, 125: 16-25.DOI:10.1016/j.Carbpol.2015.03.003.
[30] WANG K, LI W, RUI X.Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810[J].International Journal of Biological Macromolecules, 2014, 63: 133-139.DOI:10.1016/j.Ijbiomac.2013.10.036.
[31] LIU L, JIA J, ZENG G.Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge[J].Carbohydrate Polymers, 2013, 92(1): 479-483.DOI:10.1016/ j.Carbpol.2012.09.061.
[32] DILNA S V, SURYA H, ASWATHY R G, et al.Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF4[J].LWT-Food Science and Technology, 2015, 64(2): 1179-1186.DOI:10.1016/ j.lwt.2015.07.040.
DOI:10.7506/spkx1002-6630-201613022 10.7506/spkx1002-6630-201613022. http://www.spkx.net.cn
中圖分類號:TS201.3
文獻標志碼:A
文章編號:1002-6630(2016)13-0125-05
收稿日期:2016-02-01
基金項目:國家自然科學基金面上項目(31371809);上海科委國際科技合作項目(14390711700)
作者簡介:馮小婉(1991—),女,碩士研究生,研究方向為食品生物技術。E-mail:fxw2351@163.com
*通信作者:艾連中(1976—),男,教授,博士,研究方向為食品生物技術。E-mail:ailianzhong@163.com
Screening of Exopolysaccharide (EPS)-Producing Lactobacillus plantarum and Bioactivity of the EPS
FENG Xiaowan, XIA Yongjun, WANG Guangqiang, AI Lianzhong*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:The present study describes the screening of lactic acid bacterial (LAB) strains with high exopolysaccharide (EPS)-producing ability by observing whether they could form sticky colonies.One strain named AR307 was finally obtained and identified as Lactobacillus plantarum.In order to enhance EPS yield, the fermentation conditions for producing EPS by Lactobacillus plantarum AR307 were optimized.The yield of EPS produced by AR307 reached up to 389 mg/L after 20 h fermentation at 32 ℃.In vitro assay showed that the EPS had good inhibitory activity against colon cancer HT-29 cells and possessed an antidiabetic effect.
Key words:Lactobacillus plantarum; fermentation conditions; exopolysaccharide (EPS)

