芒硝真空蒸發冷卻結晶介穩區寬度研究*
張峰榛,王 海,劉興勇,湯秀華,楊 虎
(四川理工學院材料與化學工程學院,四川自貢643000)
芒硝真空蒸發冷卻結晶介穩區寬度研究*
張峰榛,王海,劉興勇,湯秀華,楊虎
(四川理工學院材料與化學工程學院,四川自貢643000)
提出了利用溴化鋰溶液的強吸濕性,以硫酸鈉溶液表面水蒸氣壓力與溴化鋰溶液表面水蒸氣壓力之差為推動力,實現芒硝真空蒸發冷卻結晶的方法。基于此方法研究了芒硝介穩區寬度,并用多元線性回歸擬合得到了硫酸鈉溶液的超溶解度曲線回歸方程。實驗結果表明:硫酸鈉溶液質量分數為9%~24%,芒硝介穩區寬度隨著硫酸鈉溶液質量分數的增大呈現先變窄后變寬的趨勢;提高結晶器的攪拌轉速、增加吸收器內溴化鋰溶液的濃度,皆使芒硝介穩區寬度變窄。該研究可為芒硝真空蒸發冷卻結晶的工程設計提供參考。
芒硝;真空蒸發;結晶;介穩區
芒硝作為一種重要的無機化工原料,廣泛用于制造玻璃、致冷混合劑、洗滌劑、染料稀釋劑等。工業上通常采用機械冷凍法生產芒硝[1]。為避免冷壁面附近溫度梯度過大造成結晶體附壁,真空蒸發冷卻結晶系統也愈發廣泛地應用于結晶過程中[2]。溶液的結晶介穩區寬度是指溶液過飽和而欲自發地產生晶核的超溶解度與溶解度之間的區域,是結晶操作和結晶器設計的必需參數。工業結晶過程中需控制結晶過程在介穩區內操作,避免自發成核,使產品粒度較大且均勻。影響介穩區寬度的因素頗多,如超聲場、降溫速率、攪拌強度、有無雜質等[3-6]。測定溶液結晶介穩區寬度多采用間壁式冷卻結晶方法,對于真空蒸發冷卻結晶過程測量介穩區寬度的報道甚少。為此提出了利用溴化鋰溶液強的吸濕性,以硫酸鈉溶液表面水蒸氣壓力與溴化鋰溶液表面水蒸氣壓力之差為推動力,實現芒硝真空蒸發冷卻結晶的方法,并應用此方法測定了芒硝真空蒸發冷卻結晶介穩區寬度,研究結果對芒硝真空蒸發冷卻結晶的工程設計具有一定的指導意義。
1 實驗部分
1.1實驗原理
圖1為芒硝真空蒸發冷卻結晶實驗原理示意圖。結晶器與吸收器用汽相連通器連通,利用溴化鋰強的吸濕性,在結晶器內硫酸鈉溶液與吸收器中溴化鋰溶液水蒸氣壓力差的推動下,實現芒硝真空蒸發冷卻結晶。
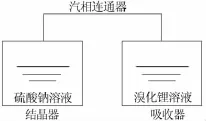
圖1 芒硝真空蒸發冷卻結晶實驗原理示意圖
1.2實驗方法
溴化鋰和無水硫酸鈉都為分析純試劑。芒硝真空蒸發冷卻結晶實驗裝置見圖2。將一定量一定濃度的溴化鋰溶液裝入吸收器。結晶器內加入100 mL (35℃)一定濃度的硫酸鈉溶液。用汽相連通器將結晶器與吸收器迅速連接起來,開啟結晶器的磁力攪拌器并設置一定的轉速,開啟真空泵使吸收器內達到溴化鋰溶液對應的飽和蒸汽壓后,迅速關閉吸收器與緩沖瓶之間的閥門,并關閉真空泵。實驗利用冷卻水移走吸收熱,并通過調節吸收器的攪拌強度使溴化鋰溶液的溫度維持在25℃左右。采用聚焦光束反射測量儀(FBRM)檢測首批晶核出現,當FBRM檢測到粒子總數驟增時表明有大量晶核產生,此時溶液的實測溫度為硫酸鈉溶液的超飽和溫度。

圖2 芒硝真空蒸發冷卻結晶實驗裝置
2 實驗結果與討論
實驗測得硫酸鈉溶液超溶解度數據見表1。

表1 硫酸鈉溶液超溶解度實驗數據
由表1實驗數據繪制芒硝介穩區寬度散點圖見圖3。圖3中硫酸鈉溶解度曲線由文獻[7]數據擬合而得,溶解度曲線方程:w=0.025T2+0.0391T+5.2692,R2=0.999 8。其中:w為硫酸鈉質量分數,%;T為溫度,℃。
對上述實驗數據應用多元線性擬合得到不同溴化鋰溶液質量分數條件下硫酸鈉溶液超溶解度曲線回歸方程:1)溴化鋰溶液質量分數為 51%,w= 1.827T0.858n-0.032,R2=0.962 7;2)溴化鋰溶液質量分數為55%,w=1.563T0.905n-0.033,R2=0.956 5;3)溴化鋰溶液質量分數為58%,w=1.328T0.960n-0.039,R2=0.9544。其中:n為結晶器攪拌速率,r/min。
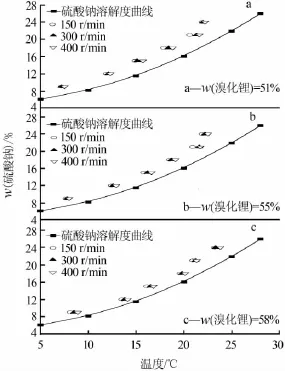
圖3 芒硝介穩區寬度
由硫酸鈉溶液超溶解度曲線回歸方程并結合圖3可知,硫酸鈉溶液質量分數為9%~24%,介穩區寬度隨著硫酸鈉溶液質量分數的增大呈現先變窄后變寬的趨勢;介穩區寬度隨著結晶器內攪拌轉速的提高略有減小;在同一硫酸鈉溶液質量分數條件下,隨著吸收器內溴化鋰溶液質量分數的增大介穩區變窄趨勢明顯,這是由于溴化鋰溶液質量分數增大,使得溴化鋰溶液表面水蒸氣壓力降低,進而增大推動力,提高了降溫速率。
3 結論
1)硫酸鈉溶液質量分數為9%~24%,芒硝介穩區寬度隨著硫酸鈉溶液質量分數的增大呈現先變窄后變寬的趨勢。2)提高結晶器的攪拌轉速、增加吸收器內溴化鋰溶液的濃度,皆使芒硝介穩區寬度變窄。3)研究獲得不同溴化鋰溶液質量分數條件下硫酸鈉溶液超溶解度曲線回歸方程:①溴化鋰溶液質量分數為51%,w=1.827T0.858n-0.032,R2=0.962 7;②溴化鋰溶液質量分數為 55%,w=1.563T0.905n-0.033,R2= 0.956 5;③溴化鋰溶液質量分數為 58%,w= 1.328T0.960n-0.039,R2=0.954 4。
[1]葉鐵林.化工結晶過程原理及應用[M].2版.北京:北京工業大學出版社,2012:121.
[2]沈晃宏,張罡.硝酸鉀真空冷卻結晶工藝[J].化學工程,2006,34(5):16-18.
[3]陳霞,李鴻.超聲波對硫酸鈉溶液結晶成核的影響[J].天津大學學報,2011,44(9):835-839.
[4]樊玉光,魏婷,華和維.降溫速率對過硫酸銨結晶介穩區影響的研究[J].無機鹽工業,2014,46(10):23-25.
[5]湯秀華,李軍,周堃,等.磷酸二氫鉀結晶介穩區寬度的研究[J].無機鹽工業,2007,39(7):27-29.
[6]張曉光.典型陰離子雜質對磷酸二氫鈉結晶過程影響[J].無機鹽工業,2013,45(7):21-23.
[7]北京石油化工工程公司.氯堿工業理化常數手冊[M].北京:化學工業出版社,1988:151.
聯系方式:zhangfengzhen421@163.com
Study on metastable zone width of glauber salt′s vacuum evaporation cooling crystallization
Zhang Fengzhen,Wang Hai,Liu Xingyong,Tang Xiuhua,Yang Hu
(School of Material and Chemical Engineering,Sichuan University of Science&Engineering,Zigong 643000,China)
It presented the use of water vapor pressure difference between the surface of lithium bromide solution and that of sodium sulfate solution as the driving force to achieve vacuum evaporation cooling crystallization of glauber salt.This method is based on the strong moisture absorption of lithium bromide solution.Based on this method,the glauber salt metastable zone width was studied,and the sodium sulfate solution super-solvus regression equation by multiple linear regression was obtaained. The results showed that:when the mass fraction of sodium sulfate was between 9%and 24%,glauber salt metastable zone first decreased and then increased with increasing mass fraction of sodium sulfate;and the metastable zone decreased with the increasing stirring speed of crystallizer and the concentration of lithium bromide in the absorber.This study could provide a reference for engineering design of glauber salt vacuum evaporation cooling crystallization.
glauber salt;vacuum evaporation;crystallization;metastable zone
TQ131.12
A
1006-4990(2016)06-0027-02
四川省科技支撐計劃項目(2014GZ0132)。
2016-01-15
張峰榛(1980—),男,講師,主要從事化工傳質與分離技術研究,已發表論文10篇。

