273.15 K下四元體系Li+,Mg2+∥Cl-,SO42--H2O相平衡研究*
任效京,黃雪莉(新疆煤炭潔凈轉化與化工過程重點實驗室,新疆大學化學化工學院,新疆烏魯木齊830046)
273.15 K下四元體系Li+,Mg2+∥Cl-,SO42--H2O相平衡研究*
任效京,黃雪莉
(新疆煤炭潔凈轉化與化工過程重點實驗室,新疆大學化學化工學院,新疆烏魯木齊830046)
采用等溫溶解平衡法研究了273.15 K下四元體系Li+,Mg2+∥Cl-,SO42--H2O的相平衡關系。測定了該體系各種鹽類的溶解度及溶液密度,并繪制相圖。研究結果表明:273.15 K下四元體系Li+,Mg2+∥Cl-,SO42--H2O等溫相圖有5個單鹽結晶區(Li2SO4·H2O,MgSO4·7H2O,LiCl·2H2O,LiCl·MgCl2·7H2O,MgCl2·6H2O);7條單變量線和3個共飽點。與該體系下298.15 K相圖相比,MgSO4·7H2O結晶區變大;Li2SO4·H2O和MgCl2·6H2O結晶區明顯減小;LiCl· MgCl2·7H2O和LiCl·2H2O結晶區比較小,減小不明顯。溫度對硫酸鹽結晶區的影響較大。
鋰;溶解度;相平衡
中國鹽湖資源常位于干旱少雨地區,冬季寒冷漫長,因此開發利用冬季冷能的低溫工藝很有意義。在開發低溫工藝時需要低溫相圖的理論指導,現有相圖大多數為常溫及高溫下的,低溫度下的相圖較少。本實驗室前期研究工作表明,一些水鹽體系相圖中,低溫下一些復鹽結晶區消失,相圖結構變得簡單,這有利于簡化生產工藝,提高目標產品質量。例如,對于 Na+,K+∥Cl-,SO42-,NO3--H2O體系[1-3],298.15 K相圖中存在的鈉硝礬、鉀芒硝的結晶區在258.15 K的相圖中均消失[3]。對于K+,Na+,Mg2+∥Cl-,SO42--H2O體系[1]也有類似情況,隨著溫度降低,298.15 K相圖中存在的鉀鎂礬、白鈉鎂礬、軟鉀鎂礬、鉀鹽鎂礬、鉀芒硝等5種復鹽結晶區縮小至消失。對于Li+,Na+∥Cl-,SO42--H2O體系[1,3],和298.15K時的相圖相比,273.15 K的相圖中Li2SO4·Na2SO4結晶區大大縮小,3Na2SO4·Li2SO4·12H2O結晶區消失,使相圖得以簡化。對于硫酸鹽型富鉀鋰鹵水體系,如果存在同樣的規律,使得相關系簡單化,將極其有利于鹵水有效成分的分離。文獻中含鋰體系低溫相平衡數據較少,本文擬進行Li+,Mg2+∥Cl-,SO42--H2O四元交互體系的相圖研究。該體系273.15 K時的溶解度數據不全[1,5],且當時測定的實驗條件不夠完善[5],需要進一步研究,確定低溫對Li2SO4·H2O,MgSO4· 7H2O,MgCl2·6H2O等結晶區變化的影響,本工作將有助于硫酸鹽型富鉀鋰鹵水體系低溫相平衡的研究。
1 實驗部分
1.1試劑和儀器
試劑:LiCl·H2O、Li2SO4·H2O、MgSO4·7H2O、MgCl2·6H2O,均是分析純。儀器:低溫攪拌反應浴(DHJF-4010型,控溫精度為±0.2℃);754紫外-可見分光光度計;X射線衍射儀;體視顯微鏡等。
1.2實驗過程
體系溶解度的測定采用等溫溶解平衡法[4],實驗裝置見文獻[4]。經實驗測定,本研究所涉及的水鹽體系平衡時間為36 h。根據文獻中273.15 K下相關三元體系中兩鹽共飽點數據[1],加入第三種鹽,計算配制合適的實驗體系所需要的鹽和水量;將配制的樣品置于低溫(恒溫)攪拌反應浴中,連續攪拌36 h以上,靜止沉降12 h后取液相分析,并鑒定固相;通過不斷減少加入樣品的水量,使體系的平衡液相組成逐漸靠近三鹽共飽點,最終得出四元體系273.15 K相平衡關系。
1.3化學分析方法[6]
Cl-:硝酸銀容量法;SO42-:濃度高時采用BaSO4重量法,濃度低時用硫酸鋇比濁法[7];Mg2+:由于Li+大量存在對Mg2+的分析測定有明顯干擾,采用文獻[8]所述方法;Li+用差減法。平衡液相密度采用比重瓶法測定。固相采用體式顯微鏡、X射線晶體衍射法綜合鑒定。
2 結果與討論
四元體系Li+,Mg2+∥Cl-,SO42--H2O在273.15 K時的平衡液相組成和密度數據分別列于表1中,同時列出相應的J?necke指數。

表1 273.15 K時四元體系Li+,Mg2+∥Cl-,SO42--H2O的溶解度及密度
由表1數據作出273.15 K下干鹽相圖,見圖1。為了比較,根據文獻[1,5]數據,同時作出298.15 K下的干鹽相圖。圖1中LiCl·2H2O和LiCl·MgCl2· 7H2O結晶區很小,故作出其局部放大圖見圖2。
由表1、圖1和圖2可見,該四元體系273.15 K時等溫相圖有5個單鹽結晶區,7條單變量線和3個共飽點。5個單鹽結晶區分別對應平衡固相LiCl· MgCl2·7H2O(d-a-b-e)、MgCl2·6H2O(e-b-c-f)、Li2SO4· H2O(h-c-b-a-g)、MgSO4·7H2O(h-c-f)、LiCl·2H2O(g-a-d);3個共飽點為圖1、2中的a、b、c點,平衡固相分別對應:LiCl·2H2O+Li2SO4·H2O+LiCl·MgCl2· 7H2O;Li2SO4·H2O+LiCl·MgCl2·7H2O+MgCl2·6H2O;Li2SO4·H2O+MgCl2·6H2O+MgSO4·7H2O。該體系273.15 K和298.15 K均沒有硫酸鹽型復鹽,硫酸鹽只有Li2SO4·H2O和MgSO4·7H2O。
圖1中MgSO4·7H2O結晶區最大,溶解度最小。由圖1和圖2可見,該四元體系273.15 K與298.15 K相比,MgSO4·7H2O結晶區變大,Li2SO4·H2O和MgCl2·6H2O結晶區明顯減小;LiCl·2H2O和LiCl· MgCl2·7H2O結晶區減小,但變化不明顯。經分析相圖變化原因為溫度變化對各種鹽類溶解度均有影響,但溫度對LiCl溶解度影響較MgSO4小。
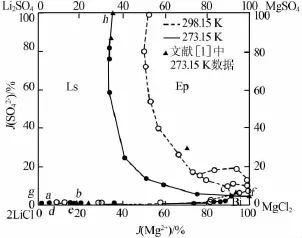
圖1 273.15、298.15 K時Li+,Mg2+∥Cl-,SO42--H2O體系干鹽相圖

圖2 273.15、298.15 K時局部放大圖
根據表1及文獻[1]數據,做出273.15 K時Li+,Mg2+∥Cl-,SO42--H2O體系水圖及273.15、298.15 K時體系密度-組成比較圖,見圖3、4。

圖3 273.15 K時Li+,Mg2+∥Cl-,SO42--H2O體系水圖
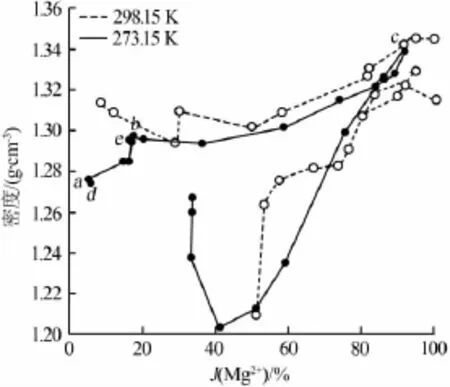
圖4 273.15、298.15 K時體系密度-組成圖比較
由圖4和圖1分析,273.15 K的密度總體上隨Mg2+含量增加而增加,但在結晶區 Li2SO4·H2O和MgSO4·7H2O的單變量線上,密度隨硫酸根的含量減小而減小,當硫酸根的J?necke指數低于24.39%時,密度隨著Mg2+含量增加而增大。273.15 K時的密度普遍低于298.15 K。結合表1,序號4點水含量比較高,其密度最低,這是由于它所對應的平衡固相為Li2SO4·H2O+MgSO4·7H2O,SO42-含量已經減小很多,而含水量比較高使密度最低;序號21點水含量較低,其密度最高,這是由于其所對應的平衡固相為MgSO4·7H2O+MgCl2·6H2O,MgSO4·7H2O和 MgCl2· 6H2O溶解度均較高。
本實驗體系中,隨著溫度降低,硫酸鹽結晶區擴大,其他文獻中也表明了這一點,對于Na+∥Cl-,SO42-,NO3--H2O體系[9],隨著溫度的降低Na2SO4·10H2O結晶區不斷擴大。而其他文獻表明,溫度降低硫酸鹽型復鹽結晶區減小,并有可能消失[3]。但非硫酸鹽型復鹽的情況不同,溫度降低,非硫酸鹽型復鹽結晶區減小不明顯,并有可能幾乎不變。如本文中273.15 K 與298.15 K的相圖相比:LiCl·MgCl2·7H2O結晶區減小不明顯;對于K+,Mg2+∥Cl-,SO42--H2O體系[10],273.15 K與298.15 K的相圖相比較,復鹽光鹵石結晶區幾乎沒變化等。
3 結論
1)獲得了273.15 K下四元交互體系Li+,Mg2+∥Cl-,SO42--H2O平衡溶解度和密度數據,繪制了273.15 K與 298.15 K下該體系相圖及密度圖。273.15 K等溫相圖有5個單鹽結晶區Li2SO4·H2O,MgSO4·7H2O,LiCl·2H2O,MgCl2·6H2O,LiCl·MgCl2·7H2O;7條單變量線和3個共飽點。該體系沒有硫酸鹽型復鹽。2)四元交互體系Li+,Mg2+∥Cl-,SO42--H2O 的273.15 K與298.15 K相圖相比,273.15 K相圖中MgSO4·7H2O結晶區變大,Li2SO4·H2O和 MgCl2· 6H2O結晶區明顯減小;273.15 K時 LiCl·2H2O和LiCl·MgCl2·7H2O結晶區很小,與298.15 K的相比減小不明顯。3)隨著溫度降低,硫酸鹽結晶區擴大;硫酸鹽型復鹽結晶區減小,并有可能消失;非硫酸鹽型復鹽的情況不同,溫度降低,結晶區減小不明顯。
[1]Дод реДаκции А Д.Иедьшь,ЗКСВЕРИМЕНТАДЬНЬIХ ДАННЫХХОРАСТВОРИМОСТИМНОГОКОМПОНЕНТНЫХ ВОДНО-СОЛЕВЫХСИСТЕМ[M].ЛенингРадское:ЛенингРадское отделение ИЗДАТЕДЬ-СТВО,1975.
[2]李亞文,韓蔚田.Na+,K+∥Cl-,SO42-,NO3-—H2O五元體系的鹵水—礦物平衡研究[J].科學通報,1998,43(19):2089-2091.
[3]廖玲,黃雪莉,朱巧麗.低溫對水鹽體系相平衡的影響及應用[J].無機鹽工業,2015,47(8):19-22.
[4]張霞.新疆含硝酸鹽鹵水低溫相平衡研究[D].新疆:新疆大學,2014.
[5]任開武,宋彭生.四元交互體系Li+,Mg2+∥Cl-,SO42--H2O 25℃相平衡及物化性質研究[J].無機化學學報,1994,10(1):69-73.
[6]中國科學院青海鹽湖研究所分析室.鹵水和鹽的分析方法[M]. 2版.北京:科學出版社,1988.
[7]GB/T 5750.5—2006生活飲用水標準檢驗方法無機非金屬指標[S].
[8]李紅霞,姚燕,曾德文.水鹽體系中有干擾Li+離子存在下測定Mg2+濃度的掩蔽法研究[J].鹽湖研究,2012,20(2):24-30.
[9]張霞,黃雪莉.低溫下Na+∥Cl-,SO42-,NO3-,H2O體系相平衡研究[J].化學通報,2015,78(4):337-341.
[10]牛自得,程芳琴.水鹽體系相圖及其應用[M].天津:天津大學出版社,2002:261-263.
聯系方式:xuelih@163.com
Phase equilibria in the quatemary system of Li+,Mg2+∥Cl-,SO42--H2O at 273.15 K
Ren Xiaojing,Huang Xueli
(Key Laboratory of Xinjiang Coal Clean Conversion and Chemical Process,College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 830046,China)
The liquid-solid phase equilibria of the quaternary system Li+,Mg2+∥Cl-,SO42--H2O were investigated by isothermal method at 273.15 K.Solubilities and densities of the quaternary system were determined experimentally.Then the equilibrium phase diagrams were plotted.Results showed that there were five crystalline regions with one salt corresponding to Li2SO4· H2O,MgSO4·7H2O,LiCl·2H2O,LiCl·MgCl2·7H2O,and MgCl2·6H2O;seven univariate curves with two salts and three invariant points with three salts.Compared with the phase diagram of the quaternary system at 298.15 K,the crystalline region of MgSO4·7H2O became larger,the crystalline regions of Li2SO4·H2O and MgCl2·6H2O became smaller obviously;the crystalline regions of LiCl·2H2O and LiCl·MgCl2·7H2O were small,and little reduced.The effect of temperature on the crystalline region of sulfates was great.
lithium;solubility;phase equilibrium
O642.42
A
1006-4990(2016)07-0013-03
國家自然科學基金資助項目(21166022)。
2016-01-11
任效京(1991—),男,碩士研究生,研究方向為化工熱力學。
黃雪莉

