響應面法分析玉米半胱氨酸蛋白酶活性影響因素*
陳方奇,劉回民,鄭明珠,靳 松,劉景圣
(1 吉林農業大學食品科學與工程學院,吉林 長春 130118;2 小麥和玉米深加工國家工程實驗室,吉林 長春 130118;3 吉林農業大學生命科學學院,吉林 長春 130118)
?
科學實驗
響應面法分析玉米半胱氨酸蛋白酶活性影響因素*
陳方奇1,2,劉回民2,3,鄭明珠1,2,靳松1,劉景圣1,2
(1 吉林農業大學食品科學與工程學院,吉林長春130118;2 小麥和玉米深加工國家工程實驗室,吉林長春130118;3 吉林農業大學生命科學學院,吉林長春130118)
玉米半胱氨酸蛋白酶(zea mays Cysteine Protease)是一類重要的蛋白水解酶,為了研究玉米半胱氨酸蛋白酶酶學性質,用重組畢赤酵母表達玉米半胱氨酸蛋白酶,以玉米半胱氨酸蛋白酶的相對酶活力為指標,采用響應面法分析pH、溫度、MgCl2濃度對該酶活性的影響。結果表明,當pH 5.95,溫度55.89 ℃,MgCl2濃度6.08 mM,預測的相對酶活力為166.78%,實測值為167.13%。模型合理,有參考價值。
玉米半胱氨酸蛋白酶;發酵;響應面法;酶活
半胱氨酸蛋白酶是以Cys-His-Asn/Glu氨基酸序列為活性中心的一類酶,廣泛分布于從病毒至脊椎動物的生物體中[1-2]。半胱氨酸蛋白酶是植物體內重要的蛋白水解酶,參與多種生理過程[3-7]。該酶的最適溫度和pH和穩定性具有滿足食品工業和醫藥行業運用的先天優勢[8-9]。
玉米不僅是重要的糧食作物,也是燃料、醫藥等領域的重要原料[10-13]。研究玉米中的半胱氨酸蛋白酶具有重要的實際意義。玉米半胱氨酸蛋白酶(zmCP1)屬于C1家族,常以酶源的形式存在并以外切酶為主。其中10~26 個氨基酸殘基組成的酶前體,結合到內質網后,通過分子內或分子間蛋白水解而激活,其它C1家族半胱氨酸蛋白酶(木瓜蛋白酶、獼猴桃素、組織蛋白酶B)盡管與zmCP1的一級結構和二級結構具有很高的同源性,但在酶學性質上有很大差別[2]。本文利用重組畢赤酵母菌株GS115-zmCP1表達zmCP1并利用響應面法分析pH值,MgCl2濃度,溫度三個因素對zmCP1活力的影響,為深入研究zmCP1的酶學性質提供依據。
1 實 驗
1.1材料與試劑
重組畢赤酵母菌株GS115-zmCP1由實驗室保存;MgCl2、生物素、酵母氮源YNB、咪唑購自鼎國公司;酵母浸粉、蛋白胨購自Sigma公司;R-AMC(7-氨基-4-甲基香豆素)、AMC購自上海生工;BCA蛋白測定試劑盒購自TaKaRa公司;組氨酸抗體、辣根過氧化物酶偶聯的羊抗鼠抗體購自QIAGEN公司。
1.2實驗方法
1.2.1重組畢赤酵母菌株GS115-zmCP1的誘導表達
挑取陽性轉化子于BMGY培養基中,30 ℃,250 rpm振蕩培養至OD600=2~6;3000 g 4 ℃離心5 min收集菌體并用 25 mL BMMY培養基在相同條件下進行誘導表達,每24 h補加100%甲醇至甲醇終濃度為0.5%,發酵96 h后離心收集上清,以GS-pPICZα-A和不加甲醇誘導的GS115-zmCP1作為陰性對照[14-15]。
1.2.2發酵產物SDS-PAGE與Western-Blot分析
取1 mL96 h發酵液上清液進行SDS-PAGE分析,上樣量20 μL。用凝膠成像系統對電泳結果進行分析,以1:1000稀釋的Penta-His Antibody作為一抗,1:1000稀釋的HRP-Goat Anti-Mouse IgG為二抗進行Western-Blot分析鑒定。
1.2.3重組蛋白zmCP1的純化
將96 h的發酵液用0.22 μm微孔濾膜過濾除菌,再經超濾管(蛋白分子截留量:10 kD)進行濃縮,測酶活。用鎳柱進行純化。純化前,讓鎳柱中的20%乙醇自然流出,用5個柱體積的蒸餾水清洗,然后用5個柱體積的Binding buffer(20 mM磷酸鈉緩沖液,500 mM氯化鈉,20 mM咪唑,pH 7.4)進行平衡,上樣,用10個柱體積的Binding buffer洗去雜蛋白,再用5個柱體積的Elution buffer(20 mM磷酸鈉緩沖液,500 mM氯化鈉,500 mM咪唑,pH 7.4)洗脫目的蛋白,收集量1 mL。對洗脫蛋白進行SDS-PAGE分析。
1.3zmCP1酶活的測定
1.3.1制備標準曲線
稱取適量AMC于100%DMSO中, 用Tris-HCl(pH 8.0、50 mmol)緩沖液配成不同濃度的200 μL AMC溶液,在激發波長380 nm、發射波長460 nm、狹縫寬5 nm條件下測定熒光強度,以熒光強度為橫坐標,AMC摩爾濃度為縱坐標,制作標準曲線[16-17]。
1.3.2樣品測定
參照文獻[16-17]檢測zmCP1酶活。反應體系為200 μL:5 μL酶液,10 μL底物(100 mmol/L,20%DMSO),185 μL Tris-HCl(pH 8.0、50 mmol)。反應液50 ℃水浴30 min 后冰浴60 min,檢測熒光活力。激發波長380 nm、發射波長460 nm、狹縫寬5 nm/1.5 nm。酶活單位為U,1 U定義為每分鐘催化生成1 μmol AMC所需要的酶量。比活力=總活力(U)/總蛋白(mg)。蛋白含量用BCA 蛋白測定試劑盒測定。
1.4單因素試驗
選取MgCl2濃度(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10 mM)、反應溫度(35、40、45、50、55、60、65、70、75、80 ℃)、pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)進行單因素試驗。固定值分別為,MgCl2濃度:4.0 mM,反應溫度:50 ℃,pH值:5.5;以R-AMC為底物按照上述酶活測定方法測定,以純化的zmCP1酶活為100%,相對酶活為縱坐標,不同單因素為橫坐標,探究各因素對zmCP1酶活的影響。
1.5響應面試驗設計
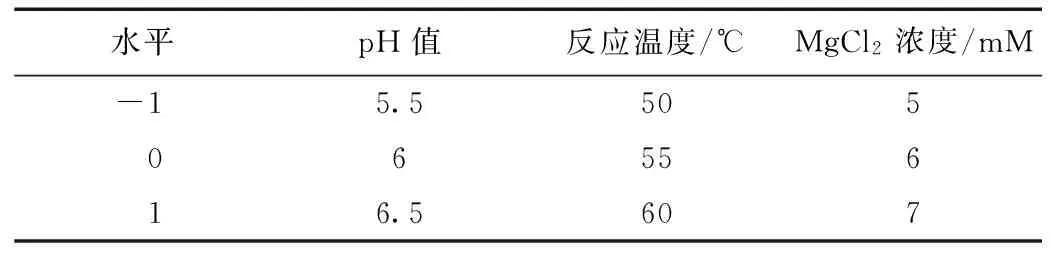
表1 響應面試驗因素水平和編碼
在單因素試驗的基礎上,以相對酶活作為響應值,進行3因素3水平響應面分析,采用Box-Benhnken 法進行響應面優化。試驗因素水平設計表,見表1。
2 結果與討論
2.1zmCP1的表達鑒定及純化
GS115-zmCP1重組菌經過96 h甲醇誘導,以GS-pPICZ-A和不加甲醇誘導的GS115-zmCP1為對照。SDS-PAGE分析結果見圖1。
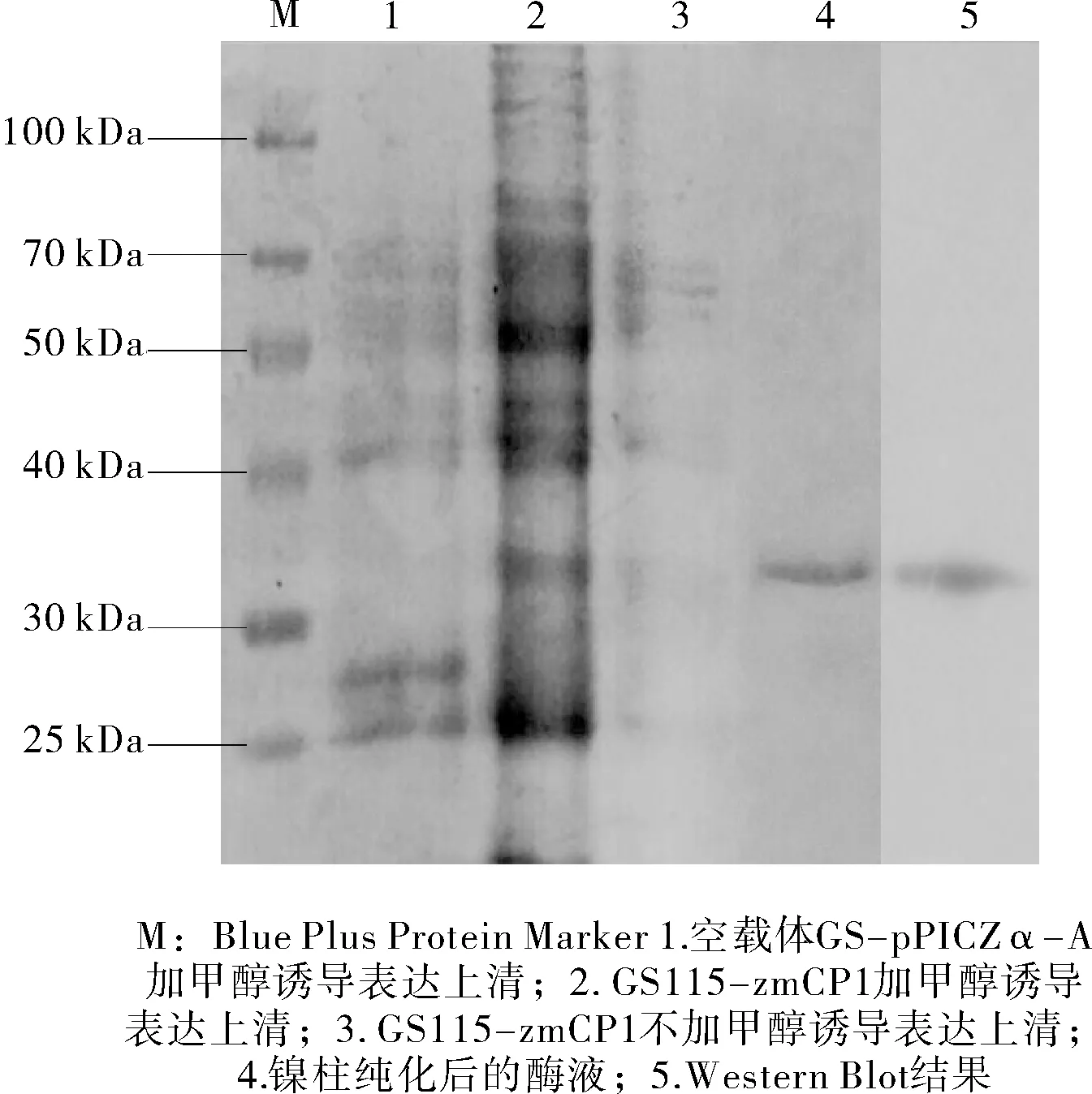
圖1 發酵產物的蛋白電泳圖和Western Blotting 鑒定
由圖1可知:在甲醇誘導后,GS115-zmCP1能特異性表達分子量約為34 kDa的蛋白,與理論分子量一致,Western-Blot鑒定的結果與SDS-PAGE分析結果相一致,表明zmCP1在畢赤酵母GS115中成功表達。純化后zmCP1的比活力為209.32 U/mg。以純化后的酶活力為100%,進行單因素試驗。
2.2單因素試驗結果
2.2.1pH對zmCP1活性的影響
pH對zmCP1活性的影響如圖4所示:高、低pH值和對酶活力都有抑制作用,在pH值從3.5逐漸增大的過程中,酶活力迅速上升,在6.0處達到最高點,之后酶活力下降相對緩和。因此選擇pH值6.0進行響應面優化試驗。
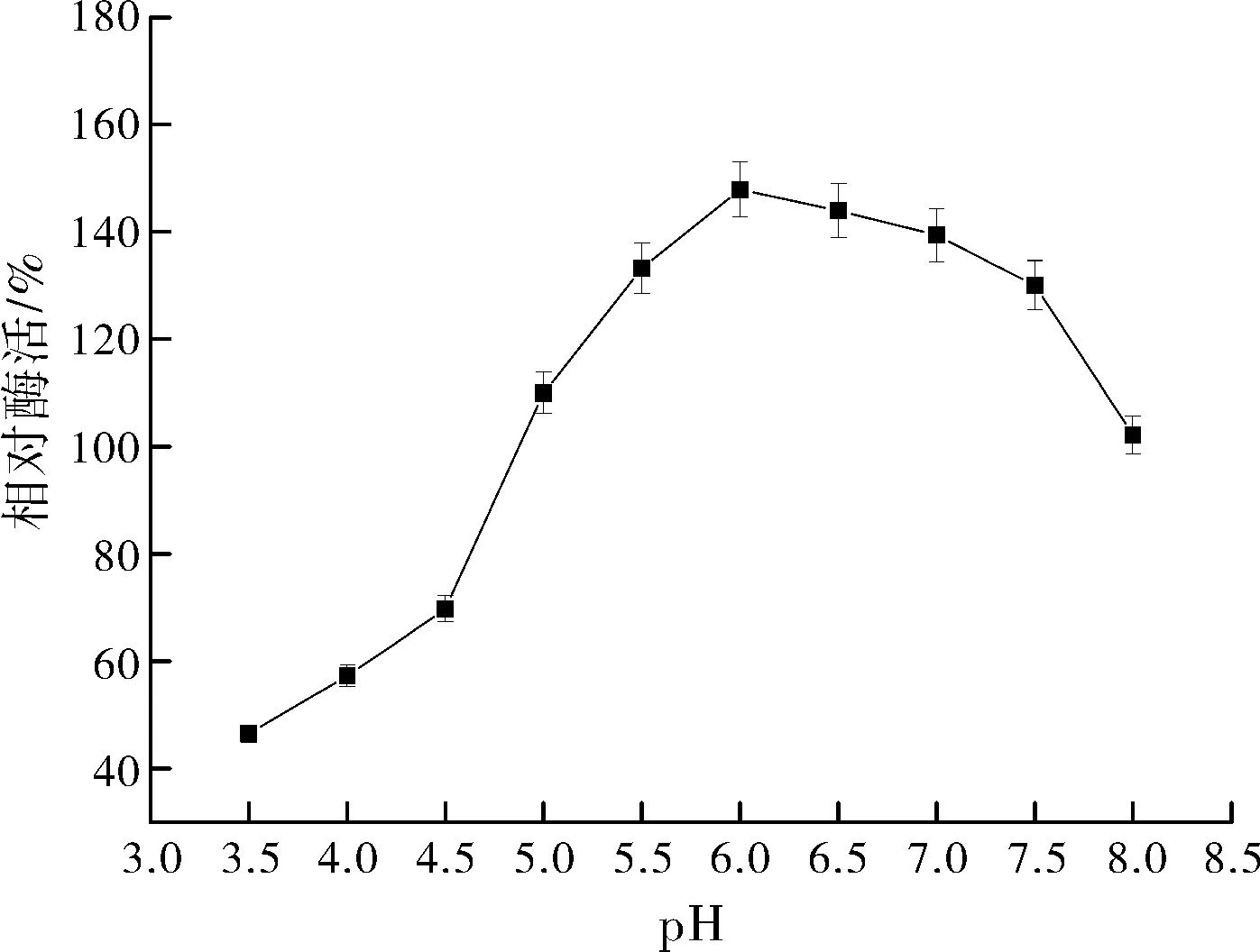
圖2 pH對zmCP1活性的影響
2.2.2反應溫度對zmCP1活性的影響
反應溫度對zmCP1活性的影響如圖3所示:zmCP1溫度適應范圍很寬,隨著反應溫度的升高,酶活力呈現先上升,后下降的趨勢,在80 ℃時依然具有70%左右的活性,55 ℃的時候達到最大值,因此選擇反應溫度55 ℃進行響應面優化試驗。
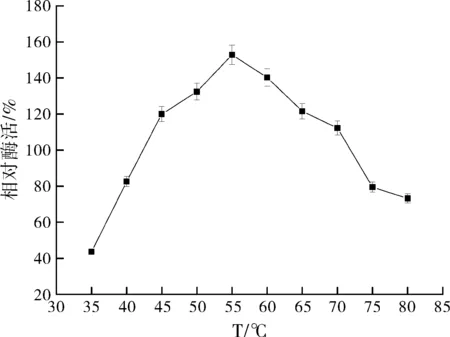
圖3 反應溫度對zmCP1活性的影響
2.2.3MgCl2濃度對zmCP1活性的影響
MgCl2濃度對zmCP1活性的影響如圖4所示:隨著MgCl2濃度的增大,酶活力逐漸上升,在6 mM時,酶活力達到最大值,但是在超過6 Mm后,酶活力就呈現出抑制作用。因此選擇MgCl2濃度6 mM進行響應面優化試驗。

圖4 MgCl2濃度對zmCP1活性的影響
2.3響應面試驗優化結果
2.3.1響應面分析設計及結果
用Box-Benhnken法,以zmCP1相對酶活力為響應值,MgCl2濃度、溫度、pH為自變量進行響應面試驗設計,響應面試驗設計及響應值見表2。

表2 響應面試驗設計方案與結果
使用Design-Expert軟件進行多元回歸擬合,結果分析表明,zmCP1酶活力大小與pH、溫度、MgCl2濃度之間為Quadratic模型關系,方程為:
zmCP1酶活力=166.42-1.91A+2.16B+1.80C+2.67AC-2.90BC-9.00A2-5.38B2-6.28C2
從方程中一次項回歸系數的絕對值大小可看出各影響因素對響應值的影響程度為:B(溫度)>A(pH)>C(MgCl2濃度)。

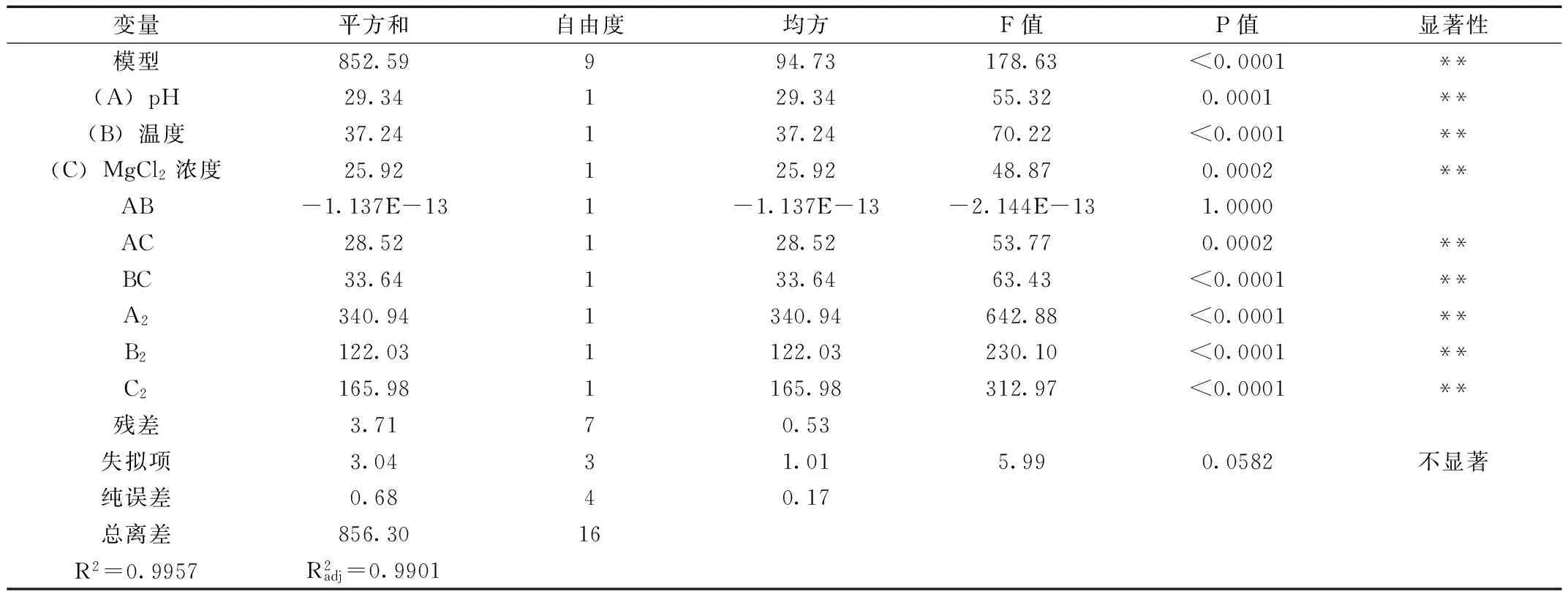
表3 響應面模型方差分析
注:P<0.01為極顯著,表示為**;P<0.05為顯著,表示為*。
2.3.2模型響應面分析
圖5~圖7為由回歸方程建立的響應面3D圖,反應了pH、溫度、MgCl2濃度對響應值zmCP1酶活的影響。曲線坡度的陡峭程度能夠反映出隨著影響因素的變化而導致的響應值的變化趨勢;等高線形狀反應出兩個交互作用是否顯著,偏橢圓則顯著,偏圓形則不顯著[18]。


圖5 Y=f(A,B)的響應面圖和等高線
由圖5可知響應面曲線相對趨于平緩,pH和溫度的交互作用對酶活性影響不大,且等高線的形狀偏圓形,說明pH和溫度兩因素的交互作用不夠顯著。
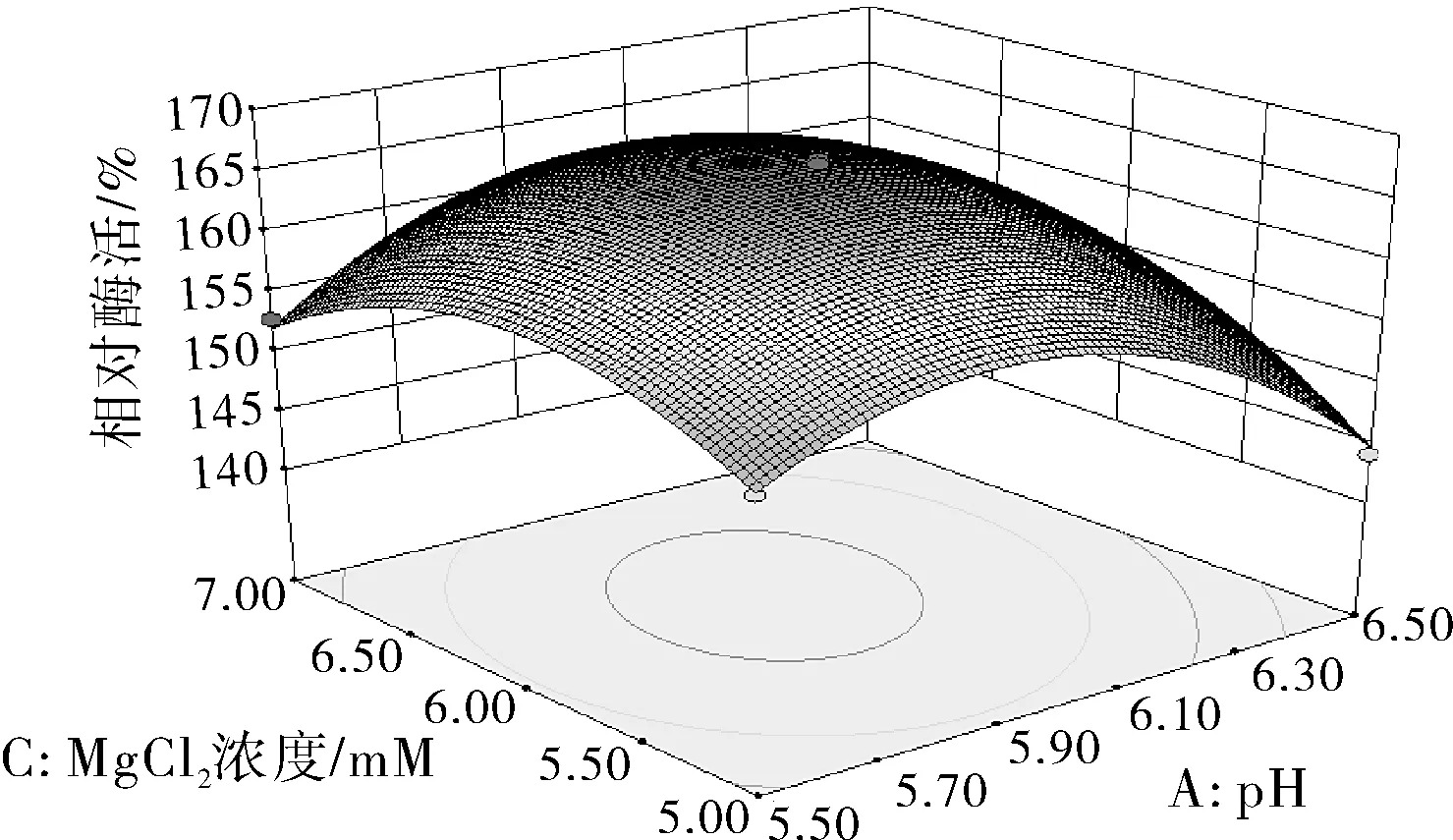
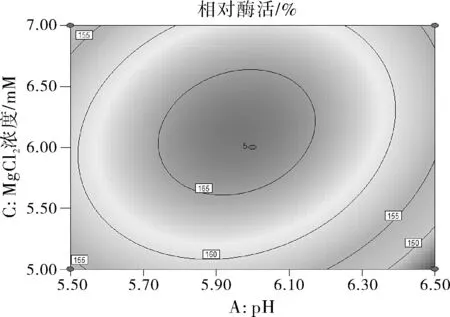
圖6 Y=f(A,C)的響應面圖和等高線
由圖6可知響應面曲線相對陡峭,說明pH和MgCl2濃度的交互作用對酶活性影響較大,且等高線形狀偏橢圓形,說明pH和MgCl2兩因素的交互作用顯著。
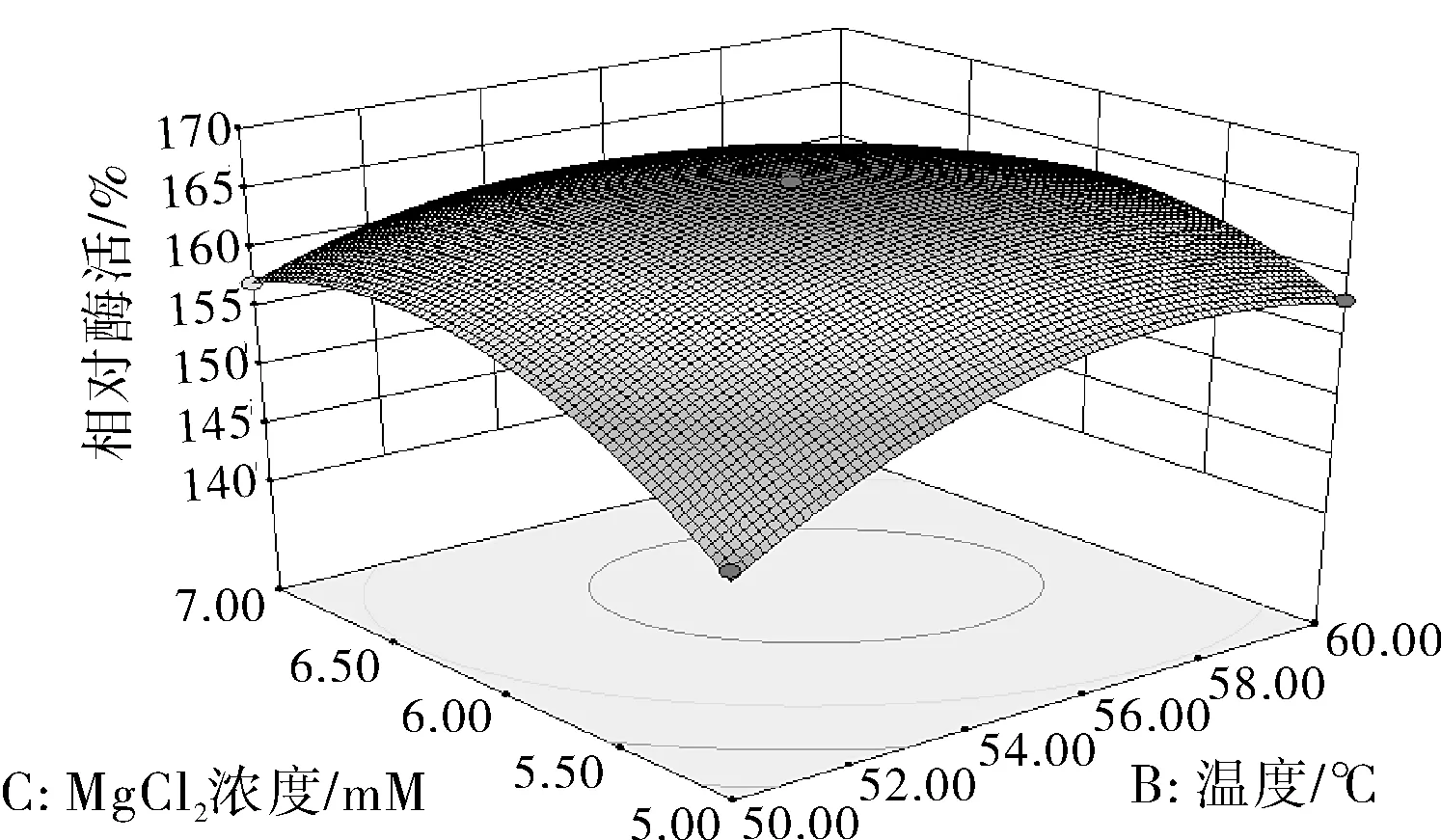

圖7 Y=f(B,C)的響應面圖和等高線
由圖7可知響應面曲線雖不及圖6響應面曲線陡峭,但是從等高線形狀偏橢圓形能夠看出溫度和MgCl2濃度兩因素的交互作用顯著。
2.4驗證試驗
運用Design-Expert分析響應面試驗得出的zmCP1酶活最佳參數為pH 5.95,溫度55.89 ℃,MgCl2濃度6.08 mM;預測相對酶活力為166.78%。由于實際操作原因,將參數修改為pH6.0,溫度56 ℃,MgCl2濃度6.0 mM。在上述參數條件下進行三組平行驗證試驗,得到的zmCP1相對酶活為167.13%,預測值與實測值相差不大,說明數學模型的合理性較高;響應面法分析各因素對zmCP1酶活力影響較可靠,有參考價值。
3 結 論
本文利用畢赤酵母進行真核表達,使得表達出的zmCP1具有天然活[19-20]并且通過 Box-Behnken 的中心組合設計及響應面分析,建立zmCP1相對酶活力的二次多項式數學模型,驗證表明該模型合理,可很好地預測zmCP1在pH,溫度,MgCl2濃度交互作用影響下的相對酶活。軟件分析結合實際操作情況得到的zmCP1酶活的最佳參數為pH 5.95溫度56 ℃,MgCl2濃度6.08 mM。相應的zmCP1相對酶活達到166.78%。驗證試驗的結果(167.13%)與預測值基本吻合,說明該模型可靠,將該模型結合zmCP1較寬的溫度和pH適應范圍,能夠較為精準的指導該酶在實際生產中的運用。
[1]Rawlings N D, Barrett A J. Families of cysteine peptidases[J].Methods Enzymol,1994,244:461-486.
[2]Wiederanders B, Kaulmann G, Schilling K. Functions of propeptide parts in cysteine proteases[J].Curr Protein Pept Sci,2003,4(5):309-326.
[3]Grudkowska M,Zagdanska B.Multifunctional Role of Plant Cysteine Proteinases[J].Acta Biochimica Polonica, 2004,51(3):609-624.
[4]Gonzalez-Rabade N, Badillo-Corona J A, Aranda-Barradas J S, et al. Production of plant proteases in vivo and in vitro--a review[J].Biotechnol Adv,2011,29(6):983-996.
[5]閆龍鳳,楊青川,韓建國,等.植物半胱氨酸蛋白酶研究進展[J].草業學報,2005(05):11-19.
[6]Watanabe Y, Matsushima S, Yamaguchi A, et al. Characterization and cloning of cysteine protease that is induced in green leaves of barley[J]. Plant Sci,2009,176(2):264-271.
[7]Lecaille F, Kaleta J, Brommole D. Human and parasitic papain-like cysteine proteases:their role in physiology and pathology and recent developments in inhibitor design[J]. Chem Rev,2002,102(12):4459-4488.
[8]吳顯榮,朱利泉.木瓜蛋白酶[J].北京農業大學學報,1988,14(1):13-17.
[9]Leite Andréa Pinto,de Oliveira Beatriz Guitton Renaud Baptista,Soares Marja Ferreira,Barrocas Desirée Lessa Rodrigues.Use and effectiveness of papain in the wound healing process: a systematic review.[J].Revista Gaucha de Enfermagem,2013,333:245-249.
[10]王如芳,張吉旺,董樹亭,等.我國玉米主產區秸稈資源利用現狀及其效果[J].應用生態學報,2011,06:1504-1510.
[11]郭玲霞,黃朝禧,彭開麗.從中國玉米生物乙醇發展分析生物能源對糧食安全的影響[J].中國科技論壇,2011,09:139-145.
[12]王莉,胡勝德.玉米用途之爭:糧食消費還是能源消費[J].農業經濟,2008,11:8-9.
[13]王雪茜,陳正華,孫軍.玉米秸稈能源化利用途徑與方法[J].中國資源綜合利用,2014(10):35-38.
[14]Yang-yuan Li, Kai-xin Zhong, Ai-hong Hu, et al. High-level expression and characterization of a thermostable xylanase mutant from Trichoderma reesei in Pichia pastoris[J]. Protein Expression and Purification,2014:90-96.
[15]Ping Yu, Xiaoqin Shen. Enhancing the production of S-adenosyl-L-methionine in Pichia pastoris GS115 by metabolic engineering[J]. AMB Express,2012,21:1-7.
[16]詹冬玲.超嗜熱古菌Pyrococcus horikoshii OT3半胱氨酸蛋白酶的研究[D].吉林大學,2011.
[17]Than M E, Helm M, Simpson D J, et al. The 2.0 A crystal structure and substrate specificity of the KDEL-tailed cysteine endopeptidase functioning in programmoled cell death of Ricinus commolunis endosperm[J]. J Mol Biol,2004,336(5):1103-1116.
[18]范曉良,李行諾,楚楚,等.響應面法優化加壓溶劑萃取香菇多糖工藝研究[J].中國食品學報,2012, 12(2):98-103.
[19]Leonardo M. Damasceno,Chung-Jr Huang,Carl A. Batt. Protein secretion in Pichia pastoris and advances in protein production[J].Applied Microbiology and Biotechnology,2012,931:31-39.
[20]Gabriel Potvin,Ayla Ahmad,Zisheng Zhang.Bioprocess engineering aspects of heterologous protein production in Pichia pastoris: A review[J]. Biochemical Engineering Journal,2012,64:91-105.
Analysis of Influences of Different Factors onZeaMaysCysteine Proteases Using Response Surface Methodology (RSM)*
CHENFang-qi1,2,LIUHui-min2,3,ZHENGMing-zhu1,2,JINSong1,LIUJing-sheng1,2
(1 College of Food Science and Engineering, Jilin Agricultural University, Jilin Changchun 130118;2 National Engineering Laboratory of Wheat and Corn Deep Processing, Jilin Agricultural University,Jilin Changchun 130118;3 College of Life Science, Jilin University, Jilin Changchun 130023, China)
ZeamaysCysteine Protease is a kind of significant proteolytic enzymes, in order to study the enzymology properties of zmCP1, the zmCP1 was expressed by using the recombinant P. pastoris and the influences of different factors (pH, temperature, concentration of MgCl2) on the activity of zmCP1 were analyzed by RSM with the relative enzyme activity of zmCP1 acted as response value. The results showed that when the three factors was pH 5.95,55.89 ℃,6.08 mM MgCl2,respectively, the predicted relative enzyme activity was 166.78%, measured value was 167.13%. The model is reasonable and has reference value.
zmCP1; fermentation; RSM; enzyme activity
國家自然科學基金(31171760);公益性行業(糧食)科技專項基金(201313011-3);吉林農業大學科研啟動基金。
陳方奇(1991-),男,碩士研究生,研究方向為食品生物化學工程與功能性食品的研究。
劉景圣(1964-),男,教授,博士,研究方向為糧食深加工與功能性食品。
Q786
A
1001-9677(2016)010-0043-05

