抑癌基因死亡相關蛋白激酶在腫瘤中的研究進展
姜應傳,陳 炳
·講座與綜述·
抑癌基因死亡相關蛋白激酶在腫瘤中的研究進展
姜應傳,陳 炳
1995年,以色列學者Deiss及其同事首次發現死亡相關蛋白激酶(DAPK)[1],其編碼的蛋白是相對分子質量為16×104的絲氨酸/蘇氨酸蛋白激酶[2],是細胞凋亡的一種正調控因子[3]。DAPK及其相關的信號通路在很多疾病中發揮了重要的作用,比如動脈粥樣硬化、炎癥以及腫瘤。它可以通過激活死亡受體、活化細胞活素類、基質脫附、神經酰胺化等各種方式調節或執行細胞死亡[4]。研究發現,DAPK是一種抑癌基因,因此它及其相關信號通道的研究對于腫瘤的早期診斷及基因靶向治療有著重要的意義。
1 DAPK的結構
人類DAPK基因全長為4293 bp,位于第9號染色體的q34.1區域。DAPK編碼的蛋白是一種復合中心結構的蛋白,由接觸反應中心和非接觸反應中心構成。接觸反應中心是由核心的激酶區和鈣離子/鈣調蛋白結合區組成,其中后者是最重要的組成部分。鈣調蛋白的結合引起的結構變化可以使 DAPK通過結合底物而激活,而絲氨酸308(Ser308)殘基的磷酸化可以通過降低其對鈣調素的親和力抑制DAPK的功能。非接觸反應中心則是由1個細胞骨架結合區、1個死亡區、2個P-loop環、8個錨蛋白重復序列區和富含絲氨酸的尾部組成[2]。目前已經發現DAPK家族有5個成員,它們的核心激酶區及肌球蛋白輕鏈激酶卻基本相似,但位于C端的死亡區各不相同,被認為與 DAPK的功能有關。DAPK誘導細胞凋亡的精確機制尚不明確。研究表明,C端的死亡區通過參加Fas L及腫瘤壞死因子-(TNF-)誘導的細胞凋亡來介導DAPK的功能。該區如果被敲除,則會下降DAPK誘導細胞凋亡的功能,因此C-端死亡區是其誘導凋亡所必需的[5]。死亡區后是長度為17個氨基酸殘基的尾部,可抑制DAPK誘導凋亡的功能[6]。
2 DAPK的調控機制
DAPK在細胞水平擁有多種調控機制。多項研究表明,在轉錄水平DAPK基因啟動子甲基化與其表達的蛋白缺失強烈相關[7]。DAPK啟動子擁有一個密集的CpG島,很多轉錄因子例如NF B,E2F1和AP1也定位于這些區域的序列。在直腸癌中,有5%~80%的CpG島發生甲基化,但是至今為止,卻沒有系統的研究去比較各個不同的CpG島對蛋白表達的意義。
DAPK的轉錄可被促炎癥轉錄因子STAT3和Nf B抑制[8]。此外,DAPK 的mRNA表達能夠被p53,C/EBP-,HSF1和SMAD等觸發[9]。其中C/EBP-的結合取決于IFN的暴露,而SMAD結合到相應的序列則需要TGF-的觸發。一般而言,DNA損害都會都可能會引起DAPK的轉錄反應性上調[10]。最近研究證明,有些miRNA(miR-103,miR-107)結合于DAPK基因3'端的不翻譯區。miR-103 和miR-107的高表達與直腸癌的患者的高轉移率及低生存率相關,也與DNPK作為轉移抑制因子的角色相呼應[11]。通過電子數據庫計算機模擬提示有些miRNA也可能在DAPK的調控中發揮作用[10]。盡管如此,在這方面的實驗證據還是有所欠缺。
DAPK在翻譯后的穩定性由兩套不同的細胞內蛋白酶解系統調控:(1)泛素-蛋白酶體體系,其中熱休克蛋白70羧基末端相互作用蛋白(CHIP)參與介導DAPK和HSP90復合物的形成。其中,HSP90主要起穩定DAPK水平的作用;而DAPK的錨蛋白重復區與DIP1/ MIB1相結合,可以調節DAPK的多泛素化以及在蛋白酶體的降解[6]。(2)自吞噬細胞/溶酶體體系。由TSC1and TSC2組成的TSC復合體(mTOR)抑制哺乳動物雷帕霉素靶蛋白1的活性。DAPK的死亡區和TSC2的結合會導致2個結果[12]:T SC2基因的磷酸化,TSC復合物的解離和mTOR的活化;TSC2通過一個翻譯后的調控機制直接降低DAPK的水平。
3 DAPK與腫瘤
和其他抑癌基因一樣,DAPK的功能在多種腫瘤中被抑制。但與傳統抑癌基因P53等不同,DAPK在腫瘤中通常是表現為表達缺失而不是突變[2]。DAPK的表達缺失主要源于5'端不翻譯區發生甲基化,雖然不太頻繁,但它仍然是一個純合子缺失的結果。超過30種腫瘤被發現發生DAPK基因甲基化,而它們的甲基化率卻不盡相同。盡管如此,有學者發現在非小細胞性肺癌的細胞系存在DAPK蛋白的表達和基因超甲基化同時存在的現象[13]。腎癌及慢性淋巴細胞性白血病等腫瘤中也有發現這種現象的出現。這說明在某些腫瘤中存在某種重要的DAPK翻譯后的調控機制在調節 DAPK蛋白的表達。由此可見,DAPK基因的甲基化并不意味著DAPK蛋白表達的缺失。
盡管大量的文獻支持DAPK是一種抑癌基因,但有些研究卻得出相反結論。有學者發現一種小鼠的 DAPK的剪接變異體(DAPK-)能夠促進細胞生存[14]。而在人類中,至今僅發現一種DAPK剪接變異體(s-DAPK-1)能夠介導全長DAPK蛋白的降解,而它在腫瘤中的作用還不清楚。但是考慮到其他抑癌基因如P53和P73在腫瘤中的積極作用,很可能在腫瘤中存在更多的 DAPK剪接變異體能夠中和野生型DAPK的作用從而保護細胞免于凋亡。此外,還有學者發現 DAPK能夠在生長因子的作用下反應性地激活哺乳動物雷帕霉素靶蛋白1(mTORC1),促進細胞增殖[15]。Tanaka等[16]發現DAPK是數種子宮癌細胞存活所必須的,而敲除DAPK基因能夠增強5-氟尿嘧啶(5-FU)誘導人類子宮內膜癌細胞的凋亡[17]。所有的這些研究表明,在某些組織和基因環境中,DAPK能夠產生促細胞生存的作用和促進腫瘤發生過程。
轉化生長因子(TGF-b)可以反應性地刺激DAPK的表達和凋亡活性增加。DAPK的表達又可以激活P53的活性,造成DNA的破壞。其他的死亡信號通道,如轉化癌基因E2F1和Myc也能夠誘導DAPK表達。除了P53、ERK1和ERK2也參與DAPK誘導的凋亡。DAPK能夠阻斷ERK向細胞核內轉運,使其保留在細胞質中,從而阻斷ERK生存信號通路。ERK-DAPK軸構成一個正反饋回路,促進細胞凋亡。除此之外,DAPK在細胞生存方面也扮演重要角色,體現在其激活生長因子信號通路及抵抗腫瘤壞死因子(TNF)介導的細胞凋亡。因此,一旦DAPK出現表達缺失,正常的細胞凋亡失去調控,不斷增殖,最終可能形成腫瘤。
4 DAPK與腫瘤轉移
Inbal等[18]最早發現DAPK和腫瘤轉移之間的聯系,他們在一個動物模型中發現,來自同一個細胞系的Lewis肺癌細胞克隆中,高轉移性的肺癌細胞出現了DAPK的表達缺失;體外試驗發現DAPK表達能夠增加腫瘤細胞對某些凋亡刺激因子的敏感性。這些發現提示DAPK表達的缺失能夠為腫瘤細胞提供生存優勢來克服轉移進程各個階段遭遇的阻礙,比如細胞基質粘附的缺失、暴露于死亡刺激因子、對內應力的應答以及面對遠處轉移的不同微環境。在另外一個結腸癌裸鼠的動物模型中,學者發現DAPK在侵襲/轉移的多個步驟中均發揮作用[19]。
基于研究腫瘤患者的臨床樣本,同樣觀察到DAPK和腫瘤轉移的聯系。在多種腫瘤中普遍觀察到DAPK的下調,有時候還和腫瘤的轉移進程相關。比如,DAPK在肺癌中表達的下調和腫瘤分期及淋巴結侵犯相關[20]。在胃癌中,DAPK啟動子的超甲基化和腫瘤分期、淋巴結侵犯情況密切相關[21]。在垂體瘤、泌尿道腫瘤和肝癌中發現DAPK表達的缺失和腫瘤分期及侵襲性相關。
在轉移的過程中,腫瘤細胞經常會遇到促氧化環境,這些都能促進腫瘤轉移的多方面進程,比如增加細胞活力、侵襲性和血管生成等。DAPK作為一種關鍵因子,能夠增加腫瘤細胞對氧化應激應激細胞死亡的敏感性。此外,DAPK還能阻斷踝蛋白(talin)與整合素b1的結合,從而抑制整合素介導的細胞黏附,抑制細胞的移動,抑制腫瘤的發展和轉移[22]。不僅如此,DAPK還能調節數種細胞細胞骨架蛋白,例如肌球蛋白輕鏈II(MLCII),從而平衡細胞的收縮力和黏附力。
5 DAPK與腫瘤治療
靶向治療是如今腫瘤治療研究的一個熱點。治療的靶點應該符合以下幾個條件:(1)這個靶點在不同的疾病中表現的狀態不同,如基因的突變、表達的水平、翻譯后修飾及細胞定位等。(2)這個靶點在疾病中發揮重要的作用,包括維持或推進疾病進展甚至是對常規的治療起到拮抗作用。對這個靶點的介入能夠為患者帶來有效的收益。(3)這個靶點是能夠藥物控制的。某些基因在生物學實驗中表現完美卻在實際操作時困難重重,如RAS癌基因[23]。一個好的治療靶點其表達和活性要能夠特異性地對外部刺激做出反應。
多項對于 DAPK催化區晶體結構的研究都指向設計出特異錨定DAPK蛋白的小分子的可能性[24]。目前有兩種策略激活DAPK:(1)上調DAPK蛋白的表達;(2)對Ser308的自體磷酸化去磷酸化,激活DAPK激酶。目前共有9種試劑能夠通過提高mRNA的表達和抑制降解來提高DAPK蛋白的表達,有2種試劑能夠通過對 Ser308的去磷酸化來提高DAPK的活性,還有3種試劑則兩者都能做到。但是沒有一種試劑能夠提高DAPK基因的表達。目前也無臨床藥物能夠真正特異地激活DAPK。盡管如此,假如一個藥物如甲基化抑制劑對患者的毒性不大且它的治療效果與激活DAPK相關,它就可以作為一種有效的DAPK激活劑用于臨床。因此,需要更多的實驗去研究這類藥物和DAPK所產生的臨床效用。
6 展望
DAPK通過各種途徑影響細胞凋亡,在腫瘤發展及轉移時亦發揮抑制作用。目前對于DAPK的結構、調控機制以及DAPK在腫瘤中發揮的作用均有了比較深入的研究,但對于利用DAPK作為靶點治療腫瘤卻還沒有重大的突破。在今后不斷的研究中,或許能夠找到更多的線索。
[1]Deiss LP, Feinstein E, Berissi H, et al. Identification of a novel serine/threonine kinase and a novel 15-kD protein as potential mediators of the gamma interferoninducedcell death[J].Genes Dev,1995,9(1):15-30.
[2]游崇登,何勤.抑癌基因DAPK甲基化在血液腫瘤中的研究進展[J].醫學綜述, 2012,18(7):1040-1042.
[3]Michie AM, McCaiq AM,Nakaqawa R, et al. Death-associated protein kinase (DAPK)and signal transduction: regulation in cancer[J]. FEBS J, 2010, 277(1): 74-80.
[4]向莎麗,陳幸華,張誠.腫瘤抑制基因DAPK:一個新的藥物治療靶點[J].現代生物醫學進展,2012,12(1):163-165.
[5]Raveh T,Berissi H,Eisenstein M,et al. Afunctional genetic screen identifies regions at the C-terminal tail and death-domain of death-associated protein kinase that are critical for its proapoptotic activity[J].Proc Natl Acad Sci USA, 2000, 97(4) :1572-1577.
[6]王振寶,潘曉琳,陳少澤,等.抑癌基因DAPK在腫瘤的發生、轉移、復發、預后中的作用[J].生命的化學,2008,28(3):295-298.
[7]ChakilamS,gandesiriM,RauTT,etal.Death-associated protein kinase controls STAT3 activ
[8]ChakilamS,gandesiriM,RauTT,etal.Death-associated protein kinase controls STAT3 activity in intestinal epithelial cells[J]. Am J Pathol,2013,182(3):1005-1020.
[9]Gade P, Roy SK, Li H,et al. Critical role for transcription factor C/EBP-beta in regulating the expression of death-associated protein kinase1[J].MolCellBiol,2008,28(8):2528-2548.
[10]Benderska N, Schneider-Stock R. Transcription control of DAPK[J]. Apoptosis, 2014,19(2): 298-305.
[11]Chen HY, Lee YR,Chen RH.The functions and regulations of DAPK in cancer metastasis[J]. Apoptosis,2014,19(2): 364-370.
[12]Gallagher PJ, Blue EK. Post-translational regulation of the cellular levels of DAPK [J]. Apoptosis,2014,19(2): 306-315.
[13]Toyooka S, Toyooka KO, Miyajima K, et,al. Epigenetic down-regulation of deathassociated protein kinase in lung cancers [J]. Clin Cancer Res,2003,9(8):3034-3041.
[14]Jin Y, Blue EK, Dixon S,et al. Identification of a new form of death-associated protein kinase that promotes cell survival[J]. Biol Chem,2001,276(43):39667-39678.
[15]Stevens C, Lin Y, Harrison B, et al. Peptide combinatorial libraries identify TSC2 as a death-associated protein kinase (DAPK) death domain-binding protein and reveal a stimulatory role for DAPK in mTORC1 signaling[J]. Biol Chem,2009, 284(1):334-344.
[16]Tanaka T, Bai T, Yukawa K. Death-associated protein kinase is essential for the survival of various types of uterine cancer cells[J]. Int J Oncol ,2010,37(4):1017-1022.
[17]Tanaka T, Bai T, Yukawa K. Suppressed protein expression of the death-associated protein kinase enhances 5-fluorouracil-sensitivity but not etoposide-sensitivity in human endometrial adenocarcinoma cells [J]. Oncol Rep ,2010,24(5):1401-1405.
[18]Inbal B, Cohen O, Polak-Charcon S,et al. DAP kinase links the control of apoptosis tometastasis[J]. Nature,1997, 390(6656):180-184.
[19]Chen HY, Lin YM, Chung HC,et al. miR-103/107 promote metastasis of colorectal cancer by targeting the metastasis suppressors DAPK and KLF4[J]. Cancer Res, 2012,72(14):3631-3641.
[20]Harden SV, Tokumaru Y, Westra WH, et al. Gene promoter hypermethylation in tumors and lymph nodes of stage I lung cancer patients[J]. Clin Cancer Res, 2003, 9(4):1370-1375.
[21]>Hu SL, Kong XY, Cheng ZD, et al.Promoter methylation of p16, Runx3, DAPK and CHFR genes is frequent in gastric carcinoma[J]. Tumori, 2010, 96(5):726-733.
Kuo JC,Wang WJ,Yao CC,et al. The tumor suppressor DAPK inhibits cell motility by blocking the integrin-mediated polarity pathway[J]. J Cell Biol,2006,172(4):619-631.
[23]Baker NM, Der CJ. Cancer: drug for an 'undruggable' protein[J]. Nature ,2013,497 (7451):577-578.
[24]Okamoto M, Takayama K, Shimizu T, et al. Identification of death-associated protein kinases inhibitors using structure-based virtual screening[J]. J Med Chem, 2009,52(22):7323-7327.
(本文編輯:鐘美春)

圖1 過表達SIAH1通過上調Bim的表達來誘導乳腺癌細胞的凋亡
林珍,高中輝,周建勤,等.急性硫化氫中毒肺部損傷影像學表現(見正文第801頁)
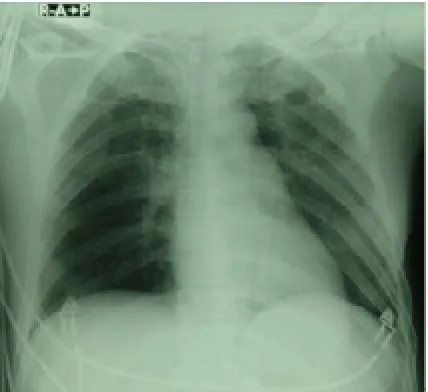
圖2 肺紋理增多加重、模糊,肺門陰影擴大增濃。

圖3 兩肺門增濃,沿增多肺紋理分布斑點狀及小片狀密度增高影,邊緣模糊,并以兩肺中下野中內帶為主。

圖4 兩肺內以肺門為中心較廣泛分布斑點、小片狀,部分融合呈片狀影,邊緣模糊。
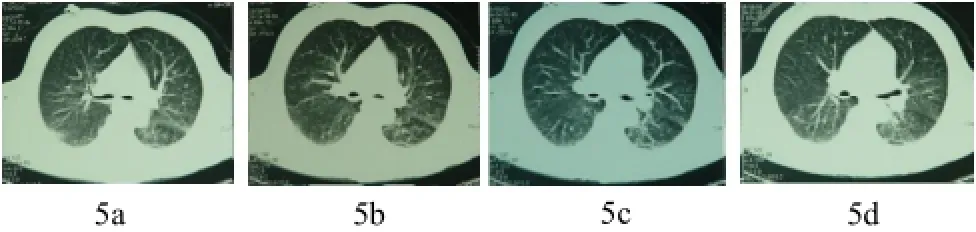
圖5 (a~d) 胸部平片陰性,CT掃描發現早期肺水腫改變。
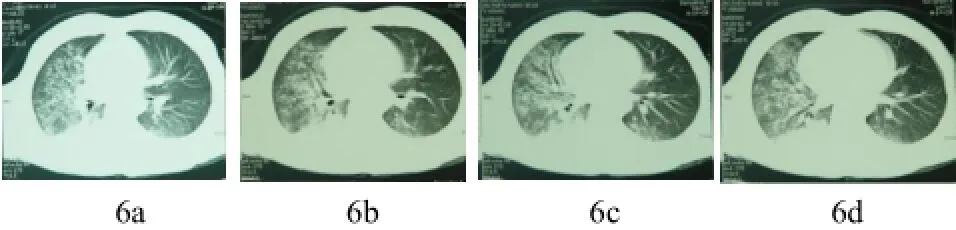
圖6 (a~d) 肺水腫改變。
邵暢,齊廣偉,過華蕾.伴有假腺樣特征的神經鞘瘤臨床病理研究(見正文第802頁)

圖1 腫瘤界限清楚,可見厚的纖維性包膜(HE,×20)

圖2 腫瘤內可見大小不等、形狀不規則的腺管和囊腔樣結構(HE,×20)

圖3 高倍鏡下囊腔被覆為多層立方或柱狀型細胞(HE,×100)
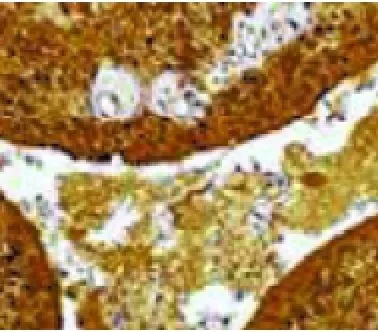
圖4 免疫組化染色,梭形細胞和囊腔被覆細胞均彌漫表達S100(EnVision,×40)

圖5 免疫組化染色,梭形細胞和囊腔被覆細胞CK均陰性(EnVision,×40)
錢立勇,徐勇飛,鄧濤.前列腺穿刺活檢標本中泡沫樣腺癌的臨床病理和免疫組化研究(見正文第808頁)

圖6 前列腺泡沫樣腺癌,瘤細胞具有豐富的淺染色泡沫樣胞漿,核固縮,核仁不明顯(HE,×200)
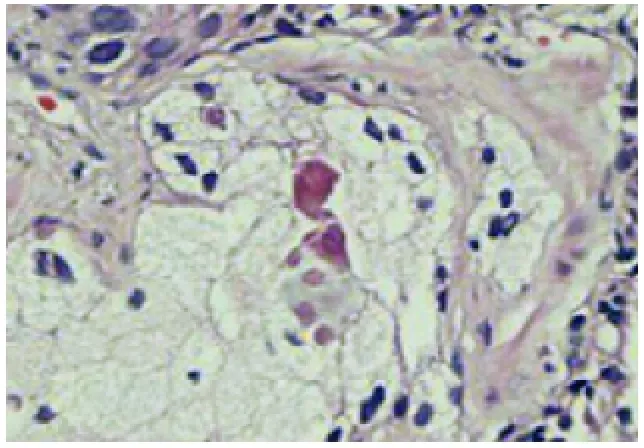
圖7 前列腺泡沫樣腺癌伴普通型腺癌(HE,×200)

圖8 前列腺泡沫樣腺癌 Gleason3+3=6 (HE,×100)
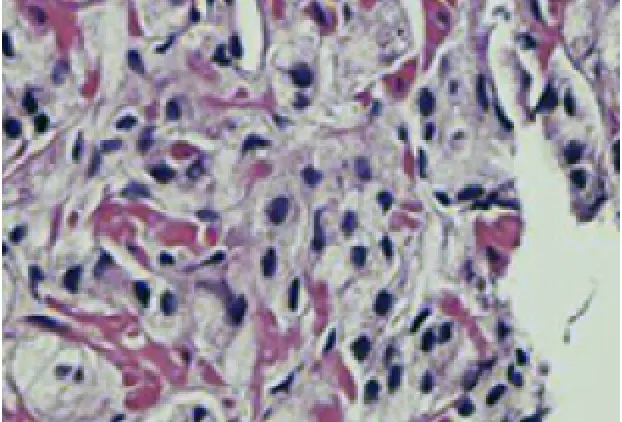
圖9 前列腺泡沫樣腺癌 Gleason4+4=8 (HE,×100)

圖10 前列腺泡沫樣腺癌累犯神經(HE,×200)
梅冠炫.肺部腫瘤化療對癌癥患者耐甲氧西林金黃色葡萄球菌的影響(見正文第811頁)

圖12 每個方形表示1個周期。2例MM患者死于MRSA感染,表示為菱形。
10.3969/j.issn.1671-0800.2016.06.077
R730.2
C
1671-0800(2016)06-0838-03
2016-03-17
舟山市醫藥衛生科技計劃項目(2012B05)
316000浙江省舟山,舟山醫院
陳 炳,Email:chenb521myf@163.com

