植酸酶在米糠谷蛋白提取中應用的研究
馬永強,程文紅,那治國,王 鑫
(哈爾濱商業大學食品工程學院,黑龍江普通高等學校食品科學與工程重點實驗室,黑龍江哈爾濱 150076)
?
植酸酶在米糠谷蛋白提取中應用的研究
馬永強,程文紅,那治國,王鑫
(哈爾濱商業大學食品工程學院,黑龍江普通高等學校食品科學與工程重點實驗室,黑龍江哈爾濱 150076)
以脫脂米糠分級去除清、球、醇溶蛋白后的殘渣為原料,以植酸去除率為評價指標,以酶解溫度、酶解pH、酶解時間和植酸酶添加量為影響因素進行單因素實驗。在此基礎上,根據Box-Benhnken中心組合實驗設計原理,設計三因素三水平響應面優化實驗。在分析各個因素的顯著性和交互作用后,得出去除植酸的最佳工藝條件為:植酸酶添加量2.5 U/g,pH5.6,酶解溫度48 ℃,酶解時間3 h,此條件下,模型實際值為85.47%。在最優植酸酶解條件下,米糠谷蛋白的提取率和純度分別提高了24.53%和10.16%,與此同時,谷蛋白中植酸含量降低了93.2%,溶解性也一定程度上得到了改善。
谷蛋白,植酸酶,植酸去除率,提取率
米糠蛋白是世界公認的優質植物性蛋白,占米糠總質量的12%~20%[1]。多年研究表明,米糠蛋白是一種低過敏性蛋白,其氨基酸組成接近FAO/WHO的推薦模式,是一種極具開發潛力的新型植物蛋白[2]。此外,米糠蛋白已被報道具有抗氧化和抗癌特性[3]。米糠蛋白是一種復合蛋白,主要由清蛋白(約37%)、球蛋白(約36%)、醇溶蛋白(約5%)及谷蛋白(約22%)構成,其中約70%為可溶性蛋白質,谷蛋白是主要不溶性蛋白[4]。谷蛋白含有豐富的谷氨酰胺結構,具有較好的彈性,影響烘焙產品的品質,是一種優質蛋白質[5]。但因與植酸等物質結合,使其提取率較低,限制了其在食品加工中的應用。目前認為造成米糠谷蛋白難溶的原因包括分子間二硫鍵的交聯及與植酸及其鹽類結合引起結構改變,導致形成不溶性的植酸——蛋白質復合體[6]。Adebiyi研究表明米糠谷蛋白中植酸含量較高,使得谷蛋白不易酶解[7]。植酸,學名肌醇六磷酸酯,其分子式為C6H18O24P6,相對分子質量為660.08,與蛋白分子具有很強的螯合能力,會與蛋白結合形成二元或三元不溶復合物,導致蛋白及氨基酸的消化利用率下降[8]。1980年,Cheryan研究發現,植酸酶水解植酸的磷酸鹽殘基,有利于增加蛋白的溶解性和提高蛋白的純度。
植酸酶能催化水解植酸向正磷酸鹽及其他磷酸肌醇中間產物轉化,釋放出磷酸根離子,將與植酸絡合的蛋白質釋放出來,而不影響蛋白整體結構[9]。在米糠谷蛋白提取前利用植酸酶降解植酸,提高谷蛋白提取率的同時可制備低植酸含量的谷蛋白,還能一定程度上改善谷蛋白的溶解特性。本實驗采用Osborne分級提取法去除清蛋白、球蛋白、醇溶蛋白,通過響應面實驗優化植酸酶解工藝,并比較分析了植酸酶解前后谷蛋白提取率及溶解特性的變化,以期為米糠谷蛋白的深加工及應用提供理論依據。
1 材料與方法
1.1材料與儀器
米糠實驗室磨制;植酸酶酶活力≥3 U/mg;植酸鈉(C6H6O2P4Na12)純度95%;D201大孔陰離子交換樹脂上海華羚樹脂有限公司;正己烷、鉬酸銨、偏釩酸銨、氫氧化鈉、氯化鈉、無水硫酸鈉、鹽酸、三氯化鐵、磺基水楊酸、福林酚試劑分析純;植酸鈉標準品純度98%;牛血清白蛋白標準品。
精米機浙東糧檢儀器廠;粉碎機天津市泰斯特儀器有限公司;UV-2100紫外可見分光光度計尤尼柯儀器有限公司;離子交換柱(0.8 cm×10 cm);HL-2恒流泵上海瀘西分析儀器廠;分析天平上海光正醫療儀器有限公司;電子天平上海越平科學儀器有限公司;磁力攪拌器上海縣曹行無線電元件廠;PP-25E型酸度計;低速離心機上海安亭科學儀器廠;電熱鼓風干燥箱上海一恒科學儀器有限公司;FD-1C-50型凍干機。
1.2實驗方法
1.2.1樣品前處理
1.2.1.1脫脂原料米糠粉碎過60目篩,常溫下按料液比1∶5加入正己烷,脫脂2 h后4000 r/min離心10 min,將沉淀置于通風櫥中自然晾干,即得脫脂米糠。
1.2.1.2酶解脫脂米糠過80目篩,按料液比1∶8加入緩沖液,α-淀粉酶添加量為20 U/g,HCl調節溶液pH6.2,62 ℃水浴2 h,接著調節溶液pH5.0,添加纖維素酶300 U/g,50 ℃水浴2 h[10],90 ℃滅酶15 min,4000 r/min離心15 min,去除上清液,沉淀45 ℃烘12 h得到經α-淀粉酶、纖維素酶酶解的米糠。
1.2.1.3去除雜蛋白參照Osborne法,略作改動。經α-淀粉酶、纖維素酶酶解的米糠加入8倍體積的3% NaCI,45 ℃恒溫水浴1.5 h,重復兩次操作去除清蛋白、球蛋白;繼續加入8倍體積的70%乙醇,45 ℃恒溫水浴1.5 h,重復兩次操作去除醇溶蛋白,殘渣45 ℃烘12 h,得到去除雜蛋白后的米糠原料[11]。
1.2.2植酸酶的活化及酶活力測定
1.2.2.1酶的活化稱取2.00 g植酸酶,pH為5.4的乙酸緩沖液將其定容到1000 mL,超聲波溶解器上超聲溶解10 min,功率設定為500 W,再用磁力攪拌器中速攪拌20 min,使酶活化,使用前存放在4 ℃冰箱中[12]。
1.2.2.2酶活力測定參照GB/T 18634-2009 飼用植酸酶活性的測定[13]。經測定,實驗所用植酸酶活為2.49 U/mg。
1.2.3影響植酸去除率的單因素實驗分4組(每組準確稱取去除雜蛋白后的米糠原料5.000 g)進行實驗。第一組:在不同pH(3.5、4.0、4.5、5.0、5.5、6.0、6.5)條件下,酶添加量為2.0 U/g,溫度55 ℃,恒溫酶解2.5 h;第二組:調節pH5.5,酶添加量為2.0 U/g,在不同溫度(35、40、45、50、55、60、65 ℃)條件下恒溫酶解2.5 h;第三組:調節pH5.5,溫度為55 ℃,植酸酶添加量分別為(0.5、1.0、1.5、2.0、2.5、3.0、3.5 U/g),酶解2.5 h;第四組:調節pH5.5,酶的添加量為2.0 U/g,溫度為55 ℃時分別酶解(1.0、1.5、2.0、2.5、3.0、3.5、4.0 h)進行酶解。實驗用3%的TCA滅活酶以控制酶解時間,用1 mol/L HCl、1 mol/L NaOH溶液控制反應溶液的pH。分別測定各組試樣酶解后的植酸含量,三次平行,取平均值。
1.2.4響應曲面法實驗設計在單因素實驗基礎上,根據Box-Benhnken中心組合實驗設計原理選取對植酸去除率影響顯著的pH、溫度、時間三因素,設計實驗。因素與水平見表1。
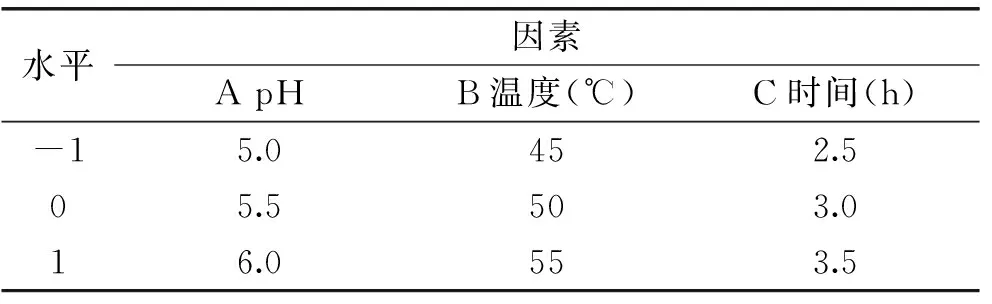
表1 因素與水平表
1.2.5植酸含量的測定參照GB/T 5009.153-2003 植物性食品中植酸含量的測定,略有改動。本實驗用D201大孔陰離子交換樹脂代替國標中使用的AG1-X4陰離子交換樹脂[14-15]。實驗得到植酸含量工作曲線方程為y=-1.1683x+0.9012,相關系數R2=0.9957。
1.2.6米糠谷蛋白提取及測定方法
1.2.6.1植酸酶解方法準確稱取去除雜蛋白后的米糠原料5.000 g溶于50 mL pH為5.6的緩沖液中,植酸酶添加量2.5 U/g,48 ℃水浴加熱3 h,4000 r/min離心15 min,倒去上清液,殘渣水洗兩次后進行谷蛋白提取實驗。
1.2.6.2谷蛋白提取殘渣2按料液比1∶8加入0.02 mol/L NaOH溶液,調節pH為9,45 ℃恒溫水浴1.5 h,4000 r/min離心15 min取上清液(重復兩次操作),測得蛋白含量,得出谷蛋白提取率[16]。上清液pH調至4.8,靜置0.5 h,4000 r/min離心15 min,沉淀水洗,pH回調至7.0,冷凍干燥,得米糠谷蛋白。
1.2.6.3谷蛋白含量測定米糠中蛋白含量測定采用凱氏定氮法,參照GB 5009.5-2010,蛋白質系數為5.95[17]。上清液中蛋白質含量測定采用福林酚法[18]。實驗得到蛋白含量標準曲線方程為y=0.0011x+0.0073,相關系數R2=0.9956。
1.2.6.4蛋白含量測定指標
米糠谷蛋白提取率(%)=提取液中谷蛋白質量/樣品中總谷蛋白質量×100
蛋白質純度(%)=冷凍干燥后濃縮蛋白樣品中蛋白質含量/冷凍干燥后濃縮蛋白樣品重×100
1.2.6.5米糠谷蛋白溶解度的測定分別稱取0.1 g植酸酶處理前后堿提得到的米糠谷蛋白樣品,加入20 mL蒸餾水,將pH分別調至2、3、4、5、6、7、8、9、10、11,25 ℃下磁力攪拌1 h,4000 r/min轉速下離心15 min,收集上清液,測其蛋白含量。計算公式如下:

1.2.7數據統計所得數據均為三次重復的平均值,數據統計分析采用SPSS13.0進行方差分析,響應面所得數據使用Design-Expert.V8.0.6軟件進行數據分析。
2 結果與討論
2.1去除植酸的單因素實驗結果
2.1.1酶解pH對植酸去除率的影響圖1表明,pH對植酸酶解效果影響較大。在pH3.5~5.5范圍內隨著pH的增加植酸去除率上升,且上升趨勢增大;在pH5.5左右時植酸去除率達到最大為72.38%,酶活最高;pH5.5~6.5范圍內,植酸去除率隨pH的增大明顯減小。植酸酶的最適pH約為5.5,符合植物性植酸酶的最適pH4~6。植酸酶對pH很敏感,因此應將pH范圍控制在5~6之間。
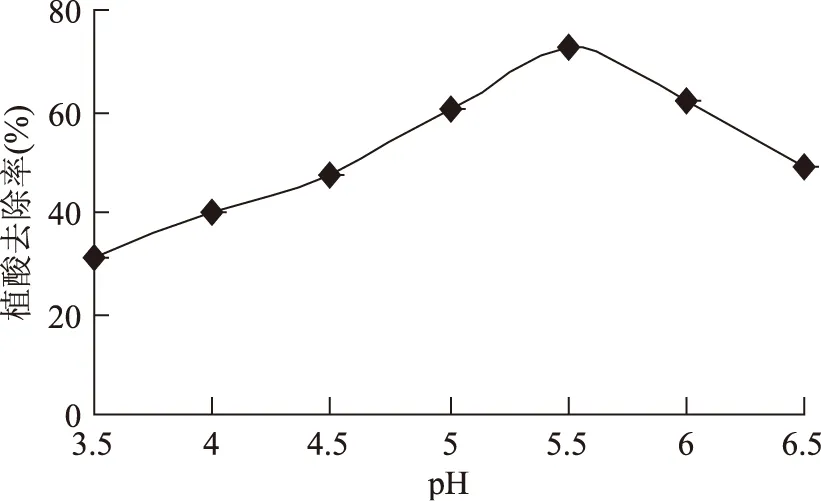
圖1 酶解pH對植酸去除率的影響Fig.1 Effect of enzymolysis pH on phytic acid removal rate
2.1.2酶解溫度對植酸去除率的影響圖2表明,溫度在35~65 ℃間,植酸去除率隨溫度的增加而呈現先緩慢上升后顯著下降的趨勢。在溫度為50 ℃時,植酸的去除率達到最大值83.30%,符合植物性植酸酶的最適溫度45~60 ℃。實驗應將反應溫度控制在45~55 ℃之間。
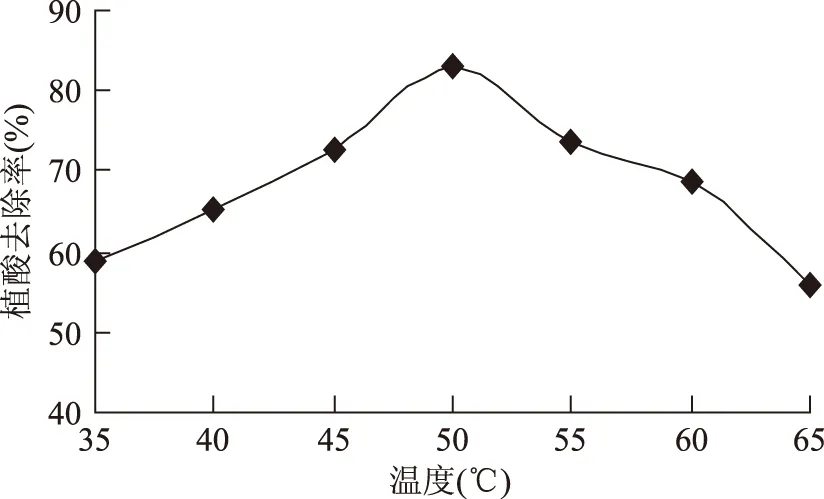
圖2 酶解溫度對植酸去除率的影響Fig.2 Effect of enzymolysis temperature on phytic acid removal rate
2.1.3酶添加量對植酸去除率的影響圖3表明,植酸含量在酶添加量為0.5~3.5范圍內變化不大,當酶添加量達到2.0 U/g,隨著酶添加量的增加,相應的植酸含量趨于平衡,表明植酸酶只能在一定程度上促進植酸鹽的酶解。因此,實驗確定酶添加量為2.5 U/g。
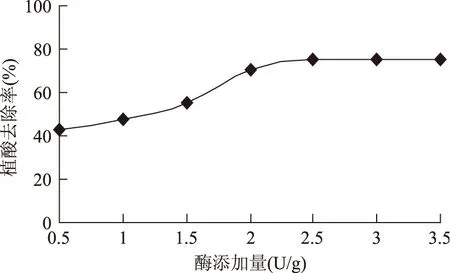
圖3 酶添加量對植酸去除率的影響Fig.3 Effect of enzyme addition on phytic acid removal rate
2.1.4反應時間對植酸去除率的影響圖4表明,隨著反應時間的延長,1.0~2.5 h之間逐漸上升,在2.5 h之后有輕微上升趨勢,但是趨于平緩。在2.5~3.5 h之間均能較好的去除植酸效果。因此,反應時間選擇在2.5~3.5 h間。
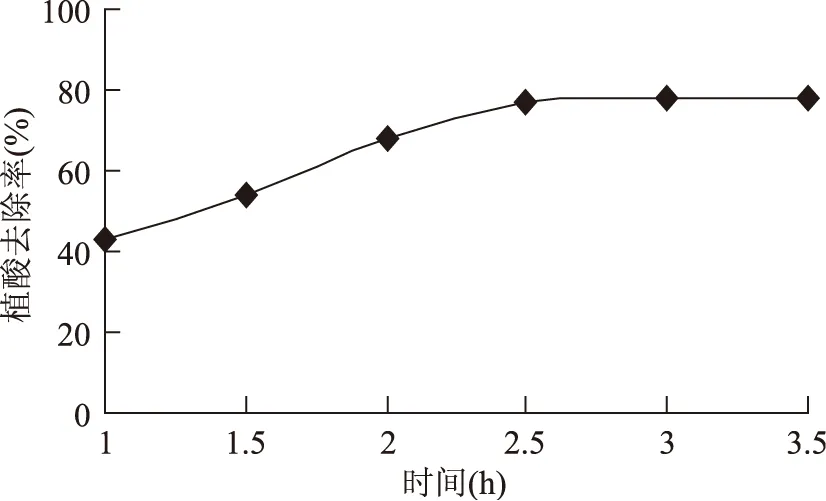
圖4 反應時間對植酸去除率的影響Fig.4 Effect of enzymolysis time on phytic acid removal rate
2.2響應面實驗結果與分析
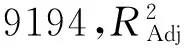
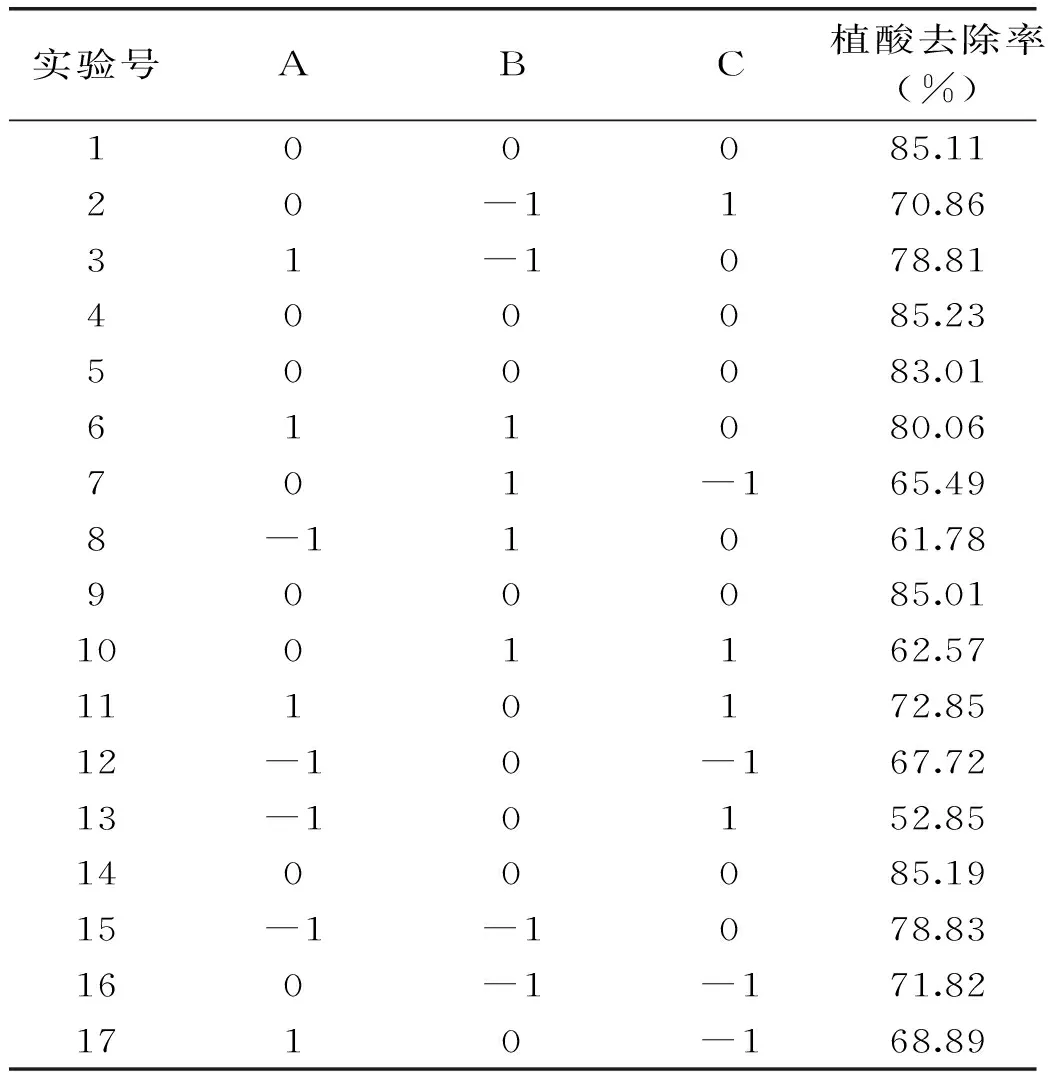
表2 響應面分析方案與實驗結果
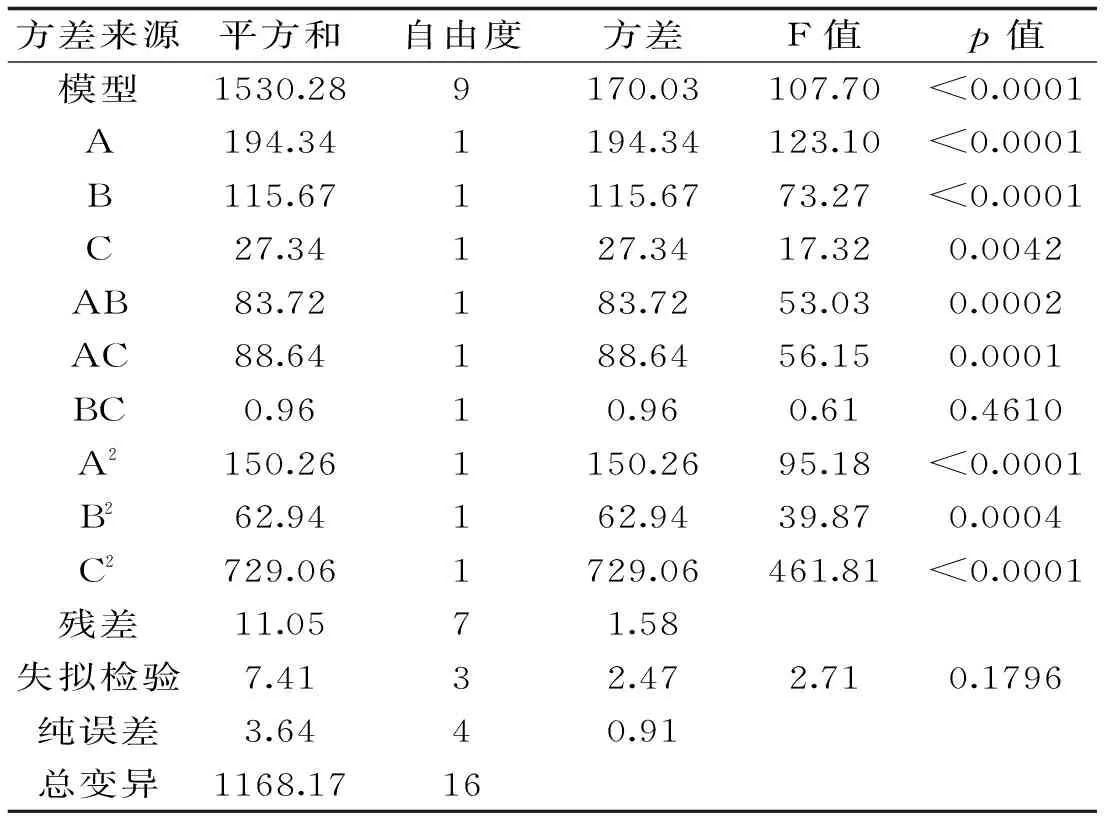
表3 回歸模型方差分析
2.2.2響應面分析與優化橢圓圖形的中心區域,植酸去除率最高,橢圓排列越密集,說明因素變化對植酸去除率影響較大。結果顯示,模型中一次項A(p<0.0001)、B(p<0.0001)及C(p=0.0042<0.01)影響極顯著,三者的二次項對植酸去除率的曲面效應極顯著,AB、AC的p<0.01,說明因素間有極顯著的交互作用,BC的p>0.05,表明反應溫度和時間沒有顯著地交互作用。交互顯著項對米糠中植酸去除率影響的響應曲面如圖5、圖6所示。
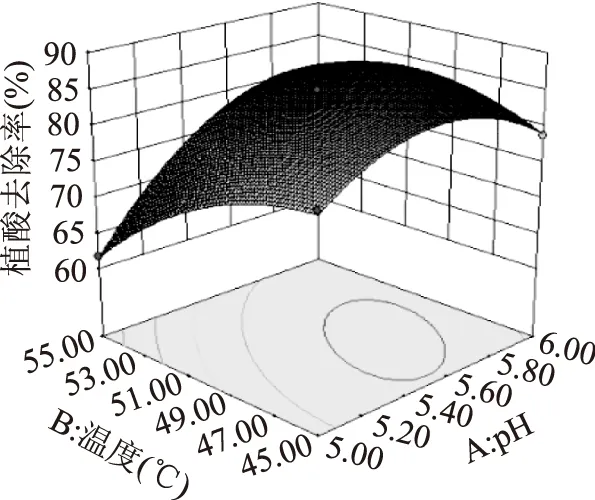
圖5 pH與溫度交互作用的三維曲面圖Fig.5 Response surface and contour plots showing the effects of enzymolysis pH and temperature on phytic acid removal rate
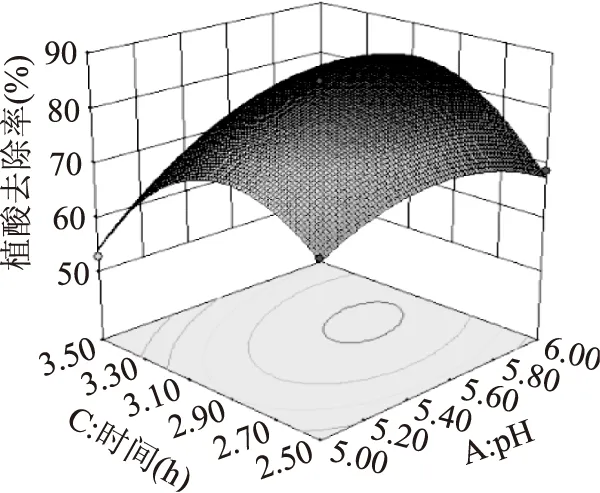
圖6 pH與時間的交互作用Fig.6 Response surface and contour plots showing the effects of enzymolysis pH and time on phytic acid removal rate
2.2.3最優條件的確定及驗證根據回歸模型通過Design Expert軟件分析得出最佳工藝參數為:植酸酶添加量2.5 U/g,pH5.64,酶解溫度48.39 ℃,酶解時間2.99 h,植酸去除率為86.04%。根據操作的實際情況,將最佳工藝參數調整為:植酸酶添加量2.5 U/g,pH5.6,酶解溫度48 ℃,酶解時間3 h。在該條件下重復3次測定的結果顯示,米糠中植酸去除率平均為85.47%,與預測值相對誤差為0.66%。表明模型與實際實驗結果相符,該模型可較好地優化米糠中植酸去除工藝參數。
2.3米糠谷蛋白含量指標比較分析
2.3.1米糠谷蛋白溶解度比較分析植酸酶解前后米糠谷蛋白的溶解性在pH5時較低,原因是米糠谷蛋白等電點為4.7,在等電點附近,水化作用最弱,溶解度最小;米糠谷蛋白含有少量的酸溶性谷蛋白,因此在酸性環境下蛋白溶解度略有提高,谷蛋白在堿性環境下溶解性更好原因可能是谷蛋白分子中的二硫鍵斷裂[19]。植酸酶解后,不同pH環境下谷蛋白溶解度都有不同程度的提高,可能是因為植酸含量大幅度減少,使得更多的谷蛋白從植酸-谷蛋白解聚出來,蛋白緊密的結構變得疏松,從而增加了谷蛋白的溶解性。
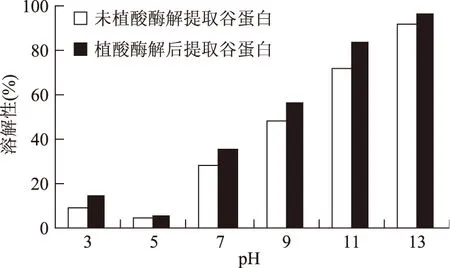
圖7 植酸酶解前后不同pH米糠谷蛋白溶解性的比較Fig.7 Comparison of solubility of gluten under different pH
2.3.2米糠谷蛋白其他指標比較分析由表4可得,植酸酶解前后谷蛋白提取率和純度分別提高了24.53%、10.16%。植酸酶降解米糠中的植酸,從而破壞植酸和谷蛋白的螯合作用,解除其對谷蛋白提取的干擾,提高了米糠谷蛋白的溶出率,使得谷蛋白提取率和純度均有較大提高。同時植酸酶解后谷蛋白植酸含量降低了93.2%,而低植酸蛋白有利于提高蛋白質及氨基酸的利用率[20]。
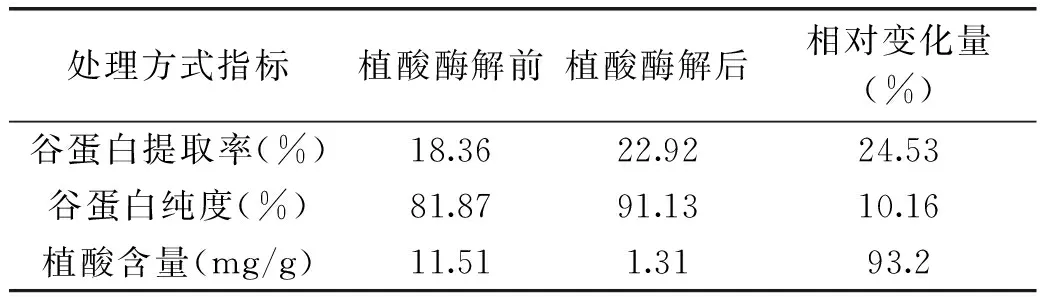
表4 米糠谷蛋白含量指標比較
3 結論
實驗利用Design Expert軟件進行實驗設計,對米糠中植酸酶解的工藝條件進行了優化,并比較分析了植酸酶解前后谷蛋白提取率及溶解特性的變化,結論如下:植酸酶解的最佳工藝條件為:植酸酶添加量2.5 U/g,pH5.6,酶解溫度48 ℃,酶解時間3 h,此條件下,植酸去除率為85.47%。經植酸酶解后,谷蛋白提取率及純度分別提高了24.53%、10.16%,谷蛋白的溶解性得到了一定程度提高,同時制得低植酸含量谷蛋白,為進一步開發利用米糠谷蛋白提供了理論基礎。
[1]Xia N,Wang J M,Yang X Q,et al. Preparation and characterization of protein from heat-stabilized rice bran using hydrothermal cooking combined with amylase pretreatment[J]. J Food Engi,2012,110(1):95-101.
[2]Wang M,Hettiarachchy N S. Preparation and functional properties of rice bran protein isolate[J]. Journal of Science Food Agriculture,1999(47):411-416.
[3]Kannan A,Hettiarachchy N,Johnson M G,et al. Human colon and liver cancer cell proliferation inhibition by peptide hydrolysates derived from heat-stabilized defatted rice bran[J]. J Agric Food Chem,2008,56(24):11643-11647.
[4]Hamada J S. Characterization and functional properties of rice bran proteins modified by commercial exoproteases and endoproteases[J]. Journal of Food Science,2000,65(2):
305-310.
[5]彭文怡,陳慧. 米糠蛋白綜合利用[J]. 糧食與油脂,2015,28(5):9-10.
[6]周小玲,劉永樂,李向紅,等. 蛋白質谷氨酰胺酶對米谷蛋白的分子結構及功能性質的影響[J]. 中國食品學報,2010,10(5):98-105.
[7]Adebiyi A P,Adebiyi A O,Ogawa T. Purication and characterization of anti-oxidative peptides from unfr-actionated rice bran protein hydrolysates[J]. International Journal of Food Scienc and Technology,2008(43):35-43.
[8]Kuma R V,Sinha A K,Makkar H P,et al. Phytate and phytase in fish nutrition[J]. J Anim Physiol Anim Nutr(Berl),2012,96(3):335-364.
[9]李欣,陳威,何敏. 熱激處理和檸檬酸提高發芽糙米中植酸酶活性[J]. 食品工業科技,2014,35(8):202-209.
[10]王慧,于國萍,于純淼. 纖維素酶提取米糖蛋白的條件優化[J]. 食品工業科技,2008,55(2):220-222.
[11]王艷玲. 米糠中四種蛋白的提取工藝及特性研究[D]. 哈爾濱:東北農業大學,2013.
[12]朱秋華,鄭超,高有領,等. 外源植酸酶對菜籽粕中植酸的酶解條件優化[J]. 中國飼料,2013,13(2):4-7.
[13]GB/T 18634-2009,飼用植酸酶活性的測定 分光光度法[S].
[14]GB/T 5009.153-2003,植物性食品中植酸含量的測定[S].
[15]任傳英,趙永煥,崔洪斌,等. 豆粕和米糠中植酸含量的測定方法研究[J]. 大豆通報,2007,88(3):43-45.
[16]王長遠,許鳳. 米糠谷蛋白提取工藝的優化及其亞基組成分析[J]. 中國生物制品學雜志,2014,27(7):940-949.
[17]GB 5009.5-2010,食品安全國家標準 食品中蛋白質的測定[S].
[18]Jowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem,1951,193(1):265-275.
[19]王力,周素梅,陳正行. 提取米糠蛋白的探討[J]. 西部糧油科技,2002,27(3):35-37.
[20]宋金彩,單安山,植酸酶對蛋白質和氨基酸利用率的影響[J]. 中國飼料,2000,10(8):14-15.
Application of phytase on the extraction of rice bran gluten
MA Yong-qiang,CHENG Wen-hong,NA Zhi-guo,WANG Xin
(College of Food Engineering,Harbin University of Commerce,Key Laboratory for Food Science and Engineering in Heilongjiang College and University,Harbin 150076,China)
The residue was used as experiment material,after albumin,globulin,prolamin were removed from defatted rice bran. Single factor experiments were conducted to explor effects of four reaction parameters,including temperature,pH,time and phytase addition amount on degradation of phytic acid in rice bran. Based on this,the response surface methodology was designed according to the principle of Box-Benhnken central combination design. The results showed that the optimal conditions were obtained as follows:phytase addition dosage 2.5 U/g,pH5.6,reaction time was 3 h,reaction temperature was 48 ℃. The practical phytic acid removal rate was 85.47%. Under the optimal conditions,the extraction yield and purity of rice bran gluten were increased by 24.53% and 10.16% respectively. At the same time,phytic acid content in gluten was reduced by 93.2% and the solubility of gluten improved to a certain extent.
gluten;phytase;phytic acid removal rate;extraction yield
2015-10-26
馬永強(1963-),男,教授,研究方向:食品酶學與食品化學,E-mail:qyma163@126.com。
黑龍江省科技攻關課題(GC12B403)。
TS209
A
1002-0306(2016)10-0189-05
10.13386/j.issn1002-0306.2016.10.030

