高產β-果糖基轉移酶的米曲霉菌株的篩選及其產酶條件優(yōu)化
高 斌,梁 露,李 婭,李 斌,劉成梅,付桂明,*
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047; 2.南昌大學中德食品工程中心,江西南昌 330047; 3.南昌大學食品學院,江西南昌 330031)
?
高產β-果糖基轉移酶的米曲霉菌株的篩選及其產酶條件優(yōu)化
高斌1,2,3,梁露3,李婭3,李斌1,2,3,劉成梅1,2,3,付桂明1,2,3,*
(1.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047; 2.南昌大學中德食品工程中心,江西南昌 330047; 3.南昌大學食品學院,江西南昌 330031)
從本實驗室保藏的6株米曲霉A-F01、A-F02、A-F03、A-F04、A-F05和 A-F06中,利用高效液相色譜HPLC-示差折光檢測器RID測定6株米曲霉生物合成β-果糖基轉移酶(β-FTase)酶活,篩選出高產β-果糖基轉移酶的米曲霉菌株A-F04,并通過單因素實驗和正交實驗對其產酶發(fā)酵條件和培養(yǎng)基進行了優(yōu)化。結果顯示,影響發(fā)酵產酶因素的主次順序為接種量、培養(yǎng)溫度和轉速;影響A-F04菌株發(fā)酵培養(yǎng)基組成因素的主次順序為庶糖、酵母粉、pH、硫酸銨;確定了A-F04菌株最佳產酶條件,即培養(yǎng)基組成為0.4%(m/v)的蔗糖、0.15%(m/v)的酵母粉、0.15%(m/v)的硫酸銨和0.2%(m/v)的氯化鈉,起始pH7.0,接種量為1.0%(v/v),培養(yǎng)時間為96 h,培養(yǎng)溫度為35 ℃,轉速為200 r/min,其β-FTase酶活力可達519.65 U/g,相比在發(fā)酵基礎培養(yǎng)基和初始條件下的酶活466.25 U/g,提高了11.45%。
β-果糖基轉移酶,米曲霉,高產菌株,條件優(yōu)化
β-果糖基轉移酶(β-fructosyltransferase,β-FTase,EC 2.4.1.9),能以蔗糖為反應底物,生成β-D-果糖殘基和葡萄糖,β-D-果糖殘基通過β-1,2-糖苷鍵再連接蔗糖,最終生成低聚果糖(fructooligosaccharides,FOS)[1-3]。FOS包括蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)[4]。FOS對改善腸道功能、防治便秘和腹瀉、提高免疫力、促進礦物質吸收等具有特殊的生理功效[5-8],因此,FOS在醫(yī)藥、食品等開發(fā)應用市場潛力巨大[9]。自然條件下,從植物中獲取FOS較為困難,且產量少,工業(yè)上主要用固定化酶β-FTase催化合成FOS[10-11]。研究表明,獲取大量β-FTase酶和選育β-FTase分泌高的安全菌株成為促進FOS生產的關鍵之一。
楊正茂等[12]利用黑曲霉分泌表達β-FTase,然而黑曲霉一些次級代謝產物的食品安全性還存在爭議[13]。研究發(fā)現,米曲霉(Aspergillusoryzae,A.oryzae)分泌和表達β-FTase能力較強,且具有極高的食品安全性,被美國FDA 認證為GRAS菌種之一[14-15]。對于利用米曲霉分泌表達β-FTase的研究近年來成為熱點。目前有關米曲霉生物合成β-FTase的相關報道中,蔣波[16]和何小妮等[17]選用酶活為105.09 U/g原始米曲霉菌株,分別通過紫外-氯化鋰復合誘變和利用非對稱滅活雙親原生質體融合法選育產β-FTase的米曲霉新菌株,最終達到的酶活力分別為291.10 U/g和172.95 U/g。本實驗以實驗室保藏的6株米曲霉A-F01、A-F02、A-F03、A-F04、A-F05和 A-F06為研究對象,6株初始菌株的酶活均較高,在6株米曲霉菌種進一步對高產β-FTase米曲霉菌株進行了篩選,并對其產酶條件進行了研究,以期獲得高產β-FTase的米曲霉菌株及其適宜的產酶條件,為工業(yè)化利用米曲霉發(fā)酵生產FOS提供一定的指導意義。
1 材料與方法
1.1材料與儀器
6株米曲霉:AspergillusoryzaeA-F01、A-F02、A-F03、A-F04南昌大學食品科學與技術國家重點實驗室保藏;AspergillusoryzaeA-F05、A-F06江西中德聯(lián)合研究院;酵母粉阿拉丁試劑,BR純度;牛肉膏、蛋白胨北京奧博星,BR純度;玉米漿新沂恒惠淀粉糖有限公司;瓊脂粉上海山浦,BR純度;乙腈西隴化工,HPLC級;低聚果糖日本WOKO,純度≥99.9%;葡萄糖、蔗糖和果糖Sigma試劑,純度≥99.0%;(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、NaOH、HCl、K2HPO4· 3H2O、磷酸氫二鈉、檸檬酸等國產分析純。
ZDX-35BI型座式蒸汽滅菌器上海申安醫(yī)療器械廠;LGJ-1冷凍干燥機北京亞泰科隆儀器技術有限公司;HWS-250型恒溫恒濕培養(yǎng)箱上海森信實驗儀器有限公司;ZHWY-2102C型恒溫培養(yǎng)振蕩器上海智誠分析儀器制造有限公司;SHZ-D(Ⅲ)型循環(huán)水式真空泵鞏義市英峪予華儀器廠;LC-1260型高效液相色譜儀、示差折光檢測器美國安捷倫公司;TGL-16B型高速離心機美國熱電。
1.2實驗方法
1.2.1生長曲線的建立采用菌絲體濕重法建立米曲霉的生長曲線。配制固態(tài)發(fā)酵基礎培養(yǎng)基于121 ℃高壓蒸汽滅菌30 min,分裝試管冷卻后制成斜面?zhèn)溆谩S媒臃N環(huán)接種6株米曲霉孢子,斜面劃線,30 ℃恒溫恒濕靜置培養(yǎng)3 d后,用滅菌生理鹽水洗脫斜面,制備米曲霉孢子懸浮液,孢子懸浮液倒入100 mL含有滅菌玻璃珠的三角瓶中,充分搖勻后用血球計數板計數。分別以1%(v/v)的接種量接種6株米曲霉孢子懸浮液,30 ℃、150 r/min培養(yǎng)0~5 d。將培養(yǎng)時間為0、24、48、60、72、84、96、120 h的米曲霉菌絲體抽濾至恒重,收集菌絲體并稱重,確定生物量,菌絲體液氮研磨后凍干。
1.2.2粗酶液的制備稱取凍干后的6株各個不同培養(yǎng)時間段的米曲霉菌粉0.2 g,用5 mL磷酸氫二鈉-檸檬酸緩沖液(pH6.0)重懸,10000 r/min 4 ℃離心10 min,吸取上層清液,過0.22 μm的水系滅菌微孔濾膜,收集濾液,即為粗酶液。
1.2.3酶活測定用磷酸氫二鈉-檸檬酸緩沖液(pH6.0)配制25%的蔗糖溶液,分裝至100 mL錐形瓶中,于48 ℃預熱30 min,分別加入6株米曲霉粗酶液5 mL于錐形瓶中。將反應體系置于恒溫水浴振蕩培養(yǎng)箱中,48 ℃、150 r/min條件下反應1 h,沸水浴15 min終止反應,離心取上清液制備樣品。酶活定義如下[18]:48 ℃條件下,每分鐘催化蔗糖產生1 μmol蔗果三糖GF2所需的酶量定義為一個酶活單位(U)。每克菌粉酶活力H=(GF2×106)/(504.44×t×m),其中,GF2為蔗果三糖生成量,g;t為反應時間,min;m為反應菌粉質量,g。
1.2.4HPLC檢測條件檢測器:安捷倫1260示差折光檢測器;色譜柱:Waters Spherisorb 5.0 μm NH2,4.6 mm×250 mm;流動相:乙腈-水(80∶20,V/V),流速1.0 mL/min;柱溫:40 ℃;進樣量:10 μL。分別配制果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖和蔗果五糖標準液,分別單個標準品進樣,確定6種糖類出峰時間。由于β-FTase在高濃度蔗糖下催化反應主要生成蔗果三糖,因此僅對蔗果三糖標準曲線進行繪制:精確配制100 mg/mL蔗果三糖標準液,超純水稀釋至0~100 mg/mL之間的不同濃度梯度的蔗果三糖標準液,HPLC示差折光檢測其峰面積,根據峰面積進行定量。
1.2.5高產β-FTase菌株產酶條件優(yōu)化
1.2.5.1菌株的發(fā)酵條件優(yōu)化以高效液相HPLC酶活測定結果,確定高產β-FTase米曲霉菌株。
本研究以前期探究出的發(fā)酵基礎培養(yǎng)基(酵母粉1 g,(NH4)2SO42 g,蔗糖3 g,NaCl 2 g,蒸餾水定容至1 L,自然pH)為出發(fā),按照初始菌液0.5%、1.0%、2.0%、5.0%和10.0%的接種量在30 ℃,150 r/min發(fā)酵培養(yǎng)96 h,測定產β-FTase酶活,探究接種量對產酶的影響;得到最佳接種量后,繼續(xù)探究菌體在25、30、35、37、40 ℃溫度下,按照最佳接種量、150 r/min搖床培養(yǎng)96 h,測定其產β-FTase酶活大小,探究溫度對產酶的影響;得到產酶最佳培養(yǎng)溫度后,繼續(xù)探究菌體在100、125、150、175、200、250 r/min轉速下,在最佳接種量、最佳培養(yǎng)溫度條件下?lián)u床培養(yǎng)96 h,探究轉速對產酶的影響。
以接種量、溫度、轉速為因子,采用L9(34)正交實驗對發(fā)酵條件進行優(yōu)化,因素水平表見表1。在所得的最佳發(fā)酵條件下進行3次驗證實驗,檢查結果的重現性。
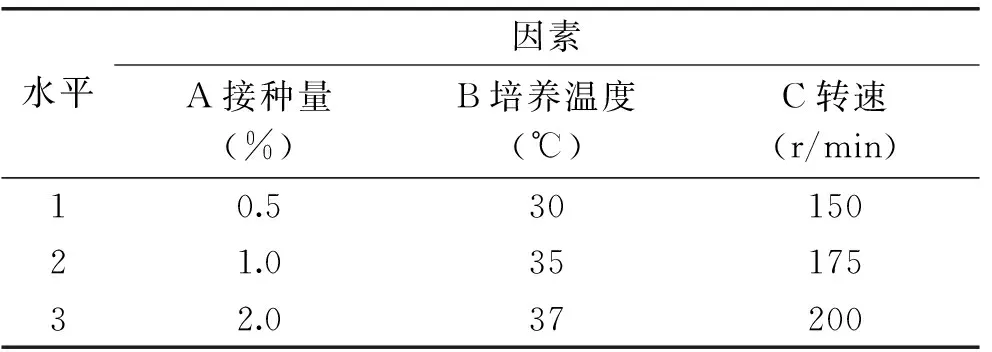
表1 發(fā)酵條件正交實驗因素水平表
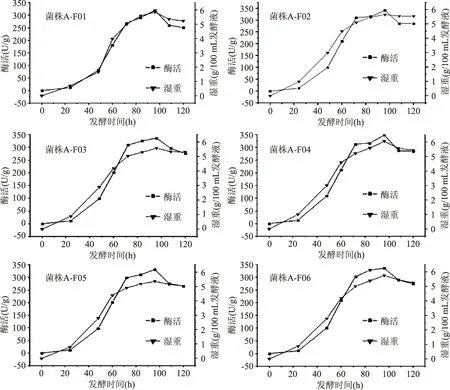
圖1 6株菌不同發(fā)酵時間的β-FTase酶活和生物量Fig.1 β-FTase enzyme activity and biomass of 6 strains during different fermentation period
1.2.5.2菌株培養(yǎng)基的優(yōu)化以最佳發(fā)酵條件(最佳接種量、溫度和轉速)為基礎,探究四種不同的0.3%(m/v)碳源(淀粉、蔗糖、果糖和葡萄糖)對產酶的影響,并以此出發(fā)探究產酶最高的碳源濃度為0.1%、0.2%、0.4%、0.5%、0.8%、1.0%時對產酶的影響;以最佳發(fā)酵條件和最佳濃度的碳源為不變因素,探究四種不同的0.1%(m/v)的有機氮源(蛋白胨、酵母粉、玉米漿和牛肉膏)對產酶的影響,并以此出發(fā)探究最佳有機氮源濃度為0.05%、0.08%、0.10%、0.15%、0.20%時對產酶的影響;以最佳發(fā)酵條件、最佳濃度的碳源和最佳濃度的有機氮源為不變因素,探究四種不同的0.2%(m/v)的無機氮源(氯化銨、硫酸銨、硝酸銨和硝酸鈉)對產酶的影響,并以此出發(fā)探究最佳無機氮源濃度為0.1%、0.15%、0.20%、0.25%時對產酶的影響;以最佳發(fā)酵條件、最佳濃度的碳源、最佳濃度的有機氮源和無機氮源為不變因素,探究不同起始pH(5.0、5.5、6.0、6.5、7.0、7.5和8.0)的培養(yǎng)基對產酶的影響。
以碳源、有機氮源、無機氮源和pH為因子,采用L9(34)正交實驗對最佳培養(yǎng)基成分進行優(yōu)化,因素水平見表2。在所得的最佳發(fā)酵條件和培養(yǎng)基下進行3次驗證實驗,檢查結果的重現性。

表2 培養(yǎng)基正交實驗因素水平表
1.3數據分析
本文中菌株產酶條件優(yōu)化、高效液相測定菌株酶活等所有實驗均重復3次,采用Origin 9.1和SPSS 16.0對實驗數據進行統(tǒng)計分析,樣品平均值之間的差異性通過Duncan法比較(p<0.05)。
2 結果與分析
2.16株米曲霉菌株產β-FTase能力分析
2.1.1蔗果三糖標曲的繪制在高濃度的蔗糖反應液中,β-FTase催化蔗糖主要生成蔗果三糖,因此測定蔗果三糖濃度即可反映β-FTase催化能力。以蔗果三糖標準品含量(x)為橫坐標,該檢測條件下信號的峰面積(y)作為縱坐標,得到的回歸線性方程為y=103143x-24416,R2=0.9994,在其濃度為0~60 mg/mL內,蔗果三糖濃度與信號峰面積呈良好的線性關系。
2.1.2米曲霉生長曲線和產酶曲線抽濾米曲霉發(fā)酵菌球,獲取菌絲體濕重。測定6株米曲霉在不同時間段(0、24、48、60、72、84、96和120 h)的酶活大小(三組平行樣),結果(圖1)可知,6株米曲霉在發(fā)酵時間為96 h時,生物量和酶活均最大,其中菌株A-F04生物達到(6.04±0.03)g,且6株菌均在對數生長期時酶活增加最快,在穩(wěn)定期時酶活最高,趨于穩(wěn)定。因此,選擇發(fā)酵96 h的6株米曲霉作為酶活對比的時間點。
2.1.3高產β-FTase的米曲霉菌株的篩選利用HPLC-RID測定6株米曲霉發(fā)酵96 h的菌絲體酶活,計算GF2的量和酶活大小,結果見圖2。可知米曲霉A-F04生成的GF2量為28.22 mg/mL,具有最高的酶活466.25 U/g。根據6株米曲霉在同等條件下的生物量和酶活測定結果,可知菌株A-F04是高產β-FTase菌株,因此選擇米曲霉菌株A-F04為基礎,進一步對其產酶條件研究。
2.2高產β-FTase米曲霉菌株A-F04產酶條件的優(yōu)化
2.2.1米曲霉A-F04發(fā)酵條件的優(yōu)化
2.2.1.1不同接種量對產酶的影響不同接種量對產酶的影響結果見圖3。分析結果可知,1.0%的接種量對應的酶活最高,為284.77 U/g;接種量從0.5%增加到1.0%時,酶活呈現出增加的趨勢,說明一定程度上,增加接種量可以提高酶的表達;而當接種量從1.0%增加到10.0%時,酶活呈現下降的趨勢,說明接種量增加到一定程度反而不利于酶的表達。結果表明接種量過大或者過小都會影響酶活大小,其可能原因是接種量過大,營養(yǎng)供應不足;接種量過小,總菌體增長較慢從而使分泌的酶的酶活降低。
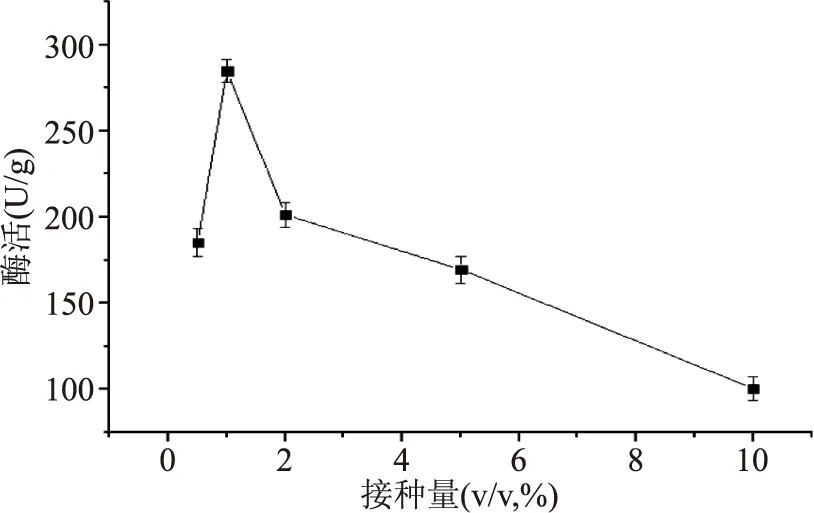
圖3 接種量對產酶的影響Fig.3 β-FTase enzyme activity in different inoculum concentration
2.2.1.2不同培養(yǎng)溫度對產酶的影響不同培養(yǎng)溫度對產酶的影響結果見圖4。分析結果可知,35 ℃條件下對應的酶活最高,為312.54 U/g;當溫度從25 ℃增加到35 ℃時,酶活呈現增加的趨勢,說明一定程度上,提高培養(yǎng)溫度可以提高酶的表達;而當溫度大于35 ℃時,酶活呈現出下降的趨勢,說明溫度過高不利于酶的表達。結果表明溫度過高或者過低都會影響酶活,其原因是菌體需要在最適溫度下,產酶能力相對較高。
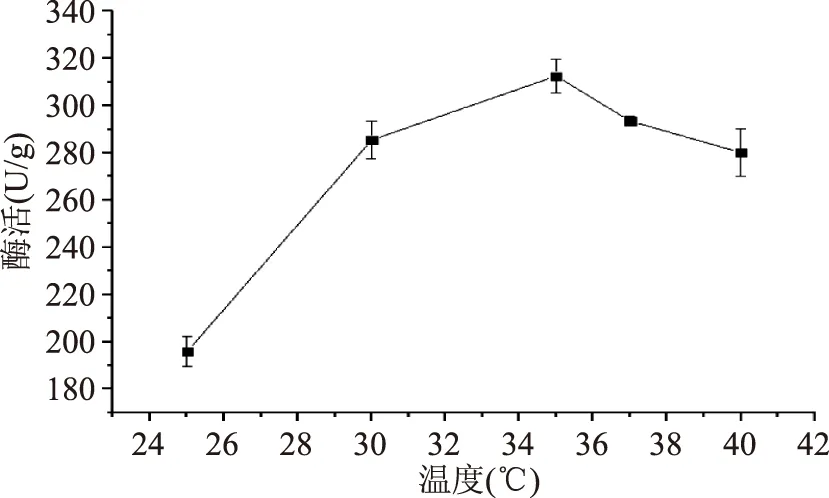
圖4 溫度對產酶的影響Fig.4 β-FTase enzyme activity in different temperature
2.2.1.3不同轉速對產酶的影響不同轉速對產酶的影響結果如圖5。分析結果可知,轉速為200 r/min對應的酶活最高,為390.65 U/g;當轉速從100 r/min增加到200 r/min時,酶活呈現出增加的趨勢,說明一定程度上,提高轉速可以提高酶的表達;而當轉速大于200 r/min時,酶活呈現出下降的趨勢,說明轉速過快不利于酶的表達。結果表明轉速過大或者過小對產酶都有影響,其原因是菌體屬于好氧菌,生長需要適宜的O2濃度,轉速會影響O2濃度大小。

圖5 轉速對產酶的影響Fig.5 β-FTase enzyme activity in different rotation rate
2.2.1.4正交實驗結果正交實驗結果見表3,方差分析結果見表4。

表3 發(fā)酵條件正交實驗結果

表4 發(fā)酵條件的方差分析
由表3和表4可知RA>RB>RC,即影響米曲霉A-F04菌株產β-FTase的主次順序為:接種量>培養(yǎng)溫度>轉速。根據各因素不同水平的K值大小,可知米曲霉A-F04產β-FTase的發(fā)酵條件優(yōu)組合為A2B2C3,即培養(yǎng)時間為96 h,接種量為1%,培養(yǎng)溫度為35 ℃,轉速為200 r/min。表4方差分析表明3個因子的影響均不顯著。對正交實驗所得的最佳產酶發(fā)酵條件組合進行3批次產酶培養(yǎng)驗證,菌體的酶活分別為(495.47±3.87)、(496.11±1.68)、(494.28±3.66) U/g,平均值為495.29 U/g,實驗結果具有較好的重現性。
2.2.2米曲霉A-F04發(fā)酵培養(yǎng)基優(yōu)化
2.2.2.1碳源對發(fā)酵產酶的影響在最佳發(fā)酵條件下,培養(yǎng)基中的不同碳源對發(fā)酵產酶的影響結果見圖6-A。圖6-A結果表明,蔗糖為碳源時,酶活最高,達到469.87 U/g,可能原因是蔗糖對β-FTase酶的產生有一定的誘導效果,故確立蔗糖最佳碳源。探究了不同濃度的蔗糖對產酶的影響,其酶活測定結果見圖6-B,可知蔗糖濃度為0.4%時,酶活最高,達到496.87 U/g。
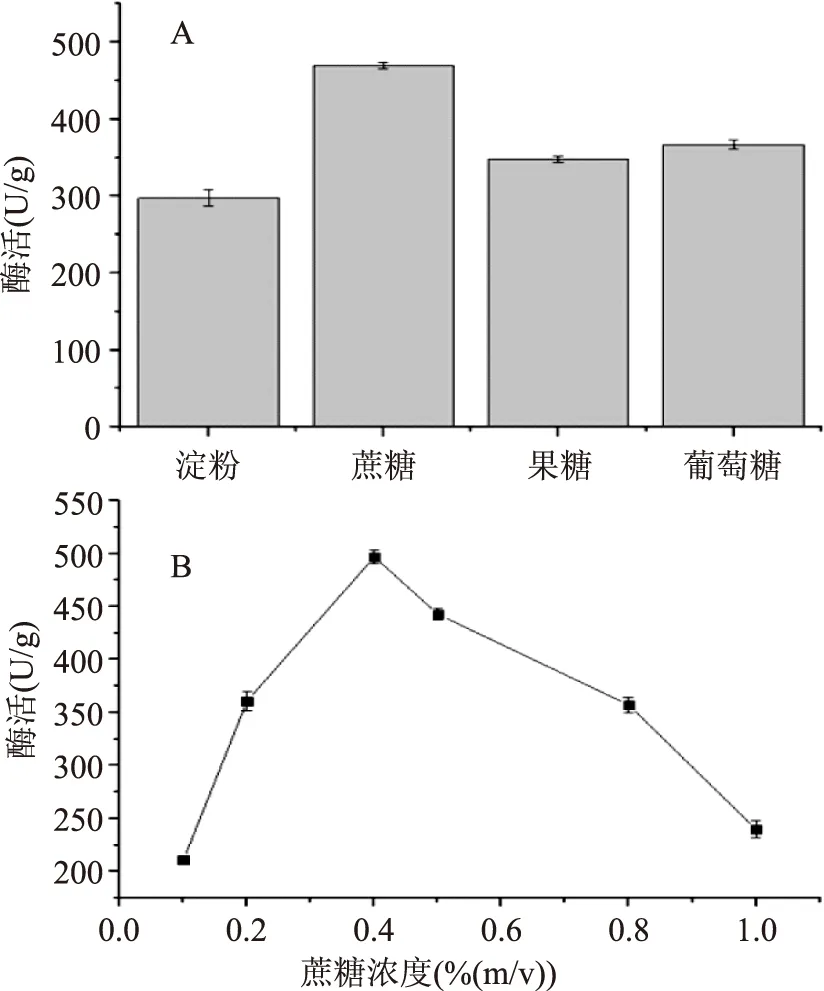
圖6 最佳碳源和蔗糖濃度對產酶的探究Fig.6 β-FTase enzyme activity in different carbon source and sucrose concentration
2.2.2.2氮源對發(fā)酵產酶的影響在最佳發(fā)酵條件下,培養(yǎng)基中不同的有機氮源對發(fā)酵產酶的影響結果見圖7-A。圖7-A表明,酵母粉為有機氮源時,酶活最高。故確立酵母粉為最佳有機氮源。以此出發(fā),探究酵母粉不同濃度。由圖7-B可知酵母粉濃度為0.15%時,酶活最高,達到512.7 U/g。

圖7 最佳有機氮源和酵母粉濃度對產酶的探究Fig.7 β-FTase enzyme activity in different organic nitrogen source and yeast extract concentration
在最佳發(fā)酵條件下,培養(yǎng)基中不同的無機氮源對發(fā)酵產酶的影響結果見圖8。圖8-A表明,硫酸銨為無機氮源時,酶活最高。故確定硫酸銨為最佳無機氮源。以此出發(fā),探究不同濃度的硫酸銨對產酶的影響,酶活測定結果見圖8-B,可知硫酸銨濃度為0.15%時,酶活最高。

圖8 最佳無機氮源和硫酸銨濃度對產酶的探究Fig.8 β-FTase enzyme activity in different inorganic nitrogen source and ammonia sulfate concentration
2.2.2.3起始pH對發(fā)酵產酶的影響在最佳發(fā)酵條件下,培養(yǎng)基中的不同起始pH對發(fā)酵產酶的影響結果見圖9,分析結果可知,培養(yǎng)基起始pH過高或過低都會對酶活會產生影響,pH為7.0時,產酶效果最好,酶活達到519.65 U/g。

圖9 不同起始pH對產酶的影響Fig.9 β-FTase enzyme activity in different initial pH
2.2.2.4優(yōu)化培養(yǎng)基的正交實驗結果正交實驗結果見表5,方差分析見表6。
由表5可知,各因素影響米曲霉A-F04菌株發(fā)酵產酶的主次順序為:A>B>D>C。由表6可知ABDC四因素對菌株A-F04產酶影響不顯著。因此,米曲霉A-F04菌株產β-FTase的最佳培養(yǎng)基組成為A2B2D2C1,即0.4%的蔗糖為碳源,0.15%的酵母粉為有機氮源,培養(yǎng)起始pH為7.0,0.15%的硫酸銨為無機氮源。對正交實驗所得的最佳產酶培養(yǎng)基組合進行3批次產酶培養(yǎng)驗證,酶活分別為(514.17±3.17)、(516.78±3.66)、(517.02±1.29)U/g,平均值為515.99 U/g,實驗結果具有較好的重現性。
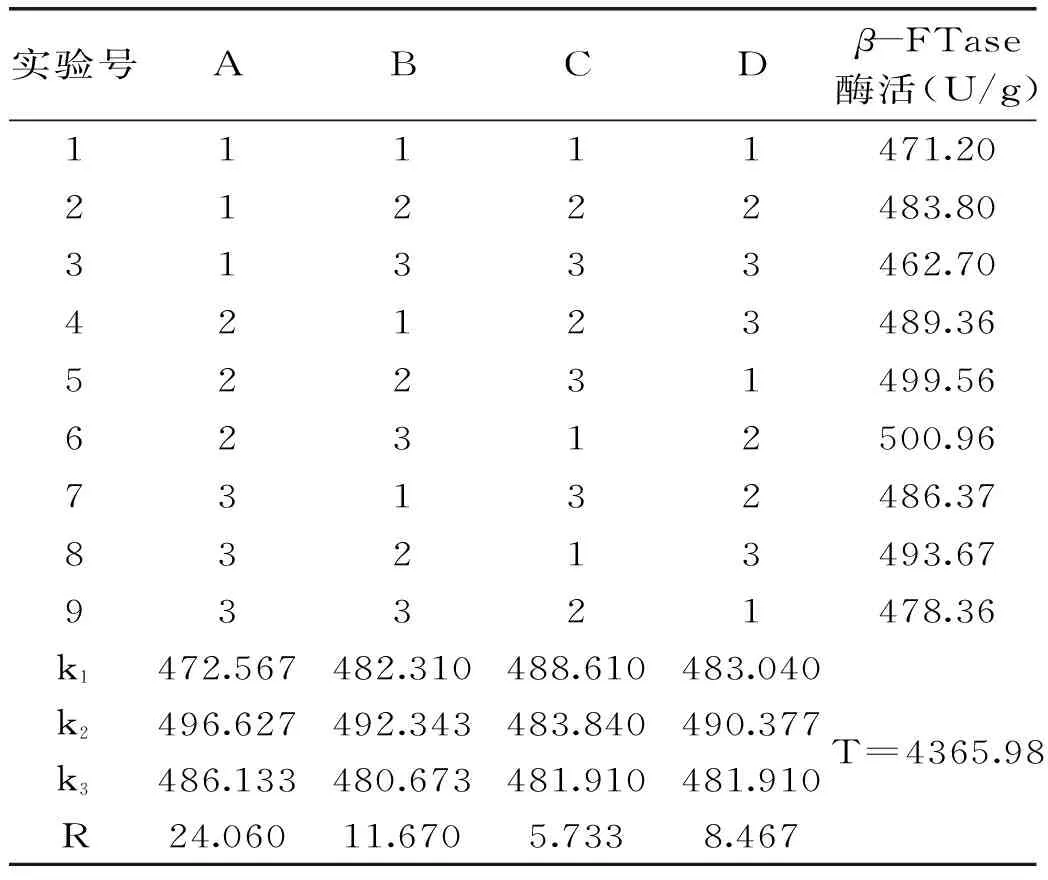
表5 培養(yǎng)基正交實驗結果
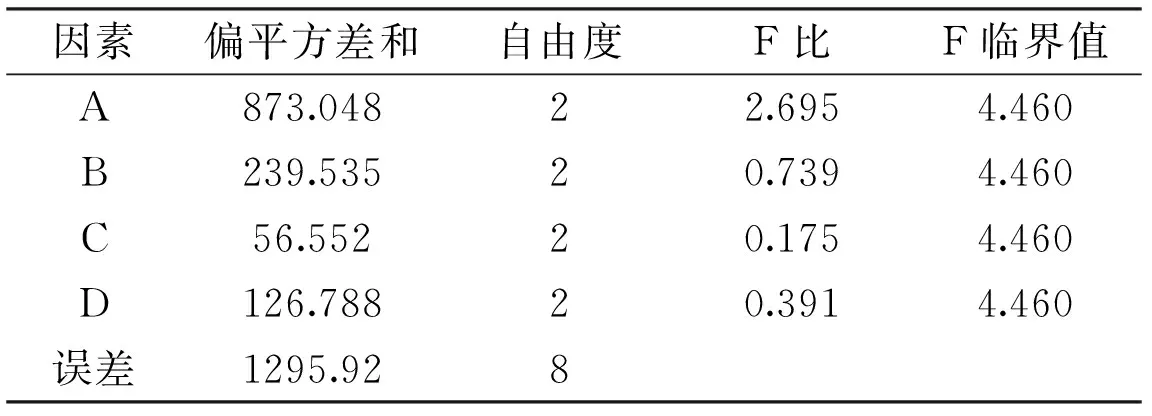
表6 培養(yǎng)基的方差分析
3 結論
通過實驗,鑒定出了6株米曲霉都具有產β-FTase能力,且篩選出了米曲霉A-F04為高產β-FTase菌株,確定了米曲霉A-F04產β-FTase的最佳產酶條件,即在0.4%的蔗糖為碳源,0.15%的酵母粉為有機氮源,培養(yǎng)起始pH為7.0,0.15%的硫酸銨為無機氮源的基礎發(fā)酵培養(yǎng)基中,接種量為1.0%,培養(yǎng)時間為96 h,培養(yǎng)溫度為35 ℃,轉速為200 r/min,具有較高的酶活力519.65 U/g,相比在發(fā)酵基礎培養(yǎng)基和初始條件下的酶活466.25 U/g,提高了11.45%。同時測定了該條件的菌絲體濕重達到(6.04±0.03)g,說明米曲霉A-F04菌株在此條件下不僅生物量較高,而且具有較高的產酶能力。本研究結果表明,米曲霉A-F04是一株具有進一步改造利用價值的產β-FTase的米曲霉菌株,但所產β-FTase的酶學性質以及能否理想擴大至工業(yè)上生產應用有待進一步研究。
[1]毛多斌,王雪. 果糖基轉移酶及低聚果糖生產研究進展[J]. 廣東化工,2009,36(4):100-102.
[2]Chiang C J,Lee W C,Sheu D C,et al. Immobilization ofβ-Fructofuranosidases from Aspergillus on Methacrylamide-Based Polymeric Beads for Production of Fructooligosaccharides[J]. Biotechnology Progress,1997,13(5):577-582.
[3]覃益民,唐江濤,蘇加坤,等. 米曲霉 GX0011β-果糖基轉移酶的性質研究[J]. 食品工業(yè)科技,2007,28(5):123-126.
[4]Ruekjumnong R,Ngampanya B,Khuwijitjaru P,et al. Functional prebiotic activity of inulin and fructooligosaccharides[J]. Journal of Food Science and Agricultural Technology(JFAT),2015,1(1):149-151.
[5]OHTA A,OHTUKI M,TAKIZAWA T,et al. Effects of fructooligosaccharides on the absorption of magnesium and calcium by cecectomized rats[J]. International Journal for Vitamin and Nutrition Research,1994,64(4):316-323.
[6]Molis C H,Flourie B,Ouarne F,et al. Digestion,excretion,and energy value of fructooligosaccharides in healthy humans[J]. The American Journal of Clinical Nutrition,1996,64(3):324-328.
[7]Costa G T,Abreu G C,Guimar?es A B B,et al. Fructo-oligosaccharide effects on serum cholesterol levels. An overview[J]. Acta Cirurgica Brasileira,2015,30(5):366-370.
[8]Vega R,Zuniga-Hansen M E. The effect of processing conditions on the stability of fructooligosaccharides in acidic food products[J]. Food Chemistry,2015,173:784-789.
[9]Spiegel J E,Rose R,Karabell P,et al. Safety and benefits of fructooligosaccharides as food ingredients[J]. Food Technology,1994,48(1):85-89.
[10]Lorenzoni A S G,Aydos L F,Klein M P,et al. Continuous production of fructooligosaccharides and invert sugar by chitosan immobilized enzymes:comparison between in fluidized and packed bed reactors[J]. Journal of Molecular Catalysis B:Enzymatic,2015,111:51-55.
[11]Mouelhi R,Abidi F,Marzouki M N. An improved method for production of fructooligosaccharides by immobilizedβ-fructofuranosidase from Sclerotinia sclerotiorum[J]. Biotechnology and Applied Biochemistry,2015,28(6),38-42.
[12]楊正茂,秦克亮.β-果糖基轉移酶和β-呋喃果糖苷酶的分離純化[J]. 中國醫(yī)藥工業(yè)雜志,2002,33(5):219-223.
[13]梁志宏,黃昆侖,何云龍,等. 黑曲霉及其食品安全領域的赭曲霉毒素問題[J]. 食品科技,2008,33(10):191-194.
[14]Kobayashi T,Abe K,Asai K,et al. Genomics of Aspergillus oryzae[J]. Bioscience Biotechnology and Biochemistry,2007,71(3):646.
[15]劉麗萍,劉麗華. 米曲霉研究進展與應用[J]. 中國調味品,2008(4):28-32.
[16]蔣波.高活力果糖基轉移酶的菌種選育及生產工藝優(yōu)化研究[D].廣州:華南理工大學,2014.
[17]何小妮,蔣波,王玉海,等. 非對稱滅活雙親原生質體融合法選育產果糖基轉移酶的米曲霉新菌株的研究[J]. 現代食品科技,2013,29(5):993-997.
[18]李秀英,黃金鳳,冼燕萍,等. 食品中低聚果糖的檢測方法研究進展[J]. 乳業(yè)科學與技術,2014,37(3):32.
Screening and identification of efficientβ-fructosyltransferase-producingAspergillusoryzaeand optimization of the fermentation condition
GAO Bin1,2,3,LIANG Lu3,LI Ya3,LI Bin1,2,3,LIU Cheng-mei1,2,3,FU Gui-ming1,2,3,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China; 2.Sino-German Food Engineering Center,Nanchang University,Nanchang 330047,China;3.Food Science and Technology College,Nanchang University,Nanchang 330031,China)
6β-fructosyltransferase-producingAspergillusoryzaestrains were activated and cultured at shake flask fermentation. In this study,high efficiency liquid chromatography technology was applied to gauging the enzyme activity ofβ-fructosyltransferase,and the enzyme activity ofβ-fructosyltransferase produced by 6 differentAspergillusoryzaestrains were contrasted,in order to screening the efficientβ-fructosyltransferase-producingAspergillusoryzaestrains. Thus,experiments of single factor and orthogonal tests were done to optimize the fermentation condition. Experimental results showed that the influencing factors of fermentation were temperature,inoculum concentration,rotation rate,sucrose concentration,yeast extract concentration,initial pH and ammonia sulfate concentration. The optimum condition for higherβ-fructosyltransferase were determined:cultured in the medium of 0.4%(m/v)sucrose,0.15%(m/v)yeast extract,0.2%(m/v)NaCl,0.15%(m/v)ammonia sulfate,initial pH7.0,inoculum concentration 1.0% under 35 ℃,200 r/min in shake cultures for 96 h. Maximalβ-fructosyltransferase activity of A-F04 was 519.65 U/g,increasing 11.45% enzyme activity compared with the original fermentation condition(466.25 U/g).
β-fructosyltransferase;Aspergillusoryzae;efficient expressing strain;optimizing
2015-10-26
高斌(1991-),男,碩士研究生,研究方向:發(fā)酵工程,E-mail:820839790@qq.com。
付桂明(1972-),男,博士,教授,研究方向:天然產物、發(fā)酵食品研究,E-mail:fuguiming@ncu.edu.cn。
食品與技術國家重點實驗室自由探索課題(SKLF-22B-201313)。
TS203.1
A
1002-0306(2016)10-0224-07
10.13386/j.issn1002-0306.2016.10.037

