神秘果種子多糖的響應面優化提取及其抗氧化活性研究
馬藝丹,劉 紅,2,*,馬思聰,閆瑞昕,薛炳祥,王 茜
(1.海南師范大學化學與化工學院,海南海口 571127; 2.熱帶特色藥食同源植物研究與開發重點實驗室,海南海口 571127)
?
神秘果種子多糖的響應面優化提取及其抗氧化活性研究
馬藝丹1,劉紅1,2,*,馬思聰1,閆瑞昕1,薛炳祥1,王茜1
(1.海南師范大學化學與化工學院,海南海口 571127; 2.熱帶特色藥食同源植物研究與開發重點實驗室,海南海口 571127)

神秘果種子,多糖,抗氧化,提取,響應面分析
神秘果(Synsepalumdulcificum)屬山欖科,又稱變味果或蜜拉圣果,是一種天然的藥食同源植物,原產于西非熱帶地區,如今在中國海南、云南、廣西等省份也大面積種植[1]。據報道,除了神秘果種子含有的神秘果素能改變人的味覺,其種子可以促進胰島素分泌[2],是用于治療糖尿病、高血壓的天然藥物[3]。種子里還含有天然固醇和一些微量礦物元素[4],以及大量的多酚類物質[5]。目前,國內外對神秘果種子都有研究,但主要集中于在多酚的提取以及生物活性等方面,有關神秘果種子多糖的提取研究尚未見文獻報道。植物多糖是一類具有高活性的物質,如免疫調節、抗腫瘤、抗炎、抗氧化、抗衰老、降血糖等[6]。因此,受到越來越多研究者的關注[7]。
常用于多糖的提取方法有:溶劑提取法、酸堿提取法、酶解法提取法、超聲波提取法、微波提取法等[8]。溶劑提法設備簡單、成本低廉,對植物組織的穿透性強,但耗時較長[9]。酸堿提取法雖然提取率有所提高,但酸堿提取法具有特殊性,僅在某些特定的植物多糖提取中有優勢。同時,若酸堿度不當,酸性條件可能引起多糖的糖苷鍵斷裂,堿性條件會使部分多糖分解[10]。超聲波提取法簡單高效,可避免溫度過高引起不穩定成分分解。因此,綜合各因素,本實驗通過超聲波輔助以水為提取試劑,采用響應面分析法優化神秘果種子多糖的提取工藝,并對其抗氧化活性進行了評價。為神秘果種子的深入研究和綜合開發利用提供理論基礎。
1 材料與方法
1.1材料與儀器
神秘果種子采自海南省保亭縣,經海南師范大學生命科學學院鐘瓊蕊教授鑒定為山欖科植物神秘果(Synsepalumdulcificum)的種子,標本現存于熱帶藥用植物化學教育部重點實驗室,備用;1,1,-二苯基-2-三硝基苯肼(DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)美國Sigma公司;乙醚、95%乙醇、濃硫酸、苯酚、葡萄糖、VC等均為分析純,國藥集團化學試劑有限公司。
XO-5200DTS超聲波清洗儀南京先歐儀器制造有限公司;TU-1901雙光束紫外可見分光光度計北京普析通用儀器有限公司;Nicolet 6700智能傅立葉紅外光譜儀美國Thermo Scientific公司;RE-52AA旋轉蒸發器上海亞榮生化儀器廠;LGJ-10冷凍干燥機北京四環科學儀器廠有限公司。
1.2實驗方法
1.2.1神秘果種子多糖提取工藝流程神秘果種子→粉碎(過60目篩)→乙醚脫脂(索氏提取)→揮干乙醚→除雜(95%乙醇浸泡2 d)→抽濾、干燥→超聲波提取2次→抽濾→旋轉蒸發濃縮→脫蛋白(Saveg法除蛋白質2次)→透析除去雜質→乙醇沉淀(加入4倍體積95%乙醇,4 ℃靜置過夜)→抽濾→脫色(無水乙醇和丙酮反復洗滌)→水復溶→冷凍干燥→神秘果種子粗多糖。
1.2.2標準曲線的繪制采用硫酸-苯酚比色法[11]略加修改。精確稱取105 ℃干燥至恒重的葡萄糖100.00 mg,定容于1000 mL容量瓶中。精確移取0.1、0.2、0.4、0.6、0.8、1.0 mL于10 mL容量瓶,分別加蒸餾水至2 mL,再加入5%苯酚1 mL,迅速加入濃硫酸5 mL,緩慢搖勻。沸水浴20 min后,冷卻至室溫。測490 nm吸光度。以橫坐標為葡萄糖質量濃度(mg/mL),縱坐標為吸光度,繪制標準曲線。
1.2.3神秘果種子多糖的提取及含量的測定精密稱取神秘果種子粉末1.0 g,置于100 mL錐形瓶中,以相應液料比加入一定體積蒸餾水,封口膜密封后,振蕩10 min,置于超聲波中,按一定的超聲時間及提取溫度進行提取(45 kHz頻率固定)2次。趁熱抽濾,合并提取液。將提取液旋轉蒸發濃縮,Saveg 法除蛋白質2次,透析除去雜質。趁熱加4倍體積95%乙醇,4 ℃靜置24 h,析出沉淀多糖,抽濾,用無水乙醇和丙酮洗滌。用適量蒸餾水復溶,定容于50 mL容量瓶作為樣品液,取適量按標準曲線的繪制方法測樣品中多糖的質量濃度。多糖得率按如下式公式計算:
多糖得率(%)=提取多糖的質量/預處理后種子粉末的質量×100
1.2.4單因素實驗
1.2.4.1超聲波功率對多糖提取率的影響固定超聲波溫度為40 ℃,超聲波時間為30 min,料液比為1∶30(g/mL),考察不同超聲波功率(35、40、45、50、55 kHz)對多糖提取率的影響。
1.2.4.2料液比對多糖提取率的影響在1.2.4.1的基礎上,固定超聲波溫度為40 ℃,超聲波時間為30 min,考察不同料液比(1∶20、1∶30、1∶40、1∶50、1∶60 m∶V)對多糖提取率的影響。
1.2.4.3超聲波時間對多糖提取率的影響固定超聲波溫度為40 ℃,采用1.2.4.1、1.2.4.2中最佳超聲功率、料液比,考察不同超聲波時間(20、30、40、50、60 min)對多糖提取率的影響。
1.2.4.4超聲波溫度對多糖提取率的影響采用1.2.4.1、1.2.4.2和1.2.4.3中最佳超聲功率、料液比和超聲波時間,考察不同溫度(30、40、50、60、70 ℃)對多糖提取率的影響。
1.2.5響應面實驗設計在單因素實驗的基礎上,利用響應面分析法優化神秘果種子多糖的提取工藝。根據Box-Behnken的中心組合設計原理,并綜合單因素實驗結果,以料液比(A)、超聲波時間(B)、超聲波溫度(C)為3個影響因素,以神秘果種子多糖提取率為響應值。采用統計分析軟件Design-Expert 8.0,建立3因素3水平的響應面分析法,進行二次多項回歸方程擬合及其優化分析。實驗因素與水平設計見表1。

表1 實驗因素與水平設計
1.2.6神秘果種子多糖的抗氧化能力
1.2.6.1對DPPH自由基清除能力的測定參照文獻[12]修改如下:取不同質量濃度的樣品液2 mL,和2 mL 0.2 mmol/L DPPH乙醇溶液混合均勻,室溫避光放置30 min,測定517 nm處吸光值為A1;同法,測定2 mL乙醇加樣品液的吸光值為A2;測定2 mL DPPH溶液與2 mL蒸餾水的吸光值為A0。以VC作陽性對照。DPPH清除率計算公式為:
1.2.6.2對ABTS+自由基清除能力的測定參照文獻[13]略加修改。首先配制ABTS+溶液,用乙醇調節pH,使734 nm處的吸光值為0.70±0.20備用。取不同質量濃度的樣品液100 μL,加入1.9 mL ABTS+,搖勻,室溫反應6 min測734 nm處的吸光值為Ax。同法,以乙醇代替ABTS測定吸光值為Ay;以乙醇代替樣品測定吸光值為Az。以VC作陽性對照。ABTS+清除率計算公式為:
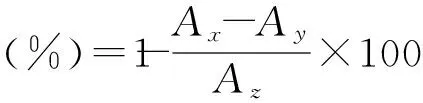
1.2.6.3對·OH自由基清除能力的測定參考Smiroff等采用的水楊酸法[14],并略作修改。取8mmol/L的FeSO4溶液0.5mL,加入6mmol/L水楊酸-乙醇溶液0.8mL和0.5mL蒸餾水,搖勻,37 ℃水浴30min。再加入不同質量濃度樣品液1.0mL,水浴30min。測520nm處吸光值為Aa;同法,用蒸餾水代替水楊酸,測吸光值為Ab;用蒸餾水代替樣品液,測吸光值為Ac。以VC作陽性對照。清除率計算公式為:


新聞傳播學、戲劇影視學兩個學科都具有中國傳媒大學的獨到優勢和特色。首先體現在“綜合”。新聞傳播學起步于廣電,隨著中國整個媒體行業的快速發展,從廣電延伸到電子媒體,再從電子媒體延伸到視聽新媒體、融媒體。戲劇影視學也大致如此,起步是電視藝術,電視藝術后來延伸到視覺藝術,又延伸到影視行業,最后將戲劇和戲曲也納入其中。第二個特點就是“交叉”。新聞傳播學、戲劇與影視學不僅載體、平臺有交叉,藝術、技術也有交叉。特別是這幾年大數據、智能媒體的興起,使它們的覆蓋領域更加寬泛。交叉、融合肯定是未來方向,需要開啟新聞傳播學、戲劇影視學的新視野和新維度,促進學科建設與發展的良性循環。
1.3數據處理
運用Excel和Design-Expert8.0.6軟件對實驗數據進行分析。
2 結果與分析
2.1葡萄糖標準曲線
以葡萄糖濃度為橫坐標,對應吸光值為縱坐標,繪制標準曲線如圖1所示。得到回歸方程y=10.564x+0.0628(R2=0.9993),吸光度與葡萄糖濃度具有良好的線性關系,因此,可用于神秘果種子多糖含量的測定。

圖1 葡萄糖標準曲線Fig.1 The standard curve of glucose
2.2單因素實驗
2.2.1超聲波功率對多糖得率的影響超聲波功率對多糖得率的影響如圖2所示。隨著超聲波功率提高,多糖提取率增加,這可能由于超聲波空化作用加快種子細胞壁和細胞膜的破碎使多糖更容易被提取。在超聲波功率為45 kHz時,多糖提取率達到最大值,之后超聲波功率再提高,多糖提取率略有降低。說明當超聲功率達到一定程度,導致部分多糖結構被破壞。因此,選最佳超聲波功率為45 kHz。

圖2 超聲波功率對多糖得率的影響Fig.2 Effect of ultrasonic power on the yield of polysaccharide

圖3 料液比對多糖得率的影響Fig.3 Effect of radio of material to iquid ratio on the yield of polysaccharide
2.2.3超聲波時間對多糖得率的影響超聲波時間對多糖得率的影響如圖4所示,隨著時間的延長,多糖的提取率呈先增大后減小的趨勢。因為超聲波可在短時間內使細胞破裂,加速多糖溶出。當提取時間超過40 min,多糖溶液趨于飽和,大量的多糖吸附在顆粒表面,阻礙多糖繼續溶出。同時超聲時間過長可能使多糖結構被破壞,雜質的溶出也會相對增多,從而減緩了多糖的溶出速率,最終導致多糖總量下降。因此,選最佳超聲波時間為40 min。

圖4 超聲波時間對多糖得率的影響Fig.4 Effect of ultrasonic time on the yield of polysaccharide
2.2.4提取溫度對多糖得率的影響提取溫度對多糖得率的影響如圖5所示,在溫度30~40 ℃之間,多糖得率逐漸增大。當提取溫度為50 ℃時,多糖得率最高為12.32%。因為溫度過低多糖不能充分溶出,升高溫度可加速分子間運動,促使逐漸溶出。當溫度大于50 ℃時,隨著溫度升高多糖得率反而降低,因為較高的溫度可能會破壞多糖的結構[16],雜質的溶出也會增加,導致多糖含量降低。因此,選最佳提取溫度為50 ℃。

圖5 提取溫度對多糖得率的影響Fig.5 Effect of extraction temperature on the yield of polysaccharide
2.3響應曲面法優化實驗結果與分析
2.3.1回歸模型的建立與分析對4個單因素變量進行顯著性分析,料液比、超聲時間、提取溫度影響顯著,因此選取3個因素設計3因素3水平的響應面分析實驗,其中超聲功率固定為45 kHz。
通過Design Expert軟件,對表2數據進行線性擬合得到以上二次多項回歸模型方程:
Y=12.33+0.24A-0.046B-0.024C+0.072AB-0.013AC+0.11BC-0.43A2-1.26B2-0.30C2

表2 Box-Behnken實驗設計和結果分析

2.3.2響應曲面模型的分析通過響應曲面模型可以確定最佳工藝參數及各因素間相互作用,響應面模型和等高線圖見圖6~圖8。從圖6可以看出,料液比(A)和超聲時間(B)的等高線為橢圓形,說明其交互作用顯著;料液比軸向的等高線變化密集,說明料液比比提取溫度對多糖得率的影響大。從圖7可以看出,料液比(A)和提取溫度(C)的等高線趨于圓形,說明其交互作用不顯著。從圖8可以看出,超聲時間(B)和提取溫度(C)的等高線為橢圓形,表明其交互作用顯著;提取時間軸向的等高線密集,說明提取溫度比提取時間對多糖得率的影響大。選擇適當的料液比(A)、超聲時間(B)和提取溫度(C),可以達到較高的多糖得率。三個因素對多糖得率的影響從大到小依次為:料液比(A)>超聲時間(B)>提取溫度(C)。

表3 二次響應面回歸模型方差分析

圖6 料液比和超聲時間對多糖得率的響應曲面圖Fig.6 Response surface of material to liquid ratio and ultrasonic time on the yield of polysaccharide

圖7 料液比和提取溫度對多糖得率的響應曲面圖Fig.7 Response surface of material to liquid ratio and extraction temperature on the yield of polysaccharide
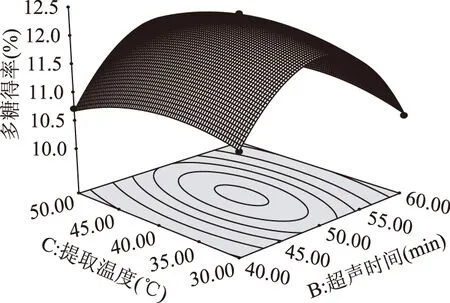
圖8 超聲時間和提取溫度對多糖得率的響應曲面圖Fig.8 Response surface of ultrasonic time and extraction temperature on the yield of polysaccharide
注:**表示極顯著(p<0.01);*表示顯著(0.01 優化后的神秘果種子多糖最佳提取工藝條件為:料液比1∶42.79(g/mL)、提取溫度49.87 ℃、超聲時間 39.53 min,在此條件下,神秘果種子多糖得率可達12.36%。為方便實際操作,將優化參數修正為:料液比1∶43(g/mL)、提取溫度50 ℃、超聲時間40 min,平行3次實驗多糖平均得率為12.33%,與預測值12.36%接近,說明此優化模型可靠。 2.5神秘果種子多糖抗氧化能力 2.5.1對DPPH自由基的清除作用不同質量濃度的神秘果種子多糖和VC對清除DPPH自由基的影響,如圖9所示。在質量濃度0~0.5 mg/mL范圍內,多糖和VC對DPPH自由基清除率均隨著質量濃度增大而升高。當多糖濃度達到0.4 mg/mL時,繼續增大濃度,清除率隨濃度變化不明顯,此時的清除率為57.13%,相比VC對DPPH自由基的清除率低38%,可見神秘果種子多糖對DPPH自由基的清除能力明顯低于VC。經計算神秘果種子多糖對清除DPPH自由基的IC50為0.31 mg/mL。 圖9 神秘果種子多糖和VC對DPPH·的清除作用Fig.9 Scavenging effect of polysaccharides from S. dulcificum and VC on DPPH· 2.5.2對ABTS+自由基的清除作用不同質量濃度的神秘果種子多糖和VC對清除ABTS+自由基的影響,如圖10所示。在質量濃度0~0.5 mg/mL范圍內,多糖和VC對ABTS+自由基清除率均隨著質量濃度增大而明顯升高。當多糖質量濃度為0.5 mg/mL時,對ABTS+自由基的清除率達到62.21%。說明神秘果種子多糖對ABTS+自由基的清除率與濃度呈較強的劑量正相關效應,但清除率低于VC。經計算神秘果種子多糖對ABTS+自由基的IC50為0.41 mg/mL。 圖10 神秘果種子多糖和VC對ABTS+的清除作用Fig.10 Scavenging effect of polysaccharides from S. dulcificum and VCon ABTS+ 2.5.3對·OH的清除作用不同質量濃度的神秘果種子多糖和VC對清除·OH的影響,如圖11所示。在質量濃度0~0.2 mg/mL范圍內,清除率隨多糖濃度增大整體呈上升趨勢。當濃度達到0.2 mg/mL時,清除率迅速升高,直至濃度達到0.4 mg/mL時,清除率升高程度減緩。當質量濃度達到0.5 mg/mL時,清除率達到85.32%,此時較同濃度的VC對·OH的清除率低8.13%。說明神秘果種子多糖對·OH的清除率與濃度呈正相關,當質量濃度達到0.5 mg/mL時與VC相差不大。經計算神秘果種子多糖對·OH自由基的IC50為0.24 mg/mL。 圖11 神秘果種子多糖和VC對·OH的清除作用Fig.11 Scavenging effect of polysaccharides from S. dulcificum and VC on ·OH 圖12 神秘果種子多糖和VC對·的清除作用Fig.12 Scavenging effect of polysaccharides from S. 將響應面分析法應用于超聲波提取神秘果種子多糖工藝的研究。在單因素實驗的基礎上,采用Box-Behnken實驗設計對超聲波提取神秘果種子多糖優化的工藝參數為:料液比1∶43(g/mL)、提取溫度50 ℃、超聲時間40 min,實測得率12.33%與預測得率12.36%接近,說明該模型可用于對神秘果種子多糖的預測,具有一定的理論價值與實際應用前景。 [1]盧圣樓,劉紅,曹佳佳,等. 神秘果中齊墩果酸和五環三萜含量的測定[J]. 食品工業,2012,33(3):130-133. [2]盧圣樓. 神秘果葉營養價值和揮發油化學成分分析及其總黃酮提取純化與藥理化學評價[D]. 海口:海南師范大學,2013. [3]盧圣樓,劉紅,賈桂云,等. 神秘果葉營養成分分析與評價[J]. 食品研究與開發,2014,35(17):111-114. [4]齊賽男,賈桂云,盧圣樓,等. 神秘果種子揮發油化學成分的氣相色譜-質譜分析[J]. 海南師范大學學報:自然科學版,2012,25(1):73-76. [5]馬藝丹,劉紅,廖小偉,等. 神秘果種子多酚超聲雙水相復合提取工藝及其抗氧化活性[J]. 食品與機械,2015,31(6):173-178. [6]葉展,胡傳榮,胡晚華,等. 響應面法優化茶葉籽粕中多糖的提取工藝[J]. 食品工業科技,2015,36(6):230-234. [7]陳莉華,高文昱,王曉靜,等. 竹筍總多糖的提取及抗氧化活性研究[J]. 林產化學與工業,2014,34(5):157-161. [8]庒永亮,孫麗平,尚小麗,等. 紅托竹蓀菌蓋多糖的提取與抗氧化能力的研究[J]. 林產化學與工業,2011,31(3):45-49. [9]李穎暢,王亞麗,齊鳳元,等. 響應面法優化藍莓葉多糖提取工藝[J]. 食品工業科技,2015,36(3):227-231. [10]李奎,李雪玲. 響應面法優化堿液提取百草蕊草多糖的工藝研究[J]. 食品工業科技,2015,36(7):204-207. [11]劉云,唐軍榮,辛培堯,等. 響應面分析法優化組培金線蓮多糖提取工藝研究[J]. 食品工業科技,2015,36(14):244-248. [12]SABIR S M,AHMAD S D,HAMID A,et al. Antioxidant and hepatoprotective activity of enthanolic extract of leaves of Solidago microglossa containing polyphenolic compounds[J]. Food Chemistry,2012,131(3):741-747. [13]ZHU K X,LIAN C X,GUO X N,et al. Antioxidant activities and total phenolic contents of various extracts from defatted wheat germ[J]. Food Chemistry,2011,126(3):1122-1126. [14]SMIROFF N,CUMBES Q J. Hyroxylradical scaven-ging activity compatiblesolutes[J]. Phytochemistry,1989,28(4):1057-1060. [15]WANG Z J,LIAO D K. Study on the anti-oxidant activity of polysaccharide in Agrocybe aegerita[J]. 食品研究與開發,2010,31(4):50-55. [16]朱麗蓉,吳萍萍,楊大偉,等. 杜仲雄花茶多糖的響應面優化提取及其抗氧化活性評價[J]. 食品工業科技,2015,36(3):199-203. Study on the optimization of extracting polysaccharides fromSynsepalumdulcificumseed by response surface methodology and evaluation of antioxidant activity MA Yi-dan1,LIU Hong1,2,*,MA Si-cong1,YAN Rui-xin1,XUE Bing-xiang1,WANG Qian1 (1.College of Chemistry and Chemical Engineering,Hainan Normal University,Haikou 571127,China;2.Key Laboratory of Research and Development on Topical and Special Medicine and Edible Plant,Haikou 571127,China) Synsepalumdulcificumseed;polysaccharides;antioxidant;extraction;response surface methodology 2015-11-09 馬藝丹(1990-),女,碩士研究生,研究方向:天然產物的提取與分離,E-mail:18789195535@163.com。 劉紅(1967-),女,博士,教授,研究方向:藥食同源植物開發利用與保健食品的研發,E-mail:lhyd123@sohu.com。 國家自然科學基金資助項目(2166009);海南省社會發展專項(2015SF11);海口市應用技術研究與開發項目(2014-90);海南省大學生創新訓練項目(2013116580);海南師范大學大學生科研項目(XSKY201512)。 TS272.5 B 1002-0306(2016)10-0289-07 10.13386/j.issn1002-0306.2016.10.050



3 結論



