β-胡蘿卜素/酪蛋白納米復合物的形成及β-CE的生物利用率
張怡欣,何勝華,唐海珊,馬 鶯
(哈爾濱工業大學食品科學與工程學院,黑龍江哈爾濱 150090)
?
β-胡蘿卜素/酪蛋白納米復合物的形成及β-CE的生物利用率
張怡欣,何勝華*,唐海珊,馬鶯
(哈爾濱工業大學食品科學與工程學院,黑龍江哈爾濱 150090)
β-胡蘿卜素(β-CE)具有多種生物活性,但是不穩定,容易降解,利用酪蛋白(CN)對β-胡蘿卜素進行自組裝能夠對其起到保護作用,從而提高β-胡蘿卜素在食品工業中的利用價值。本文以β-CE/CN形成納米復合物為背景,研究了其形成的影響因素、粒徑分布以及β-CE的生物利用率。結果表明,β-CE/CN納米復合物的形成受溫度與β-CE/CN質量比的影響較大,β-胡蘿卜素經酪蛋白自組裝后,其水溶解性提高。經體外消化實驗,β-CE/CN納米復合物經胰蛋白酶和胃蛋白酶酶解后,酶解產物經SDS-PAGE分析,酪蛋白隨著酶解時間的延長其水解程度增加,因此β-CE從納米復合物中更易釋放出來,其生物利用率提高。
β-胡蘿卜素,酪蛋白,納米復合物,生物利用率
乳蛋白由于其價廉、無毒、高營養價值以及多種結構和功能特性使得其適合各種生物活性物質的載體[1]。酪蛋白(CN)在整個蛋白中所占比例較高,在牛乳中以膠束的形式存在。酪蛋白的自組裝作用是Semo等人首次提出,隨著人們對酪蛋白自組裝作用的認識,利用酪蛋白自組裝作用作為生物活性物質的載體也越來越受到人們的重視[2]。Zimet等人利用酪蛋白膠束和酪蛋白納米粒子來作為多不飽和脂肪酸的載體,大大的提高了不飽和脂肪酸的穩定性[3]。Bargarum等人利用β-CN與疏水性維生素D混合,利用β-CN的自組裝作用,形成了β-CN/維生素D納米粒子復合物,其膠束的粒徑接近于天然酪蛋白膠束,提高了維生素D在水介質中的穩定性,對紫外光誘導降解起到了顯著的保護作用[4]。
β-胡蘿卜素(β-CE)是維生素A的前體,具有多種生物活性功能[5]。國內外大量研究表明:β-CE具有抗癌和作為天然抗氧化劑的作用,而且還可以作為天然色素應用于飲料加工中[6]。然而,β-CE在食品工業中的應用有較大的局限性,主要是由于β-CE對光、熱、氧等條件十分敏感,極其不穩定,容易降解,另外,β-CE的水溶性差[7]。β-CE與CN在體外通過自組裝作用形成β-CE/CN納米復合物,對β-CE起到了保護的作用,而且CN在胃腸中易于消化吸收,因此為β-CE的釋放和提高生物利用率創造了條件[8]。
本研究以酪蛋白酸鈉為原料,通過β-CE與CN混合,形成β-CE/CN納米復合物,并測定影響β-CE/CN納米復合物形成的因素,β-CE/CN納米復合物的粒徑分布以及β-CE/CN納米復合物的生物利用率。
1 材料與方法
1.1材料與儀器
β-胡蘿卜素SIGMA公司,酪蛋白酸鈉蒙牛乳業,丙酮天津科密歐化學試劑廠,氯化鈣天津博迪化工有限公司,磷酸氫二鉀天津博迪化工有限公司,檸檬酸三鈉天津致遠化學有限公司,胰蛋白酶SIGMA公司,胃蛋白酶SIGMA公司,十二烷基硫酸鈉天津博迪化工有限公司,過硫酸銨天津博迪化工有限公司,甲醇天津科密歐化學試劑廠,冰乙酸天津科密歐化學試劑廠,考馬斯亮藍南京奧多福尼生物公司。
pH計sartorius,電子天平上海越平科學儀器有限公司,HWS24型恒溫水浴鍋上海一恒科技有限公司,F-2700型熒光分光光度計HITACHI,激光粒度分析儀 Malvern公司,DYY-8C型凝膠電泳儀北京六一儀器廠。
1.2實驗方法
1.2.1β-CE/CN納米復合物的制備18 mL 0.3 mmol/L的β-胡蘿卜素丙酮溶液經過0.45 μm濾膜過濾,并與4 mL 1 mol/L檸檬酸三鈉共同加入到200 mL 5%的酪蛋白酸鈉溶液中,然后將24 mL 0.2 mol/L的K2HPO4和20 mL 0.2 mol/L的CaCl2分8次加入上述溶液中,每次間隔15 min,在加入過程中,溶液在37 ℃水浴鍋中邊攪拌邊加入,加完后將溶液pH調至6.7,最后用蒸餾水將上述溶液定容到400 mL,將pH重新調至6.7,輕輕攪拌1h,通過CN的自組裝得到β-CE/CN納米復合物[9]。
1.2.2β-CE/CN納米復合物熒光強度測定
1.2.2.1溫度對β-CE/CN納米復合物的影響在溫度分別為28、32、36、40、44、48 ℃,β-CE與CN質量比為1∶300,pH6.7的情況下,按1.2.1的方法分別對β-CE進行自組裝,使用熒光分光光度計測定相對熒光強度來表示自組裝分子在不同溫度環境中的最佳組裝條件,其中激發波長為301 nm,發射波長為409 nm。
1.2.2.2β-CE與CN質量比對β-CE/CN納米復合物的影響在β-CE與CN質量比分別為1∶200、1∶250、1∶300、1∶350、1∶400、1∶450,在溫度40 ℃,pH6.7的情況下,按1.2.1的方法分別對β-CE進行自組裝,使用熒光分光光度計測定相對熒光強度來表示自組裝分子在不同溫度環境中的最佳組裝條件。
1.2.2.3pH對β-CE/CN納米復合物的影響在pH分別為6.4、6.6、6.8、7.0、7.2、7.4,β-CE與CN質量比為1∶300,pH6.7的情況下,分別進行自組裝,使用熒光分光光度計測定相對熒光強度來表示自組裝分子在不同溫度環境中的最佳組裝條件。

1.2.4β-CE/CN納米復合物的生物利用率
1.2.4.1胰蛋白酶酶解產物的SDS-PAGE分析將β-CE/CN納米復合物中加入2 g胰蛋白酶,調pH至胰蛋白酶活性位點,37 ℃水浴條件下攪拌,分別在酶解0、30、60、90、120 min時取樣并分別用HCl終止反應,將5個時間段所取樣品進行SDS-PAGE。
胰蛋白酶解產物采用SDS-PAGE進行分析,分離膠濃度為15%,濃縮膠濃度為5%,酶解產物用上樣緩沖液稀釋后取10 μL點樣于進樣孔,電泳槽運行電壓穩定在120 V,分離的蛋白用考馬斯亮蘭進行染色1h,然后用脫色液(冰乙酸∶甲醇∶水=7.5∶7.5∶85,v∶v∶v)進行脫色,最后經凝膠成像處理,水解產物分子量的確定通過與標準蛋白的分子量進行比較。
1.2.4.2胃蛋白酶酶解產物的SDS-PAGE分析將β-CE/CN納米復合物中加入0.5 g胃蛋白酶,調pH至胃蛋白酶活性位點,37 ℃水浴條件下攪拌,分別在酶解0、30、60、90、120 min時取樣并分別用NaOH終止反應,將5個時間段所取樣品進行SDS-PAGE,其條件同胰蛋白酶解產物的SDS-PAGE分析。
2 結果與分析
2.1β-CE/CN納米復合物熒光強度測定結果分析
研究表明,酪蛋白與脂溶性分子β-CE相結合會使β-CE熒光基團發生淬滅,因此利用熒光分光光度計測得的β-CE/CN納米復合物自組裝分子的相對熒光強度會低于正常濃度的β-CE的相對熒光強度。根據相對熒光強度的大小能夠表現出酪蛋白與子β-CE的結合強度[7]。
圖1~圖3分別為溫度、β-CE與CN質量比與pH對β-CE/CN納米復合物影響的熒光強度結果圖。圖1中,當自組裝溫度在28~40 ℃范圍內,其熒光強度變化不大,因此溫度在此范圍內對β-CE/CN納米復合物的結合強度影響較小,而當溫度為44、48 ℃時,其熒光強度顯著增大。由此可知,溫度超過40 ℃時,β-CE/CN納米復合物的結合強度顯著降低;從圖2中可以看出,當β-CE與CN質量比為1∶300時,其熒光強度最小,β-CE/CN納米復合物結合強度最大,當β-CE與CN質量比為1∶200與1∶250時,β-CE/CN納米復合物結合強度略低于質量比為1∶300時的結合強度,但差異并不顯著,而當β-CE與CN質量比大于1∶300時,β-CE/CN納米復合物結合強度顯著降低(p<0.05),質量比超過1∶400時結合強度的變化趨于穩定;由圖3可知,pH在6.4~7.4的范圍內,β-CE/CN納米復合物的熒光強度值基本趨于穩定,在pH為7時其熒光強度稍有降低,但差異并不顯著,因此可知,pH對β-CE/CN納米復合物的結合強度的影響不大。

圖1 溫度對β-CE/CN納米復合物影響的熒光強度Fig.1 Effect of temperature on fluorescence intensity from β-CE/CN nanoparticle complex

圖2 β-CE與CN質量比 對β-CE/CN納米復合物影響的熒光強度Fig.2 Effect of ratio of β-CE to CN on fluorescence intensity from β-CE/CN nanoparticle complex
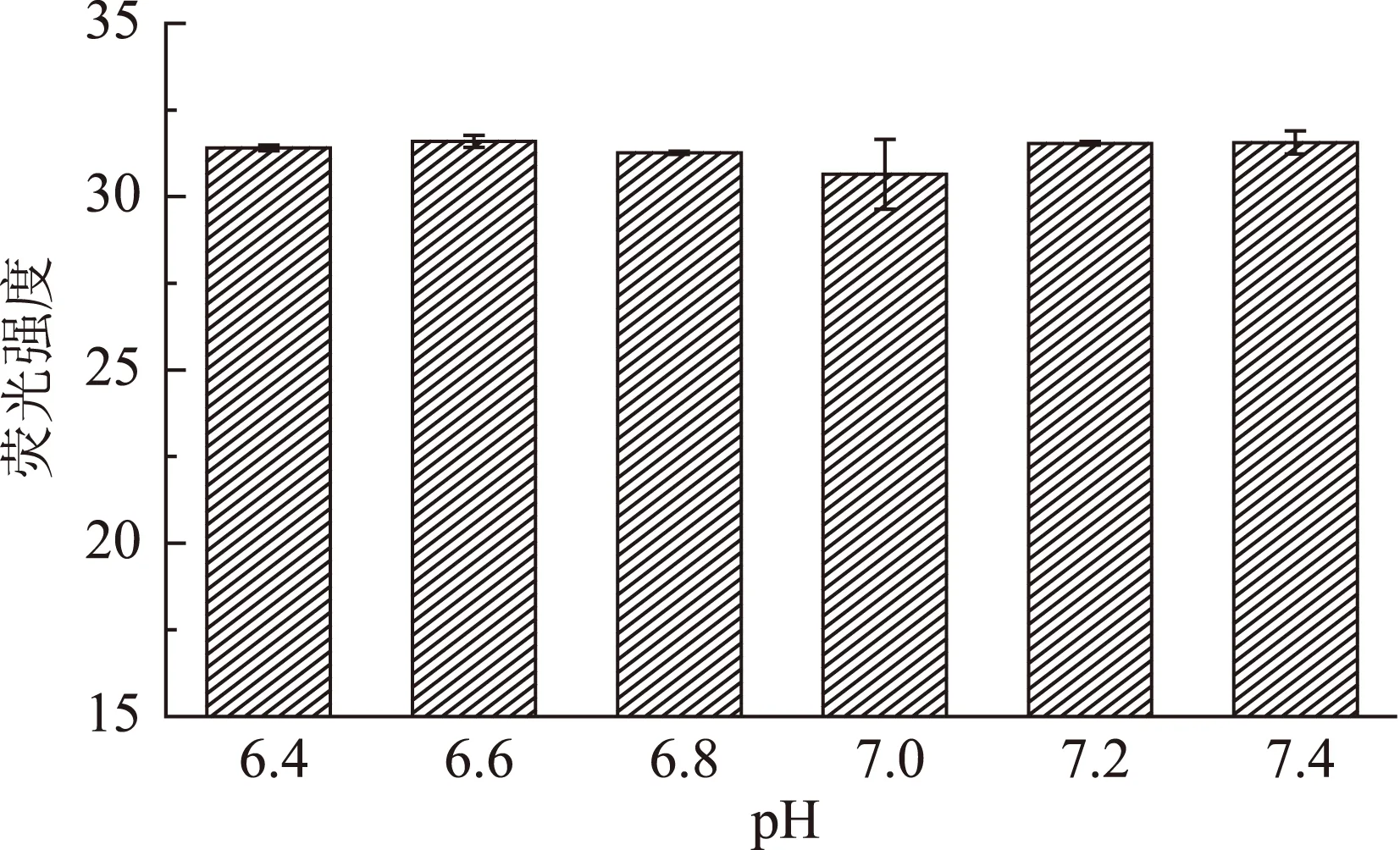
圖3 pH對β-CE/CN納米復合物影響的熒光強度Fig.3 Effect of pH on fluorescence intensity from β-CE/CN nanoparticle complex
2.2β-CE/CN納米復合物粒徑測定結果分析
圖4是β-CE/CN納米復合物及對照組的粒徑分布情況,由圖4可以看出,β-CE/CN納米復合物的平均粒徑為18.53 nm,酪蛋白酸鈉的平均直徑為47.63 nm,經自組裝的β-CE/CN納米復合物的平均粒徑與對照組酪蛋白的平均粒徑相比顯著減小。該結果說明β-CE經酪蛋白自組裝以后,酪蛋白與β-CE結合以后,其β-CE能更好的分散于水溶液中,提高了其水溶解度。

圖4 β-CE/CN納米復合物與對照組酪蛋白粒徑分布Fig.4 Particle size distribution of β-CE/CN nanoparticle complex and casein
2.3β-CE/CN納米復合物中β-CE的生物利用率
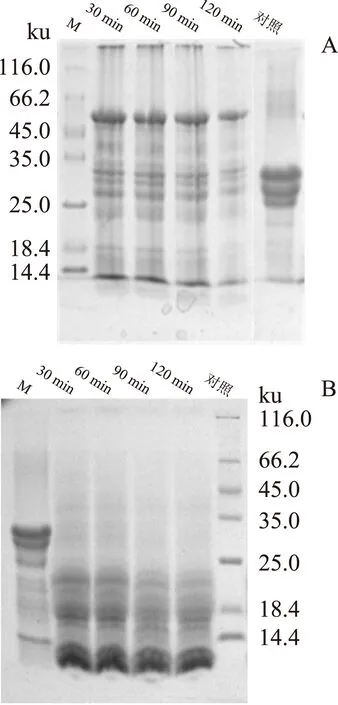
圖5 胰蛋白酶和胃蛋白酶酶解β-CE/CN 納米復合物產物的SDS-PAGEFig.5 SDS-PAGE of enzymatic hydrolysis product from β-CE/CN nanoparticle complex by trypsin and pepsin
為了分析β-CE/CN納米復合物中β-CE的生物利用率,本實驗通過體外模擬腸道中胰蛋白酶和胃蛋白酶酶解β-CE/CN納米復合物,以酪蛋白的降解來分析β-CE的釋放。
圖5A為胰蛋白酶酶解β-CE/CN納米復合物產物的SDS-PAGE圖,從該圖可以看出,隨著酶解時間的延長,分子量范圍為25.0~35.0 ku的酪蛋白在SDS-PAGE中條帶的密度逐漸降低,說明了酪蛋白的降解增大,說明了β-CE從β-CE/CN納米復合物中釋放率增加。
圖5B為胃蛋白酶酶解β-CE/CN納米復合物產物的SDS-PAGE圖,從該圖可以看出,胃蛋白酶解以后,其酪蛋白條帶幾乎消失,而在酪蛋白條帶的下面,出現了很多條帶,說明了酪蛋白經胃蛋白酶解以后,產物中出現了更多的小分子量蛋白和肽。隨著胃蛋白酶酶解時間的延長,小分子量蛋白的密度降低,說明產物中有更多的小分子量蛋白和肽,隨著蛋白的不斷酶解,β-CE也會逐漸釋放出來。
3 結論
在特定的條件下,β-胡蘿卜素與酪蛋白能夠形成β-CE/CN納米復合物,實驗中分別測定了不同溫度、β-CE與CN質量比、pH對β-CE/CN納米復合物形成的影響,溫度高于40 ℃與β-CE與CN質量比大于1∶300時不利于β-CE/CN納米復合物的形成,而pH對β-CE/CN納米復合物的形成沒有顯著的影響。β-CE/CN納米復合物的平均粒徑小于酪蛋白,說明β-CE經酪蛋白自組裝后,提高了β-CE的水溶性。體外模擬胰蛋白酶和胃蛋白酶酶解作用的結果顯示,隨著酶解時間的延長,酪蛋白被酶解的量增加,表明β-CE從β-CE/CN納米復合物中會更多的釋放出來,提高了β-CE的生物利用率。
[1]Yoav D. Milk protein as vehicles for bioactives[J]. Current Opinion in Colloid & Interface Science,2010,15:73-83.
[2]Semo E,Kesselman E,Danino D,et al. Casein micelle as a natural nano-capsular vehicle for nutraceuticals[J]. Food Hydrocolloids,2007,21:936-942.
[3]Zimet P,Rosenberg D,Livney Y D. Re-assembled casein micelles and casein nanoparticles as nano-vehicles for u-3 polyunsaturated fatty acids[J]. Food Hydrocolloid,2011,25:1270-1276.
[4]Bargarum J,Danino D,Livney Y D. Nanoencapsulation of vitamin D in beta casein micelles. Aposter presentation at the IFT 2009 Annual Meeting Anaheim,CA,USA,June 2009.
[5]Maria J,Saiz A,Carolina G F,et al. Thermal protein ofβ-carotene in re-assembled casein micelles during different processing technologie applied in food industry. 2013:138,1581-1587.
[6]Yi J,Li Y,Zhong F,et al. The physicochemical stability andinvitrobioaccessibility of beta-carotene in oil-in-water sodium caseinate emulsions[J]. Food Hydrocolloids,2014,35:19-27.
[7]Martin A,Mattea F,Gutierrez L,et al. Co-precipitation of carotenoids and bio-polymers with the supercritical anti-solvent process[J]. Journal of Supercritical Fluids,2007,41:138-147.
[8]Avi S,Yifat C,Yoav D. Thermally-inducedβ-lactoglobulin-EGCG nanovehicles:Loading,stability,sensory and digestive-release study[J]. Food Hydrocolloids,2012,29:57-67.
[9]Maria S,Carolina G F,Ana M R,et al. Thermal protection ofβ-carotene in re-assembled casein micelles during different processing technologies applied in food industry[J]. Food Chemistry,2013,138:1581-1587.
[10]Thiebaud M,Dumay E,Picart L,et al,Cheftel J C. High-pressure homogenisation of raw bovine milk. Effects on fat globule size distribution and microbial inactivation[J]. International Dairy Journal,2003(13):427-439.
[11]孔小宇,劉寧.β-乳球蛋白-番茄紅素自組裝分子抗消化性的研究[J]. 食品工業科技,2012,33(3):60-67.
Formation ofβ-CE/CN nanoparticle complex and bioavailability ofβ-CE
ZHANG Yi-xin,HE Sheng-hua*,TANG Hai-shan,MA Ying
(College of Food Science & Engineering,Harbin Institute of Technology of China,Harbin 150090,China)
β-carotene(β-CE)has various biological activities,but it is unstable and easily degradation.β-carotene self-assembles in casein(CN)and form nanoparticle complex,with plays an important role in protectingβ-carotene. Thereby,β-carotene/CN nanoparticle complex can enhances the utilization value ofβ-carotene in the food industry. The paper was based on the formation ofβ-CE/CN nanoparticle complex,and the influence factors,such as formation,the particle size distribution and bioavailability ofβ-CE were investigated. The results showed that temperature andβ-CE/CN mass ratio had great impact on its formation,β-CE re-assembled in CN can improve water solubility ofβ-CE. After digestion experimentinvitro,β-CE was hydrolyzed by trypsin and pepsin,the hydrolysis degree of casein was increased with the increase of hydrolysis time. Therefore,β-CE easily released fromβ-CE/CN nanoparticle complex and its bioavailability was enhanced.
β-carotene;casein;nanoparticle complex;bioavailability
2015-05-19
張怡欣(1991-),女,碩士研究生,研究方向:乳品化學與乳品加工技術,E-mail:zyxkysmile@163.com。
何勝華(1974-),男,博士,講師,研究方向:乳品化學與乳品加工技術,E-mail:heshenghua@hit.edu.cn。
中國博士后特別資助(2014T70360)。
TS255.1
A
1002-0306(2016)05-0068-04
10.13386/j.issn1002-0306.2016.05.005

