高產蝦青素紅法夫酵母菌株的選育和發酵參數優化
胡向東,潘玲燕,葉茂,胡偉卿
(浙江皇冠科技有限公司,浙江杭州 310012)
?
高產蝦青素紅法夫酵母菌株的選育和發酵參數優化
胡向東,潘玲燕*,葉茂,胡偉卿
(浙江皇冠科技有限公司,浙江杭州310012)
目的:選育出高產、穩產蝦青素的紅法夫酵母菌株,并對培養基進行參數優化。方法:以紅法夫酵母(P.Rhodozyma02)為出發菌株,分別進行紫外-氯化鋰(UV-LiCl)和60Co-γ誘變,從中篩選出高產蝦青素的突變株作為基因組重排育種的出發菌株;經過五輪原生質體融合,篩選得到的基因組重排最優菌株。通過富含蝦青素合成前體的天然促進劑的添加及對發酵培養基的參數優化,得到最佳培養基條件。結果:最終篩選得到高產、穩產蝦青素的融合菌株F5-9,在此基礎上優化得到最佳培養基參數條件為葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO41.5 g/L,CaCl2·2H2O 0.2 g/L,胡蘿卜汁150 mg/L,最終蝦青素的產量高達(83.39±1.03)mg/L,是原始出發菌株的17.56倍。結論:采用傳統誘變和基因組重排技術,能顯著提高蝦青素產量,培養基中添加蝦青素前體物質胡蘿卜汁能進一步促進蝦青素產量的提高。
紅法夫酵母,蝦青素,誘變,基因組重排,參數優化
蝦青素具有極強的生物抗氧化性、還具有促進機體抗體產生、增強免疫力以及抗紫外線輻射等作用[1]。因而在食品添加劑、水產養殖、化妝品、保健品和醫藥工業方面有廣闊的應用前景[2-5]。
紅法夫酵母是蝦青素的主要生物來源之一,但由于蝦青素是胞內色素,是一種與細胞生長相偶聯的次級代謝產物,且紅法夫酵母最適生長溫度低,菌體生長緩慢,所以蝦青素的產量也比較低,目前高產蝦青素酵母菌株主要是通過反復多次誘變和篩選得到[6-7],但反復多次誘變會產生有毒的突變株,且會產生抗藥性,難以再大幅度提高產量。
基因組重排技術是20世紀90年代中期,美國加州Maxgen公司Cardayré等首次提出的,是基于DNA Shuffling的原理[8]將傳統誘變技術和細胞融合技術相結合,以整個基因組作為重組對象的多親本原生質體遞推融合技術。2002年Zhang等[9]又進一步提出在細胞水平的基因組重排,該技術模擬自然進化的過程,將誘變育種技術和原生質體融合技術相結合,以分子進化為核心在實驗室實現微生物全細胞快速定向進化。目前,基因組重排主要應用于提高微生物代謝產物產率,增強菌株對環境的耐受性,提高底物利用率和范圍,改變代謝途徑產生新的代謝產物等。Wang等[10]采用紫外線與亞硝基胍(NTG)兩種誘變劑分別對干酪乳桿菌進行誘變,以獲得的突變菌株作為親本株進行了3輪原生質體融合,得到的融合子可在pH3.6條件下生長,pH3.8條件下乳酸產量比野生型菌株提高3倍。Wang[11]等對一株產紫杉醇的內生真菌用UV和NTG對原生質體誘變建立突變庫,經過1輪重排,篩選到一株能產生3種新的倍半萜類化合物的突變株及一株能產生18種其他化合物的重排融合菌株。
針對野生紅法夫酵母菌株蝦青素產量低的問題,本文采用基因組重排技術,即將原始出發菌株分別經UV和60Co-γ誘變,篩選高產量正突變菌株,再進行原生質體遞歸融合,最終得到高產、穩產蝦青素的融合菌株,并對蝦青素產量最高菌株的發酵工藝進行了合理優化。
1 材料與方法
1.1材料與儀器
親本菌株紅法夫酵母(P.Rhodozyma02),其來源為浙江工商大學食品與生物工程學院保藏,由梁新樂(浙江杭州)贈送,于-80 ℃下保存;
培養基YM培養基、YM-二苯胺選擇性培養基、高滲再生培養基、選擇性再生培養基、搖瓶發酵培養基均參照文獻[12]進行配制,種子培養基為YM液體培養基。
1.2培養及分析方法
1.2.1溶液配制生理鹽水:稱取8.5 g NaCl溶于1000 mL去離子水中,分裝高壓蒸氣滅菌后待用;KCl高滲緩沖液的配制(0.8 mol/L):稱取59.6 g KCl溶解于0.01 mol/L的Tris-HCl(pH7.4)緩沖溶液中,定容到1000 mL,分裝高壓蒸氣滅菌后待用;PTC溶液的配制:分別準確稱取70 g PEG-4000,0.22 g無水CaCl2,KCl溶液溶解并定容至200 mL;溶壁酶混合液:分別稱取0.6 g溶菌酶,0.6 g蝸牛酶,1.2 g纖維素酶,分別溶于30 mL KCl 緩沖液中,分別用 0.22 μm的無機微孔膜過濾,4 ℃保存,使用時按纖維素酶∶溶菌酶∶蝸牛酶=2∶1∶1 混合。
1.2.2菌種培養菌種的活化、種子培養及搖瓶發酵培養均參照文獻[6]的方法進行。
1.2.3蝦青素含量的測定紫外分光光度測定法[13]。
1.2.4菌體生物量的測定取5 mL菌懸液,5000 r/min離心10 min,棄上清,菌體用去離子水洗兩次,在烘箱中于105 ℃烘至恒重,然后稱重。
1.3實驗方法
1.3.1復合誘變育種將對數期的出發菌株菌液用無菌生理鹽水稀釋到106個/mL,參照文獻[6]的誘變方法分別進行UV-LiCl復合誘變和60Co-γ射線誘變處理,篩選平板中加入40 μmol/L二苯胺進行抗性篩選。
1.3.2原生質體的制備見參考文獻[12]。
1.3.3原生質體形成率和再生率的測定見參考文獻[14]。
1.3.4原生質體融合與再生見參考文獻[12]。
1.3.5融合子的篩選將融合菌株分別劃線于含40 μmol/L濃度二苯胺的YM選擇性培養基平板上,22 ℃培養后觀察平板上菌落的生長情況,從長出的菌落中選出顏色較紅,半徑較大的,蝦青素產量相對高的幾株融合菌株。
1.3.6遞歸融合將篩選出的蝦青素產量相對高的幾株融合菌株繼續進行步驟1.3.2至1.3.5的操作,將每輪融合菌株分別劃線于含有不同濃度(80~360 μmol/L)的二苯胺的YM選擇性培養基平板上,篩選出蝦青素產量較高的融合菌株,如此循環往復,進行5輪遞歸融合,最后篩選出蝦青素產量相對較高的幾株菌株。
1.3.7穩定性實驗將最終篩選出蝦青素產量相對較高的融合菌株按10%接種量接入裝有30 mL液體發酵培養基的250 mL三角瓶中進行發酵培養,22±1 ℃,150 r/min,培養48 h,傳代5次,提取發酵液,測定蝦青素含量,最終得到蝦青素含量穩定的融合菌株。
1.3.8高產融合子發酵生產蝦青素的工藝優化影響紅法夫酵母高產蝦青素的因素有很多,如培養基的成分和配比、發酵pH、發酵溫度、發酵時間、轉速、裝液量等,另有研究報道一些天然促進劑,如橙子、茶葉汁、胡蘿卜汁、番茄汁[15-16]等,在紅法夫酵母發酵生產蝦青素的過程中,對于提高蝦青素產量有著重要的作用。本實驗主要針對天然促進劑種類及各營養物質的比例對發酵蝦青素的影響進行考查,設計5因素4水平正交實驗,按正交表L16(45)進行發酵實驗,測定蝦青素的產量。
2 結果與討論
2.1誘變育種的結果
2.1.1UV-LiCl復合誘變育種結果參考文獻[6],得到H1-2和H1-12兩株蝦青素產量較高的突變株,產量分別是(9.62±0.16)、(9.44±0.14)mg/L,將其作為第一輪原生質體融合的親本菌株。
2.1.260Co-γ射線誘變結果P.rhodozyma02菌株經3.5 kGy劑量的60Co-γ射線誘變篩選后,得到10個菌落大、顏色亮而紅的菌株,進行搖瓶發酵復篩,測定蝦青素含量和生物量。結果見表2。從表2中可以看出,突變株Co-4、Co-5和Co-9的蝦青素產量分別是(9.35±0.16)、(9.27±0.07)和(9.46±0.15) mg/L,分別是出發菌株P. Rhodozyma 02的1.97、1.95和1.99倍。因此將Co-4、Co-5和Co-9作為第一輪原生質體融合的親本菌株。

表1 最佳融合菌株發酵工藝條件優化正交實驗因素水平Table 1 Factors and levels of fermentation conditions optimization for the best fusion strains
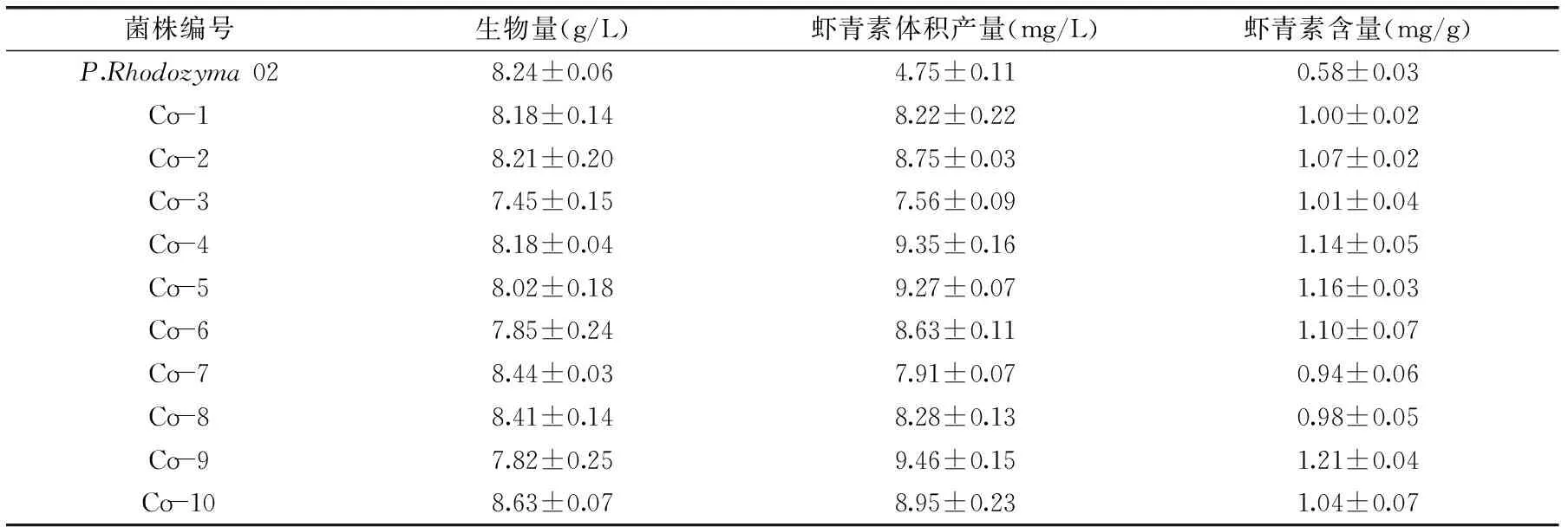
表2 60Co-γ射線誘變突變株的生物量和蝦青素產量Table 2 Biomass and astaxanthin production of mutants by 60Co-γ radiation
2.2原生質體融合結果
2.2.1第一輪原生質體融合結果將經UV-LiCl和60Co-γ誘變方式篩選得到的5株突變株作為出發菌株進行第一輪的原生質體融合,從黃色菌株中挑選生長較好的30個菌株進行搖瓶復篩,以菌株編號為橫坐標,蝦青素產量為縱坐標繪圖,如圖1。最終得到6株融合子 F1-8、F1-10、F1-12、F1-17、F1-21、F1-27,蝦青素產量都有所提高,其中F1-17的蝦青素產量為(17.48±0.36) mg/L,是原始出發菌株P.Rhodozyma02的3.68倍。

圖1 第一輪融合子搖瓶發酵復篩 Fig.1 The screening of the first round generation fusants of shake-flask fermentation
2.2.2第二輪原生質體融合結果第一輪融合子F1-8、F1-10、F1-12、F1-17、F1-21、F1-27作為第二輪融合的出發菌株,進行步驟1.3.2至1.3.5的操作進行原生質體的制備和融合,本輪抗性平板中二苯胺濃度為80 μmol/L。從篩選平板上挑選顏色深且生長較好的30個菌株進行搖瓶復篩,結果如圖2。最終得到5株融合子F2-6、F2-11、F2-25、F2-26、F2-28蝦青素產量都有所提高,其中F2-28的蝦青素產量為(26.91±0.07) mg/L,是原始出發菌株P.Rhodozyma02的5.66倍。
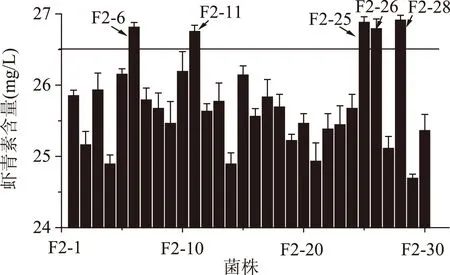
圖2 第二輪融合子搖瓶發酵復篩Fig.2 The screening of the second round generation fusants of shake-flask fermentation
2.2.3第三輪原生質體融合結果將第二輪得到的蝦青素產量較高的5株融合子作為第三輪融合的出發菌株,步驟同“2.2.2”,本輪抗性平板中二苯胺濃度為160 μmol/L。結果如圖3所示,最終得到5株融合子F3-2、F3-8、F3-12、F3-15、F3-19、蝦青素產量較高,其中F3-15的蝦青素產量為(42.09±1.08) mg/L,是原始出發菌株P.Rhodozyma02的8.86倍。
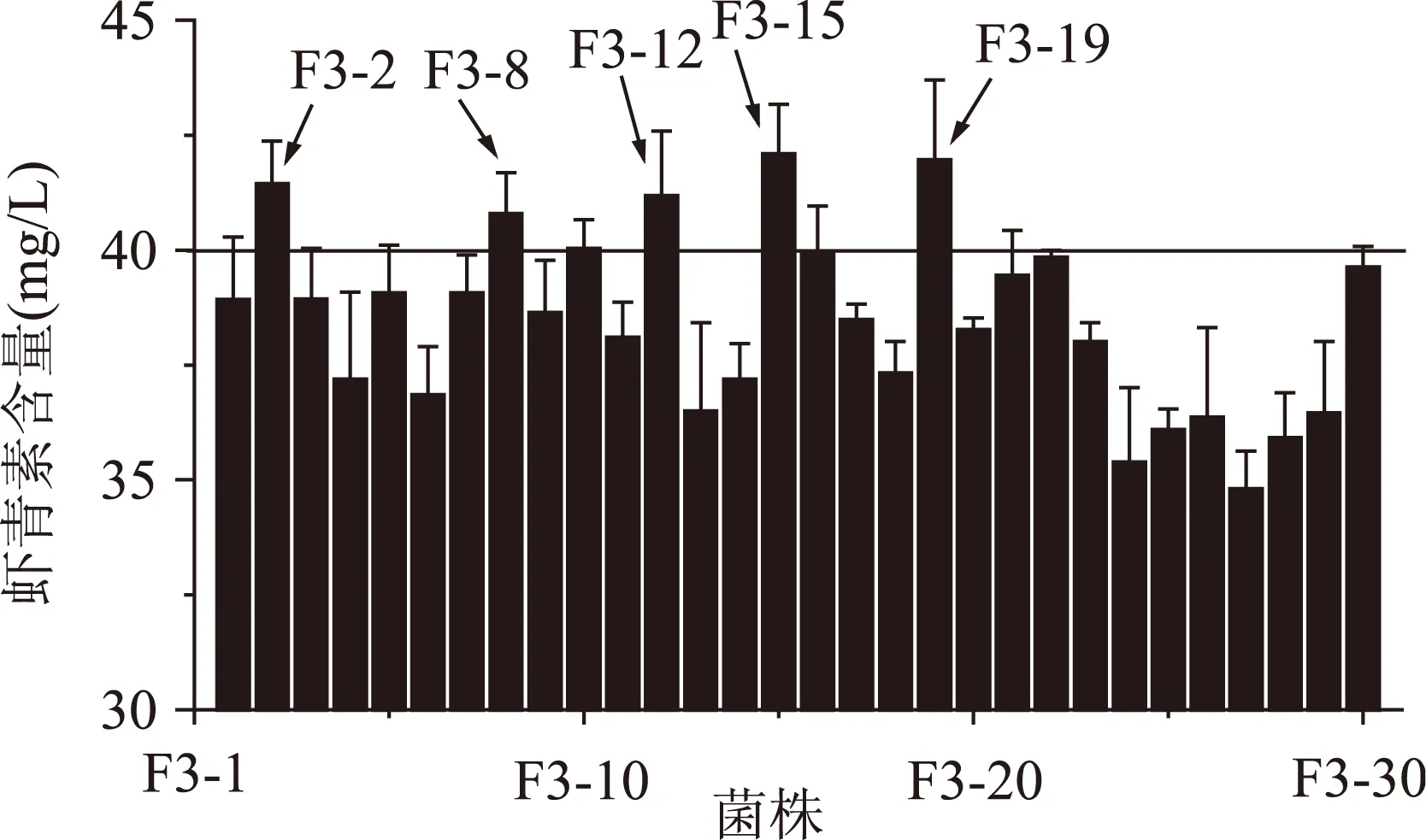
圖3 第三輪融合子搖瓶發酵復篩Fig.3 The screening of the third round generation fusants of shake-flask fermentation
2.2.4第四輪原生質體融合結果將第三輪得到的蝦青素產量較高的5株融合子作為第四輪融合的出發菌株,步驟同“2.2.2”,本輪抗性平板中二苯胺濃度為240 μmol/L,從篩選平板上挑選顏色深且生長較好的20個菌株進行搖瓶復篩。結果如圖4所示,最終得到4株融合子F4-4、F4-7、F4-10、F4-18蝦青素產量較高,其中F4-4和F4-10的蝦青素產量分別為(56.88±0.74)和(56.89±0.61) mg/L,是原始出發菌株P.Rhodozyma02的11.98倍。
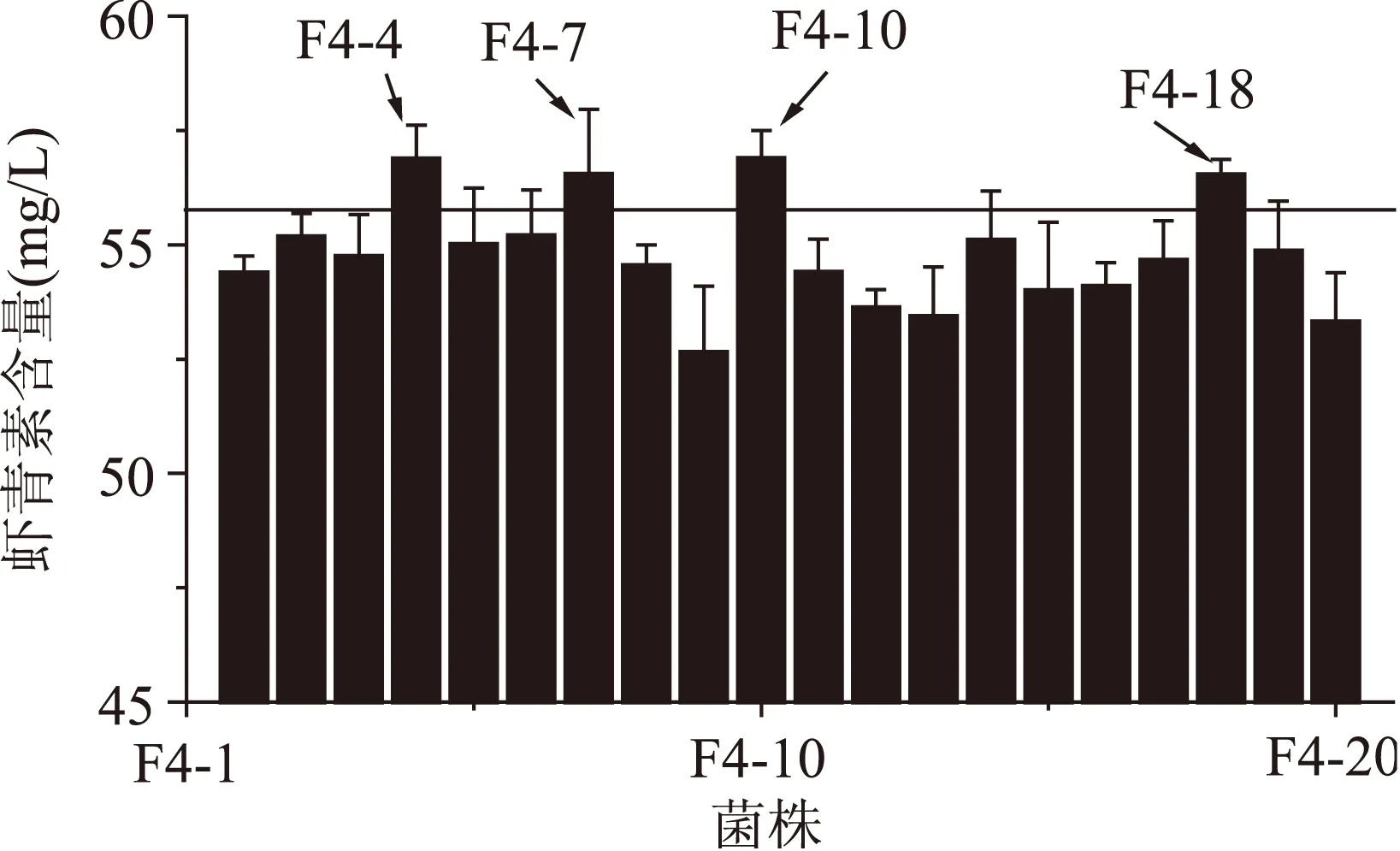
圖4 第四輪融合子搖瓶發酵復篩Fig.4 The screening of the fourth round generation fusants of shake-flask fermentation
2.2.5第五輪原生質體融合結果將第四輪得到的蝦青素產量較高的4株融合子作為第四輪融合的出發菌株,步驟同“2.2.2”,本輪抗性平板中二苯胺濃度為360 μmol/L,從篩選平板上挑選顏色深且生長較好的10個菌株進行搖瓶復篩。結果如圖5所示,最終得到3株融合子F5-2、F5-5、F5-9蝦青素產量較高,蝦青素產量分別為(67.96±0.69)、(68.09±0.86)和(68.23±0.75) mg/L。
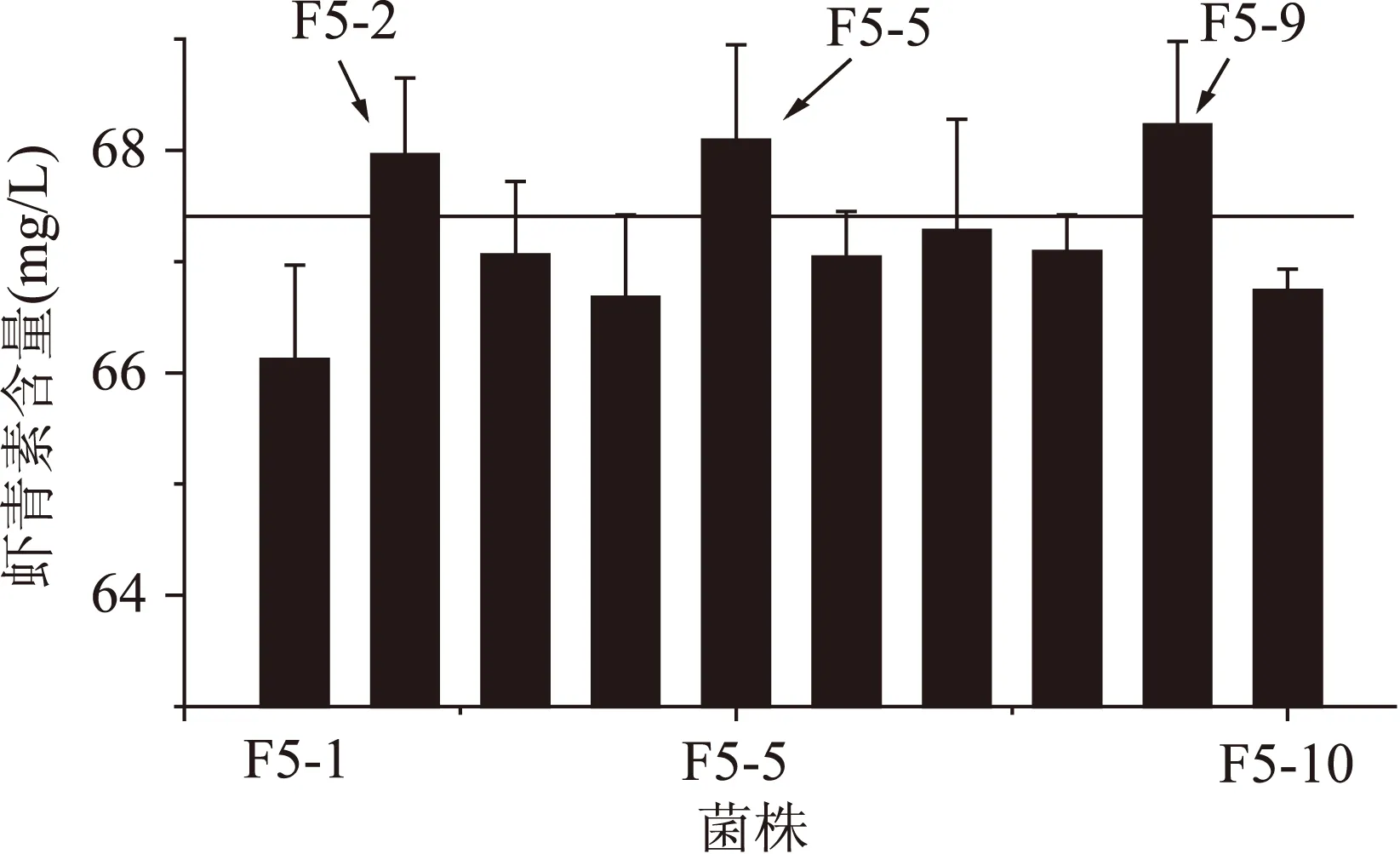
圖5 第五輪融合子搖瓶發酵復篩Fig.5 The screening of the fifth round generation fusants of shake-flask fermentation
2.3原生質體融合子穩定性測試結果
通過5輪原生質體融合后得到的3株產量較高的菌株,進行搖瓶穩定性遺傳實驗,考察菌株穩定性,結果見表3。傳代5次后,發現F5-9具有良好的穩定性,體積產量達到(68.10±0.56)mg/L,而F5-2、F5-5遺傳穩定性較差,蝦青素體積產量不穩定,所以最終得到一株穩產、高產蝦青素的法夫酵母菌株F5-9。

表3 紅法夫酵母菌株遺傳穩定性實驗結果Table 3 Inheritance stability tests of P. rhodozyma mutants
2.4融合菌株F5-9發酵生產蝦青素工藝條件的優化
2.4.1天然促進劑選擇了橙汁、綠茶汁、胡蘿卜汁、番茄汁作為天然促進劑添加到發酵培養基中,各濃度均為100 ml/L,發酵結果見表4。結果表明加入橙汁和胡蘿卜汁,生物量和蝦青素的體積產量提高較明顯,加入番茄汁反而抑制了蝦青素的產量,可能是由于菌體在利用番茄汁進行生長的同時合成了其他物質,從而使蝦青素的合成受阻。從經濟成本角度考慮,最終選擇胡蘿卜汁作為促進劑添加到發酵培養基中。

表4 天然促進劑對F5-9發酵蝦青素產量的影響Table 4 Effect of natural promoter on astaxanthin yield of F5-9

表5 融合菌株F5-9發酵工藝條件優化正交實驗結果分析Table 5 Results and analysis of fermentation conditions optimization for the F5-9 fusion strains
2.4.2正交實驗結果正交實驗結果如表5。各因素的極差R值表明,各因素對融合菌株F5-9發酵生產蝦青素產量的影響大小順序為葡萄糖>胡蘿卜汁>蛋白胨>(NH4)2SO4>酵母浸出粉。由表中k值可以確定最適培養基的配方為葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,胡蘿卜汁150 mL/L。
2.4.3最優條件下發酵生產蝦青素在優化后的條件下發酵生產蝦青素,發酵溫度22±1 ℃,發酵轉速150 r/min,pH5.4,蝦青素產量達到最值的時間有所延長,從圖6可以看出,蝦青素體積產量達到最值的時間為60 h,產量最高達(83.39±1.03) mg/L。發酵時間由原來的48 h延長至60 h,其可能原因是培養基中初始碳源、氮源含量的提高,使菌體的生長時間延長,同時由于天然促進劑胡蘿卜汁的添加,進一步促進了蝦青素的合成。
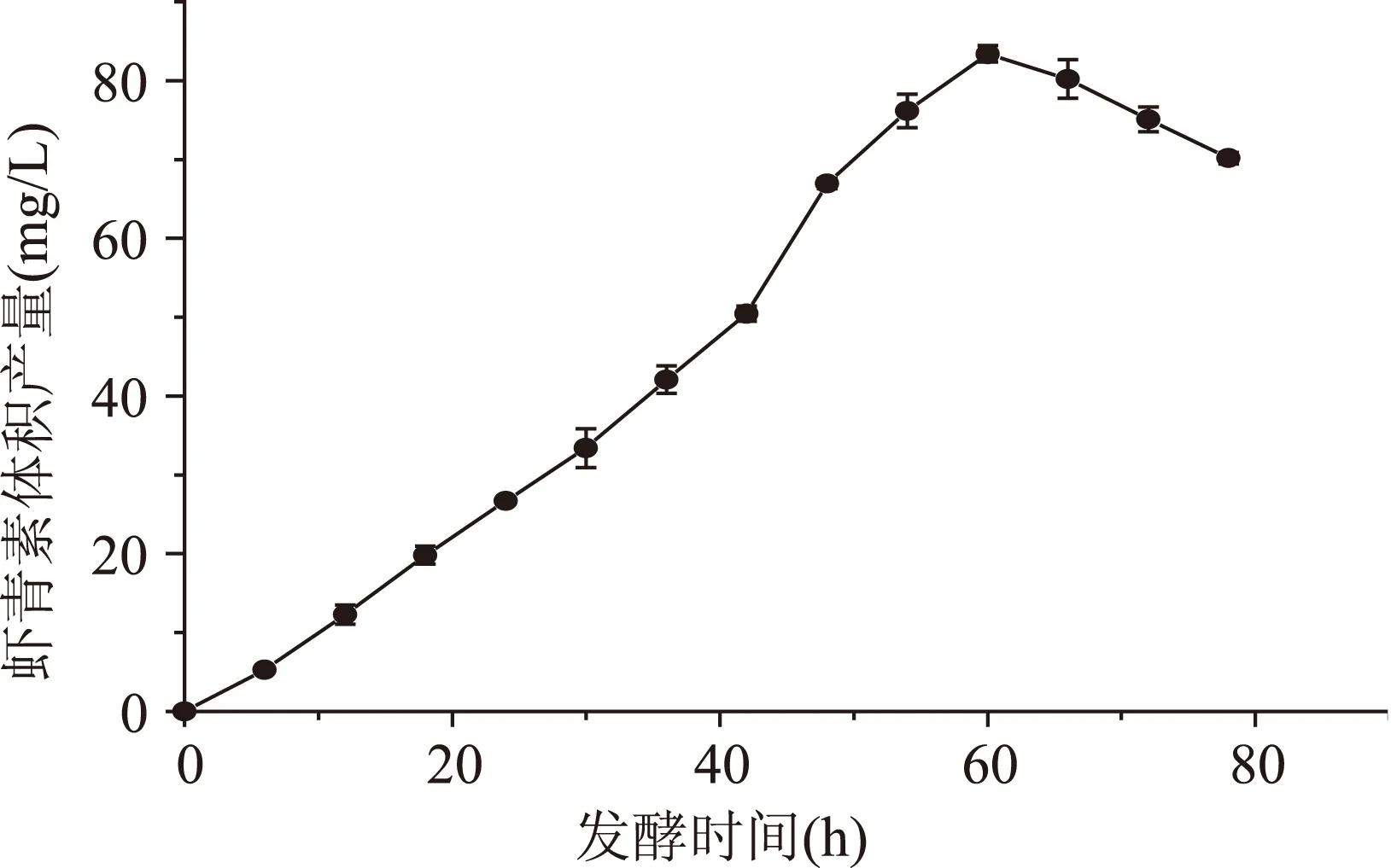
圖6 發酵時間對F5-9發酵生產蝦青素產量的影響Fig.6 Effect of fermentation time on astaxanthin yield of F5-9
3 結論
基因組重排育種技術作為一種新型、快速、有效的技術,其與經典的誘變育種、原生質體融合技術相比具有明顯的優勢。文獻[6]中依次經過兩輪物理復合誘變得到的菌株產量為25.36 mg/L,較原始出發菌株有一定的提高,但是單純的物理誘變,會使菌株正突變率低,容易導致回復突變,出現“疲勞效應”[17]。本文經誘變和基因組重排最終選育出的一株高產、穩產蝦青素的重組紅法夫酵母菌株F5-9,蝦青素產量達到(68.10±0.56) mg/L,是文獻[6]選育出的菌株產量的2.69倍,這樣做提高了同源重組的頻率,產生各種各樣的突變組合,從而達到快速進化菌株表型的目的,實現多親本的基因水平轉移、選育出的子代菌株穩定性與安全性高。
從蝦青素生物合成途徑可知,番茄紅素、β-胡蘿卜素等是蝦青素合成的重要前體物質,自然界中許多植物中都含有較高的此類前體物質,將其添加到發酵蝦青素的培養基中,能在一定程度上促進蝦青素的合成,提高蝦青素的產量。本文從降低發酵成本考慮,最終選擇胡蘿卜汁天然促進劑添加到發酵培養基中,并對發酵培養基進行參數優化,最終培養基成份為:葡萄糖30.0 g/L,蛋白胨3.0 g/L,酵母浸出粉7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO41.5 g/L,CaCl2·2H2O 0.2 g/L,胡蘿卜汁150 mL/L,得到發酵融合菌株F5-9,蝦青素的產量高達(83.39±1.03)mg/L。
[1]Hu C,Han W,Chen Z,et al. Statistical optimization of microwave-assisted astaxanthin extraction from Phaffia rhodozym[C]. Yan Tai:2010 3rdInternational Conference on Biomedical Engineering and Informatics,2010,5:2104-2109.
[2]Mezquita P C,Huerta B B,Ramírez J P,et al. Milks pigmentation with astaxanthin and determination of colour stability during short period cold storage[J]. Journal of Food Science and Technology,2015,52(3):1634-1641.
[3]汪洪濤,徐學明,金征宇. 天然蝦青素對金魚體色變化的影響[J]. 現代食品科技,2013,29(4):749-751.
[4]Tominaga K,Hongo N,Karato M,et al. Cosmetic benefits of astaxanthin on humans subjects[J]. Acta Biochimica Polonica,2012,59(1):43-47.
[5]Yoshida H,Yanai H,Ito K,et al. Administration of natural astaxanthin increases serum HDL-cholesterol and adiponectin in subjects with mild hyperlipidemia[J]. Atherosclerosis,2010,209(2):520-523.
[6]胡向東,潘玲燕,章祺,等. 復合誘變選育高產蝦青素的紅法夫酵母菌株[J]. 食品與發酵工業,2014,40(10):58-68.
[7]龔玉姣,屈平華,曹理想,等. 協同誘變法選育蝦青素高產優良酵母菌株[J]. 微生物學雜志,2010,30(1):16-20.
[8]Stemmer W P C. Rapid evolution of a proteininvitroby DNA shuffling[J]. Nature,1944,370(6488):389-391.
[9]Zhang Y X,Perry K,Vinci V A,et al. Genome shuffling leads to phenotypic improvement in bacteria[J]. Nature,2002,415(6872):644-646.
[10]Wang Y H,Li Y,Pei X L,et al. Genome shuffling improved acid tolerance and L-lactic acid volumetric productivity in Lactobacillus rhamnosus[J]. Journal of Biotechnologica,2007,129(3):510-515.
[11]Wang M Z,Liu S S,Li Y Y,et al. Protoplast mutation and genome shuffling induce the endophytic fungus Tubercularia sp. TF5 to produce new compounds[J]. Current Microbiology,2010,61(4):254-260.
[12]胡向東,朱靜,梁新樂. 一株高產天然蝦青素的紅法夫酵母菌株及其選育方法和應用[P]. 中國專利,201210321949.2. 2013-01-09.
[13]鄭宗寶. 基于基因組重排技術的紅法夫酵母蝦青素高產株選育[D]. 天津:天津大學,2009.
[14]曲秋皓,寧國贊. 紅色酵母原生質體形成和再生條件的研究[J]. 工業微生物,1998,28(4):38-41.
[15]張麗敏,華艷艷,孫玉梅,等. 紅發夫酵母生物合成蝦青素天然促進劑的研究[J]. 河南工業大學學報2011,32(1):66-69.
[16]朱曉立,梁世中,鄧毛程. 幾種物質對紅發夫酵母生長和蝦青素合成的影響[J]. 食品科技,2008,33(12):20-23.
[17]魏希穎,王家穩,劉清梅,等. 基因組重排技術在微生物菌種選育中的應用[J]. 陜西師范大學學報,2013,41(5):68-72.
Screening and fermentation optimization of a high-yield-astaxanthin-producingPhaffiarhodozyma
HU Xiang-dong,PAN Ling-yan*,YE Mao,HU Wei-qing
(Zhejiang Crown Technology Co.Ltd,Hangzhou 310012,China)
Objective:To screen out a high-yield-astaxanthin-producingPhaffiarhodozymaand optimize the culture medium conditions. Method:Phaffiarhodozymastrain(P. rhodozyma 02)was used as original strain treated with UV-LiCl and60Co-γ mutagenesis respectively. Mutant strains with higher astaxanthin productivity were screened out and used as the starting strains for genome shuffling. After 5 rounds of protoplast fusion,obtained the best recombinant with further high yield of astaxanthin. The optimum culture medium conditions was obtained by adding natural promoter rich in synthetic precursor of astaxanthin to the medium and optimizing the parameter of culture medium. Result:a high-yield-astaxanthin-producing recombinant F5-9 was obtained and the optimum culture medium conditions were:glucose 30.0 g/L,peptone 3.0 g/L,yeast extract powder 7.0 g/L,(NH4)2SO45.0 g/L,MgSO4·7H2O 2.75 g/L,KH2PO4 1.5 g/L,CaCl2·2H2O 0.2 g/L,carrot juice 150 mg/L. Eventually the astaxanthin production reached at(83.39±1.03)mg/L,which was 17.56 times than the original strain. Conclusion:The traditional mutation and genome shuffling can significantly improve the yield of astaxanthin and there is room for further improvement in the yield of astaxanthin by adding natural promoter rich in synthetic precursor of astaxanthin carrot juice into culture medium.
Phaffiarhodozyma;astaxanthin;mutagenesis;genome shuffling;parameter optimization
2015-06-05
胡向東(1957-),男,碩士,主要從事微生物發酵及動物營養方面的研究,E-mail:hxd@zjcrown.cn。
潘玲燕(1987-),女,碩士,主要從事微生物發酵及提取方面的研究,E-mail:ply1987@126.com。
國家重點新產品計劃項目資助(2010GRC20064);國家發改委綠色農用生物產品高技術產業化專項資助項目(發改高技【2011】1158號)。
TS202.3
B
1002-0306(2016)05-0142-06
10.13386/j.issn1002-0306.2016.05.019

