過量表達葡萄糖脫氫酶對E.coli羥基脂肪酸合成能力的影響
王相偉,邢 翔,馬慶林
(山東大學(威海)海洋學院,山東威海 264209)
?
過量表達葡萄糖脫氫酶對E.coli羥基脂肪酸合成能力的影響
王相偉,邢翔,馬慶林
(山東大學(威海)海洋學院,山東威海 264209)
在工程大腸桿菌生產羥基脂肪酸的基礎上,為解決構建的以葡萄糖為底物合成羥基脂肪酸(HFAs)代謝途徑中存在的細胞內還原力(NADPH)不平衡的問題,克隆了來源于巨大芽孢桿菌葡萄糖脫氫酶(GDH)基因,構建了胞內HFAs和NADPH聯產的工程菌株;實驗結果表明該重組大腸桿菌合成HFAs的產量得到顯著提高,搖瓶條件下HFAs產量達到173.9 mg/L。具有較好的工業化開發前景。
羥基脂肪酸,葡萄糖脫氫酶,基因工程,重組大腸桿菌
ω-羥基脂肪酸是羥基位置較靠近首位甲基碳端的羥基脂肪酸,它作為單體在合成高分子聚合物時可提供最長的碳鏈,使合成材料性能更優越,是當今生物可降解聚合物材料研究開發中最理想的原料之一[1-3],日益受到國內外的高度關注。由于ω-羥基脂肪酸的羥基位于不活潑的碳鏈端,傳統的化學合成工藝反應步驟繁瑣,反應條件苛刻,催化劑特異性不高,給后期產物分離造成了很大的困難,限制了化學法合成羥基脂肪酸的工業化應用[4-5]。基于對原料資源、成本、環境效應等綜合考慮,以可再生資源如葡萄糖等為原料,利用微生物細胞催化合成羥基脂肪酸已成為近年的研究熱點[6-8]。
目前,國內外微生物合成羥基脂肪酸的報道主要集中在菌種的篩選及外源脂肪酸催化方面,酵母[9]、銅綠假單胞菌[10]、芽孢桿菌[11]及大腸桿菌[12]催化合成羥基脂肪酸已有報道,然而,上述合成過程均需添加外源脂肪酸作為催化底物,原料價格昂貴且抑制細胞的生長,不適合用于大規模工業化生產,而以可再生資源如葡萄糖為底物進行羥基脂肪酸生產的報道較少,為解決這一問題,研究者構建了以葡萄糖為底物合成HFAs的代謝途徑,但報道的搖瓶產量不高[6],原因之一是由于以葡萄糖為底物生成HFAs過程中,胞內游離脂肪酸羥基化需要供應還原力NADPH,而細胞內產生的NADP+無法及時再生,最終影響了HFAs的合成與產量。作者在前期構建大腸桿菌由葡萄糖合成HFAs途徑的基礎上,引入來源于巨大芽孢桿菌的葡萄糖脫氫酶(GDH)基因,在氧化葡萄糖為葡萄糖酸內酯的同時,將NADP+持續轉化為NADPH[13],作為羥化反應所需的氫供體,用以平衡胞內HFAs生產過程的還原力,從而有效提高了HFAs的產量。
1 材料與方法
1.1材料與儀器

表1 本研究所用的菌株、質粒及引物Table 1 E.coli strains,plasmids and primers used in this study
注:全部引物合成由上海捷瑞生物公司完成。
E.coliBL21(DE3)和BacillusmegateriumATCC 14581Invitrogen公司;質粒pET-28a(+)和pACYCDuet-1Novagen公司;工程菌E.coliBL21(DE3)ΔfadD+pACYCDuet-1-P450BM3+‘tesA,記作WX1本實驗室構建并保藏。WX1菌株攜帶質粒pACYCDuet-1,質粒上攜有脂肪酸羥化酶基因P450BM3和硫酯酶‘tesA基因,菌株為脂酰基輔酶A合成酶(fadD)基因敲除型。本研究所用的菌株、質粒及引物見表1。Pyrobest DNA聚合酶、T4 DNA連接酶、dNTP、感受態細胞制備試劑盒等Takara公司;限制性內切酶及膠回收試劑盒,質粒提取試劑盒等Omega公司;胰蛋白胨、酵母提取物及IPTG(異丙基硫代-β-D-半乳糖苷)等上海生工,其余實驗試劑國產分析純。LB液體培養基(g/L):1%蛋白胨,0.5%酵母提取物,1%NaCl。固體培養基為上述成分再加入2%瓊脂粉。M9培養基(g/L):2%葡萄糖,磷酸氫二鈉6 g/L,磷酸二氫鉀3 g/L,氯化銨1 g/L,氯化鈉0.5 g/L,硫酸鎂1 mmol/L。
LDZM-80KCS型蒸汽滅菌器、ZHWY-1102B恒溫搖床上海申安醫療器械廠;Aglient 7890A-5975C氣相色譜-質譜聯用儀美國Aglient Technologies公司;Mycycler 型PCR擴增儀、PowerPac Basic 核酸電泳儀、Gel Doc XR 凝膠成像系統美國Bio-Rad 公司;I-14型臺式離心機、Allegra X-22型冷凍離心機德國Beckman公司。
1.2實驗方法
1.2.1外源基因GDH的克隆及質粒的構建根據GenBank中巨大芽孢桿菌(Bacillusmegaterium)葡萄糖脫氫酶基因序列(GenBank:LK055286.1),設計合成PCR引物,并分別引入酶切位點NcoI和EcoR I。PCR反應條件為:預變性3 min,變性30 s,退火30 s,72 ℃延伸1 min,35個循環;72 ℃延伸10 min。PCR反應產物經1.2%瓊脂糖凝膠電泳檢測。
切膠回收后的GDH基因和pET-28a(+)質粒均采用NcoI和EcoR I酶切,將純化后的DNA片段與線性化的pET-28a(+)載體連接,轉化大腸桿菌感受態細胞。菌液PCR篩選陽性克隆,提取質粒,酶切鑒定并測序,獲得的重組質粒命名為pWX2。
1.2.2重組蛋白的誘導表達質粒pWX2轉化工程菌WX1感受態細胞,獲得的菌株命名為WX2。以1%接種量將WX2及E.coliBL21(DE3)菌株(對照)接種至添加相應抗生素的LB液體培養基中,恒溫振蕩培養至OD600為0.6,加入相應濃度IPTG(0.1 mmol/L),誘導蛋白表達15 h。4 ℃,10000 r/min離心15 min收集菌體,細胞超聲破壁后上清液即為粗酶液,用于SDS-PAGE蛋白電泳檢測。
1.2.3發酵條件工程菌株WX2搖瓶培養前,首先轉接到LB培養基中活化,活化后的菌體以1∶100的比例轉接至M9培養基的搖瓶中,并加入相應濃度的抗生素(卡那霉素:50 mg/L,氯霉素:34 mg/L),然后置于37 ℃恒溫搖床振蕩培養至OD600為2.0,加入IPTG(0.1 mmol/L)誘導基因表達,培養溫度降為30 ℃,以利于蛋白表達。菌體培養至指數后期,離心收獲菌體用0.2 mol/L磷酸鉀緩沖液(pH7.4)配成一定濃度菌懸液,同時補加葡萄糖(0.5%),30 ℃,180 r/min反應15 h。
1.2.4代謝產物處理及分析產物處理及檢測參考文獻[6],發酵液離心收集上清液,6 mol/L鹽酸調節上清pH至2.0,等體積氯仿抽提,取上層有機相加入甲酯化試劑(H2SO4/CH3OH),置于60 ℃水浴酯化反應30 min,等體積正己烷萃取三次,0.22 μm濾膜過濾后進行氣質檢測。利用安捷倫(Agilent)公司GC-7890A-5975C氣質聯用儀對產物進行定量和定性。色譜條件:HP-5毛細管柱(30 m×0.32 mm×0.25 μm);升溫程序:起始80 ℃,持續2 min,5 ℃/min升溫至250 ℃,保持10 min。加樣器和檢測器溫度分別為250、300 ℃。以羥基癸酸為內標進行定量。質譜條件:電子轟擊(EI)離子源;離子能量70 eV;離子源溫度220 ℃;掃描模式:全掃描;質量掃描范圍m/z 10~600。
2 結果與分析
2.1重組工程菌株的構建
將從Bacillusmegaterium基因組擴增出的片段連接到表達載體pET-28a(+)上獲得重組質粒,重組大腸桿菌進行菌液PCR鑒定,產物經瓊脂糖凝膠電泳鑒定,在800 bp處可見一條與預期大小相符條帶(圖1)。DNA序列分析顯示插入的基因片段與GenkBank中已報道的序列一致,二者的基因同源性為100%。表明目的基因已成功插入到pET-28a(+)表達載體上,所獲得的重組菌為陽性克隆。

圖1 GDH基因的菌液PCR鑒定Fig.1 PCR identification of GDH注:M:DNA marker DL2000;1-3:GDH PCR圖譜。
2.2蛋白誘導表達
將重組質粒pWX2轉化至WX1感受態細胞中,構建重組菌WX2。表達羥化酶P450BM3和脫氫酶GDH進行SDS-PAGE檢測,與對照菌株E.coliBL21(DE3)相比較,重組菌WX2在119和29 ku附近出現兩條明顯的特異蛋白條帶(圖2),兩條帶的大小與預測的一致。檢測結果表明,P450BM3和GDH基因在重組菌中均能正常表達。

圖2 P450BM3與GDH基因共表達菌株SDS-PAGE圖譜Fig.2 SDS-PAGE analyses of recombinant proteins P450BM3and GDH注:M:蛋白分子量標準;1:對照E.coli BL21(DE3); 2、3:WX2全蛋白表達。
2.3重組菌發酵條件優化
菌株發酵條件優化是提高產物產量的一種有效方法。為了進一步提高羥基脂肪酸產量,采用單因素優化法分別對葡萄糖濃度、轉化時間及反應體系pH進行了優化,發現在以10 g/L葡萄糖為碳源,轉化時間15 h,pH7.5時重組菌具有最大產量,在此條件下,重組菌WX2在搖瓶條件下可產生173.9 mg/L羥基脂肪酸。
2.4GDH基因表達對羥基脂肪酸產量的影響
大腸桿菌轉化葡萄糖生成HFAs過程會消耗NADPH,因此在HFAs的合成途徑中引入葡萄糖脫氫酶,可以平衡菌體內還原力,增加HFAs產量。在上述基因成功表達的基礎上,為驗證GDH基因過表達對E.coli產量的促進作用,分別將重組菌WX1和WX2接種至M9基本培養基中,測定細胞HFAs產量的變化情況。結果表明:菌株WX2發酵后HFAs產量為173.9 mg/L,是原始菌株產量的1.5倍(圖3)。這一結果證明在E.coli中表達葡萄糖脫氫酶后,對羥基脂肪酸產量有明顯的促進作用,提高了E.coli羥基脂肪酸合成能力。
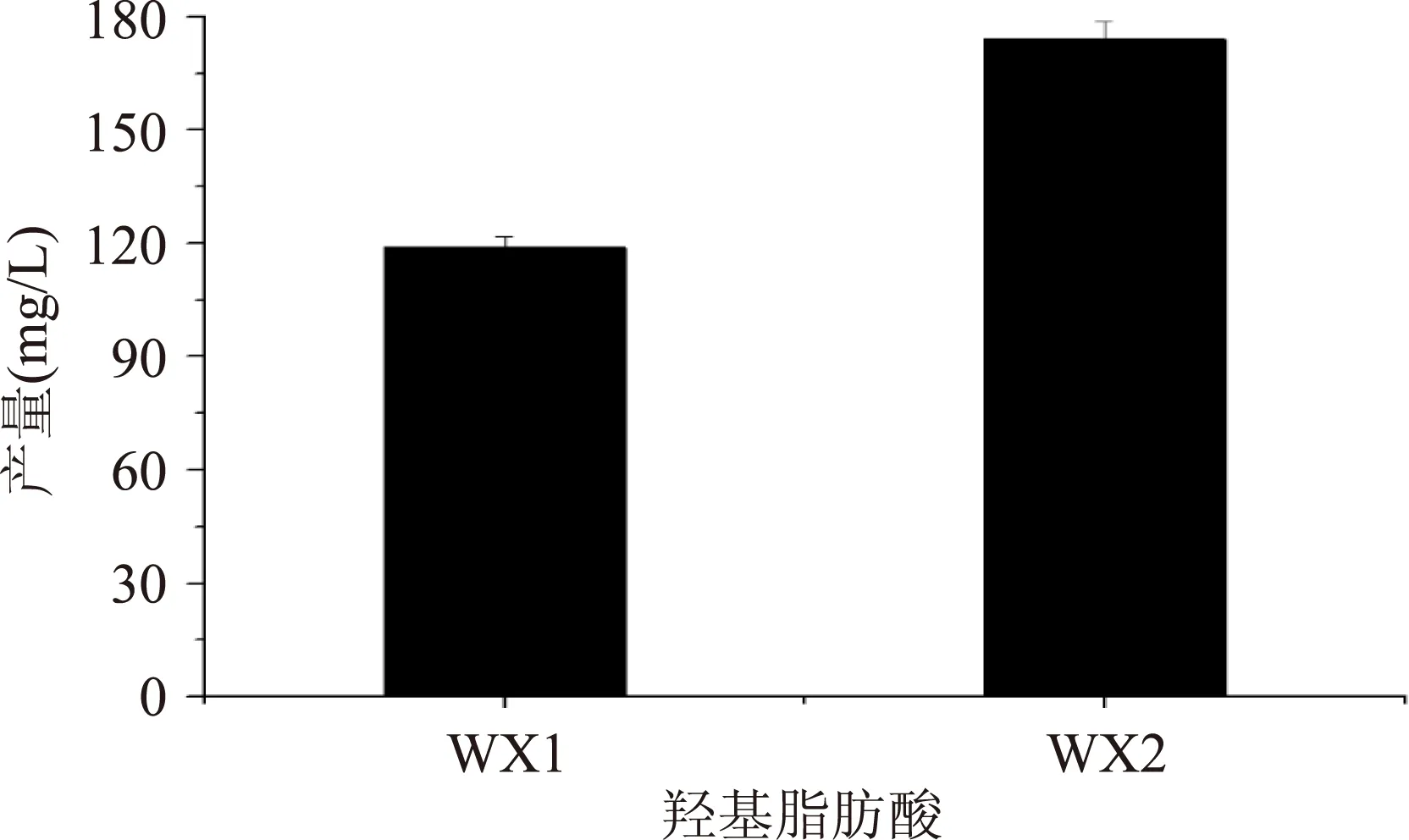
圖3 不同菌株羥基脂肪酸產量比較Fig.3 The HFA production of WX1 and WX2 from glucose
2.5GDH基因表達對羥基脂肪酸組成的影響
為進一步驗證GDH基因對羥基脂肪酸產物組成的影響,通過GC-MS方法對產物進行鑒定和定量分析,結果如圖4所示。工程菌株WX1和WX2產物均含有6種羥基脂肪酸,分別為ω-(1-3)羥基十二酸和ω-(1-3)羥基十四酸。其中,ω-(1-3)羥基十二酸在兩種工程菌種產物所占比例較少,含量在14.6%~17.5%之間,無明顯差異。在菌株WX1和WX2的產物ω-(1-3)羥基十四酸中,ω-1-C14∶0在HFA總量中所占比例最高,分別為32.8%和34.3%;ω-2-C14∶0和ω-3-C14∶0在HFA中所占比例差別不大,分別為28.6%、24.0%和27.8%、22.9%。上述結果表明來源于巨大芽孢桿菌的GDH基因的過量表達僅影響HFA產量而不能改變羥基脂肪酸的種類和組成。
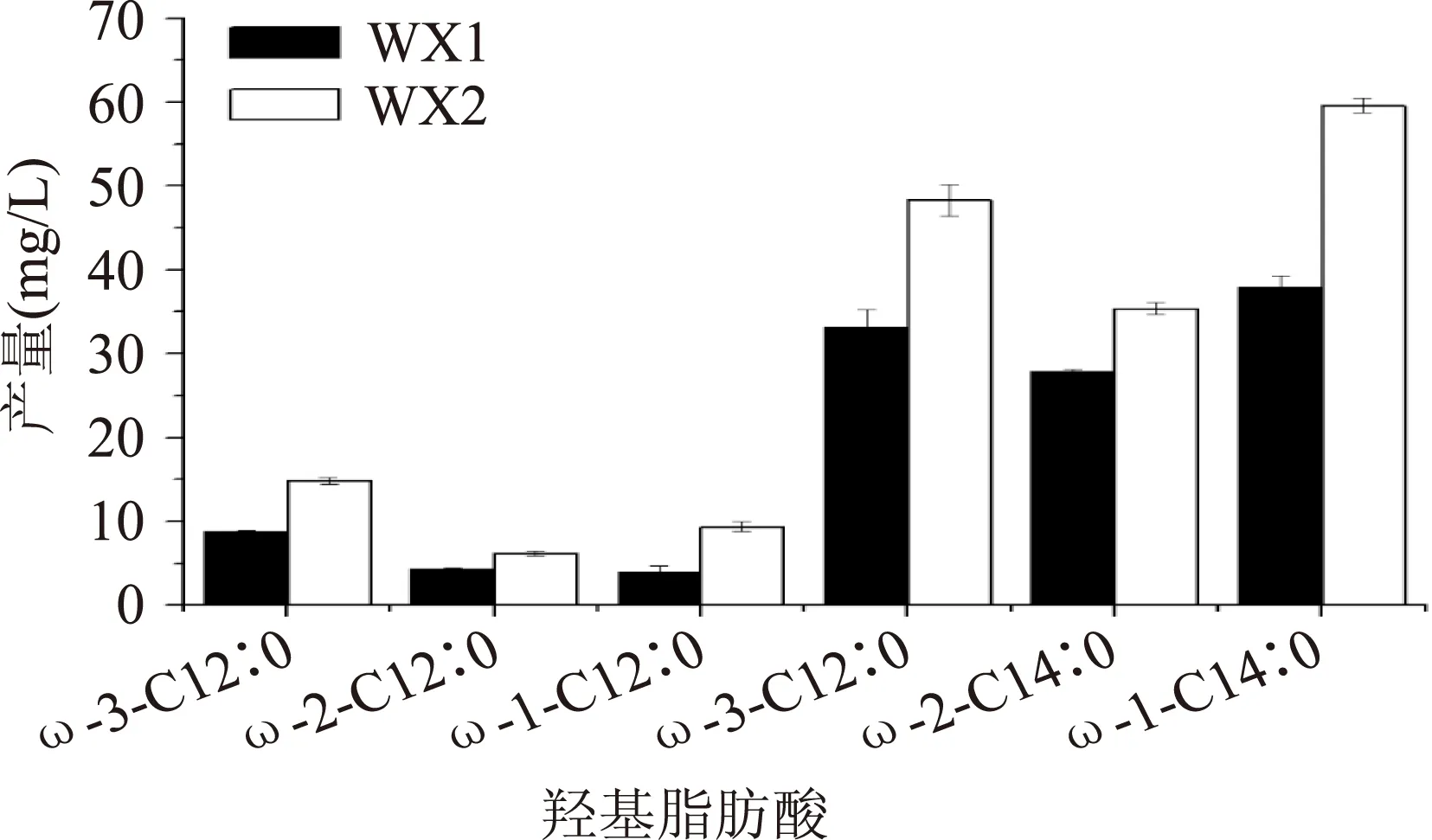
圖4 菌株WX1和WX2產物分布Fig.4 The HFA composition of WX1 and WX2
3 結論與討論
隨著傳統石化資源的日益枯竭,以生物基為原料,利用生物手段生產生物基化學品已成為近年的研究熱點[14-16]。與酵母、霉菌等相比,大腸桿菌具有遺傳背景清晰,易于工程調控,可高密度發酵及生長速度快等諸多優點,已成為微生物催化合成化學品和燃料的理想受體菌[17]。實驗中構建的工程大腸桿菌能轉化葡萄糖生產羥基脂肪酸,代表了羥基脂肪酸生物合成的一個新方向;本研究為解決合成過程中胞內輔酶再生問題,過量表達了來源于巨大芽孢桿菌的葡萄糖脫氫酶基因,以平衡細胞內還原力,經過發酵條件優化后,構建的工程菌株獲得了173.9 mg/L羥基脂肪酸產量,相比之前報道的原始菌株有了近1.5倍的提高[6],代表了生物轉化葡萄糖合成羥基脂肪酸的一個較高水平。相信在今后的研究中,通過尋找反應性更強的脫氫酶以及對E.coli進行進一步代謝工程改造,羥基脂肪酸產量有望得到進一步的改善和提高。同時需要指出的是,以葡萄糖為底物合成羥基脂肪酸目前研究較少,發酵產量也較低,現階段還未有工業化生產的可能。本文的研究結果可為工業化生產提供一些理論依據。
[1]翁佩芳,吳祖芳. 脂肪酸微生物轉化生產羥基脂肪酸的研究進展[J]. 中國糧油學報,2008,23(1):203-206.
[2]Kim K R,Oh D K. Production of hydroxy fatty acids by microbial fatty acid-hydroxylation enzymes[J]. Biotechnology advances,2013,31(8):1473-1485.
[3]Metzger J O. Fats and oils as renewable feedstock for chemistry[J]. European journal of lipid science and technology,2009,111(9):865-876.
[4]Liu C,Liu F,Cai J,et al. Polymers from fatty acids:poly(ω-hydroxyl tetradecanoic acid)synthesis and physico-mechanical studies[J]. Biomacromolecules,2011,12(9):3291
-3298.
[5]Yokota T,Watanabe A. Process for producing ω-hydroxy fatty acids[M]. Google Patents. 1993.
[6]Wang X,Li L,Zheng Y,et al. Biosynthesis of long chain hydroxyfatty acids from glucose by engineered Escherichia coli[J]. Bioresource Technology,2012,114:561-566.
[7]Bae J H,Park B G,Jung E,et al. fadD deletion and fadL overexpression in Escherichia coli increase hydroxy long-chain fatty acid productivity[J]. Applied microbiology and biotechnology,2014,98(21):8917-8925.
[8]Takeuchi M,Kishino S,Tanabe K,et al. Hydroxy fatty acid production byPediococcussp[J]. European Journal of Lipid Science and Technology,2013,115(4):386-393.
[9]Lu W,Ness J E,Xie W,et al. Biosynthesis of monomers for plastics from renewable oils[J]. Journal of the American Chemical Society,2010,132(43):15451-15455.
[10]Wallen L,Benedict R,Jackson R. The microbiological production of 10-hydroxystearic acid from oleic acid[J]. Archives of biochemistry and biophysics,1962,99(2):249-253.
[11]Kuo T M,Nakamura L K,Lanser A C. Conversion of fatty acids by Bacillus sphaericus-like organisms[J]. Current microbiology,2002,45(4):265-271.
[12]劉強,劉玉珍,劉東杰,等. 利用大腸桿菌工程菌株生物轉化脂肪酸的初步研究[M]. 中國糧油學報,2013,28(7):41-45.
[13]Lu Y,Mei L. Co-expression of P450 BM3 and glucose dehydrogenase by recombinant Escherichia coli and its application in an NADPH-dependent indigo production system[J]. J Ind Microbiol Biotechnol,2007,34(3):247-253.
[14]Steen E J,Kang Y,Bokinsky G,et al. Microbial production of fatty-acid-derived fuels and chemicals from plant biomass[J]. Nature,2010,463(7280):559-562.
[15]Liu X,Brune D,Vermaas W,et al. Production and secretion of fatty acids in genetically engineered cyanobacteria[J]. Proceedings of the National Academy of Sciences,2010,107(29):1-6.
[16]Lu X,Vora H,Khosla C. Overproduction of free fatty acids in E. coli:implications for biodiesel production[J]. Metabolic engineering,2008,10(6):333-339.
[17]Chu B C,Lee H. Genetic improvement of Saccharomyces cerevisiae for xylose fermentation[J]. Biotechnology advances,2007,25(5):425-441.
Effect of overexpression of glucose dehydrogenase on hydroxyfatty acids production ofEscherichiacoli
WANG Xiang-wei,XING Xiang,MA Qing-lin
(Marine college of Shandong University(Weihai branch),Weihai 264209,China)
A metabolic pathway to synthesize hydroxyfatty acids(HFAs)from glucose was constructed. But the reducibility(NADPH)imbalance hampers its application. In order to increase the yield of HFAs,the glucose dehydrogenase(GDH)from Bacillus megaterium was cloned and a NADPH and HFAs co-product strains was built to solve the reducibility imbalance in cell. Under shake-flask conditions,this recombinant strain produced 173.9 mg/L HFAs. The research laid the foundation in industrial applications for obtaining engineered Escherichia coli to produce HFAs with high production.
hydroxyfatty acids;glucose dehydrogenase;genetic engineering;recombinantEscherichiacoli
2015-06-03
王相偉(1980-),男,博士,主要從事生物基化學品的相關研究,E-mail:wangxw@qibebt.ac.cn。
威海市科技發展計劃(2014DXGJ40)。
TS201.3
A
1002-0306(2016)05-0163-04
10.13386/j.issn1002-0306.2016.05.023

