腸膜明串珠菌胞外多糖合成的蛋白組學分析
鄢明輝,吳正鈞
(1.乳業生物技術國家重點實驗室,光明乳業研究院,上海 200436;2.上海乳業生物工程技術研究中心,上海 200436)
?
腸膜明串珠菌胞外多糖合成的蛋白組學分析
鄢明輝1,吳正鈞2,*
(1.乳業生物技術國家重點實驗室,光明乳業研究院,上海 200436;2.上海乳業生物工程技術研究中心,上海 200436)
以高產胞外多糖的腸膜明串珠菌BD3749為材料,通過雙向電泳技術分析了產糖過程中的蛋白質組。結果表明,在產糖過程中有131個蛋白發生了明顯變化(2倍以上),其中25個蛋白有顯著改變(10倍以上)。初步的質譜鑒定表明,其中包含GH70家族的糖基轉移酶、絲氨酸/蘇氨酸蛋白激酶以及分子伴侶。腸膜明串珠菌胞外多糖的合成是一個復雜的過程,涉及眾多基因在蛋白水平的變化。
腸膜明串珠菌,胞外多糖,蛋白組,雙向電泳
乳酸菌(Lactic acid bacteria,LAB)是能夠發酵碳水化合物并產生大量乳酸的革蘭氏陽性、非芽孢菌的總稱,在食品中具有悠久的應用歷史,被廣泛應用于發酵制品、肉類制品及醫藥保健品等領域。腸膜明串珠菌(Leuconostocmesenteroides)是一種重要的工業用生產菌種,能夠利用蔗糖產生不同聚合度的右旋糖苷(Dextran),右旋糖苷可用作血漿代用品,用于出血性休克、創傷性休克及燒傷性休克等癥狀的治療。此外,明串珠菌還可產生的其他種類胞外多糖(EPS),如左旋糖苷(Levan)類型的果聚糖等,也被證實有重要的應用價值。雖然明串珠菌的胞外多糖在工業上得到廣泛應用,但其合成機制仍不十分清楚。隨著右旋糖苷及其他胞外多糖的廣泛應用,闡明明串珠菌中負責EPS合成的關鍵酶及調控機理,對于高效制備所需求類型的胞外多糖可以提供技術上的支持。目前已經在明串珠菌中鑒定的葡聚糖蔗糖酶(GS)包括右旋糖苷合成酶(Dextransucrase)和果聚糖合成酶(Levansucrase)等,并且有多個GS基因得到克隆并實現了原核表達,如dsrA,dsrB,dsrD,dsrS等[1-4]。但對于這些基因在明串珠菌細胞內的功能(invivofunction),以及在多糖合成過程中如何協同作用尚不清楚。
蛋白質組(proteome)的概念最先由Marc Wilkins提出,指由一個基因組(Genome)所表達的全套蛋白質(protein)。雙向凝膠電泳(Two-dimensional gel electrophoresis,2-DE)是蛋白質組學研究的核心技術,由O’Farrell等首次提出[5]。利用雙向電泳技術構建蛋白質表達圖譜,可以分離得到數以百計的蛋白質。乳酸菌中的蛋白質組學研究起步較晚,有研究者利用雙向電泳技術對乳桿菌及雙歧桿菌在酸性脅迫下的蛋白質組進行了研究[6-8]。國內張和平等利用蛋白雙向電泳技術對多株乳桿菌在脅迫條件下的蛋白質組進行了分析[9-10]。
腸膜明串珠菌BD3749(CGMCC10064)是一株從泡菜中分離獲得、能夠利用蔗糖合成大量胞外多糖的菌株,其產生的胞外多糖由不溶性的多糖以及水溶性的多糖組成。因其在胞外多糖產量及類型上的優勢,是研究乳酸菌胞外多糖合成的理想材料。鑒于上述分子克隆及原核表達在研究基因功能方面的局限性,本研究采用雙向電泳來分析腸膜明串珠菌產糖條件下的蛋白質組,尋找負責胞外多糖合成的糖基轉移酶,并通過優化培養及抽提條件,克服BD3749培養過程中產生的胞外多糖(水溶性及不溶性多糖)對總蛋白抽提及分析的影響。
1 材料與方法
1.1材料與儀器
腸膜明串珠菌BD3749由乳業生物技術國家重點實驗室提供;MRS 培養基(1 L)蛋白胨10 g,牛肉膏 5 g,酵母膏粉10 g,葡萄糖20 g,吐溫-80 1 g,K2HPO42 g,乙酸鈉 5 g,檸檬酸三銨 2 g,MgSO4·7H2O 0.2 g,MnSO4·4H2O 0.05 g;改良產糖培養基(1 L)蔗糖 20 g,蛋白胨 10 g,酵母提取物 5 g,K2HPO45 g;丙烯酸胺、Tris、SDS、TEMED、N,N'-甲叉雙丙烯酞胺、硝酸銀、三氯乙酸上海生工生物;尿素、硫脲、DTT、CHAPS、碘乙酰胺、考馬斯亮藍、IPG(Immobilized pH gradient)干膠條(18 cm、pI 4~7)美國Bio-rad公司;正丁醇、過硫酸胺、無水乙酸鈉、丙酮、EDTA、Na2S2O3、Na2CO3等;蛋白裂解液PL039及蛋白質定量試劑盒SK3031上海生工。
SDS-PAGE電泳儀Bio-rad公司;等電聚焦儀、Ettan DALT Twelve system 裝置、Image Scanner 掃描儀及 Image Master 5. 0 圖像分析系統美國GE公司;TGL-168 低溫離心機德國 Eppendorf 公司。
1.2實驗方法
1.2.1用于蛋白分析的培養條件的改良參考Jun等人的工作[11],對用于蛋白質分析的培養條件做了改良。使用20 g/L蔗糖、不加Ca2+的培養條件,產糖量顯著降低,以便于后續的蛋白電泳分析。
1.2.2BD3749生長曲線測定及生長情況比較挑取MRS平板上活化的BD3749單菌落,轉接至新鮮MRS液體中培養12 h后按1∶50轉接至改良產糖培養基中(對照組以相同濃度的葡萄糖替代蔗糖),30 ℃搖床培養。期間每隔2 h取樣測定OD600,每組取三個重復。同時取樣經梯度稀釋后涂布于MRS平板,置于厭氧箱中培養48 h后進行菌落計數。通過所得的活菌數量繪制生長曲線,比較添加葡萄糖和蔗糖條件下BD3749的生長情況。
1.2.3樣品蛋白提取MRS液體中培養12 h的種子,以1∶50轉接至50 mL改良產糖培養基中,30 ℃搖床培養12 h后離心收集到菌體,所得樣品以0.5 mol/L NaOH洗三遍去除不溶性多糖,所得菌體沉淀中加入1 mL蛋白裂解液,100 W超聲破碎,超聲2 s間歇5 s,共3 min,超聲結束后4 ℃,12000 r/min離心30 min,獲得上清液,加入1 mL預冷丙酮,-20 ℃過夜。4 ℃,12000 r/min離心30 min,去除上清,待沉淀揮干丙酮后加入500 μL蛋白裂解液。使用 Bradford 法蛋白質濃度測定試劑盒對所得蛋白提取液進行濃度測定,具體步驟參照使用說明書。
1.2.4雙向電泳
1.2.4.1等電點聚焦(IEF)取1.2.2中所得總蛋白樣品150 μg,選用pH4~7 NL IPG預制干膠條,進行第一向等電聚焦,電泳參數見表1。

表1 等電聚焦電泳參數Table 1 Isoelectric focusing(IEF)parameters
1.2.4.2膠條平衡將聚焦完成的膠條加2D Equilibration Buffer(加1% DTT)10 mL,搖床平衡15 min。清洗膠條,加入2D Equilibration Buffer(加2.5% IAA),搖床平衡15 min。
1.2.4.3SDS-PAGE將平衡后的膠條放入凝膠板中,加入低熔點瓊脂糖封膠液(0.5%低熔點瓊脂糖+電泳緩沖液),室溫靜置20 min后開始第二向電泳。第二向SDS-PAGE凝膠濃度為12.5%,電泳參數設定為:100 V/膠,電泳45 min;200 V/膠,至溴酚藍離膠下沿0.5 cm處停止;冷循環設定溫度為15 ℃。電泳結束后,輕輕撬開兩層玻璃,取出凝膠進行染色。
1.2.4.4凝膠染色凝膠采用銀染試劑盒進行染色,具體操作如下:水洗5~10 min,固定30 min,10%乙醇洗兩遍,每遍5 min,水洗兩遍,每遍5 min,敏化1 min,水洗兩遍,每次1 min,銀染20 min,水洗凝膠兩次,每次30 s,顯影5 min后拍照分析。
1.2.4.5凝膠圖像掃描對脫色結束的聚丙烯酰胺凝膠進行掃描,分辨率為300 dpi。使用PDquest 8.0軟件對圖像進行分析。
2 結果與分析
2.1用于蛋白分析的培養條件改良
BD3749是一株高產胞外多糖的腸膜明串珠菌,在含200 g/L蔗糖的產糖培養基中產生大量胞外多糖,使得菌體分離和蛋白提取非常困難。在Jun等人的研究基礎上[11],對產糖過程進行了優化,目的是在不明顯影響糖基轉移酶誘導效果的前提下,降低胞外多糖的產量。粗多糖測定表明,采用改良后的培養條件(含20 g/L蔗糖),BD3749總多糖的產量降低到5 g/L以下。
作為雙向電泳的預實驗,同時檢測上述條件優化對于總蛋白分析的改善效果,對上述條件下的培養物進行了菌體總蛋白SDS-PAGE分析,如圖1所示。結果表明,優化后的條件下,胞外多糖對于蛋白質分析的影響已經基本去除,SDS-PAGE分析能夠得出清晰的蛋白條帶。

圖1 優化后的條件下BD3749菌體總蛋白SDS-PAGE結果Fig.1 SDS-PAGE of total protein of BD3749 cultivated under the optimized condition 注:S1,S2為BD3749在兩種不同產糖條件(振蕩培養和靜置) 下的總蛋白樣品,右側為蛋白分子量標尺。
2.2不同條件下BD3749的生長情況比較
在上述實驗結果的基礎上,選擇20 g/L蔗糖條件來分析產糖過程中的蛋白表達差異。因為BD3749的胞外多糖合成主要是以蔗糖作為底物,同樣條件的葡萄糖培養物基本不合成胞外多糖,因此,以20 g/L的葡萄糖作為對照組。
為了避免不同培養條件菌體生長差異對蛋白分析的干擾,對BD3749分別在20 g/L葡萄糖和20 g/L蔗糖培養基中的生長情況進行了比較,如圖2所示。OD600值測定表明,BD3749在蔗糖培養基中能夠更快地積累生物量,這很大程度上是由于合成的胞外多糖。而菌體總蛋白濃度的結果表明,葡萄糖和蔗糖培養物中菌體生長速度相當(葡萄糖和蔗糖條件下同體積培養物所得的蛋白濃度相差不大)。

圖2 BD3749在葡萄糖和蔗糖培養基中的生長情況Fig.2 Growth of BD3749 in medium containing glucose(Glc)or sucrose(Suc)
2.3產糖條件下蛋白組的雙向電泳分析
分別取BD3749在上述優化條件下的對數期培養物50 mL進行菌體總蛋白抽提,所得總蛋白經Bradford法定量后進行雙向電泳,經銀染后所得結果如圖3所示。
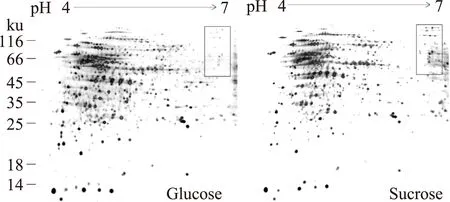
圖3 BD3749產糖條件下的雙向電泳分析Fig.3 2-D gel electrophoresis of BD3749 total protein
雙向凝膠電泳結果表明,葡萄糖和蔗糖培養條件下的菌體總蛋白的蛋白點吻合率在90%以上。PDquest 8.0 軟件分析表明,蔗糖和葡萄糖兩種條件下有明顯差異(差異在2倍以上)的蛋白點為131個,其中差異倍數在10倍以上的蛋白點為25個。
2.4差異表達的蛋白分析
在上述差異表達的蛋白點中,重點關注是BD3749的糖基轉移酶。已有的研究表明,腸膜明串珠菌中負責胞外多糖合成的主要是葡聚糖蔗糖轉移酶(Glucansucrase,屬于GH70家族),而已發現的GH70家族的糖基轉移酶分子量都很大,在180 ku以上[3,12]。同時,如圖3所示,雙向電泳結果表明,產糖過程中明顯上調的蛋白點主要分布于較高分子量、中性蛋白區域(圖3中右上角部分)。因此,對大分子量的差異蛋白(圖3中右上角方框中部分)進行了重點分析。通過對上述蛋白斑點(5個高分子量的斑點)進行質譜分析(代表性肽譜圖如圖4所示),除了GH70家族的糖基轉移酶以外,鑒定除了包含檸檬酸合成酶、絲氨酸/蘇氨酸蛋白激酶和分子伴侶在內的一系列差異表達的蛋白質,如表2所示。
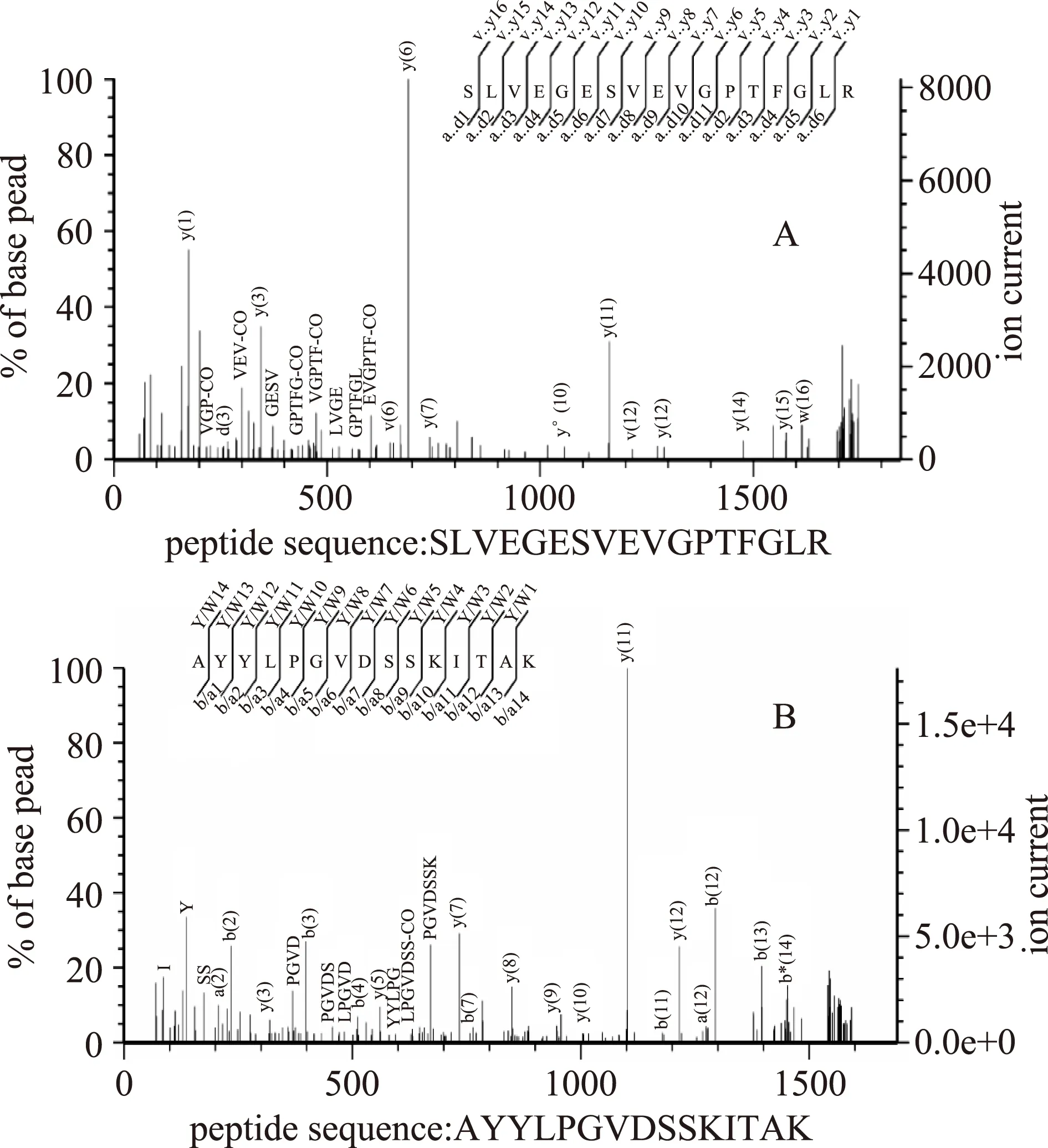
圖4 代表性肽指紋圖譜Fig.4 Representative peptide fingerprinting map 注:A圖中譜圖對應的肽段N-SLVEGESVEVGPTFGLR-C, 匹配到的蛋白為gi|517441595,B圖中譜圖對應的肽段 N-AYYLPGVDSSKITAK-C,匹配到的蛋白為gi|499999644。
胞外多糖的合成及調控是一個復雜的生物學過程,其中可能涉及到對環境中的信號(如誘導物蔗糖)的感知及信號轉導、多糖合成相關的基因表達調控以及糖基轉移酶加工及分泌等環節。蛋白組分析結果表明,雙組份信號系統相關的絲氨酸/蘇氨酸蛋白激酶KFRI-MG_1289在產糖過程中顯著上調,同
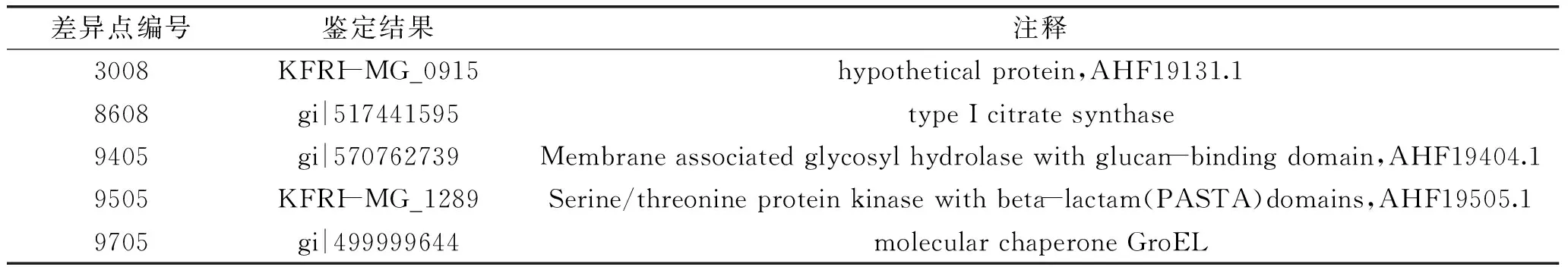
表2 差異蛋白的質譜鑒定結果Table 2 MASS analysis of differentially expressed proteins
時,GH70家族的糖基轉移酶AHF19404.1也發生顯著上調。同時,分子伴侶GroEL也顯著上調,提示其可能在多糖合成相關酶的加工及分泌中發揮功能。此外,檸檬酸合酶的表達量也發生變化,這可能與不同碳源導致的細胞內代謝差異有關。
此外,除了上述已經成功鑒定的蛋白,差異蛋白中可能還包括了對這些糖基轉移酶的表達進行調控的轉錄因子,對這些轉錄因子的鑒定有望進一步解釋胞外多糖合成的調控機制。因此,更多的差異蛋白點的鑒定工作還在進行中。
3 結論與展望
對腸膜明串珠菌BD3749產糖過程的總蛋白進行了雙向電泳分析,從中找到大量在產糖過程中發生顯著改變的蛋白點,通過質譜分析對其中的5個大分子量差異蛋白進行了鑒定,其中包括GH70家族的糖基轉移酶、絲氨酸/蘇氨酸蛋白激酶以及分子伴侶。
本研究以高產胞外多糖的腸膜明串珠菌BD3749作為材料,通過雙向電泳技術分析了其產糖過程的蛋白質組,得到了產糖過程中顯著改變的25個蛋白斑點,并已成功地對其中的5個高分子量的斑點進行了鑒定。為了進一步闡述產糖過程的調控機制,正在對其他的差異斑點進行鑒定,這些結果將進一步揭示糖基轉移酶基因的轉錄調控機理,從而對產糖相關的基因表達調控有更全面的認識,為通過基因工程手段改良腸膜明串珠菌產糖特性提供理論支撐。
[1]Monchois V,Remaud-Simeon M,Russell RR,et al. Characterization of Leuconostoc mesenteroides NRRL B-512F dextransucrase(DSRS)and identification of amino-acid residues playing a key role in enzyme activity[J]. Appl Microbiol Biotechnol,1997,48(4):465-472.
[2]Neubauer H. Molecular characterization and expression analysis of the dextransucrase DsrD of Leuconostoc mesenteroides Lcc4 in homologous and heterologous Lactococcus lactis cultures[J]. Microbiology,2003,149(4):973-982.
[3]van Hijum S A,Kralj S,Ozimek L K,et al.,Structure-function relationships of glucansucrase and fructansucrase enzymes from lactic acid bacteria[J]. Microbiol Mol Biol Rev,2006,70(1):157-176.
[4]Fraga Vidal R,Claire Moulis,Pierre Escalier,et al. Isolation of a gene from Leuconostoc citreum B/110-1-2 encoding a novel dextransucrase enzyme[J]. Curr Microbiol,2011,62(4):1260-1266.
[5]O’Farrell P. High resolution two-dimensional electrophoresis of proteins[J]. J Biol Chem,1975,250(10):4007-4021.
[6]Aurélie Budin-Verneuil,Vianney Pichereau,Yanick Auffray,et al. Proteomic characterization of the acid tolerance response in Lactococcus lactis MG1363[J]. Proteomics,2005,5(18):4794-4807.
[7]Borja Sánchez,Marie-Christine Champomier-Vergès,María del Carmen Collado,et al. Low-pH adaptation and the acid tolerance response of Bifidobacterium longum[J]. Applied Environment Microbiology,2007,73(20):6450-6459.
[8]Maria De Angelis,Marco Gobbetti. Environmental stress responses in Lactobacillus:A review[J]. Proteomics,2004,4(1):106-122.
[9]烏日娜,張和平,孟和. 干酪乳桿菌蛋白質雙向電泳條件優化及圖譜建立[J]. 食品與生物技術學報,2009,28(5):598-602.
[10]烏日娜,張和平. 益生菌LactobacilluscaseiZhang在酸脅迫下的蛋白質組學研究[J]. 食品與發酵工業,2012,38(7):17-20.
[11]Jun Liu,Jianguang Luo,Hong Ye,et al. Medium optimization and structural characterization of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohydrate Polymers,2010,79(1):206-213.
[12]Maher Korakli,Rudi F Vogel. Structure/function relationship of homopolysaccharide producing glycansucrases and therapeutic potential of their synthesised glycans[J]. Appl Microbiol Biotechnol,2006,71(6):790-803.
[13]Wackett L P. Microbial exopolysaccharides[J]. Environmental Microbiology,2009,11(3):729-730.
Proteomic analysis of EPS synthesis ofLeuconostocmesenteroides
YAN Ming-hui1,WU Zheng-jun2,*
(1.State Key Laboratory of Dairy Biotechnology,Bright Dairy Research Institute,Shanghai 200436,China;2.Shanghai Engineering Research Center of Dairy Biotechnology,Shanghai 200436,China)
The proteome ofLeuconostocmesenteroidesBD3749,a strain with large amount of exopolysaccharides(EPS),was analyzed with 2-D gel electrophoresis. The results showed that during the process of EPS production,131 proteins were obviously changed by 2 folds,among which 25 proteins were dramatically changed by 10 folds. MASS analysis of the differential protein dots showed that glycosyltransferases of GH70 family,as well as chaperones were up-regulated in the process of EPS production. These results indicated that EPS synthesis was a complicated process which involved the regulation of many genes.
Leuconostocmesenteroides;exopolysaccharides(EPS);proteomics;2-D gel electrophoresis
2015-12-29
鄢明輝(1985-),男,博士,研究方向:乳酸菌,E-mail:yanminghui@brightdairy.com。
吳正鈞(1966-),男,高級工程師,研究方向:乳業生物技術,E-mail:wuzhengjun@brightdairy.com。
“十二五”國家科技支撐計劃課題(2013BAD18B01)。
TS252.54
A
1002-0306(2016)14-0158-04
10.13386/j.issn1002-0306.2016.14.023

