HPV16 E5、E6和E7基因重組慢病毒載體的構建及其感染口腔上皮細胞
項先旺,江 彤,陳傳俊,3
?
HPV16 E5、E6和E7基因重組慢病毒載體的構建及其感染口腔上皮細胞
項先旺1,江 彤2,陳傳俊1,3
目的 分別構建HPV16 E5、E6和E7癌基因的重組慢病毒載體感染人口腔上皮細胞,為研究E5基因對口腔上皮細胞的致癌機制奠定基礎。方法 克隆HPV16 E5、E6和E7基因,分別構建pLVX-AcGFP-E5、pLVX-AcGFP-E6和pLVX-AcGFP-E7重組慢病毒載體,與包裝質粒共轉染293T細胞。收集3種慢病毒上清液,分別感染口腔上皮細胞、腺嘌呤素篩選感染細胞,RT-PCR和Western blot法檢測目的基因的表達。結果 成功構建pLVX-AcGFP-E5、pLVX-AcGFPE6和pLVX-AcGFP-E7重組慢病毒載體,獲得3種慢病毒上清液,篩選得到3個穩定的細胞株。RT-PCR和Western blot均可檢測到HPV16 E5、E6和E7基因在口腔上皮細胞內表達。結論 本研究構建的3個重組慢病毒載體能成功感染口腔上皮細胞。
人乳頭狀瘤病毒;HPV16癌基因;慢病毒載體;口腔上皮細胞
網絡出版時間:2016-6-6 13:52:31 網絡出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.010.html
人乳頭狀瘤病毒(human papillomavirus,HPV)是宮頸癌發生的主要致病因子。大量的流行病學調查資料顯示,HPV也與口腔癌的發生密切相關[1-2]。目前關于HPV與口腔癌關系的研究主要集中于對高危型HPV E6和E7基因的研究,它們都可與腫瘤抑制物結合并使其失活[3]。實際上,HPV E5基因有其特殊的生物活性,與腫瘤的發生關系同樣非常密切。E5基因可抑制細胞的凋亡,導致細胞周期異常,甚至還能增強E6和E7基因對細胞的惡性轉化作用[4-5]。Schiffman et al[6]比較不同型別HPV全基因組序列發現,有生物活性的E5基因總是存在于引起惡性腫瘤的高危型HPV基因組中,說明E5基因在HPV致癌過程中可能發揮著至關重要的作用。因此,深入研究HPV E5基因的功能及其致癌性,可能是進一步了解HPV致癌機制的重要突破口。該研究擬構建HPV16 E5、E6和E7基因重組慢病毒載體,感染口腔上皮細胞,以期為研究高危型HPV E5基因在口腔上皮細胞癌的致病機制奠定基礎。
1 材料與方法
1.1材料
1.1.1樣本采集 感染HPV16的口腔癌病理標本由本實驗室保存,取自臨床腫瘤組織;無菌口腔黏膜標本則取自安徽醫科大學第三附屬醫院小兒唇腭裂術中多余上皮。
1.1.2菌種及載體 大腸桿菌DH5α由本實驗室保存;克隆載體pGEM-Teasy Vector購自美國Promega公司;慢病毒核心質粒pLVX-AcGFP-N1購自上海吉凱公司;慢病毒包裝質粒psPAX2、pMD2G購自美國Addgen公司。
1.1.3酶與試劑 反轉錄試劑盒、各種限制性內切酶、Taq DNA聚合酶、T4 DNA連接酶、Prime Script TM RT reagent Kit with gDNA Eraser等工具酶均購自日本TaKaRa公司;脂質體Lipofectamine 2000、無血清培養基Defined Keratinocyte-SFM、分散酶DispaseⅡ、嘌呤霉素購自美國Life Technologies公司;293T細胞購自美國ATCC公司;質粒抽提試劑盒購自美國OMEGA公司;一抗(Mouse Anti-GFP)、二抗(Goat Anti Mouse)、hexadimethrine bromide、DMEM、胎牛血清購自美國Sigma公司。
1.2方法
1.2.1HPV16 E5、E6和E7基因的克隆及3個慢病毒載體的構建 根據本實驗室已報道的HPV16 (GenBank登錄號:KC935953)序列,分別設計擴增E5、E6和E7特異性引物,見表1。上游引物5′端引入EcoR I位點,下游引物5′端引入BamH I位點。提取感染HPV16腫瘤標本的總DNA,PCR擴增條件為:94℃ 30 s、57℃ 30 s、72℃ 14 s,30個循環。PCR產物進行0.8%瓊脂糖凝膠電泳,回收目的DNA片段。EcoR I和BamH I雙酶切純化的目的片段,與同樣雙酶切的慢病毒載體pLVX-AcGFP-N1連接,轉化大腸桿菌DH5α。PCR篩選陽性克隆,測序驗證重組慢病毒載體 pLVX-AcGFP-E5、pLVX-AcGFP-E6和pLVX-AcGFP-E7攜帶的E5、E6和E7基因序列是否發生突變。

表1 引物序列
1.2.2重組慢病毒的包裝 分別將3個重組質粒與包裝質粒psPAX2和pMD2G共轉染293T細胞,48 h后收集病毒上清液,濃縮后分裝保存于-80℃冰箱。
1.2.33種慢病毒滴度測定 逐步稀釋法測定3種慢病毒滴度,分別在96孔板中接種293T細胞,第2天用完全培養基按(1~10-9)10個梯度稀釋病毒液,每孔加入100 μl稀釋后的病毒液,每個梯度設置3個重復;48 h后觀察細胞中GFP的表達,若10-8梯度孔中分別有2、3和4個細胞GFP(+),則取平均值,此病毒滴度為3×108TU/ml。
1.2.4口腔上皮細胞的原代及傳代培養 將無菌口腔黏膜標本置于2 mg/ml DispaseⅡ中,4℃消化過夜。次日,用眼科鑷分離獲取上皮層并用剪刀將其剪成1 mm×1 mm大小,胰酶消化10 min,含10%胎牛血清的DMEM中止消化。1 000 r/min離心10 min,棄上清液,加入Defined Keratinocyte-SFM培養基重懸細胞。以1×104個/cm2接種到35 mm的培養皿中,37℃5%CO2培養箱中培養,當細胞鋪滿瓶底的70%~80%時,按1∶3的比例進行傳代培養。
1.2.5獲得穩定感染的細胞株 取P1代口腔上皮細胞接種至6孔板,待細胞融合度約70%時,換液,每孔分別加入pLVX-AcGFP-E5、pLVX-AcGFP-E6和pLVX-AcGFP-E7慢病毒100 μl,并在每孔中加入終濃度為8 μg/ml的ploybrene,隔天換液,加入終濃度為2 μg/ml嘌呤霉素,培養2周,即可得到穩定感染的細胞株。
1.2.6RT-PCR檢測E5、E6和E7基因mRNA表達水平 分別取pLVX-AcGFP-E5、pLVX-AcGFP-E6和 pLVX-AcGFP-E7慢病毒穩定感染的口腔上皮細胞株。各提取細胞總 RNA,反轉錄 cDNA第一鏈。以cDNA為模板,RT-PCR檢測E5、E6和E7。
1.2.7Western blot檢測E5、E6和E7蛋白表達水平 收集穩定感染HPV16 E5、E6和E7基因的口腔上皮細胞株,PBS洗3次,加入細胞裂解液200 μl,冰上孵育3 min;將細胞收集到500 μl EP管中,置于冰上繼續裂解20 min,12 000 r/min、4℃離心30 min;加入5×SDS-PAGE上樣緩沖液,100℃變性5 min;取30 μg樣品總蛋白進行10%SDS-PAGE電泳,蛋白電轉至PVDF膜上;5%脫脂奶粉液封閉2 h,加入Anti-GFP一抗,室溫孵育2 h;TBST洗膜4次,再加入二抗,室溫孵育1.5 h;TBST洗膜10次,加入新配置的Western blot化學顯色劑進行顯色,5 min后拍照分析。
2 結果
2.1目的基因的擴增 以感染HPV16腫瘤組織的總DNA為模板,分別用3對特異性引物進行PCR擴增,可以擴增出3條約250、500、300 bp的特異性條帶,條帶大小與預期結果相符。見圖1。
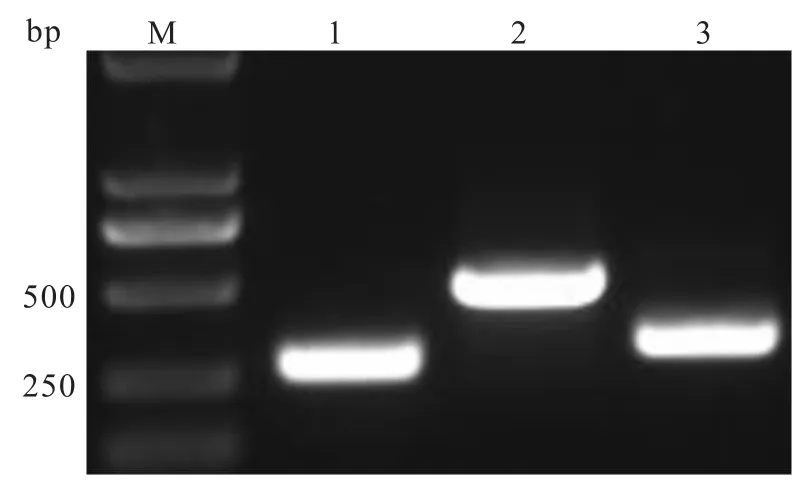
圖1 HPV16 E5、E6和E7基因的PCR產物
2.2重組慢病毒載體酶切和測序驗證 重組慢病毒載體pLVX-AcGFP-E5、pLVX-AcGFP-E6和pLVXAcGFP-E7經雙酶切體系驗證,酶切片段大小符合理論值。說明插入的E5、E5和E6基因讀碼框正確。測序進一步驗證插入的基因序列未發生突變。見圖2。
2.3重組慢病毒滴度的測定 3種慢病毒pLVXAcGFP-E5、pLVX-AcGFP-E6和pLVX-AcGFP-E7分別感染293T細胞,逐步稀釋法測定滴度,分別為3 ×108、2×108、2×108TU/ml。
2.4口腔上皮細胞的原代及傳代培養 原代培養6~7 d,上皮細胞開始增殖,15~20 d細胞開始融合,融合的口腔上皮細胞為不規則多邊形,呈鋪路石樣結構排列。見圖3。
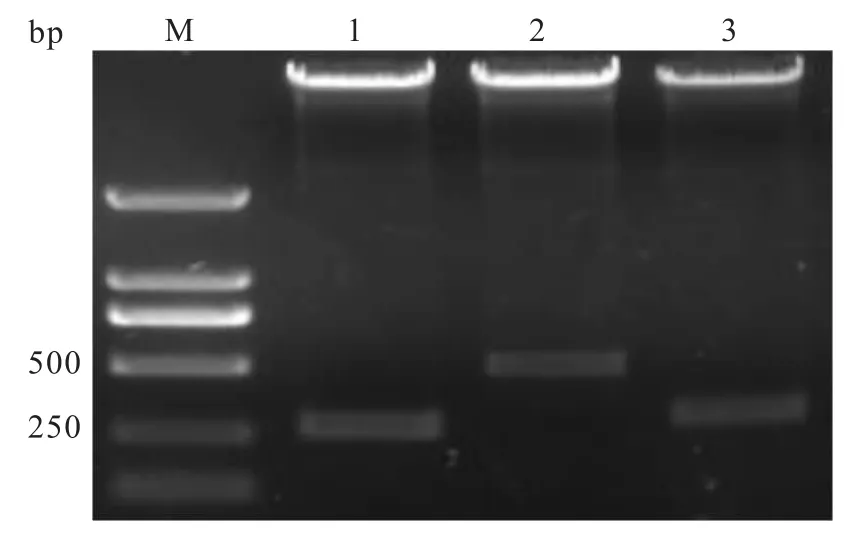
圖2 重組慢病毒質粒的EcoRⅠ和BamHⅠ雙酶切鑒定

圖3 P1代口腔上皮細胞形態
2.5RT-PCR和Western blot檢測目的基因的表達 倒置顯微鏡下觀察顯示,慢病毒pLVX-AcGFPE5、pLVX-AcGFP-E6和 pLVX-AcGFP-E7轉染的口腔上皮細胞均有綠色熒光蛋白表達,說明3種慢病毒均可轉染口腔上皮細胞。見圖4。RT-PCR檢測表明,在轉染3種慢病毒的口腔上皮細胞中,均可擴增出特異性條帶,大小分別約為250、500、300 bp。見圖5。Western blot檢測顯示,在轉染3種慢病毒的口腔上皮細胞中,均檢測出特異性條帶,大小分別約為37、46、39 kDa,與理論大小相符。上述檢測結果表明,E5、E6和E7蛋白在口腔上皮細胞中均能成功表達,見圖6。
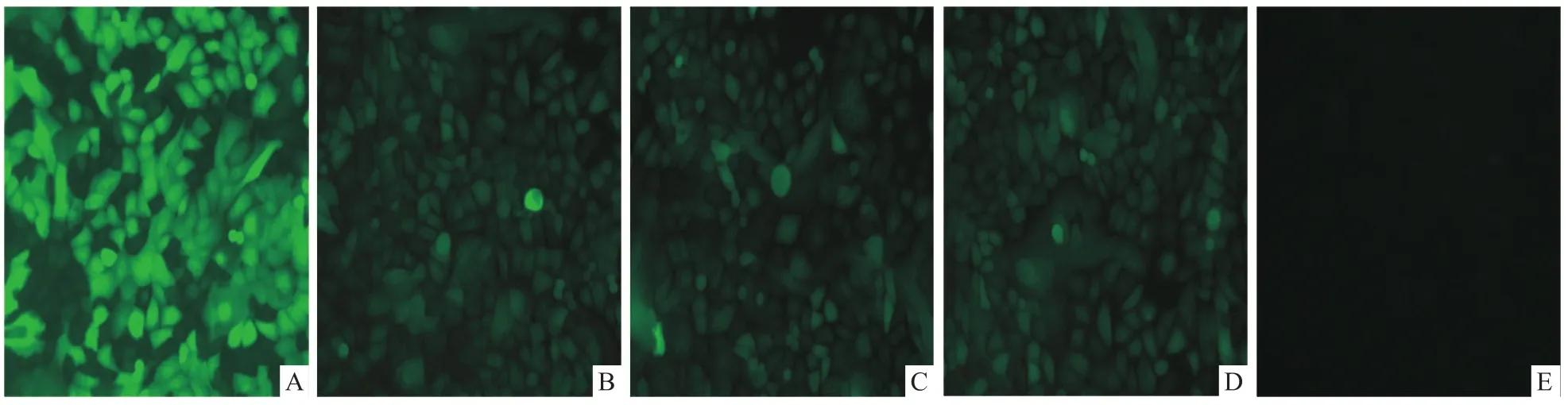
圖4 穩定轉染慢病毒的口腔上皮細胞 ×100
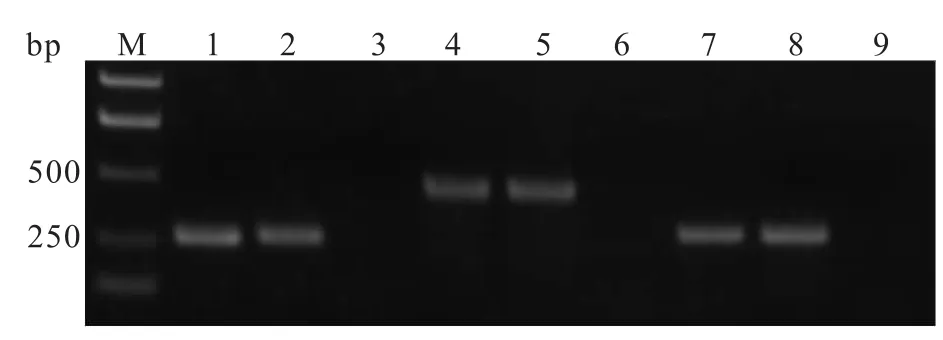
圖5 穩定轉染慢病毒口腔上皮細胞總RNA反轉錄產物PCR檢測
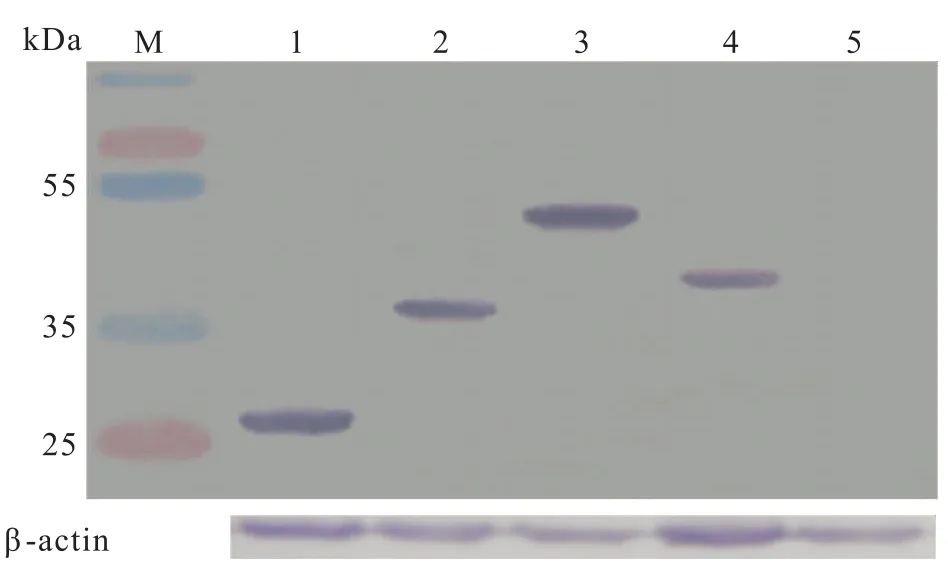
圖6 穩定轉染慢病毒的口腔上皮細胞Western blot檢測GFP表達
3 討論
Sdek et al[7]利用HPV16 E6和E7基因轉染人正常口腔上皮細胞引起永生化,與HPV16在宮頸癌的致病機制不同是他檢測到腫瘤抑制物p53上調,提示高危型HPV引起口腔癌的機制可能與宮頸癌不同,但其未做進一步研究,尤其缺乏對HPV16致癌基因E5的研究。本課題組前期研究[8]顯示HPV16 E5基因可在一定程度上促進人永生化口腔上皮細胞增殖,并對E6和E7基因mRNA表達量有一定的間接上調作用。值得注意的是,HPV16 E5蛋白分子量為10 ku,是由83個氨基酸構成的疏水性膜聯合蛋白,隨著后期病毒DNA的整合,E5基因會發生缺失,提示在相關腫瘤形成的早期階段發揮重要作用[9]。E5蛋白可以與各種膜蛋白發生相互作用,主要與表皮生長因子受體(epidermal growth factor receptor,EGFR)結合并增強其活性,誘導細胞過度增生和抑制細胞凋亡,使一系列原癌基因過度表達[10]。動物實驗[11]表明注射重組腺病毒HPV16 E5疫苗或細胞毒性T淋巴細胞E5肽和CpG寡核苷酸可顯著降低腫瘤的生長。Hu et al[12]證實HPV16 E5蛋白能介導細胞融合,而細胞融合可充分誘導染色體不穩定,從而使癌基因表達和細胞周期異常,導致腫瘤,HPV16 E5與E6和E7共表達時能促進這些雙核細胞繁殖,也能增加雙核細胞的形成率。研究高危型HPV E5基因對口腔上皮致癌性對口腔癌的防治有重要的指導價值和實踐意義。
本實驗選用的口腔上皮樣本材料來自于小兒唇腭裂術中多余口腔上皮,增殖能力較好,原代口腔上皮細胞可傳代培養 4~5代。文獻[13]顯示隨著年齡的增加,口腔上皮細胞傳代次數減少,成人的口腔上皮細胞只能傳至2~3代。同時本研究也表明P1代和P2代口腔上皮細胞與原代細胞生物學性狀接近,后隨著傳代次數增加,部分細胞形態發生改變,細胞增殖減慢,融合時間延遲,細胞逐漸凋亡。
慢病毒載體是以人類免疫缺陷Ⅰ型病毒為基礎發展起來的病毒載體[14-15]。慢病毒核蛋白質前整合復合物有噬核特性,從而使慢病毒對分裂細胞和非分裂細胞均有感染能力,對于一些較難轉染的細胞,如原代細胞、干細胞、不分化的細胞等,可以將外源基因有效地整合到宿主染色體上,從而達到穩定持久性表達。其次,慢病毒還有初次感染后即喪失繼續感染的能力,有安全性好、不易誘發宿主免疫反應、感染效率高等特點。在體外實驗及體內實驗的研究中,慢病毒己經成為表達外源基因或外源shRNA的常用載體形式之一,并且正在獲得越來越廣泛的應用。
本研究選擇慢病毒載體,應用分子生物學技術,成功構建了慢病毒載體pLVX-AcGFP-E5、pLVXAcGFP-E6和pLVX-AcGFP-E7,均能感染口腔上皮細胞,RT-PCR和 Western blot均能檢測E5、E6和E7蛋白在口腔上皮細胞中表達,為后續3種慢病毒單獨感染或共感染口腔上皮細胞,闡明HPV16 E5基因與口腔癌的相關性奠定基礎。
[1]Herrero R,Castellsagué X,Pawlita M,et al.Human papillomavirus and oral cancer:the international agency for research on cancer multicenter study[J].J Natl Cancer Inst,2003,95(23):1172-83.
[2]Smith E M,Ritchie J M,Summersgill K F,et al.Human papillomavirus in oral exfoliated cell and risk of head and neck cancer [J].J Natl Cancer Inst,2004,96(6):449-55.
[3]Rampias T,Sasaki C,Weinberger P,et a1.E6 and E7 gene Silencing and cancer cells[J].J Natl Cancer Inst,2009,101(6):412-23.
[4]Kim M K,Kim H S,Kim S H,et al.Human papillomavirus type 16 E5 oncoprotein as a new target for cervical cancer treatment [J].Biochem Phar Macol,2010,80(12):1930-5.
[5]Ganguly N.Human papillomavirus-16 E5 protein:oncogenic role and therapeutic value[J].Cell Oncol(Dordr),2012,35(2):67 -76.
[6]Schiffman M,Herrero R,Desalle R,et al.The carcinogenicity of human papillomavirus types reflects viral evolution[J].Virology,2005,337(1):76-84.
[7]Sdek P,Zhang Z Y,Cao J,et al.Alteration of cell-cycle regulatory proteins in human oral epithelial cells immortalized by HPV16 E6 and E7[J].Int J Oral Maxillofac Surg,2006,35:653-7.
[8]候瀟瀟,江 彤,蔣欣泉,等.HPV16型 E5基因對人永生化口腔上皮細胞E6、E7基因表達的影響[J].上海口腔醫學雜志,2011,20(4):368-72.
[9]Conrad M,Bubb V J,Schlegel R,et al.The human papillomavirus type 6 and 16 E5 proteins are membrane-associated proteins which associate with the 16-kilodalton pore-forming protein[J].J Virol,1993,67(10):6170-8.
[10]Maufort J P,Williams S M,Pitot H C,et al.Humanpapillomavims16 E5 oncegene contributes to two stages of skin carcinogenesis[J].Cancer Res,2007,67(13):6106-12.
[11]Liao S J,Deng D R,Zeng D,et al.HPV16 E5 peptide vaccine in treatment of cervical cancer in vitro and in vivo[J].J Huazhong Univ Sci Technol,2013,33(5):735-42.
[12]Hu L,Platker K,Vorozhko V,et al.Human papillomavirus16 E5 induces bi-nucleated cell formation by cell-cell fusion[J].Virology,2009,384(1):125-34.
[13]丁桂聰,毛天球,楊維東,等.人口腔黏膜上皮細胞的培養及生物學特性的研究[J].實用口腔醫學雜志,2000,16(4):288 -90.
[14]Blomer U,Naldini L,Kafri T,et al.Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector[J].J Virol,1997,71(9):6641-9.
[15]Zufferey R,Nagy D,Mandel R J,et al.Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo[J].Nat Biotechnol,1997,15(9):871-5.
Construction of three lentiviral vectors expressing HPV16 E5,E6 or E7 oncogene and respective infection of oral epithelial cells with the vectors
Xiang Xianwang1,Jiang Tong2,Chen Chuanjun1,3
(1Dept of Oral and Maxillofacial Surgery,The Third Affiliated Hospital of Anhui Medical University,Hefei 230061;2College of Plant Protection,Anhui Agricultural University,Hefei 230036;3Dept of Stomatology,Wannan Medical College,Wuhu 241002)
Objective To provide the basis for the study of HPV16 E5 gene inthe pathogenesis of oral squamous cell carcinoma by constructing three lentiviral vectors expressing HPV16 E5,E6 or E7 oncogene and transfecting oral epithelial cells with the vectors.Methods HPV16 E5,E6 or E7 oncogene was amplified using PCR and ligated into the lentiviral vector pLVX-AcGFP-N1 respectively to construct vectors pLVX-AcGFP-E5,pLVX-AcGFP-E6 and pLVX-AcGFP-E7,then respectively cotransfected 293T cells with packaging plasmids,viral supernatant was collected to respectively transfect oral epithelial cells.Afterpuromycin screening,oral epithelial cells with HPV 16 E5,E6,or E7 oncogene transfection were constructed,then reverse transcription PCR and western blotassays were performed for verifying HPV16 E5,E6 or E7 expression.Results pLVX-AcGFP-E5,pLVX-AcGFP-E6 and pLVX-AcGFP-E7 were successfully constructed,oral epithelial cells expressing HPV 16 E5,E6 or E7 oncogene wereacquired,HPV16 E5,E6 or E7 expression was confirmed in oral epithelial cellsthrough reverse transcription PCR and western blot assays.Conclusion Three lentiviral vectors expressing HPV16 E5,E6 or E7 oncogene can successfully infect oral epithelial cells.
human papillomavirus;HPV16 oncogene;lentiviral vector;oral epithelial cells
R 739.8
A
1000-1492(2016)07-0940-05
2016-03-08接收
國家自然科學基金資助項目(編號:81172574);皖南醫學院人才引進科研啟動基金資助
1安徽醫科大學第三附屬醫院,合肥 2300612安徽農業大學植物保護學院,合肥 2300363皖南醫學院口腔醫學院,蕪湖 241002
項先旺,男,碩士研究生;陳傳俊,教授,碩士生導師,責任作者,E-mail:ccj6318@sina.com

