響應面法優化雙酶提取仿刺參卵粗多糖工藝及其抗氧化性研究
劉 昕,張 健,2,劉京熙,趙云蘋,王共明,喬瑞光
(1.山東省海洋資源與環境研究院,山東煙臺 264006;2.山東省海洋生態修復重點實驗室,山東煙臺 264006)
?
響應面法優化雙酶提取仿刺參卵粗多糖工藝及其抗氧化性研究
劉昕1,張健1,2,劉京熙1,趙云蘋1,王共明1,喬瑞光1
(1.山東省海洋資源與環境研究院,山東煙臺 264006;2.山東省海洋生態修復重點實驗室,山東煙臺 264006)
以仿刺參卵為原料提取多糖,在單因素實驗的基礎上,通過響應面分析優化雙酶提取仿刺參卵多糖工藝,并對其體外抗氧化活性進行初步研究。結果表明:仿刺參卵多糖的最佳提取條件為復合蛋白酶與木瓜蛋白酶配比1∶2、加酶量2.78%、酶解溫度60 ℃、酶解時間6 h,在此條件下卵多糖的預測得率為8.84‰,實際得率為8.76‰;仿刺參卵多糖的自由基清除活性呈明顯的劑量依賴關系,對DPPH自由基的IC50為1.71 mg/mL,是一種良好的天然抗氧化劑。
仿刺參卵多糖,雙酶,響應面法,抗氧化
海參是珍貴的海珍品之一。近年來隨著人們對海參的保健認識日漸增強,市場需求海參的數量也逐年增加。據2015年中國漁業年鑒統計,我國海參年產量超過20萬t,產值在300億元以上,海參產業已成為我國水產品主導產業之一。海參卵是海參加工過程中產生的主要副產物之一。研究表明,海參卵中含有豐富的營養物質,其中粗多糖含量為干質量的26.98 g/100 g,粗蛋白含量達51.80 g/100 g[1]。目前由于人們對這部分資源認識不夠充分,使得海參卵這一原料沒有得到有效的開發利用。
海參多糖一般以糖肽鍵的形式與蛋白質連接在一起,通過氫鍵和疏水作用進一步形成具有一定空間結構的大分子物質[2]。通過酶解斷裂蛋白質與糖鏈的共價鍵從而釋放出多糖是制備海參多糖的有效手段。當前有關海參卵的研究多集中于酶解法制備海參多肽[3-4],有關海參卵多糖的制備及活性研究還較少。本文以仿刺參卵為原料,通過雙酶復合水解以充分斷裂糖肽鍵釋放多糖,結合單因素實驗及響應面分析得到最佳提取工藝條件,并對卵多糖的抗氧化性進行初步研究,為海參資源的高值化利用及海參多糖相關產品的開發提供理論依據。
1 材料與方法
1.1材料與儀器
仿刺參卵煙臺山水海產有限公司;木瓜蛋白酶(活力80×104U/g,最適溫度50~55 ℃)南寧龐博生物工程有限公司;復合蛋白酶(活力1.5 AU/g,最適溫度50 ℃)丹麥諾維信公司;DPPH(1,1-二苯基-2-三硝基苯肼)美國sigma;其余試劑均為國產分析純。
電子天平美國Ohaus公司;電熱恒溫水浴鍋煙臺龍口市先科儀器公司;TU-1810SPC紫外-可見分光光度計北京普析通用儀器有限公司;TGL-16M臺式高速冷凍離心機湖南湘儀儀器有限公司;傅里葉變換紅外光譜儀(Nicolet iS10)美國Thermo Fisher公司。
1.2實驗方法
1.2.1仿刺參卵多糖的酶法提取工藝取新鮮的仿刺參卵用膠體磨研磨勻漿,按設定的酶解條件在恒溫水浴鍋中酶解。酶解完成后升溫至100 ℃滅酶10 min[5]。將酶解液經過離心、取上清加入TCA除蛋白、離心去除蛋白沉淀后,即得粗多糖溶液。向粗多糖溶液中加入95%乙醇使其終體積分數為70%,4 ℃靜置過夜,離心,將沉淀用無水乙醇洗2~3次,于60 ℃烘干即為仿刺參卵粗多糖。
1.2.2多糖含量的測定采用苯酚硫酸法[6],以葡萄糖為標準品測定粗多糖樣品溶液中卵多糖的含量。以葡萄糖質量濃度為橫坐標,吸光度為縱坐標繪制葡萄糖標準曲線。
測定粗多糖樣品溶液中多糖含量,并計算多糖得率。
多糖得率(‰)=樣品溶液多糖濃度×稀釋倍數/樣品質量×樣品溶液體積×1000
1.2.3單因素實驗選取木瓜蛋白酶與復合蛋白酶對仿刺參卵進行雙酶水解。考察加酶量(0.5%,1%,2%,3%,4%)、酶解時間(0.5、1、2、4、6 h)、酶解溫度(30、40、50、60、70 ℃)、雙酶配比(木瓜蛋白酶與復合蛋白酶配比1∶4、1∶2、1∶1、2∶1、4∶1)四個因素對仿刺參卵多糖得率的影響。
1.2.4響應面實驗設計依據單因素實驗結果,在木瓜蛋白酶與復合蛋白酶配比2∶1條件下,以多糖得率為響應值,選擇加酶量、酶解溫度、酶解時間為自變量,根據Box-Behnken設計,進行三因素三水平的響應面分析實驗,得出最佳酶解條件。實驗因素水平見表1。
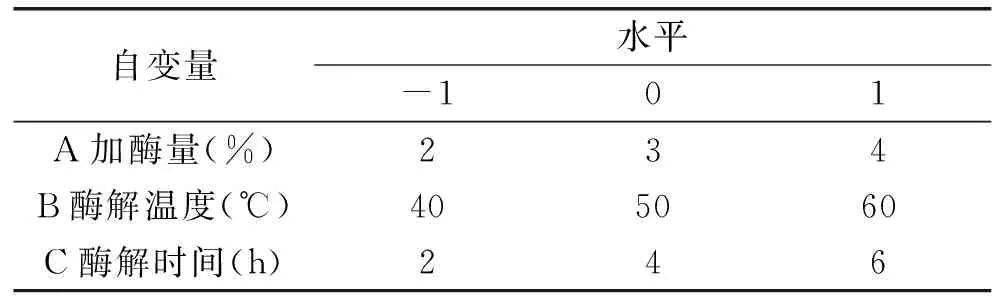
表1 響應面實驗因素與水平表Table 1 Factors and levels used in response surface design
1.2.5光譜分析紫外光譜分析:將多糖配成1 mg/mL的水溶液,利用紫外分光光度計在190~600 nm范圍內掃描檢測。紅外光譜分析:將少量多糖樣品與KBr混合,研磨均勻后壓片,在4000~400 cm-1范圍內掃描檢測。
1.2.6仿刺參卵多糖的體外抗氧化性分析
1.2.6.1DPPH自由基清除能力取2 mL不同濃度的多糖溶液與2 mL 1 mmol/L的DPPH乙醇(95%)溶液混合均勻,暗處30 ℃反應30 min,以95%乙醇做空白對照,測其在517 nm處的吸光度為Ai,以VC取代多糖溶液做陽性對照[7]。多糖對DPPH清除率的計算公式為:

其中,Aj為多糖與95%乙醇混合測得的吸光度,A0為DPPH與95%乙醇混合測得的吸光度。
1.2.6.2羥自由基清除能力采用Fenton體系法測定多糖對·OH的清除能力[8-9]。取1 mL不同濃度的多糖溶液,依次加入1 mL 6 mmol/L的FeSO4和1 mL 6 mmol/L的H2O2溶液,靜置10 min后加入1 mL 6mmol/L的水楊酸-乙醇溶液,搖勻,于37 ℃水浴30 min后510 nm測吸光度為Ai。以VC取代多糖溶液做陽性對照。多糖對·OH的清除率計算公式為:

其中,Aj為蒸餾水代替水楊酸-乙醇溶液測得的吸光度,A0為蒸餾水取代多糖測得的吸光度。

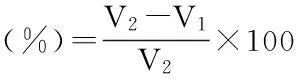
1.3數據處理
采用Design-Expert和SPSS17.0進行數據分析;實驗中處理均重復3次。
2 結果與分析
2.1多糖含量測定
多糖在濃硫酸作用下,脫水生成的糠醛或羥甲基糠醛能與苯酚縮合成一種橙紅色化合物,在1~100 mg范圍內其顏色深淺與糖的含量成正比,且在490 nm波長下有最大吸收。采用苯酚硫酸法繪制葡萄糖標準曲線的回歸方程為y=6.651x-0.06718,R2=0.9935。式中:x為葡萄糖質量濃度,y為葡萄糖在490 nm出的吸光度。
2.2單因素實驗
2.2.1加酶量對多糖得率的影響由圖1可以看出,隨加酶量的增加,卵多糖的得率逐漸上升,當加酶量達到3%時,多糖得率趨于平緩,最高得率為8.42‰。這是因為在酶濃度較低時,隨著酶量的增加,更多的蛋白質被水解為多肽,多糖逐漸釋放[11],當酶量超過3%時,酶與底物的接觸已經趨于完全,所以多糖得率不再上升。

圖1 加酶量對多糖得率的影響Fig.1 Effects of enzyme dosage on extraction rate of polysaccharides
2.2.2酶解時間對多糖得率的影響由圖2可以看出,隨著酶解時間的延長,多糖得率逐漸升高,這是因為酶與蛋白質開始反應,多糖得到逐漸釋放。當時間達到4 h時,酶解反應進行完全,多糖得率趨于平緩,最高得率為8.05‰。

圖2 酶解時間對多糖得率的影響Fig.2 Effects of enzymolysis time on extraction rate of polysaccharides

圖3 酶解溫度對多糖得率的影響Fig.3 Effects of enzymolysis temperature on extraction rate of polysaccharides
2.2.3酶解溫度對多糖得率的影響由圖3可以看出,隨著溫度的上升,多糖得率逐漸升高,50 ℃后趨于平緩,最高得率為8.08‰。這是因為溫度的提升促使酶反應活性的增大及底物結構的展開,有利于水解反應的進行,也促使分子運動速度加快;當溫度超過最適反應溫度時,酶逐漸失活,多糖釋放速度變緩。
2.2.4雙酶配比對多糖得率的影響由圖4可以看出,隨著木瓜蛋白酶在雙酶體系中含量的增加,多糖得率逐漸升高;當復合蛋白酶與木瓜蛋白酶比例為1∶2時,多糖得率最高為8.03‰,之后得率隨木瓜蛋白酶含量的升高而降低。這可能是由于蛋白酶對肽鍵作用具有專一性,單酶的固定酶切位點使水解受到限制。復合蛋白酶與木瓜蛋白酶比例為1∶2復配時達到最好的互補作用,使肽鍵得到最大程度的水解。

圖4 雙酶配比對多糖得率的影響Fig.4 Effects of the ratio of two enzyme on extraction rate of polysaccharides
2.3響應面優化
2.3.1回歸模型的建立及其顯著性檢驗應用Box-Benhnken設計3因素3水平的實驗方案,實驗結果如表2所示。對表中實驗數據進行多元回歸擬合,獲得響應值多糖提取率對自變量加酶量A、酶解溫度B、酶解時間C的二元多次回歸模擬方程為:
多糖得率(%)=8.70-0.026A+0.017B+0.13C-0.36AB+0.18AC+0.47BC-0.45A2-0.25B2-0.26C2。

表2 響應面實驗設計與結果Table 2 Response surface design and experimental results
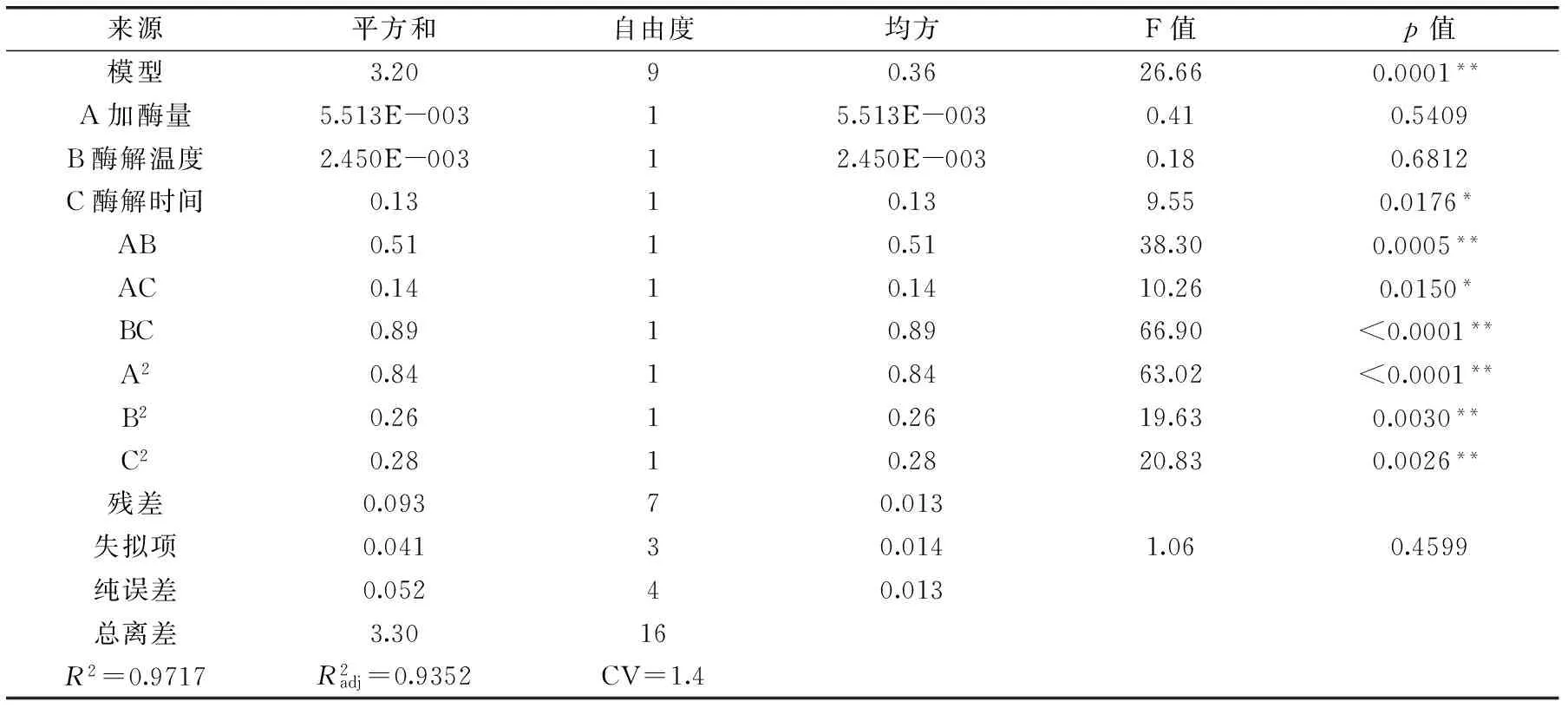
表3 回歸模型方差分析Table 3 ANONA analysis of regression model
注:**:p<0.01,差異極顯著;*:p<0.05,差異顯著


圖5 加酶量和酶解溫度對多糖得率交互影響的響應面Fig.5 Response surface of enzyme dosage and temperature
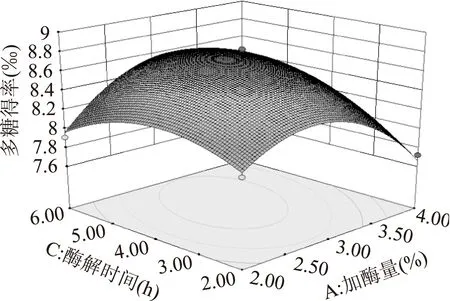
圖6 加酶量和酶解時間對多糖得率交互影響的響應面Fig.6 Response surface of enzyme dosage and enzymolysis time

圖7 酶解溫度和時間交互作用對多糖得率影響的響應面Fig.7 Response surface of enzymolysis temperature and time
2.3.2響應面優化及分析加酶量和酶解溫度的交互作用如圖5所示。圖中等高線呈橢圓形,表明二者的交互作用極顯著。從響應面曲線可知,隨加酶量和酶解溫度的增加多糖得率呈先增大后減小的趨勢,在酶解溫度55 ℃左右,加酶量3%左右時,多糖得率達到最大值。加酶量和酶解時間的交互作用如圖6所示。圖中等高線呈橢圓形,表明二者的交互作用顯著。從響應面曲線可知,隨加酶量和酶解時間的增大多糖得率呈先增加后減小的趨勢,在加酶量3%左右,酶解時間4 h左右時,多糖得率達到最大值。酶解時間和酶解溫度的交互作用如圖7所示。圖中等高線呈橢圓形,表明二者的交互作用極顯著。圖中響應面曲線坡度較為陡峭,表明酶解時間和酶解溫度對多糖得率的影響均較大。
基于以上分析,影響卵多糖得率的因素按主次順序為:酶解時間>加酶量>酶解溫度。獲得雙酶水解仿刺參卵制備多糖的最佳酶解條件為:加酶量2.78%,酶解溫度60 ℃,酶解時間6 h。在此條件下重復實驗三次獲得實際仿刺參卵多糖的得率為8.76‰,與得率為8.84‰吻合情況較好,說明該模型適用于對仿刺參多糖的雙酶提取工藝進行回歸分析和參數優化。
2.4光譜分析
圖8為仿刺參卵多糖的紫外掃描圖譜。從圖中可以看出在190~200 nm處有最強吸收峰,表明被測物為多糖;在260 nm和280 nm處吸收很低,表明核酸和蛋白含量很少。

圖8 仿刺參卵多糖的紫外光譜圖Fig.8 UV absorption spectrum of polysaccharides from A. japonicus spawn
圖9為仿刺參卵多糖的紅外吸收光譜圖。由圖中可知在3413 cm-1處的強吸收峰為多糖分子中O-H的伸縮振動,2927 cm-1附近的信號為糖環上C-H的伸縮振動,1735 cm-1附近可能為糖中乙酰基的酯基吸收峰,1650 cm-1和1380 cm-1附近的吸收峰為C=O的非對稱和對稱伸縮振動,以上幾組吸收峰可以判定該物質為多糖類化合物[12]。1218 cm-1附近為S=O的伸縮振動,表明多糖中存在硫酸基的取代[13],844 cm-1附近為α-吡喃糖苷鍵的特征吸收峰。
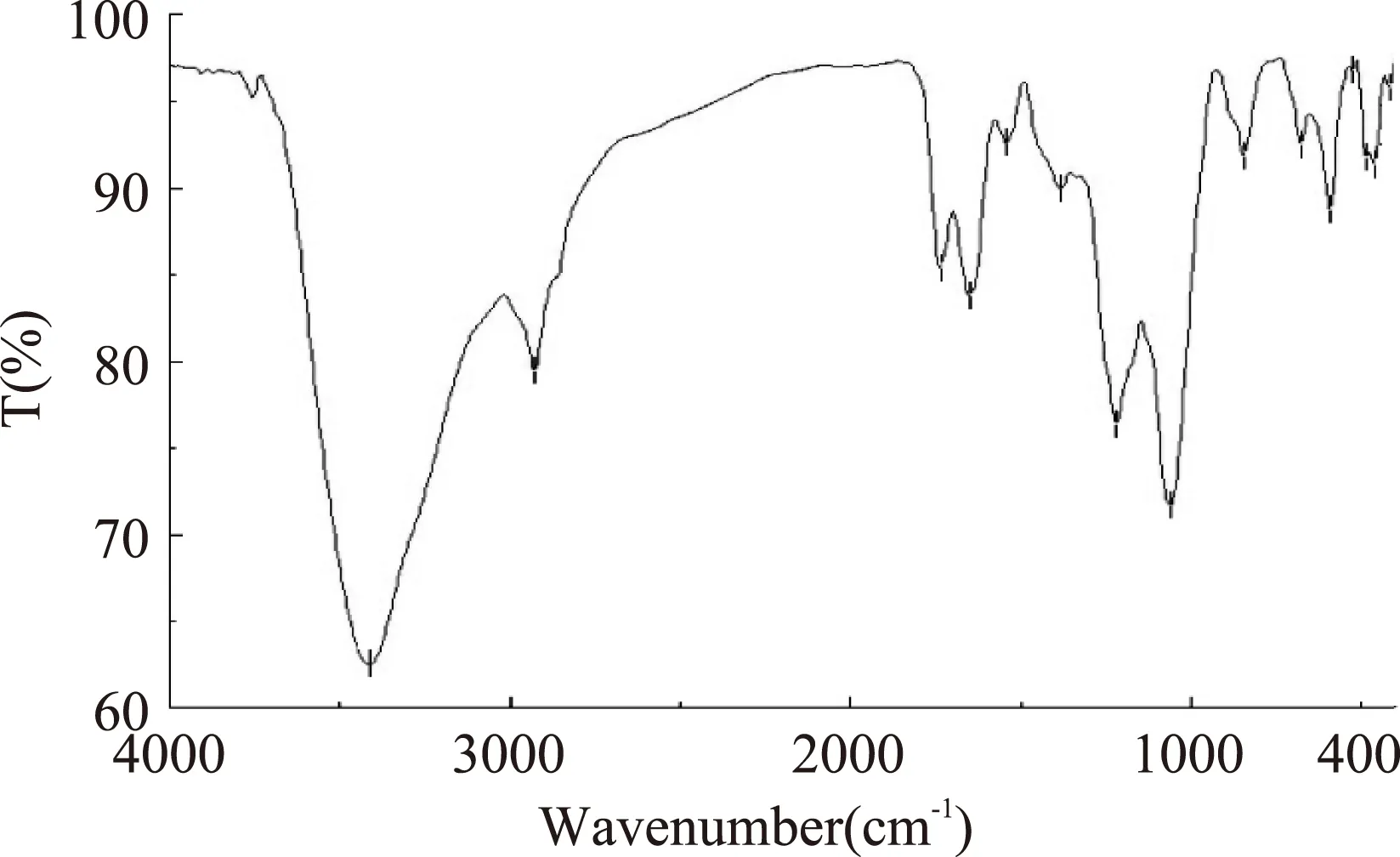
圖9 仿刺參卵多糖的紅外光譜圖Fig.9 IR absorption spectrum of polysaccharides from A. japonicus spawn
2.5抗氧化性分析
2.5.1DPPH自由基清除能力仿刺參卵多糖對DPPH自由基清除率結果如圖10所示。從圖中可以看出,在設定濃度范圍內,DPPH自由基清除率與多糖濃度呈明顯劑量依賴關系。當多糖濃度為4 mg/mL時,清除率達66.67%。仿刺參卵多糖具有明顯清除DPPH自由基的能力,其原因可能是多糖中的羥基具有供氫質體能力的結果[14]。多糖對DPPH自由基的IC50為1.71 mg/mL,VC的IC50為0.19 mg/mL。

圖10 仿刺參卵多糖的DPPH自由基清除率Fig.10 Scavenging effect on DPPH radical of polysaccharide from A. japonicus spawn
2.5.2羥自由基清除能力仿刺參卵多糖對羥自由基清除率結果如圖11所示。從圖中可以看出,在設定濃度范圍內,隨著卵多糖濃度的增加,對羥自由基清除率逐漸增大。當多糖濃度為4 mg/mL時,多糖對羥自由基的清除率為42.38%。

圖11 仿刺參卵多糖的羥自由基清除率Fig.11 Scavenging effect on hydroxyl radical of polysaccharide from A. japonicus spawn
2.5.3超氧陰離子自由基清除能力仿刺參卵多糖對超氧陰離子自由基清除率結果如圖12所示。從圖中可以看出,在設定濃度范圍內,超氧陰離子自由基清除率隨多糖濃度的增加而逐漸增大。當多糖濃度為4 mg/mL時,多糖對超氧陰離子自由基的清除率為34.11%。
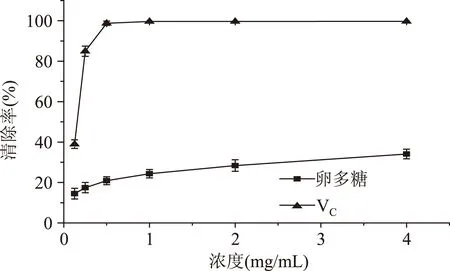
圖12 仿刺參卵多糖的超氧陰離子自由基清除率Fig.12 Scavenging effect on superoxide radical of polysaccharide from A. japonicus spawn
體內存在的活性氧以及自由基反應會產生致癌、動脈硬化、DNA破壞等諸多病理學傷害。抗氧化物質可以延緩或避免細胞內易氧化成分發生變化。目前常用的合成抗氧化劑如丁基羥基茴香醚和2,6-二叔丁基對甲酚等,雖然清除自由基的效果很好,但長期服用有致毒或致癌的風險[15-16]。因此,發現并獲得天然抗氧化劑對食品安全和人類健康越來越重要。仿刺參卵多糖具有明顯的清除自由基活性,可能與其結構中含有硫酸基團有關。與相似結構的中性多糖相比,硫酸多糖顯示出更強的清除自由基能力[17]。Hu T T等[18]從昆布中分離出兩種硫酸多糖并對其進行了脫硫反應,對多糖脫硫酸根前后的抗氧化研究顯示,帶有硫酸根的多糖顯示出更強的抗氧化活性。這可能是由于硫酸基團可以作為親電體促進分子內脫氫反應。Tsiapali等[19]人的研究顯示硫酸基團和磷酸基團兩種親電基質都可以促進碳水化合物清除自由基的能力,但是,硫酸化程度與清除自由基能力沒有嚴格的相關性,而是與其他因素共同作用的結果,如分子量、分子組成也是影響自由基清除能力的重要因素[20]。
3 結論
本實驗以仿刺參加工副產物仿刺參卵為原料,采用雙酶提取法制備卵多糖。在單因素實驗的基礎上,通過響應面分析進行優化,獲得仿刺參卵多糖的最佳提取條件為:復合蛋白酶與木瓜蛋白酶配比1∶2、加酶量2.78%、酶解溫度60 ℃、酶解時間6 h,在此條件下卵多糖的實際得率為8.76‰。獲得的模型適用于對仿刺參多糖的雙酶提取工藝進行回歸分析和參數優化。
對仿刺參卵多糖的體外抗氧化活性進行研究表明,多糖的自由基清除作用呈明顯的劑量依賴關系,對DPPH自由基的IC50為1.71 mg/mL,具有良好的抗氧化活性。作為外源性抗氧化劑,多糖在生物體內發揮作用的機制除了直接參與猝滅自由基的途徑外,還可能通過參與調動或激活機體的內源性抗氧化劑,使其數量增大和活性增強到機體需要的水平,從而避免或減輕自由基對機體的損傷[21]。因此,在今后的研究中,將對仿刺參卵多糖體內抗氧化作用及機理開展進一步研究,以期為海參多糖相關產品的研發提供參考和依據。
[1]張健,王茂劍,馬晶晶,等. 仿刺參生殖腺營養成分分析[J]. 食品科學,2013,34(14):232-236.
[2]宿瑋,常耀光,薛長湖,等. 海地瓜多糖中蛋白含量測定方法比較[J]. 食品科學,2011,32(2):201-204.
[3]趙鴻霞,周大勇,秦磊,等. 響應面法優化海參卵酶解工藝[J]. 食品與機械,2010,26(5):114-117.
[4]曹榮,劉淇,殷邦忠. 響應面法優化海參性腺酶解工藝[J].食品科學,2012,33(2):29-33.
[5]王共明,張健,王茂劍,等. 仿刺參卵酶解工藝條件優化[J]. 食品科學,2012,23:193-198.
[6]張軍瑞,陳健. 木瓜蛋白酶酶解白底輻肛參提取多糖的研
究[J].現代食品科技,2009,5:542-545.
[7]蔣德旗,黃利敏,王艷,等. 響應面優化纖維素酶法提取桂花多糖工藝及其抗氧活性研究[J]. 食品工業科技,2015,36(2):271-281.
[8]呂喜茹,郭亮,常明昌,等. 姬松茸多糖抗氧化作用[J]. 食用菌學報,2010,17(1):69-71.
[9]Song H F,Zhang Q B,Zhang ZS,et al.Invitroantioxidant activity of polysaccharides extracted from Bryopsis plumosa[J]. Carbohydrate Polymers,2010,80(4):1057-1061.
[10]Liu X,Sun ZL,Zhang MS,et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers,2012,90:1664-1670.
[11]蔡彬新,吳成業. 海參多糖的分離純化方法及其主要生物活性[J]. 福建水產,2008,3:70-74.
[12]Li S C,Yang X M,Ma H L,et al. Purification,characterization and antitumor activity of polysaccharides extracted from Phellinus igniarius mycelia[J]. Carbohydrate Polymers,133(2015):24-30.
[13]林聰,趙春琦,李娜,等. 1種綠藻硫酸多糖的化學組成及其結構表征[J]. 中國海洋藥物,2014,33(4):55-58.
[14]Chen H X,Zhang M,Xie B J. Components and antioxidant activity ofpolysaccharide conjugate from green tea[J]. Food Chemistry,2005,90:17-21.
[15]劉微微,劉旭,曹學麗,等. 白背三七多糖的結構表征及α-葡萄糖苷酶的抑制活性[J]. 食品科學,2013,34(7):115-120.
[16]Zhu L C,Bo J T,Wang C,et al. Antioxidant Activities of Aqueous Extract from Agrimoniapilosa Ledeb and Its Fractions[J]. Chemistry&biodiversity,2009,6:1716-1726.
[17]Qi H M,Zhang Q B,Zhao T T,et al. Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa(Chlorophyta)invitro[J]. International Journal of Biological Macromolecules,2005,37:195-199.
[18]Hu T T,Liu D,Chen Y. Antioxidant activity of sulfated polysaccharide fractions extracted from Undaria pinnitafidainvitro[J]. International Journal of Biological Macromolecules,2010,46:193-198.
[19]Tsiapali E,Whaley S,Kalbfleisch J,et al. Glucans exhibit weak antioxidant activity,but stimulate macrophagefree radical activity[J]. Free Radical Biology & Medicine,2001,30:393-402.
[20]謝明勇,王之珺,謝建華. 多糖的硫酸化修飾及其結構與生物活性關系研究進展[J]. 中國食品學報,2015,15(2):1-8.
[21]許海順,蔣劍平,徐攀,等. 紅參多糖抗氧化活性的研究[J]. 浙江中醫藥大學學報,2011,35(6):909-912.
Optimization for extraction of polysaccharides fromApostichopusjaponicusspawn using double enzymetic by response surface methodology and antioxidant activity analysis
LIU Xin1,ZHANG Jian1,2,LIU Jing-xi1,ZHAO Yun-ping1,WANG Gong-ming1,QIAO Rui-guang1
(1.Shandong Marine Resource and Environment Research Institute,Yantai 264006,China;2.Shandong Provincial Key Laboratory of Restoration for Marine Ecology,Yantai 264006,China)
On the basis of single factor experiments,the double enzymetic extraction process was optimized to extract polysaccharides fromApostichopusjaponicusspawn with response surface methodology,and the preliminary antioxidant activity of polysaccharides was investigated. The results showed that the best optimum condition for the extraction of polysaccharides were as follows:the ratio of protamex and papain was 1∶2,enzyme dosage 2.78%,enzymolysis temperature 60 ℃,enzymolysis time 6h. Under such condition,the model-predicted and experimental values of polysaccharides yield were 8.84‰ and 8.76‰,respectively. Polysaccharides had ability to scavenge free radical in a dose-dependent manner,the IC50values of DPPH free radical scavenging abilities were 1.71 mg/mL. TheA.japonicusspawn polysaccharides is a good source of natural antioxidants.
Apostichopusjaponicusspawn polysaccharides;double enzymetic;response surface methodology;antioxidant activity
2016-03-01
劉昕(1988-),女,碩士,研究實習員,研究方向:天然產物及功能分析,E-mail:liuxinyz@163.com。
山東省自然科學基金培養基金項目(ZR2014CP030);山東省現代農業產業技術體系刺參產業創新團隊建設項目(SDAIT-22-07);山東省農業重大應用技術創新項目;煙臺市科技發展計劃項目(2014ZH081)。
TS254.9
B
1002-0306(2016)15-0203-06
10.13386/j.issn1002-0306.2016.15.031

