醇酶法制大豆油廢液中異黃酮的純化及其抗腫瘤作用研究
穆 瑩,張曉南,徐 漸,張宏偉
(東北農業大學食品學院,黑龍江哈爾濱 150030)
?
醇酶法制大豆油廢液中異黃酮的純化及其抗腫瘤作用研究
穆瑩,張曉南,徐漸,張宏偉
(東北農業大學食品學院,黑龍江哈爾濱 150030)
用有機溶劑萃取和樹脂吸附純化醇酶法制大豆油廢液中的異黃酮,用高效液相色譜檢測純化的異黃酮的純度。以人乳腺癌細胞系MCF-7為模型,檢測純化的大豆異黃酮對MCF-7增殖的影響。結果表明,萃取法粗提的最佳萃取溶劑為乙酸乙酯與正丁醇(1∶1)的混合液,異黃酮提取率為70.47%,純度為26.45%;樹脂吸附純化的最佳條件為:樹脂型號,LSA-8;上樣濃度,0.8 mg/mL;上樣流速,0.5 BV/h;洗脫液,75%的乙醇;洗脫流速,6 BV/h;洗脫體積,1.5倍上樣體積,異黃酮提取率為83.28%,純度為71.45%。抗腫瘤實驗表明,大豆異黃酮濃度達到100 mg/L時,能顯著(p<0.01)抑制MCF-7細胞的增殖,其作用有一定的劑量依賴性。
大豆異黃酮,純化,抗腫瘤,MCF-7細胞
大豆異黃酮(soybean isoflavone)是大豆生長過程中形成的次生代謝產物,它是一類具有多酚結構的混合物的統稱[1-4]。大豆異黃酮是大豆中有效活性物質之一,它表現弱的雌激素雙向調節作用,具有抗氧化、抗腫瘤、促進機體生長等多種生理功能[5-8]。有機溶劑萃取和樹脂吸附純化法是常用的生物活性物質提取的方法,其分離純化過程較簡單,效果較好,并且一般不會影響分離物的生物活性[9-10]。大豆在用醇酶法制大豆油后,其副產物往往被作為廢物直接丟棄,但這些副產物中含有較豐富的大豆異黃酮,如能合理回收利用則能變廢為寶,有效合理的利用大豆資源。本研究以醇酶法制大豆油副產物為原料,通過有機溶劑萃取及樹脂吸附法提取大豆異黃酮,并且以人乳腺癌細胞MCF-7為細胞模型,研究大豆異黃酮對乳腺癌細胞增殖的影響。
1 材料與方法
1.1材料與儀器
醇酶法制大豆油副產物(本實驗室保存):大豆用醇酶法提取大豆油后的廢液,其來源工藝如下:

其中下劃線標記的上清液即本實驗的原材料。
人乳腺癌細胞MCF-7美國ATCC細胞庫;DMEM/F12培養基,細胞增殖檢測試劑美國Gibco公司;乙腈(色譜純),甲醇(色譜純),乙醇(色譜純),磷酸(分析純),二甲基亞砜(分析純),鹽酸(分析純)和萃取用正丁醇,丙酮,乙酸乙酯天津市科密歐化學試劑有限公司;大豆苷,大豆黃苷,大豆異黃酮,大豆素,大豆黃素,染料木素標準品TEDIA公司。
高效液相色譜儀Agilent 1100,Agilient Technologies;色譜柱ODS3 C18,4.6×250 mm,5μm,Phenomenex;旋轉蒸發儀N-1000,東京理化;CASY 細胞分析儀德國;CO-150型CO2培養箱日本三洋;各型號大孔樹脂國產。
1.2實驗方法
1.2.1大豆異黃酮標準曲線的建立參照國標GB/T 23788-2009《保健食品中大豆異黃酮的測定方法》[11]。其方法與色譜條件如下:分別取大豆苷、大豆黃苷、染料木苷、大豆素、大豆黃素和染料木素對照品各4 mg,分別置于10 mL容量瓶,加入50%二甲基亞砜至接近刻度,超聲處理30 min后用二甲基亞砜定容制成標準儲備液,各標準儲備液的濃度均為400 mg/L。
8.0、16.0、24.0、32.0、40.0 mg/L混合標準儲備液配制:分別吸取大豆苷、大豆黃苷、染料木苷、大豆素、大豆黃素、染料木素六種標準儲備液各0.2、0.4、0.6、0.8、1.0 mL于10 mL容量瓶中,加入等體積的水后,再加入50%二甲基亞砜溶液定容。
色譜條件色譜柱:ODS3 C18(4.6 mm×250 mm,5 μm);流動相:流動相A:乙腈(色譜純);流動相B:磷酸水溶液(pH3.0,0.45 μm膜過濾)。A,B流動相用前均超聲30 min脫氣。洗脫條件:見表1。流速:1.0 mL/min;波長:260 nm;進樣量:10 μL;柱溫:30 ℃。
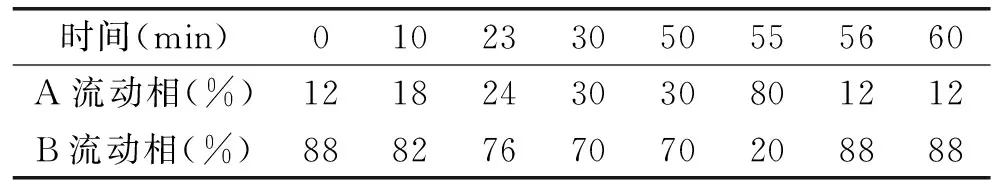
表1 梯度洗脫條件
1.2.2萃取法初步純化大豆異黃酮本實驗以醇酶法生產大豆油的副產物為原材料,以有機溶劑萃取法對原材料中的大豆異黃酮進行粗提。所選有機溶劑為正丁醇,丙酮和乙酸乙酯。萃取方法如下:取醇酶法制大豆油后的上清醇液200 mL,旋轉蒸發去除乙醇,濃縮液用6 mol/L的鹽酸調pH至4.5,冷藏72 h,3600 r/min離心15 min。取上清加水至總體積為200 mL,此即為大豆異黃酮原料液。此原料液一部分真空干燥用于液相色譜檢測,另一部分用于后續分離純化。
取200 mL上述原料液,加200 mL萃取溶劑,25 ℃震蕩后靜置萃取,分離萃取上清。大豆異黃酮富集在上清中。萃取3次,合并3次萃取上清的體積,真空干燥,稱重。液相色譜檢測萃取產物中大豆異黃酮含量,計算大豆異黃酮的提取率和純度。實驗重復3次[12]。
大豆異黃酮提取率(%)={[純化后樣液中大豆異黃酮的含量(mg/g)]/[原料液中大豆異黃酮的含量(mg/g)]}×100
大豆異黃酮純度(%)=[純化后樣液中大豆異黃酮的質量(mg)/純化干燥品總質量(mg)]×100
1.2.3樹脂吸附法精制大豆異黃酮本實驗將萃取后干燥的異黃酮樣品用離子水溶解,配制成0.6 mg/mL的濃度,在pH為7.0的條件下,35 ℃對樣品溶液進行靜態吸附24 h,然后用90%乙醇靜態洗脫,以樹脂的吸附量、吸附率、大豆異黃酮純度和提取率為考察指標,考察LSA-8、P2002-6、DM130、ADS-22、D100等5種型號的樹脂對大豆異黃酮純化效果的影響。
樹脂吸附率(%)={[初始溶液中大豆異黃酮含量(mg)-樹脂吸附后溶液中大豆異黃酮含量(mg)]/初始溶液中大豆異黃酮含量(mg)}×100
樹脂吸附量(mg大豆異黃酮/g干樹脂)=[初始溶液中大豆異黃酮含量(mg)-樹脂吸附飽和后溶液中大豆異黃酮含量(mg)]/樹脂干重(g)
樹脂解吸率(%)={洗脫液中大豆異黃酮含量(mg)/[初始溶液中大豆異黃酮含量(mg)-樹脂吸附后溶液中大豆異黃酮含量(mg)]}×100
選擇好樹脂后,本實驗以樹脂對大豆異黃酮的吸附率、解吸率為考察指標,從樣品上樣濃度、上樣流速、洗脫液中乙醇濃度、洗脫流速、洗脫體積等方面優化大豆異黃酮的純化條件。進行單因素實驗時,先固定其他因素。HPLC檢測純化產物中大豆異黃酮含量,計算大豆異黃酮的提取率和純度。實驗重復3次。
實驗中設計的樣品濃度為0.4、0.6、0.8、1.0、1.2 mg/mL;樣品流速為0.1、0.3、0.5、0.7、0.9 BV/h;洗脫液中乙醇濃度為60%、65%、70%、75%、80%、85%和90%;洗脫流速為2、4、6、8、10 BV/h;洗脫體積為上樣體積的1、1.5、2、2.5倍。
1.2.4大豆異黃酮抗腫瘤活性分析將純化的大豆異黃酮干燥品用DMEM/F12培養液溶解,分別配置成含大豆異黃酮濃度為0、10、100、200、300 mg/L的DMEM/F12培養液待用。將MCF-7細胞以1×105/mL培養液的密度接種至六孔板中,6孔板中的隨機5個孔分別標記1、2、3、4和5。待細胞生長到80%左右匯合度時,去掉培養液,細胞用D-Hanks液洗細胞3遍,然后在標記數字的空中按數字順序分別添加含大豆異黃酮濃度為0、10、100、200、300 mg/L的DMEM/F12培養液,培養48 h后收集各組細胞進行實驗。各組細胞樣品用CASY細胞分析儀檢測細胞數與細胞活力(經制樣處理后活細胞數占總細胞數的百分比)。每組均設3個平行。
1.2.5數據統計與分析實驗數據用Microsoft Excel進行統計分析,用單因素方差分析組間差異,結果用“平均值±標準差”表示。
2 結果與分析
2.1大豆異黃酮標準曲線的建立及原液中大豆異黃酮含量檢測
2.1.1標準曲線建立與原料液中大豆異黃酮含量檢測按國標要求配制各組分濃度為8~40 mg/L的混合標準品,通過高效液相色譜建立標準曲線方程,如表2和圖1所示,在標準品濃度范圍內,經重復進樣,R2均在0.9999,在此范圍內標準曲線相關系數高(R2≥0.9999),線性范圍較廣,可以用來進行分析。
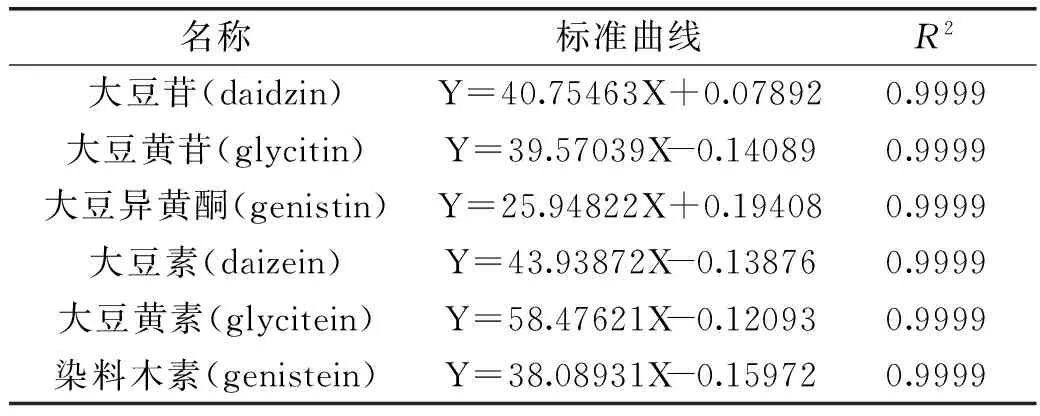
表2 大豆異黃酮標準曲線
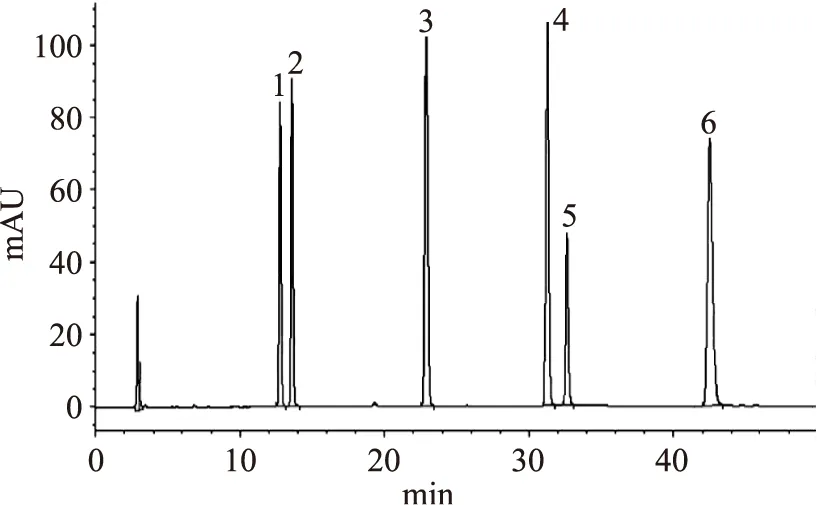
圖1 混合標準品色譜圖(24.0 mg/L)Fig.1 The chromatogram of mixed standard product(24.0 mg/L)注:圖中峰1~6分別為大豆苷、大豆黃苷、染料木苷、大豆素、大豆黃素和染料木素的峰圖,圖2同。
將原料液烘干品按國標要求稀釋,高效液相色譜檢測其大豆異黃酮的含量(圖2),根據標準曲線計算結果表明,樣品原液中大豆異黃酮的總含量為0.4135 mg/mL,其中絕大部分為大豆苷和染料木苷。
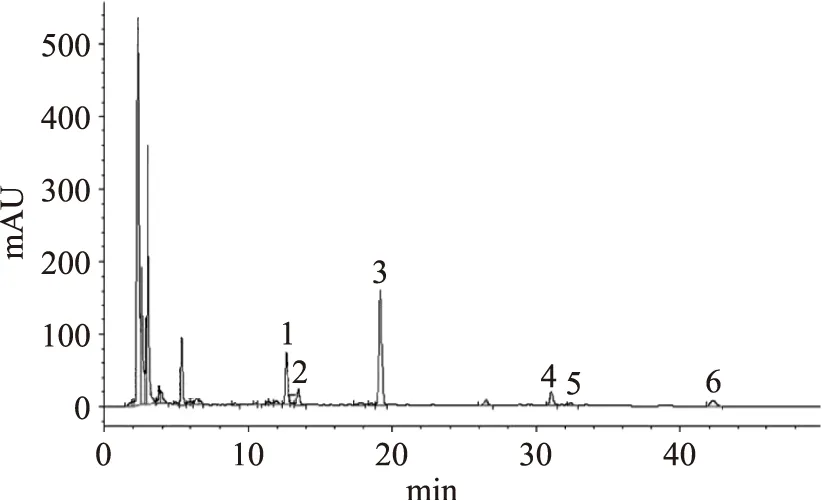
圖2 樣品色譜圖Fig.2 The chromatogram of sample
2.2萃取法初步純化大豆異黃酮
實驗通過前期預備實驗發現用乙酸乙酯、正丁醇和丙酮對原料液進行等體積萃取效果均不理想,正丁醇萃取純度高但提取率低,而乙酸乙酯則反之,故實驗設計正丁醇和乙酸乙酯的混合溶劑來萃取大豆異黃酮,以純度×提取率為檢測指標。結果如圖3所示,正丁醇和乙酸乙酯的體積比為1∶3時,大豆異黃酮純度為12.39%,提取率為75.83%,綜合指標為939.53;正丁醇和乙酸乙酯的體積比為3∶1時,大豆異黃酮純度為30.18%,提取率為55.12%,綜合指標為1663.52;而正丁醇和乙酸乙酯的體積比為1∶1時,大豆異黃酮純度為26.45%,提取率為70.47%,綜合指標為1863.93,明顯高于其他比例組合的綜合指標。所以本實驗選用正丁醇和乙酸乙酯體積比為1∶1的混合溶劑作為萃取溶劑對原料液中大豆異黃酮進行萃取。
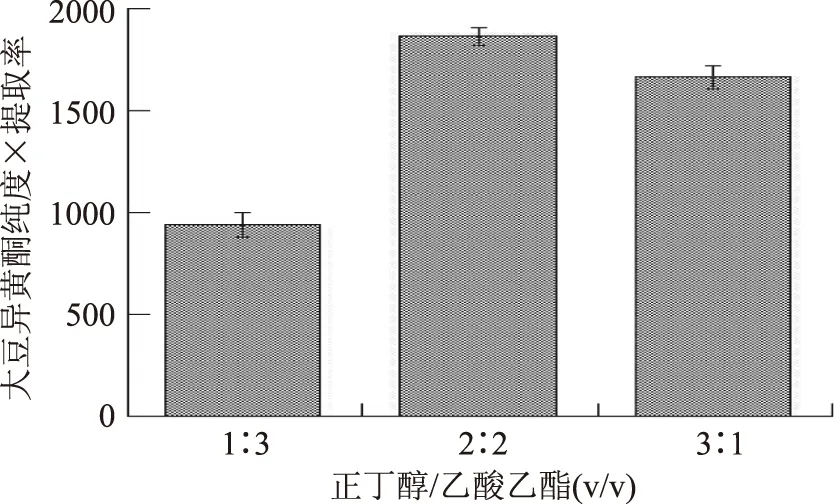
圖3 不同比例的正丁醇和乙酸乙酯混合溶劑萃取大豆異黃酮的效果Fig.3 The result of extraction of soybean isoflavoneby the mixed solvents of different volume ratio of butyl alcohol and ethyl acetate
大豆異黃酮可溶于丙酮、乙酸乙酯、正丁醇溶液中,而皂甙類物質難溶于丙酮等有機溶劑,多糖、單糖及小分子蛋白質也難溶于乙酸乙酯和正丁醇等溶劑,利用此性質采用溶劑萃取法可以初步純化大豆異黃酮[13]。袁建[14]等實驗發現以氯仿、苯、乙醚作為萃取劑時,大豆異黃酮萃取效率較低;以正丁醇萃取時萃取率高,但萃取液中雜質較多;而以乙酸乙酯萃取時萃取率稍低,但萃取液中雜質較少。本實驗選用體積比為1∶1的正丁醇和乙酸乙酯作為萃取劑,主要是考慮了大豆異黃酮的萃取率,但同時在一定程度上又兼顧了純度。
2.3樹脂吸附法精制大豆異黃酮
2.3.1吸附樹脂的選擇實驗從LSA-8、P2002-6、DM130、ADS-22、D100等5種型號的樹脂中進行選擇,以樹脂的吸附量、吸附率、純化后大豆異黃酮純度和提取率為考察指標。實驗結果如圖4所示,LSA-8型號的樹脂在各個指標上均顯著優于其余四種型號的樹脂。因此,本實驗選擇LSA-8型號的樹脂對大豆異黃酮進行分離純化。
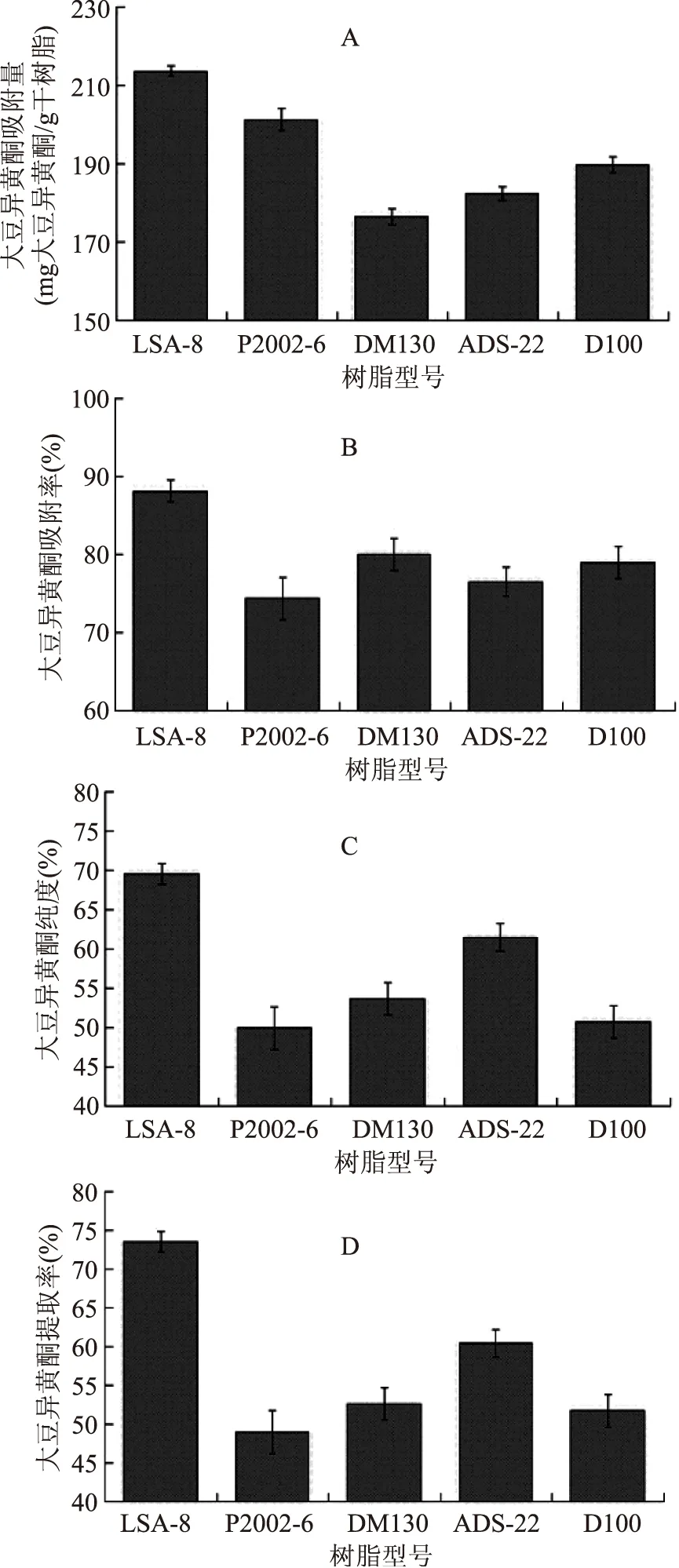
圖4 不同樹脂對大豆異黃酮的吸附效果 Fig.4 The result of extraction of different resins for soybean isoflavone注:A:不同樹脂對大豆異黃酮的吸附量;B:不同樹脂對大豆異黃酮的吸附率;C:不同樹脂吸附純化后,大豆異黃酮的純度;D:不同樹脂吸附純化后,大豆異黃酮的提取率。
2.3.2上樣濃度及上樣流速對大豆異黃酮純化的影響以不同上樣濃度和流速為因素進行單因素實驗,考察上樣濃度和流速對LSA-8吸附能力的影響。圖4A結果表明,上樣濃度為0.4~0.8 mg/mL時,隨上樣濃度的增加,LSA-8對大豆異黃酮的吸附變化不明顯;上樣濃度在0.8~1.2 mg/mL時,隨上樣濃度的增加,LSA-8對大豆異黃酮的吸附顯著下降,故最佳上樣濃度應為0.8 mg/mL。圖4B結果表明,上樣流速在0.1~0.5 BV/h時,隨上樣流速的加快,LSA-8對大豆異黃酮的吸附變化不明顯;上樣流速在0.5~0.9 BV/h時,隨上樣流速的增加,LSA-8對大豆異黃酮的吸附顯著下降,故最佳上樣流速應為0.5 BV/h。綜合上述結果,在上樣濃度為0.8 mg/mL,流速為0.5 BV/h時,LSA-8樹脂對大豆異黃酮的吸附效果最好。
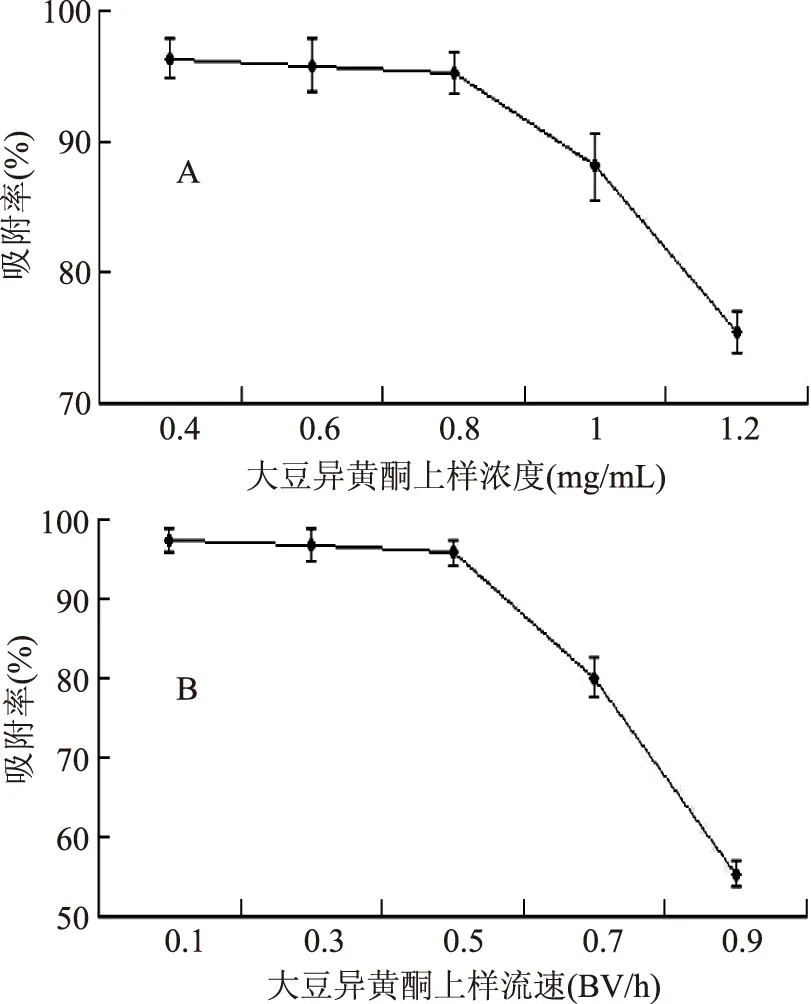
圖5 上樣條件對LSA-8樹脂吸附大豆異黃酮的影響Fig.5 The affect of the conditions of the sample on adsorption rate of LSA-8 resin for soybean isoflavone注:A:上樣濃度對LSA-8吸附大豆異黃酮的影響;B:上樣流速對LSA-8吸附大豆異黃酮的影響。
2.3.2洗脫液中乙醇濃度、洗脫流速及洗脫體積對大豆異黃酮純化的影響以洗脫液中不同乙醇濃度、不同洗脫流速及不同洗脫體積為因素進行單因素實驗,考察洗脫液中乙醇濃度、洗脫流速和洗脫體積對LSA-8解吸能力的影響。圖5A結果表明,乙醇濃度在60%~75%時,隨乙醇濃度的增加,LSA-8的解吸率逐漸上升;乙醇濃度在75%~90%時,隨乙醇濃度的增加,LSA-8的解吸率逐漸降低,故洗脫液的最佳乙醇濃度應為75%。圖5B結果表明,洗脫流速在2~6 BV/h時,隨洗脫流速的增加,LSA-8的解吸率明顯上升;洗脫流速在6~10 BV/h時,隨洗脫流速的增加,LSA-8的解吸率沒有明顯的上升,故洗脫的最佳流速應為6 BV/h。圖5C結果表明,洗脫體積為上樣體積的1~1.5倍時,隨洗脫液的增加,大豆異黃酮的洗脫量也增加;洗脫體積為上樣體積的1.5~2.5倍時,隨洗脫液體積的增加,大豆異黃酮的洗脫量基本保持不變,故最佳洗脫體積應為上樣液體積的1.5倍。綜合上述結果,在洗脫液乙醇濃度為75%,洗脫流速為6 BV/h及洗脫體積為上樣液體積的1.5倍時,LSA-8樹脂對大豆異黃酮的解吸效果最好。

表3 樹脂吸附法純化大豆異黃酮的純度和提取率
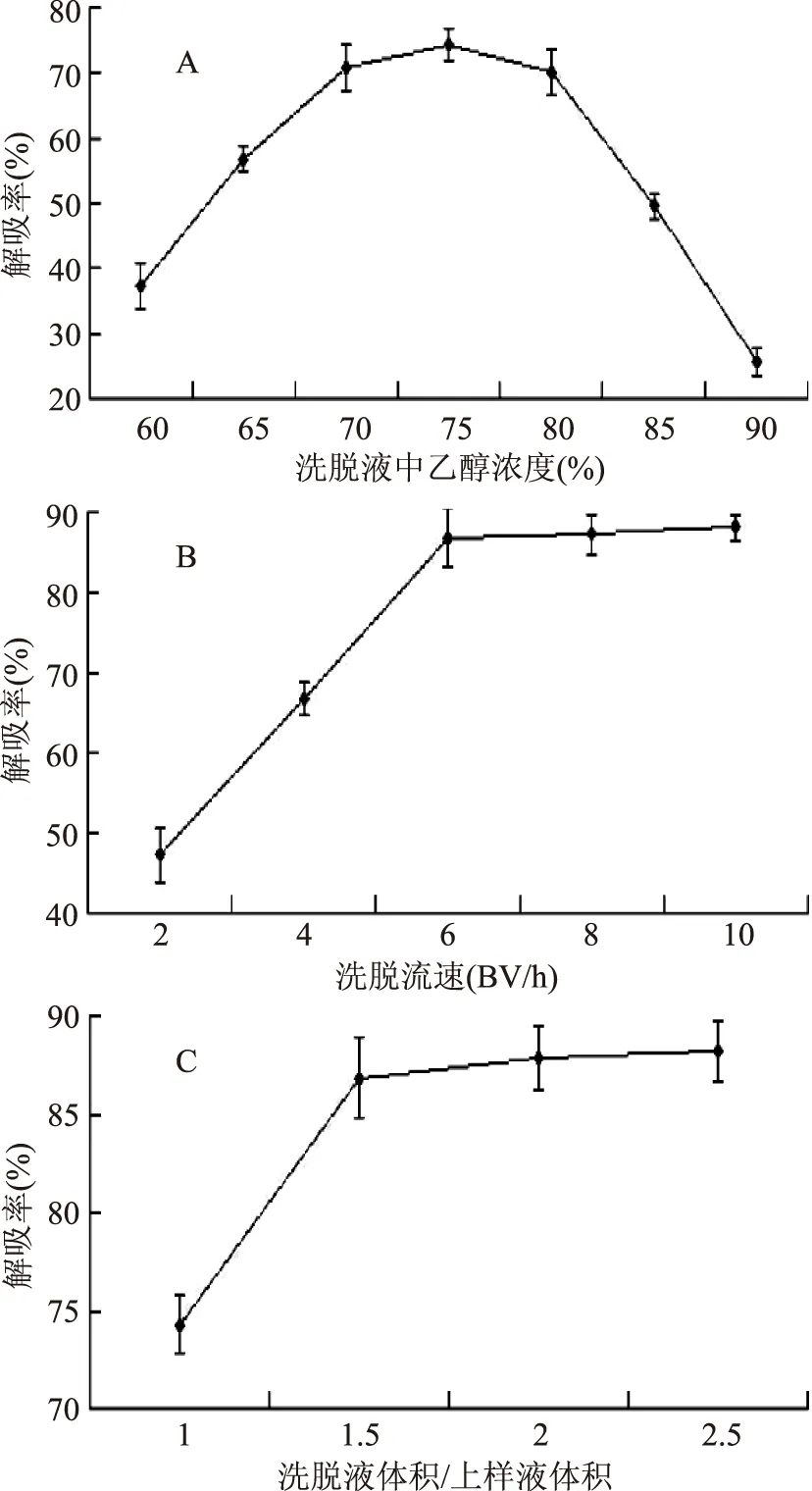
圖6 不同洗脫條件對LSA-8樹脂對大豆異黃酮解吸的影響Fig.6 The affect of different elution conditions on desorption rate of LSA-8 resin for soybean isoflavone注:A:洗脫液中乙醇濃度對LSA-8樹脂解吸的影響;B:洗脫流速對LSA-8樹脂解吸的影響;C:洗脫體積對LSA-8樹脂解吸的影響。
綜合樹脂吸附法結果,選用最優條件對萃取法粗提的產物進行純化,取粗提后的產物1 g,用離子水溶解,在最優條件下對其進行純化。結果如表3所示,在此條件下,純化回收大豆異黃酮提取率為83.71%,純度為72.09%。
大孔樹脂是一種不溶于酸、堿及各種有機溶劑的有機高分子聚合物,應用大孔樹脂對物質進行分離具有吸附快、解吸率高、吸附容量大、洗脫率高等優點。目前,對于用大孔樹脂柱層析分離純化大豆異黃酮的報道也比較多。蔡力[15]等的研究表明,用D4006大孔樹脂純化后,大豆異黃酮純度為30.58%;牛新春[16]等選用ADS21型大孔樹脂純化大豆異黃酮,在最優條件下得到大豆異黃酮純度為42.70%;井樂剛[17]等用D4006大孔樹脂純化大豆異黃酮純度,制得純度70%以上大豆異黃酮產品;潘廖明[18]等的研究表明,LSA-8型大孔吸附樹脂對大豆異黃酮具有較好吸附特性。該樹脂對大豆異黃酮的動態最大吸附量為204.6 mg/g干樹脂,純化后大豆異黃酮含量為57.0%。本研究結果表明,在LSA-8、P2002-6、DM130、ADS-22和D100 5種樹脂中,LSA-8樹脂分離純化大豆異黃酮效果最好,其最優條件下得到的異黃酮產物中異黃酮純度為72.09%,顯著高于上述報告結果,且提取率為83.71%,也較理想。
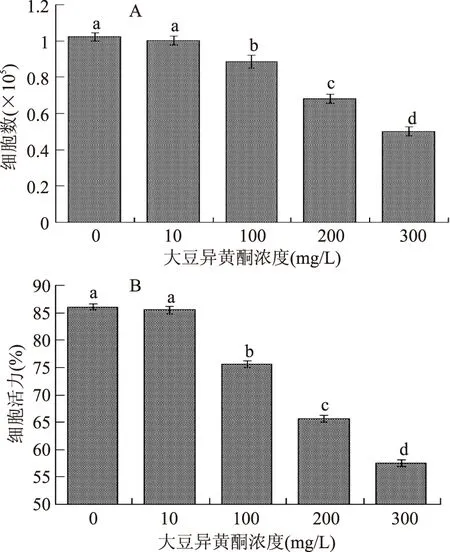
圖7 不同濃度的大豆異黃酮對MCF-7細胞增殖的影響Fig.6 The affect of different concentrations of soy isoflavones on the proliferation of MCF-7 cells注:柱形圖中,上標不同小寫字母表示差異極顯著(p<0.01);相同小寫字母表示差異不顯著(p>0.05),A:不同濃度大豆異黃酮處理后細胞數的變化;B:不同濃度大豆異黃酮處理后細胞活力的變化。
綜合上述結果,醇酶法制大豆油副產物中大豆異黃酮的分離純化的最佳條件及結果如下:萃取法粗提的最佳萃取溶劑為乙酸乙酯與正丁醇(體積比1∶1)的混合液,萃取后大豆異黃酮純度為26.45%,提取率為70.47%;樹脂吸附法純化的最佳條件為:樹脂型號,LSA-8,上樣濃度,0.8 mg/mL,上樣流速,0.5 BV/h,洗脫液,75%的乙醇,洗脫流速,6 BV/h,洗脫體積,1.5倍上樣體積,該條件下,異黃酮純度為72.09%,提取率為83.71%。
2.4大豆異黃酮抗腫瘤活性
實驗檢測了添加不同濃度的大豆異黃酮對MCF-7細胞增殖的影響。結果如圖7所示,添加大豆異黃酮濃度為10 mg/L時,與空白組細胞比較,實驗組細胞的細胞數和細胞活力無顯著差異(p>0.05),這說明低濃度的大豆異黃酮對人乳腺癌細胞的增殖沒有抑制效果;添加大豆異黃酮濃度為100、200、300 mg/L時,與空白組細胞比較,各實驗組細胞的細胞數和細胞活力均顯著下降(p<0.01),且添加濃度越高,下降越明顯,這說明在濃度≥100 mg/L時,大豆異黃酮對人乳腺癌細胞的增殖有顯著的抑制效果,且其效果有濃度依賴性。根據文獻報道,大豆異黃酮能通過抑制癌細胞的增殖來發揮其抗癌作用[19-22]。本實驗用MCF-7細胞驗證了大豆異黃酮對人乳腺癌細胞的抑制增殖作用。
3 結論
萃取法粗提的最佳萃取溶劑為乙酸乙酯與正丁醇(體積比1∶1)的混合液,萃取后大豆異黃酮純度為26.45%,提取率為70.47%;樹脂吸附純化的最佳條件為:樹脂型號,LSA-8;上樣濃度,0.8 mg/mL;上樣流速,0.5 BV/h;洗脫液,75%的乙醇;洗脫流速,6 BV/h;洗脫體積,1.5倍上樣體積,異黃酮提取率為83.28%,純度為71.45%。抗腫瘤實驗表明,大豆異黃酮濃度達到100 mg/L時,能顯著(p<0.01)抑制MCF-7細胞的增殖,其作用有一定的劑量依賴性。
[1]Xi YD,Ding J,Han J,et al. The Effect of Soybean Isoflavone on the Dysregulation of NMDA Receptor Signaling Pathway Induced byβ-Amyloid Peptides 1-42 in Rats[J]. Cellular and Molecular Neurobiology,2015,35(4):555-562.
[2]Roghani M,Mahdavi MRV,Jalali-Nadoushan MR,et al. Chronic Administration of Daidzein,a Soybean Isoflavone,Improves Endothelial Dysfunction and Attenuates Oxidative Stress in Streptozotocin-induced Diabetic Rats[J]. Phytotherapy Research,2013,27(1):112-117.
[3]Takasugi M,Shimada K,Yamada K,et al. Effects of Soybean Isoflavones on the Release of Chemical Mediators from Rat Peritoneal Exudate Cells by Allergic ReactioninVitro[J]. Food Science and Technology Research,2014,20(3):725-730.
[4]Wang Q,Ge X,Tian X,et al. Soy isoflavone:the multipurpose phytochemical(Review)[J]. Biomed Rep,2013,1(5):697-701.
[5]Ding BJ,Ma WW,He LL,et al. Soybean isoflavone alleviatesβ-amyloid 1-42 induced inflammatory response to improve learning and memory ability by down regulation of Toll-like receptor 4 expression and nuclear factor-κB activity in rats[J]. International Journal of Developmental Neuroscience,2011,29(5):537-542.
[6]Lee YK,Park OJ. Soybean isoflavone genistein regulates apoptosis through NF-κB dependent and independent pathways[J]. Experimental and Toxicologic Pathology,2013,65(1-2):1-6.
[7]Bao ZS,Hong L,Guan Y,et al. Inhibition of airway inflammation,hyperresponsive-ness and remodeling by soy isoflavone in a murine model of allergic asthma[J]. Int. Immunopharmacol.,2011,11(8):899-906.
[8]Xi YD,Li XY,Ding J,et al. Soy isoflavone alleviates Abeta1-42-induced impairment of learning and memory ability through the regulation of RAGE/LRP-1 in neuronal and vascular tissue[J]. Curr Neurovasc Res,2013,10(2):144-156.
[9]Cao YF,Xing HB,Yang QW,et al. Separation of Soybean Isoflavone Aglycone Homologues by Ionic Liquid-Based Extraction[J]. J. Agric. Food Chem.,2012,60(13):3432-3440.
[10]張佳秀,侯俊財,鄒艷楠,等.大孔樹脂對酶解大豆肽脫鹽效果影響極其最佳條件研究[J].食品工業科技,2014,35(3):203-206.
[11]Baglia ML,Gu K,Zhang X,et al. Soy isoflavone intake and bone mineral density in breast cancer survivors[J]. Cancer Causes Control,2015,26(4):571-80.
[12]李雪玲.大豆異黃酮的提取分離技術研究[D].合肥:安徽農業大學,2006.
[13]蘇小紅.Ab-8型大孔吸附樹脂分離純化大豆異黃酮的研究.[D].蘭州:甘肅農業大學,2006.
[14]袁建,鞠興榮.大豆異黃酮分離與精制工藝研究[J].食品科學,2002,23(8):118-121.
[15]蔡立,郁建平,占建波.豆粕中大豆異黃酮提取純化工藝研究[J].食品科學,2008,29(4):185-188.
[16]牛新春,張守勤,王長征,等.大孔樹脂對豆粕中異黃酮吸附特性的研究[J]. 食品研究與開發,2007,28(4):36-39.
[17]井樂剛,張永忠.用大孔樹脂從大豆乳清中純化大豆異黃酮的一種有效方法[J].化工學報,2006,57(5):1209-1214.
[18]潘廖明.大豆異黃酮提取分離技術及檢測方法研究[D].成都:四川大學,2003.
[19]Yang X,Belosay A,Hartman JA,et al. Dietary soy isoflavones increase metastasis to lungs in an experimental model of breast cancer with bone micro-tumors[J]. Clin Exp Metastasis,2015,32(4):323-333.
[20]孫權,徐俊萍,許惠仙,等.大豆異黃酮抗腫瘤作用的研究[J].食品科技,2009,34(8):60-62.
[21]Hejazi E,Nasrollahzadeh J,Fatemi R,et al. Effects of Combined Soy Isoflavone Extract and Docetaxel Treatment on Murine 4T1 Breast Tumor Model[J]. Avicenna J Med Biotechnol,2015,7(1):16-21.
[22]Liu Y,Hilakivi-Clarke L,Zhang Y,et al. Isoflavones in soy flour diet have different effects on whole-genome expression patterns than purified isoflavone mix in human MCF-7 breast tumors in ovariectomized athymic nude mice[J]. Mol Nutr Food Res,2015,27. doi:10.1002/mnfr.201500028.[Epub ahead of print].
Extraction of soybean isoflavone from byproducts of enzyme-assisted alcohol leaching soybean oil and its activity of anticancer
MU Ying,ZHANG Xiao-nan,XU Jian,ZHANG Hong-wei
(Food Science College of northeast agricultural university,Harbin,Heilongjiang,150030)
The isoflavone was purificated from byproducts of enzyme-assisted alcohol leaching soybean oil by organic solvent extraction and resin adsorption. The purity of isoflavone was investigated by high performance liquid chromatography(HPLC). The human breast cancer cell line MCF-7 was used as the model cells and the affect of soybean isoflavone on the proliferation of MCF-7 cells were studied. The result showed that the optimum extraction solvent for purification of soybean isoflavone was ethyl acetate and n-butyl alcohol mixture(1∶1)and the extraction rate and purity of isoflavone were 70.47% and 26.45%,respectively. The optimum conditions of resin adsorption for extraction of isoflavone were as follows:the adsorption resin was LSA-8,the concentration and flow rate of the sample were 0.8 mg/mL and 0.5 BV/h,respectively,the eluent solution was 75% ethanol and the flow rate and volume of eluent solution were 6 BV/h and 1.5 times of the sample volume,respectively. The extraction rate and purity of soybean isoflavone under the optimal condition of resin adsorption extraction were 83.28% and 71.45%,respectively. The MCF-7 cell experiments suggested that when the concentration of soybean isoflavone was up to 100 mg/L,it could significantly inhibit the proliferation of human breast cancer cell. And the anticancer function of soybean isoflavone was concentration-dependent.
soybean isoflavone;purification;anticancer;MCF-7 cells
2015-05-15
穆瑩(1982-),女,碩士研究生,實驗員,研究方向:食品科學與工程,E-mail:my1982123456@163.com。
TS229
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000

