霉菌利用纖維質原料產乙醇的研究進展
崔田田,張寶善,馮亞運,王金丹,林 敏
(陜西師范大學食品工程與營養科學學院,陜西西安 710119)
?
霉菌利用纖維質原料產乙醇的研究進展
崔田田,張寶善*,馮亞運,王金丹,林敏
(陜西師范大學食品工程與營養科學學院,陜西西安 710119)
利用霉菌發酵纖維質原料生產乙醇技術越來越受到人們的廣泛關注。本文列出了具有潛在產乙醇能力的霉菌種類,介紹了有關霉菌代謝糖類物質的機理及霉菌產乙醇的特點,同時指出不同因素對霉菌發酵產乙醇的影響,這對探索霉菌利用纖維質原料制備乙醇新方法具有一定的指導意義。
纖維質原料,霉菌,乙醇
當前,能源危機已成為世界問題,利用微生物生產燃料酒精等生物能源被認為是解決能源問題的最有效、最能實現的方法之一。現在燃料酒精生產大多以糖類或淀粉質原料為原料,但產量受到糧食資源的限制,難以長期滿足能源需求。人們在尋找新型原料時發現纖維質是一種良好的可再生替代源[1],部分微生物可利用纖維質發酵生產酒精和其他清潔燃料,如金花等人對Mucor indicus利用麥稈水解液發酵生產燃料乙醇進行了研究,結果表明M.indicus較釀酒酵母的顯著優勢在于不僅能利用秸稈水解液中的葡萄糖,而且也能利用其中的木糖產生乙醇[2]。纖維質原料主要包括農作物秸稈、林業加工廢料、甘蔗渣及城市垃圾中所含的廢棄生物質等[3]。一直以來,酵母被認為是生產乙醇的常用菌種,但酵母菌不能將纖維質原料水解成木糖,并將其轉化為酒精,限制了其在纖維素乙醇領域的利用。細菌也能進行酒精發酵,但它們在產乙醇的同時還會產生副產物,致使乙醇的轉化率較低,經濟成本很高[4]。霉菌屬微生物利用纖維質原料也能產酒精,但很少受到關注,這是因為霉菌在傳統上被認為是好氧菌屬,需在有氧條件下生長,而酒精發酵是厭氧過程[5]。其中選用合適的菌種發酵纖維素生產酒精對工業化應用極為重要[6]。現有研究發現部分霉菌具有直接把纖維素轉化為乙醇的能力,這就為我們在同一個生物反應器中,利用同一種微生物完成酶水解纖維質原料成多糖并發酵成酒精的全過程,從而為簡化工藝、降低成本提供了可能[7]。
本文綜述了霉菌利用纖維素原料轉化為酒精的研究進展,列舉了幾種具潛在發酵酒精能力的霉菌種類,介紹了霉菌發酵糖類物質的機理、霉菌產酒精的特點以及影響其酒精發酵的因素,同時提出了目前霉菌產酒精存在的問題,并對其未來的應用進行了展望。
1 產酒精的霉菌種類
霉菌一般可在較高溫度下生存,且其產酒精經常伴隨著有氧菌絲生長及無氧發酵兩個階段,且霉菌可利用多種糖類物質尤其是酵母所不能利用的戊糖類,部分霉菌可將纖維素類物質直接轉化為酒精。有報道能產乙醇的霉菌包括尖鐮孢菌(Fusarium)、根霉屬(Rhizopus)、毛霉屬(Mucor)、粗糙脈孢菌(Neurospora)、念珠菌屬(Monilia)、擬青霉屬(Paecilomyces)、和曲霉屬(Aspergillus)等。
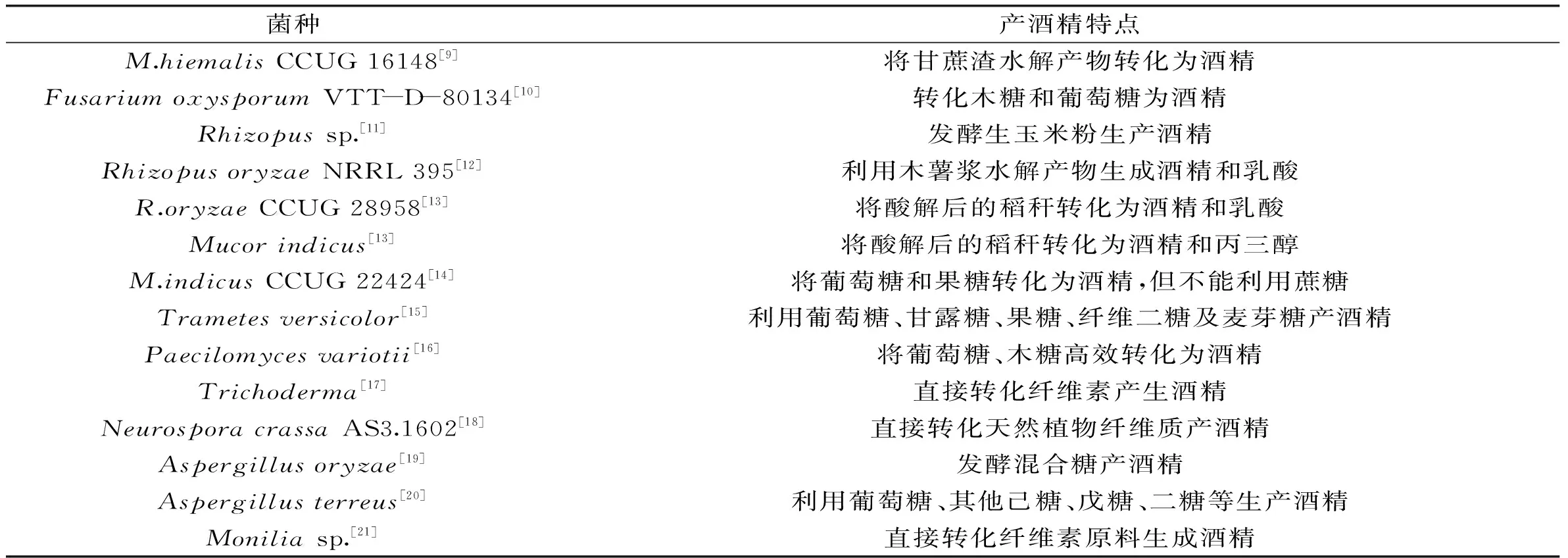
表1 產乙醇霉菌種類及其特點
Lubbehusen等人研究了Mucorcircinelloides采用液態深層分批發酵方式,利用多種碳源產酒精的情況,結果表明M.circinelloides在不限氧條件下可利用葡萄糖產生酒精,而其轉化半乳糖及木糖產酒精能力相對較弱[8]。Goshadrou等人采用Mucorhiemalis作為發酵菌種對不同預處理的甘蔗渣進行發酵,其中利用堿液輔助超聲破碎法處理后的甘蔗渣水解物M.hiemalis具有較高的酒精轉化率,發酵24h酒精產率達到0.70g/L(h[9]。美國人Stevenson在農場的奶牛尿中分離出一株菌,在厭氧的條件培養,能直接將纖維素發酵成酒精,產量為0.4g/L,經鑒定此菌株為木霉[17]。張志華對N.crassa AS3.1602好氧產酶和厭氧直接發酵產生酒精的過程進行了代謝分析,以20g/L的微晶纖維素為碳源進行產酶培養,好氧發酵3d時菌體處于穩定期,所產生的酶活性都處于較高水平。厭氧條件下直接轉化20g/L的微晶纖維素,發酵96h時酒精濃度可達到6.3g/L[18]。Gong等人發現Monilia sp.能夠將高于70%的濾渣和60%的微晶纖維素轉化為酒精,并且乙醇產量分別達到16、12g/L[21]。研究表明Monilia sp.還可以利用半纖維素及果膠,由于農業殘渣的主要成分是半纖維素因而提高了該菌種工業化應用的潛在能力。表1列出了可以產乙醇的霉菌種類及其特點。
2 霉菌轉化纖維質產乙醇的機理
霉菌可利用纖維質降解的糖類物質如葡萄糖、木糖、阿拉伯糖等生產乙醇。到目前為止,關于霉菌直接將纖維素轉化為酒精的報道很少,而F.oxysporum[10]和N.crassa[18]被發現具有將水解和酒精轉化過程同時進行的能力。
利用微生物轉化纖維質原料產乙醇的步驟有兩步[6]:纖維素水解成可發酵性糖,微生物將可發酵性糖轉化為酒精。有關微生物代謝葡萄糖產生酒精的機制已經很清楚,霉菌和酵母菌是通過EMP途徑將葡萄糖轉化為酒精。EMP途徑大致可分為兩個階段:第一階段只是生成兩分子的主要中間代謝產物3-磷酸-甘油醛;第二階段發生氧化還原反應,釋放能量合成ATP,同時形成兩分子的丙酮酸。理論上1g葡萄糖可產生0.51g乙醇和0.49g CO2,乙醇及CO2產生實際值分別為0.46、0.44g,因為有0.1g的葡萄糖轉化為生物質。盡管微生物自身代謝機制可以促進葡萄糖進入細胞,但糖代謝過程影響因素很復雜,目前還沒完全被大家所熟知。在酵母屬中發現兩條主要的抑制葡萄糖代謝因素包括巴斯德效應及葡萄糖效應。
對于利用木糖代謝,第一步要將木糖轉化為木酮糖,細菌可直接利用木糖異構酶將木糖轉化為木酮糖,而對于擬青霉屬,在戊糖代謝初始階段中會檢測到一系列的酶,這些酶常見于酵母屬和霉菌屬。在該氧化還原途徑中,木糖首先在NAD(P)作為輔酶的木糖還原酶作用下變為木糖醇,接著在木糖醇脫氫酶作用下重新氧化成木酮糖[22]。該氧化還原途徑已被證明存在于大多數常見的霉菌中,本過程中涉及到的木糖還原酶及木糖醇脫氫酶具有可誘導性,并且專一作用于D-木糖及木糖醇,但細菌中的木糖異構酶不具有可誘導性。在木糖轉化為木酮糖后,由D-木酮糖磷酸化生成D-木酮糖-5-磷酸,之后進入磷酸戊糖途徑,以中間產物葡萄糖-6-磷酸和甘油醛-3-磷酸進入EMP途徑,最終在厭氧條件下生成乙醇,如圖1。戊糖代謝途徑遠比己糖代謝復雜,這也是霉菌利用戊糖產酒精較己糖低的原因。
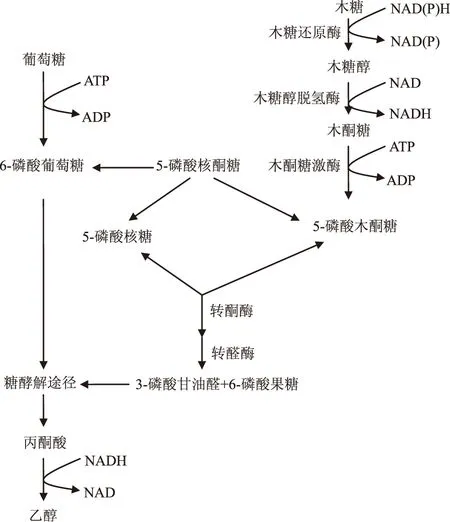
圖1 霉菌利用單糖代謝途徑Fig.1 Pathway for monosaccharide catabolismin filamentous fungi
3 霉菌發酵產乙醇的特點
3.1同步糖化和生物轉化
纖維質經微生物轉化為乙醇的傳統工藝主要包括兩步:首先在酶解糖化作用下將多糖降解為單糖;其次將單糖轉化為乙醇。為了提高工業效率,有研究者采用不同的纖維素酶產生菌與酒精發酵菌種共同培養,使酶解與產酒精過程在同一反應器中進行。采用同步糖化發酵法可以緩解終產物抑制作用,因為水解后產生的葡萄糖在該系統中可以很快轉化為乙醇。
F.oxysporum因其具有產多糖酶及發酵糖類物質產酒精能力而使它成為同步糖化與生物轉化的理想菌種。Panagiotou等人將F.oxysporumF3置于30℃,pH6的培養液中孵育72h,該階段為菌種的生長產酶期,通過調節攪拌速率將氧濃度控制在30%;之后將菌種接入濃度為20g/L的纖維素漿液中進行厭氧發酵。結果表明F.oxysporumF3在纖維素基質中最大比生長速率達到0.023h-1,且產內切葡聚糖酶、β-葡聚糖酶及纖維二糖酶活性分別為55、1.25、0.43U/mL,其發酵纖維素生成乙醇得率為0.35g/g[23]。近年來,Zerva等人實驗證明Paecilomycesvariotii可將葡萄糖、木糖轉化為乙醇,即使在有葡萄糖存在時仍優先利用木糖,該菌種不僅能產生可降解纖維素的酶,并能將水解底物轉化為乙醇,且最大乙醇產量接近理論值[24]。
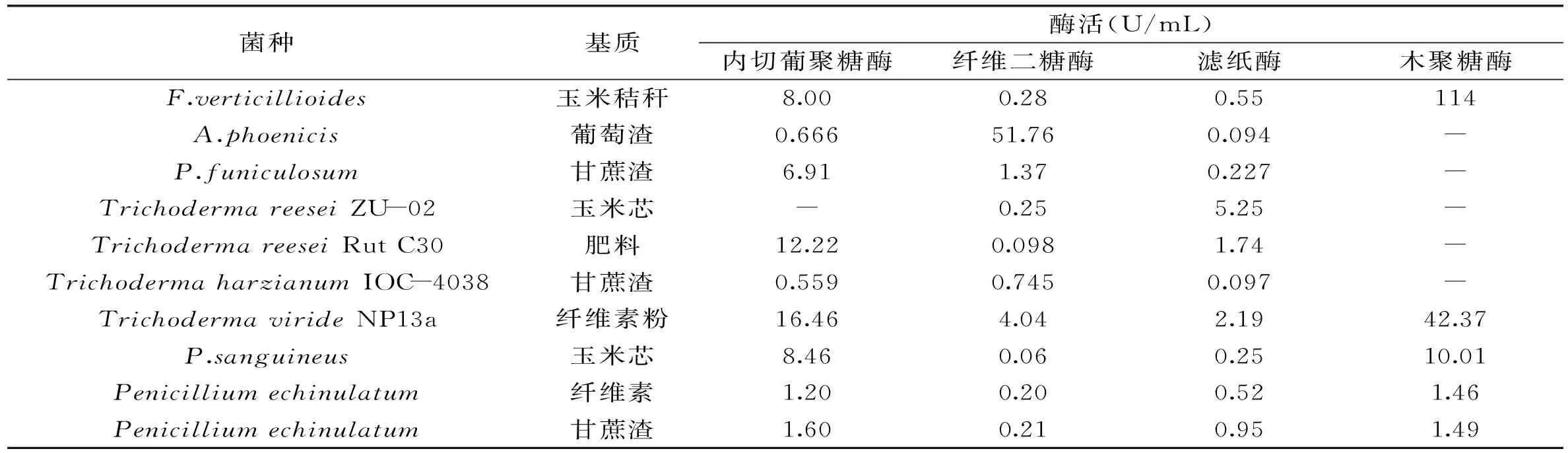
表2 不同種類真菌產纖維素酶及木聚糖酶活性的比較[18]
3.2直接生物轉化纖維素原料
霉菌直接將纖維素原料生物轉化是一項極具潛力的產乙醇方法,原因在于僅利用單一菌種即可將基質的有氧水解和半厭氧條件下的乙醇發酵過程同時進行,既可產生水解酶又能進行酒精發酵。
3.2.1多糖酶的產生纖維素酶是一種多組分的復合酶,現已確定纖維素酶含有3種主要組分,即內切葡萄糖苷酶(EC3.2.1.4)、外切葡萄糖苷酶(EC3.2.1.91)和纖維二糖酶(EC3.2.1.21)。在纖維素水解過程中首先由內切葡萄糖苷酶在纖維素鏈內部水解,降低其聚合度,然后由外切葡萄糖苷酶作用于非還原性末端釋放出纖維二糖;最后由纖維二糖酶將纖維二糖水解為葡萄糖。有多種微生物能夠產生纖維素酶,例如細菌、放線菌、絲狀真菌、粘細菌、擔子菌和其他高等形式軟體動物等。研究發現,某些微生物可以合成纖維素酶,但無法將水解得到的糖轉化為酒精。而某些微生物可將蔗糖轉化為酒精,但卻不能合成能夠水解纖維素的多糖酶。只有極少一部分絲狀真菌既能水解多糖又可以將水解產物轉化為酒精,如表2所示。
Gong等人從甘蔗渣中分離的Moniliasp.可以利用多糖包括纖維素產生酒精,并產生纖維素酶及木聚糖酶。在菌種培育48h后可以檢測到纖維素酶的活性,當纖維素作為發酵基質時,可以檢測到纖維素酶和木聚糖酶的活性[21]。有研究發現鏈霉菌屬(Streptomyces)在木聚糖作為碳源時也可以產生木聚糖酶,但木聚糖不是它們產生木聚糖酶所必需的,因為在純纖維素或葡萄糖作為碳源時檢測到高活性的木聚糖酶[25]。在同步發酵中,酒精對纖維素酶產生非競爭性抑制,而產酒精霉菌所產生的纖維素酶在整個生物轉化過程中都保持其穩定性。
3.2.2乙醇的轉化由于纖維素直接發酵法生產乙醇具有工藝簡單,歷時短,有望大幅度降低產酶成本以及纖維素乙醇生產總成本,近二十年來該項技術研究受到了國內外學者的廣泛重視,有研究者報道了以嗜溫細菌(Clostridiumthermocellum)和C.thermohydrosulfuricum以及絲狀真菌N.crassa,Moniliasp.和F.oxysporum進行纖維素直接發酵生產乙醇[26]。
4 影響霉菌產乙醇的因素
4.1通氣量
研究發現大部分霉菌在有氧情況下生長,在半厭氧狀態下產乙醇。通氣量對霉菌利用基質中的碳源及最終乙醇的轉化量具有重要影響,乙醇積累只發生在低氧條件下。在缺氧情況下,霉菌生長受到限制,隨著氧氣的限制量增加,乙醇的積累量表明氧氣利用率是決定乙醇產量的一個重要因素。隨著氧氣限制的增加,菌體生長能力減弱,而乙醇產量逐漸增加。
Dogaris等人研究發現N.crassa產乙醇的兩個階段為:有氧生長階段,粗糙脈孢菌在有氧條件下生長,逐漸產生纖維素酶及半纖維素酶;厭氧發酵階段,將菌種由生長瓶轉移至特制錐形瓶中,該瓶頂部裝有針孔橡膠塞以降低氧氣的滲入同時排出CO2,該裝置同樣適用于F.oxysporum[27]。Lubbehusen等人研究發現卷枝毛霉不僅可以在完全厭氧條件下生長,并且能夠在葡萄糖過量時有氧條件下產生乙醇[28];Kurakov等人從不同地區篩選出多株霉菌在厭氧條件下利用葡萄糖發酵生產酒精,其最大生產量達到2.5%~4.7%,幾乎接近于酵母屬發酵生產酒精量[29]。Karimi等人發現在基質葡萄糖濃度高于30g/L無氧條件下培養有助于提高M.indicus產生酒精量[30],另外由于M.indicus具有形態二相性,孢子濃度的大小以及所處環境中氧氣的含量都會對該菌形態產生一定的影響[31]。
Rasika等人研究白腐菌Trametes versicolor在完全缺氧及低氧含量兩種條件下利用木糖與己糖混合物發酵產乙醇,結果表明T.versicolor低氧條件下發酵354h后酒精轉化率達到最大20g/L,而完全厭氧條件下未檢測到乙醇的產生[32]。Xiros和Christakopoulos以樹膠醛糖∶木糖∶葡萄糖(1∶2∶1)混合糖作為發酵基質,在通氣率分別為0、0.1、0.2及0.4vvm時觀察F. oxysporum利用混合糖產乙醇的情況。結果顯示在所有通氣條件下,乙醇產量72h時達到最大,而在完全厭氧條件下乙醇轉化較慢,120h后乙醇量才達到最大值;當通氣率為0.1、0.2 vvm,發酵72h后基質中檢測不到木糖,而在完全缺氧條件下F. oxysporum對木糖的吸收較慢,這說明少量通氣對F. oxysporum利用木糖發酵產乙醇是極為必要的[33]。由此可見通氣量是影響霉菌生物轉化乙醇的一個重要因素,通過調節氣體比例可獲得較高產量的乙醇。
4.2碳源
到目前為止,生產乙醇主要采用傳統的釀酒酵母(Saccharomycescerevisiae),然而Saccharomycescerevisiae并不能很好的適用于木質纖維原料的發酵,它只能發酵葡萄糖、果糖、麥芽糖和蔗糖,不能轉化半纖維素中的戊糖。由于在木質纖維素原料中存在大量的半纖維素,所以這一點限制了酵母菌的應用[1]。
研究發現部分霉菌可產生降解纖維素酶,并將水解產物中的所有糖類物質轉化為乙醇。N.crassa是一種能夠利用多種碳源包括纖維素、木糖、樹膠醛糖、甘露糖、半乳糖以及葡萄糖生產酒精的霉菌,該菌種現以被廣泛應用于基因學、生物化學以及分子生物學[34]。Dogaris等人采用經稀酸前處理的甘蔗渣,分別以N.crassa、S.cerevisiae以及二者混合菌種作為發酵菌,結果表明N.crassa乙醇轉化能力高于S.cerevisiae,混合菌種發酵反而降低了乙醇產量[27]。另外,Paecilomycessp.NF1也可以利用多種糖作為碳源產生乙醇,Zhang等人通過研究發現P.chrysosporium是目前利用木糖產生乙醇量最大的菌種,產酒精量可高達73g·L-1/200g·L-1木糖,且只產生痕量的其他副產物[35]。
Sharifia采用M.indicus作為發酵菌種,分別利用不同的糖類物質作為碳源,結果表明M.indicus可以利用糖漿中的葡萄糖、果糖產生乙醇,而不能直接利用蔗糖發酵產生酒精[14]。Millati 等人對Rhizopus,Rhizomucor,及Mucor分別利用葡萄糖、木糖和稀酸水解物作為碳源進行乙醇發酵,結果表明其中兩株毛霉M.hiemalis和M.indicus產酒精量較高,其他菌種代謝除產生乙醇外,還會產生乳酸、丙三醇等副產物[36]。Colabardini 等人將A.nidulans的木糖轉運蛋白基因導入酵母屬進行表達,提高了酵母屬對戊糖的利用率[37]。Rasika等人用Trametesversicolor發酵木質素降解的己糖和木糖,結果表明在以己糖和木糖單獨作為碳源時產酒精量分別為20.0、9.02g/L,當葡萄糖與木糖等比例時,總糖發酵產乙醇可達到80%[32]。
4.3氮源
有關氮元素對霉菌的生長及代謝的影響已經為大家熟知,銨離子可以通過ATP抵消對磷酸果糖激酶的抑制作用,進而促進糖酵解,其還可以刺激微生物生長,降低細胞內的NADH水平,阻遏6-磷酸葡萄糖脫氫酶,從而促進了磷酸戊糖途徑的進行。很多學者對一系列的有機氮和無機氮進行了研究,如表3所示,Asachi等人利用M.indicus的菌體自溶物代替酵母膏,結果顯示當添加菌體自溶物10g/L時,乙醇得率為0.47g/g,產率達到0.71g/L·h,相比于添加酵母膏的乙醇得率及產率分別為0.45、0.67g/L·h,乙醇產量明顯提高[33]。
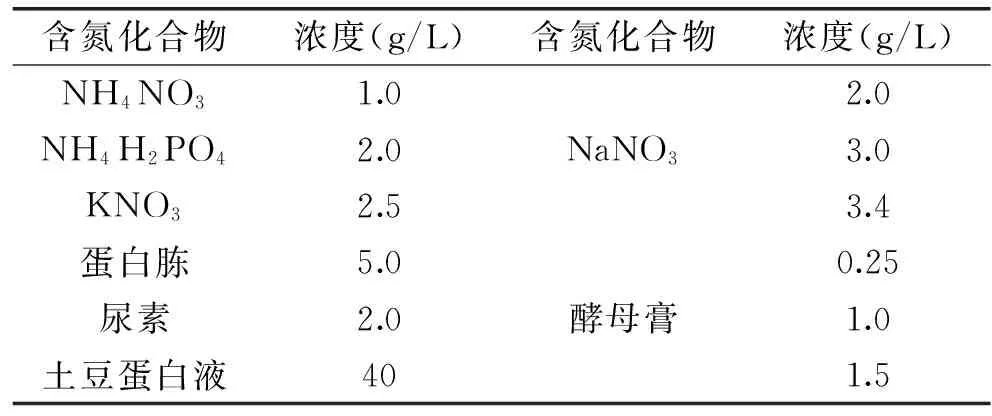
表3 霉菌生物轉化過程中利用的含氮化合物[39]
Zerva和Savvides采用尿素、NaNO3、NH4NO3、(NH4)2HPO4、(NH4)2SO4、蛋白胨及酵母膏作為氮源,以Paecilomyces variotii為發酵菌種利用等濃度葡萄糖、木糖作為發酵基質,結果表明以硝態氮作為氮源產乙醇量明顯較高[16]。
4.4礦物質及維生素
有關礦物質及微量元素對微生物代謝物的生物合成影響早有報道,但對霉菌產酒精的影響鮮有研究。有研究發現微量元素如Fe、Zn、Cu和Mn可以促進Polyporusanceps的生長,而鈷在濃度為1~100mg/L時產生毒性,鉬對霉菌生長基本無影響。另外發現,硫胺素對P.anceps的生長起著至關重要的作用,隨著基質中硫胺素濃度的增加,菌絲的重量增加,同時葡萄糖消耗量及乙醇產生量也隨之增加[40]。Marzieh等人研究了磷酸鹽對M.indicus產酒精量的影響,在基質中添加0.5g/L的KH2PO4,不僅提高了葡萄糖胺的產量,同時也增加了乙醇產量[41]。
4.5接種期
接種期是影響纖維質轉化為乙醇的一個重要因素,研究發現將菌種在營養液中搖床培養一段時間后獲得菌體懸浮液接種至發酵基質,相比于直接從瓊脂斜面中獲得的菌體,前者所產生的乙醇量明顯較高。Goshadrou等人在研究M.hiemalis利用甘蔗渣發酵產乙醇情況時,前期要進行接種準備,主要包括在營養瓊脂上的活化以及在合適條件下進行搖床培養以獲得孢子懸浮液,之后接種至發酵基質中進行發酵[9]。另外,接種量會通過改變生物過程的延遲期,進而影響發酵過程中的乙醇產量。Molaverdi等人研究了不同接種量對M.indicus固態發酵高粱秸稈產酒精的影響,當初始菌種濃度為0.001、1及5g/L對乙醇發酵的影響表現為隨著濃度的增加,乙醇產量也隨之增加[42]。Dogaris等人在利用N.crassa將高粱渣轉化乙醇實驗中,將菌種在有氧條件下培養48h后獲得高濃度孢子懸浮液,取一定量的孢子液接入高粱渣水解液中,結果表明隨接種量的增加,酒精產生量也增加[27]。
4.6pH
最初學者們選取霉菌發酵產酒精的pH一般為5.0~6.0,Xiros和Christakopoulos利用F.oxysporum產乙醇最適pH為5.5,而當pH為6.0時,會產生較多的乳酸[33];N.crassa產乙醇最適pH范圍在5~6之間,這也是纖維素酶作用的最適pH[28];Paecilomycessp. NF1發酵最適pH范圍較廣,當pH在2.2~7.0時,可產生相同量的乙醇[16];而對于F.oxysporumF3,pH對其酒精產量的影響,在有氧和無氧情況下,最適pH分別為5.5和6.0。有氧條件下,低pH會導致酒精產量下降,因而調整最初pH在最適條件下既有利于β-葡萄糖苷酶的活性又有利于乙醇的產生[23]。
4.7溫度
乙醇發酵溫度一般在25~37℃,如表4所示,研究發現不同菌種的最佳發酵溫度不一致。N.crassa利用葡萄糖發酵生產乙醇時的最適溫度為28~37℃,而其利用纖維質原料發酵產乙醇時的最佳溫度為37℃,該溫度下90%的纖維素在4天后轉化為乙醇[28]。同樣,Paecilomycesp.發酵最適溫度范圍是30~37℃[16],而M.indicus發酵高粱秸桿產乙醇最適溫度為32℃[42]。
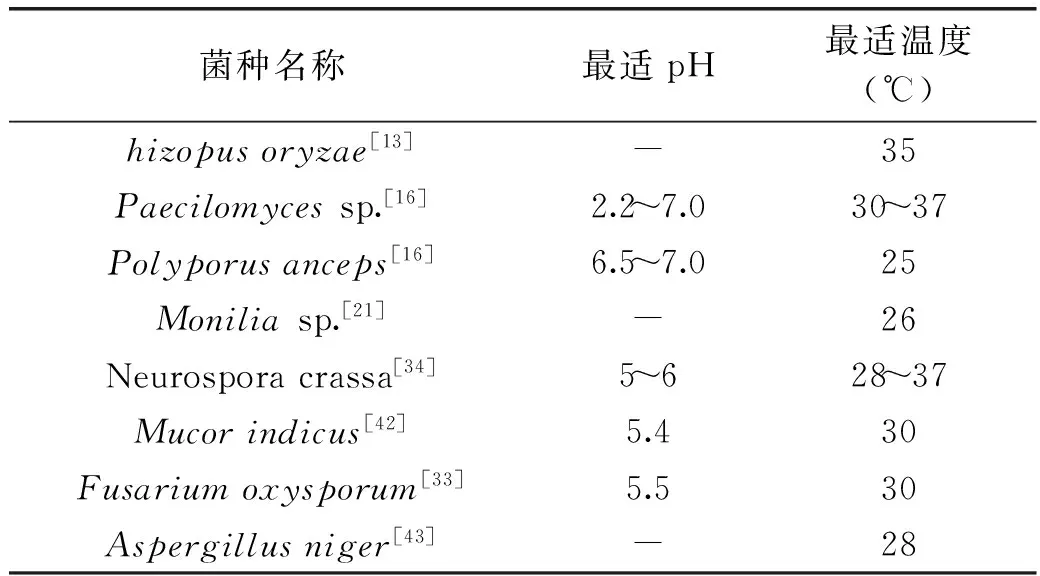
表4 霉菌產乙醇的最適溫度及pH
5 霉菌產乙醇存在問題及展望
利用霉菌以纖維質原料生產乙醇是緩解化工原料消耗的一種有效手段,具有成本低、生產設備簡單以及可再生性等優點,對未來燃料酒精的生產發展具有無限潛力。但目前利用霉菌生產酒精仍未投入工業化生產,原因在于該方法生產酒精仍存在一些問題:第一,纖維素生物質中除了含有大量的纖維素外,還有大約20%~30%的半纖維素,而半纖維素水解成分組成中含有五碳糖(主要為木糖),霉菌利用木糖發酵酒精的效率仍相對較低。第二,半纖維素經預處理和水解過程后還產生了小分子酸、醛類、酚類等發酵抑制劑,更加大了發酵難度。第三,所采用的同步糖化發酵法還存在一定的缺點,例如最佳的水解和最佳的發酵需要不同的溫度,最佳水解溫度為45~50℃,而最佳的發酵溫度為28~35℃。SSF常在35~38℃下操作,這一折中處理使酶的活性和發酵的效率都不能達到最大[44]。
到目前為止,盡管還沒找到完全令人滿意的將纖維質轉化為乙醇的菌種,但利用一些霉菌將纖維素、淀粉以及戊糖轉化為酒精仍給生產化工原料帶來了經濟效益。此外,通過對比不同因素對霉菌發酵乙醇的影響可知,嚴格控制通氣量相較于其他因素對乙醇產量的影響顯著,因而需在進一步工業化生產乙醇產業中通過調節氣體比例以提高酒精產量。目前生產燃料酒精是以玉米為原料,但原料成本占總成本的70%~80%。纖維素是地球上最豐富、最廉價可再生資源,因此研究開發纖維素轉化技術,將秸稈、蔗渣、廢紙、垃圾纖維等纖維素類物質高效轉化為糖,進一步發酵成乙醇,對開發新能源,保護環境,具有非常重要現實意義。
[1]陰春梅,劉忠,齊宏升.生物質發酵生產乙醇的研究進展[J]. 釀酒科技,2007(1):87-90.
[2]金花,陸軍,李濤,等.麥稈水解液發酵生產燃料乙醇的研究[J].釀酒科技,2007,162(12):25-27.
[3]張寧,蔣劍春,等.木質纖維生物質同步糖化發酵生產乙醇的研究進展[J].化工進展,2010,29(2):238-242
[4]賈莉華.木質纖維素生產乙醇的研究進展[J]. 林產工業,2007,34(5):10-12.
[5]Carmen Sánchez. Lignocellulosic residues:Biodegradation and bioconversion by fungi[J]. Biotechnology Advances,2009(27):185-194.
[6]孫逸,賀稚非.纖維素發酵生產酒精的研究進展[J]. 農產品加工,2009(4):70-73.
[7]Nanda Sonil,Mohammad Javeed,Reddy S N,et al. Pathways of lignocellulosic biomass conversion to renewable fuels[J]. Biomass Conv Bioref,2014,4:157-191.
[8]Lubbehusen T L,Nielsen J,McIntyre M. Aerobic and anaerobic ethanol production byMucorcircinelloidesduring submerged growth[J]. Appl Microbiol Biotechnol,2004(63):543-548.
[9]Goshadroua Amir,Karimi Keikhosro,Taherzadeh M J. Bioethanol production from sweet sorghum bagasse byMucorhiemalis[J].Indstrial Crops and Products,2011,34:1219-1225.
[10]Ruiz E,Romero I,Moya M,et al. Sugar fermentation byFusariumoxysporumto produce ethanol[J]. World J Microbiol Biotechnol 2007,23:259-267.
[11]Wang Li-Sen,Ge Xiang-Yang,Zhang Wei-Guo. Improvement of ethanol yield from raw corn flour byRhizopussp.[J]. World J Microbiol Biotechnol,2007,23:461-465.
[12]Thongchul N,Navankasattusas S,Yang Shang-Tian. Production of lactic acid and ethanol byRhizopusoryzaeintegrated with cassava pulp hydrolysis[J]. Bioprocess Biosyst Eng,2010,33:407-416.
[13]Karimi Keikhosro,Emtiazi Giti,Taherzadeh M J. Ethanol production from dilute-acid pretreated rice straw by simultaneous saccharification and fermentation withMucorindicus,Rhizopusoryzae,andSaccharomycescerevisiae[J]. Enzyme and Microbial Technology,2006,40:138-144.
[14]Sharifia Mahnaz,Karimi Keikhosro,Taherzadeh M J. Production of ethanol by filamentous and yeast-like forms ofMucorindicusfrom fructose,glucose,sucrose,and molasses[J]. J Ind Microbiol Biotechnol,2008,35:1253-1259.
[15]Okamoto K,Uchii A,Kanawaku R,et al. Bioconversion of xylose,hexoses and biomass to ethanol by a new isolate of the white rot basidiomyceteTrametesversicolor[J]. SpringerPlus,2014,3:121.
[16]Zerva A,Savvides AL,Katsifas EA,et al. Evaluation ofPaecilomycesvariotiipotential in bioethanol production from lignocellulose through consolidated bioprocessing[J].Bioresource Technology,2014,163:294-299.
[17]Stevenson D M,Weimer P J. Isolation and characterization of aTrichodermastrain capable of fermenting cellulose to ethanol[J].Appl Microbiol Biotechnol,2002,59:721-726.
[18]張志華. 粗糙脈孢菌AS3.1602乙醇發酵的代謝研究[D].山東:山東大學,2007.
[19]Yang Siyoung,Choi Seung Jun,Kwak Jungki,et al.AspergillusoryzaeStrains Isolated from Traditional Korean Nuruk:Fermentation Properties and Influence on Rice Wine Quality[J]. Food Sci Biotechnol,2013,22(2):425-432.
[20]Almeida M N,Guimar?es V M,Falkoski D L,et al. Optimization of Endoglucanase and Xylanase Activities fromFusariumverticillioidesfor Simultaneous Saccharification and Fermentation of Sugarcane Bagasse[J]. Appl Biochem Biotechnol,2014,172:1332-1346.
[21]Gong CS,Mann CM,Tsao GT. Direct fermentation of cellulose to ethanol by a cellulolytic filamentous fungus,Moniliasp[J]. Biotechnol Lett,1981(3):77-82.
[22]Jeffries T W. Utilization of Xylose by Bacteria,Yeasts,and Fungi.
[23]Panagiotou G,Christakopoulos P,Olsson L. Simultaneous saccharification and fermentation of cellulose byFusariumoxysporumF3-growth characteristics and metabolite profiling[J]. Enzyme and Microbial Technology,2005,36:693-699.
[24]Zerva A P,Stathopoulou P M,Katsifas E A,et al. The filamentous fungusPaecilomycesvariotiias a potential candidate for bioethanol production via consolidated bioprocessing of lignocellulosics[J]. New Biotechnology,2012,29:23-26.
[25]Brito-Cunha C C Q,Campos I T N,Faria F P. Screening and Xylanase Production by Streptomyces sp. Grown on Lignocellulosic Wastes Appl Biochem Biotechnol,2013,170:598-608.
[26]Balusu R,Paduru R M R,Seenayya G.,et al. Production of Ethanol From Cellulosic Biomass by Clostridium thermocellum SS19 in Submerged Fermentation[J]. Applied Biochemistry and Biotechnology,2004,117:133-141.
[27]Dogaris Ioannis,Gkounta Olga,Mamma Diomi,et al. Bioconversion of dilute-acid pretreated sorghum bagasse to ethanol By Neurospora crassa[J]. Appl Microbiol Biotechnol,2012,95:541-550.
[28]Lubbehusen TL,Nielsen J,McIntyre M. Aerobic and anaerobic ethanol production byMucorcircinelloidesduring submerged growth[J]. Appl Microbiol Biotechnol,2004(63):543-548.
[29]Kurakov AV,Khidirov KS,Sadykova VS,et al. Anaerobic Growth Ability and Alcohol Fermentation Activity of Microscopic Fungi[J]. Prikladnaya Biokhimiya Mikrobiologiya,2011,47(2):187-193.
[30]Karimi K,Zamani A.Mucorindicus:biology and industrial application perspectives:a review[J]. Biotechnology Advances,2013(31):466-481.
[31]Patrik RL,Keikhosro K. Effects of different growth forms ofMucorindicuson cultivation on dilute-acid lignocellulosic hydrolyzate,inhibitor tolerance,and cell wall composition[J]. Journal of Biotechnology,2009(143):255-261.
[32]Rasika L,Kudahettige,Marie Holmgren,et al. Characterization of bioethanol production from hexoses and xylose by the White Rot Fungus Trametes versicolor[J]. Bioenergy Res,2012(5):277-285.
[33]Xiros Charilaos,Christakopoulos Paul. Enhanced ethanol production from brewer’s spent grain by a Fusarium oxysporum consolidated system[J]. Biotechnology for Biofuels,2009,2:1-12.
[34]Dogaris Ioannis,Mamma Diomi,Kekos Dimitris. Biotechnological production of ethanol from renewable resources byNeurosporacrassa:an alternative to conventional yeast fermentations?[J]. Appl Microbiol Biotechnol,2013,97:1457-1473.
[35]Zhang BS. Process for preparing fuel ethanol by using straw fiber materials. 2006,Patent CN1880416.
[36]Millati R,Edebo L,Taherzadeh M J. Performance ofRhizopus,Rhizomucor,andMucorin ethanol production from glucose,xylose,and wood hydrolyzates[J]. Enzyme and Microbial Technology,2004(2-3):294-300.
[37]Colabardini AC,Ries LNA,Brown NA. Functional characterization of a xylose transporter inAspergillusnidulans[J].Biotechnology for Biofuels,2014(7):46-50.
[38]Asachi Reihaneh,Karimi Keikhosro,Taherzadeh M J. Fungal autolysate as a nutrient supplement for ethanol and chitosan production byMucorindicus[J]. Biotechnol Lett,2011,33:2405-2409.
[39]Ajay Singh,P K R. Kumar,K Schiigerl. Bioconversion of Cellulosic Materials to Ethanol by Filamentous Fungi[J]. Advances in Biochemical Engineering,1992(45):30-52.
[40]Volz P A,Beneke E S. Nutritional regulation of basidiocarp formation and mycelial growth of Agaricales[J]. Mycopathologia et mycologia applicata 1969,37(3):225-253.
[41]Marzieh M,Akram Z,Keikhosro K. Effect of phosphate on glucosamine production by ethanolic fungusMucorindicus[J]. Appl Biochem Biotechnol,2013,171:1465-1472.
[42]Molaverdia Maryam,Karimi Keikhosro,Khanahmadi Morteza,et al. Enhanced sweet sorghum stalk to ethanol by fungusMucorindicususing solid state fermentation followed by simultaneous saccharification and fermentation[J]. Industrial Crops and Products,2013,49:580-585.
[43]Acourene S,Ammouche A. Optimization of ethanol,citric acid,α-amylase production from date wastes by strains ofSaccharomycescerevisiae,Aspergillusniger,andCandidaguilliermondii[J]. J Ind Microbiol Biotechnol,2012,39:759-766.
[44]樂易林,邵蔚藍.纖維素乙醇高溫發酵的研究進展與展望[J].生物工程學報,2013,29(3):274-284.
Advances in bioconversion of cellulosic materials to ethanol by moulds
CUI Tian-tian,ZHANG Bao-shan*,FENG Ya-yun,WANG Jin-dan,LIN Min
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710119,China)
Ethanol production,using cellulosic materials by moulds,has been paid more and more attention. The recent development of the ethanol production from cellulosic materials has been reviewed,including the potential fungal strains,the carbohydrate metabolism in moulds,the characteristics of ethanol producing moulds and the factors affecting ethanol production,in this paper,which has a certain guiding significance for exploring a new method to produce ethanol from cellulosic materials by moulds.
cellulosic materials;moulds;ethanol
2014-10-27
崔田田(1990-),女,在讀碩士,主要從事食品發酵與質量控制研究。
張寶善(1968-),男,教授,副院長,主要從事于食品微生物學、食品發酵學、果蔬加工學的教學、科研與生產服務工作。
TS201.3
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000

