低溫高效降解玉米秸稈復合菌系發酵條件優化及腐解菌劑的研究
胡海紅,孫繼穎*,高聚林,王 振,包鬧干朝魯,胡樹平,青格爾(.內蒙古農業大學農學院,呼和浩特 0008;.內蒙古農業大學職業技術學院,內蒙古 包頭 0400)
低溫高效降解玉米秸稈復合菌系發酵條件優化及腐解菌劑的研究
胡海紅1,孫繼穎1*,高聚林2,王振1,包鬧干朝魯1,胡樹平2,青格爾1
(1.內蒙古農業大學農學院,呼和浩特 010018;2.內蒙古農業大學職業技術學院,內蒙古 包頭 014100)
為解決北方低溫條件下玉米秸稈降解難的問題,利用篩選于鋸末的一組玉米秸稈降解復合菌系GF-S72,通過單因素、正交試驗及載體生物相容性試驗,研究了復合菌系的發酵條件、菌劑載體類型、用量及保存條件。結果表明,復合菌系GF-S72最佳發酵條件為:尿素0.1%、碳氮比20∶1、培養溫度10℃、初始pH為8.0、裝液量18 mL/150 mL、培養時間6 d、接種量2%。基于試驗選取硅藻作為最佳載體,在菌液∶載體=3∶1、菌劑與秸稈配比為0.05 g/2 g,制備低溫高效降解玉米秸稈復合型菌劑。試驗結果還表明,pH值為8.2、含水量為1.42%、保藏濕度為10%、保藏溫度為15℃時,復合型菌劑降解玉米秸稈的效率最高。
玉米秸稈;降解;復合菌系;發酵
胡海紅,孫繼穎,高聚林,等.低溫高效降解玉米秸稈復合菌系發酵條件優化及腐解菌劑的研究[J].農業環境科學學報,2016,35(8):1602-1609.
HU Hai-hong,SUN Ji-ying,GAO Ju-lin,et al.Optimization of fermentation conditions for low-temperature and high-efficiency composite microbial system for corn stover degradation and preliminary development of microbial inocula[J].Journal of Agro-Environment Science,2016,35(8):1602-1609.
秸稈通常占作物生物量的50%以上,是極為豐富且能直接利用的可再生有機資源[1]。據統計,我國約有35.3%的秸稈在田間焚燒[2],不僅造成大量秸稈資源的浪費而且污染環境,影響交通安全,也不利于土壤質量的培育和農業的可持續發展[3-4]。秸稈還田是增加土壤有機質含量、全面提升地力的有效途徑[5-7],秸稈還田增加了土壤有機質的含量,改善了土壤理化性狀[8-11],對促進農業的可持續發展起到重要作用。但是在北方春玉米地區,由于秋冬季氣溫低,導致玉米秸稈腐解緩慢,甚至不能完全降解,對農田土壤整地播種質量產生不利影響[12-15],因而北方地區秸稈還田比例僅為30.9%,蒙新地區甚至僅為7.4%和5%。目前,秸稈腐解菌的研究主要集中在中高溫或者常溫條件下,這些菌株不適合在北方地區低溫條件下應用,有關低溫秸稈腐解菌的研究鮮有報道。因此,研發低溫條件下高效快速分解秸稈的菌劑是推進北方春玉米地區玉米秸稈還田的重要措施。
研究證實,天然復合菌系對秸稈的腐解效果顯著優于人工純培養的微生物[16-17]。Kato等[18]將天然復合菌系中分離的微生物重新組合后,發現復合菌系中非纖維素菌群對菌系纖維素的降解起了非常重要的作用。20世紀中葉以來,科學家們獲得了大量天然降解秸稈的真菌,尤以木霉屬(Trichoderma)、青霉屬(Penicillium)、漆斑霉屬(Myrothecium)、毛殼霉屬(Chaetomium)、曲霉屬(Aspergillus)等為主[19-23]。
國內外對高效秸稈菌劑及發酵條件的研發取得了一定進展。金海洋等[24]使用經過芽孢桿菌屬和分解脂肽梭菌屬組合的菌劑處理的秸稈,在30℃條件下秸稈降解率為45.5%;張慶華等[25]篩選出4株效果較好的纖維素腐解菌劑,在50℃時秸稈腐解率達到83.7%;Haruta等[26]通過多次組合篩選構建了一個穩定的復合菌系,在50℃條件下,4 d內可使水稻秸稈降解率高于60%以上;Spela等[27]研究表明,在堆肥活躍期接種微生物菌劑能提高堆肥效率,有機質的礦化更為迅速,產生的堆肥品質更穩定。張麗青等從稻稈堆腐物及牛糞中分離篩選出一株分解纖維素能力較強的菌株N-12,培養基pH設置為8.0,接種量設置為4%,蛋白胨作為氮源,在37℃條件下培養72 h,此時菌株的CMC(Sodium carboxyl methyl cellulose羧甲基纖維素)酶最高[28];以腐解過程中秸稈失重率、CMC酶活等指標評價玉米秸稈腐解效果可行,以腐熟終點C/N和T值作為評價玉米秸稈的腐熟度指標初步可行[29]。
本研究利用從自然界低溫腐殖鋸末已分離高效秸稈降解復合菌系,研究發酵條件及液態發酵條件下菌劑對秸稈的降解能力,制成生物菌劑,并應用于大田試驗。以期為解決低溫秸稈田間降解難的難題提供微生物資源和技術支撐。
1 材料與方法
1.1試驗材料
復合菌系:篩選自鋸末中的一組玉米秸稈降解復合菌系GF-S72[14]。
載體:白炭黑(Silica,成都艾科達化學試劑有限公司)、煅燒高嶺土(Kaolin,國藥集團化學試劑有限公司)、硅藻土(Diatomite,國藥集團化學試劑有限公司)、滑石粉(Talc,天津風船化學試劑科技有限公司)、皂土(Bentonite,上海山浦化工有限公司)、凹凸棒土(Attapulgite,國藥集團化學試劑有限公司)、輕質碳酸鈣(Calcium carbonate,上海泗聯化工有限公司)。
DNS試劑:準確稱取酒石酸鉀鈉(C4H4Na2O6)185.0 g溶于蒸餾水中(低于50℃加熱),待溶解后加入3,5-二硝基水楊酸(C7H4N2O7)6.313 g,全部溶解后加入氫氧化鈉(NaOH)21 g、苯酚(C6H5OH)5.0 g、無水亞硫酸鈉(Na2SO3)5.0 g,攪拌使之溶解,冷卻至室溫后加水定容到1000 mL,貯存于棕色試劑瓶,室溫放置一周后使用。
檸檬酸緩沖液(pH=4.8):A液:取一水檸檬酸(C6H8O7·H2O)21.014 g,定容到1000 mL;B液:稱取二水檸檬酸鈉(Na3C6H5O7·2H2O)29.412 g定容至1000 mL。取A液271.2 mL、B液228.8 mL定容至1000 mL,于4℃冰箱內保存。
1%羧甲基纖維素鈉:稱取1.0 g羧甲基纖維素鈉(CMC-Na)于燒杯中,加熱溶解后用檸檬酸緩沖液(pH=4.8)定容至100 mL。
基礎培養基:硫酸銨[(NH4)2·SO4]1.0 g、磷酸氫二鉀(K2HPO4)1.0 g、氯化鈉(NaCl)0.2 g、硫酸鎂(MgSO4)0.5 g、碳酸鈣(CaCO3)2.0 g,加入蒸餾水1000 mL。
1.2菌株培養基的優化
1.2.1不同氮源的優化
選用基礎培養基,以玉米秸稈作為碳源,分別用蛋白胨、酵母粉、硝酸銨、硝酸鈉、硫酸銨、尿素代替基礎培養基中的氮源,加入量為0.2%;培養條件為裝液量30 mL/150 mL,接種量為10%,pH7,溫度15℃,轉速130 r·min-1。每個處理設3次重復,培養3 d后測量菌系纖維素酶活,進而選出最佳氮源。纖維素酶活包括濾紙酶活FPA(Filter paper activity)、內切酶Cx(Endoglucanases)、外切酶C1(Cellobiohydrolases)。纖維素酶活力是指在特定條件下,經酶的催化作用形成葡萄糖時每分鐘所需該酶的量為1個酶活國際單位“U”。
1.2.2最佳尿素濃度、碳氮比的優化
選用基礎培養基,尿素濃度為0.1%、0.2%、0.4%、0.8%、1.6%,設置碳氮比分別為0.1∶1、5∶1、10∶1、20∶1、40∶1,共5個水平進行試驗。培養條件為裝液量30 mL/ 150 mL,接種量10%,pH7,溫度15℃,在轉速為130 r·min-1的搖床中培養。每個處理設3次重復,3 d后測量菌系纖維素酶活,得出最佳尿素濃度和碳氮比。
1.3復合菌系培養條件的優化
選用基礎培養基,對培養溫度、裝液量、培養時間、初始pH、接種量進行單因素優化試驗,每組試驗設3次重復,3 d后測量菌系纖維素酶活,得出各單因素最佳指標。
1.4復合菌系GF-S72正交試驗
在以上試驗的基礎上,按正交試驗L9(34)四因素三水平對菌株搖瓶培養條件進行優化,3 d后測定菌系纖維素酶活,得出搖瓶培養復合菌系GF-S72的最優配比。
1.5菌劑研制
1.5.1篩選試驗加工工藝
將復合菌系(GF-S72號復合菌系在pH8.0、10℃、C∶N=20∶1、裝液量12%、接種量2%的條件下振蕩培養6 d獲得)搖瓶發酵液與填料按一定比例混合制成母液,置于冷凍干燥機干燥制成母粉。
1.5.2初始制劑成分配比
初始制劑成分質量配比為發酵液50%,填料50%。
1.6載體篩選試驗
選擇白炭黑、煅燒高嶺土、硅藻土、皂土、凹凸棒土、滑石粉、輕質碳酸鈣7種不同載體做填料,比較不同載體情況下制劑降解纖維素的差異。將制備的各制劑室溫貯藏14 d后測定秸稈降解率和濾紙降解情況(在無菌條件下取1 g搭載不同載體的制劑接種到盛有基礎培養基的三角瓶中,每個三角瓶放3條濾紙條,每處理設定3次重復,搖床130 r·min-1振蕩培養,10℃恒溫培養2 d,檢測濾紙降解情況),以此考察填料對復合菌系的生物相容性。綜合秸稈降解率、濾紙降解情況、價格等因素,篩選出最適填料。以原菌液為CK。
1.7質量指標測定
1.7.1pH值的測定
取1 g自制菌劑置于100 mL燒杯中,加入100 mL蒸餾水,攪拌后靜置1 min,用pH計測其pH值。平行測定3次,取其平均值。
1.7.2含水量的測定
稱取1 g自制菌劑置于托盤中,在105℃烘箱中烘干,24 h后取出測定前后質量差。
1.7.3保藏參數的測定
選取含水量較高的低溫高效降解玉米秸稈復合菌制劑3 g,于-109℃下采用冷凍干燥機(labogene-Scanvac冷凍干燥機系列,丹麥)冷凍干燥,然后在此冷凍干燥后菌劑基礎濕度上加入相應質量的蒸餾水使菌劑密封“保藏濕度”為0%、10%、20%、40%和80%,并將樣品分別抽真空密封保存。在無菌條件下取3 g密封菌劑接種到盛有基礎培養基的三角瓶中,每個三角瓶放5條濾紙條,每處理設定3次重復,搖床130 r·min-1振蕩培養,10℃恒溫培養2 d,檢測濾紙降解情況,14 d后測定秸稈降解率,以原菌液為CK。選擇制備的低溫高效降解玉米秸稈復合菌制劑3 g,將樣品分別密封后,分別存于4℃、15℃、25℃、35℃、45℃保溫箱中,2 d后觀察濾紙降解情況(方法同上),14 d后測定秸稈降解率。以原菌液為CK。
1.7.4負載量的測定
載體與菌液最佳負載量配比測定:分別稱取1 g載體與菌液按一定比例混合(具體配比見表4)。2 d后觀察濾紙降解情況(方法同上),14 d后測定秸稈降解率,以原菌液為CK。
菌劑與秸稈負載量配比試驗:分別稱取0.002 g、0.01 g、0.05 g、0.25 g、1.25 g菌劑放入三角瓶中,每瓶放入2 g秸稈,每個處理重復3次,14 d后取樣測定秸稈降解率。以原菌液為CK。
1.8數據處理
利用IBM SPSS Statistics 19.0統計軟件對試驗結果進行統計分析,所有數據均采用3次重復的平均值±標準偏差表示。不同處理間的差異顯著性采用配對樣本進行評價。采用Sigmaplot 12.5進行數據分析和繪圖。
2 結果與討論
2.1復合菌系GF-S72培養基優化
本試驗中,采用纖維素酶活來表征微生物的生長狀況。在供試的6種氮源中,GF-S72在以尿素為氮源時生長最好,其次是硫酸銨,蛋白胨最差(P<0.05,圖1)。由此可以看出,GF-S72對無機氮的利用率好于有機氮。當選擇尿素作為最佳氮源,其濃度為0.1%時,GF-S72的生長狀況最好(P<0.05,圖2)。此外,在供試的5種碳氮比條件下,GF-S72在碳氮比為20∶1時生長最好,其次是碳氮比10∶1,碳氮比為0.1∶1時生長最差(P<0.05,圖3)。當碳氮比為10∶1時FPA酶活高于其他比例,因此需要做正交試驗進一步驗證。
2.2復合菌系GF-S72培養條件優化
選擇培養溫度、裝液量、培養時間、初始pH、接種量五個因素,每個因素設定合適的水平數,對復合菌系GF-S72進行培養條件單因素優化,并對所得數據進行單因素方差分析。由圖4可知,裝液量、培養時間三種酶活統一,培養溫度、初始pH、接種量這三個因素三種酶活不統一。據此就這三個指標做了正交試驗,進一步驗證單因素試驗。
2.3復合菌系GF-S72正交試驗
根據單因素試驗結果,選擇合適因素和水平(表1),按正交試驗對GF-S72復合菌系培養條件(培養溫度、初始pH、接種量、碳氮比)進行優化,每個處理3個重復,對所得數據進行分析,結果見表2。四個因素對試驗結果影響強弱順序為C(培養溫度)>B(初始pH)>D(碳氮比)>A(接種量);C1酶活的正交試驗結果與FPA和Cx酶活正交試驗結果稍有不同。結合單因素結果可得,復合菌系GF-S72最佳搖瓶培養條件為:接種量2%,初始pH8,培養溫度10℃,碳氮比20∶1。

圖1 不同氮源對菌株GF-S72生長的影響Figure 1 Effects of nitrogen sources on growth of strain GF-S72
2.4復合菌系GF-S72載體篩選試驗
由表3可知,硅藻土效果最佳,白炭黑、滑石粉、輕質碳酸鈣的濾紙降解情況優于凹凸棒土及皂土,低于硅藻土。但是硅藻土、凹凸棒土及皂土的玉米秸稈降解率明顯優于白炭黑、滑石粉、輕質碳酸鈣。該結果表明,白炭黑、滑石粉、輕質碳酸鈣與GFS-72復合菌系的生物相容性較差。就硅藻土、凹凸棒土、皂土做方差分析顯示,硅藻土明顯優于后兩種載體,因此選擇硅藻土作為填料。
2.5GF-S72復合菌劑質量指標的測定
2.5.1pH對復合菌劑生長的影響
GF-S72復合型菌劑pH值為8.2,與之前發酵條件測得的最適pH值相差不大,能很好滿足復合菌系生存,符合標準。
2.5.2含水量對復合菌劑降解率的影響
本試驗測得復合型菌劑的含水量為1.42%。

圖2 不同尿素濃度對菌株GF-S72生長的影響Figure 2 Effects of urea concentrations on growth of strain GF-S72
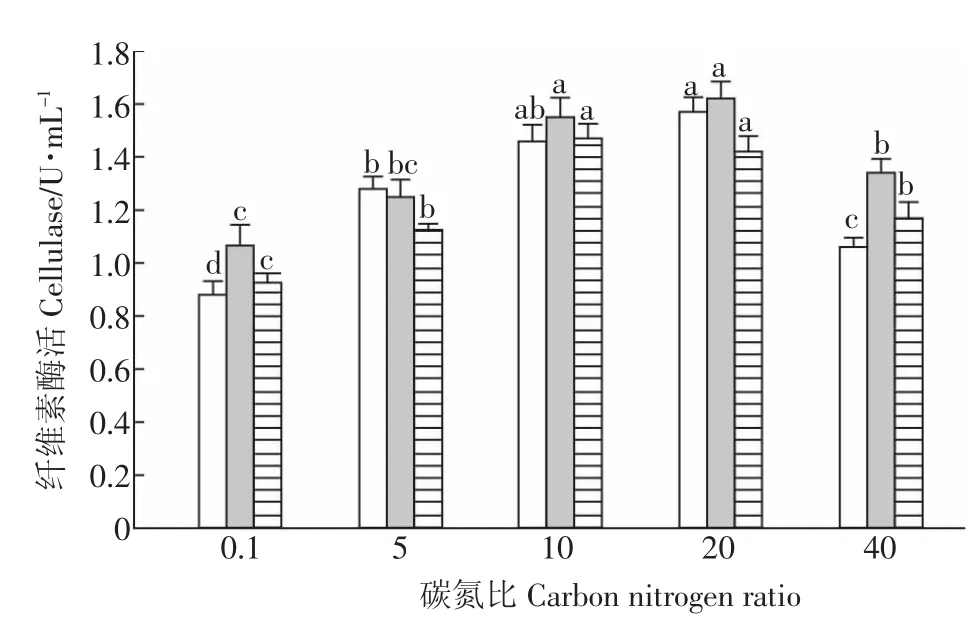
圖3 不同碳氮比對菌株GF-S72生長的影響Figure 3 Effects of carbon nitrogen ratios on growth of strain GF-S72
含水量及保藏濕度測定結果表明,菌劑在不同儲藏條件下對菌株存活率影響很大,水分過高,菌體代謝旺盛,死亡率高,還容易造成粘結成團,影響制劑使用。但菌劑含水量也不是越小越好,如果粉體過于干燥,含水量接近零點,則微粒對周圍環境中水分吸收強,且因為干燥微粒間存在強靜電,吸收的水分子與微粒會迅速結成穩定的晶體結構,造成粉體絮結成堅硬的塊狀,影響制劑的濕潤性和分散性。因此,將菌劑中水分控制在合理范圍內及選擇合適保藏濕度對于菌劑加工和應用都具有非常重要的意義。
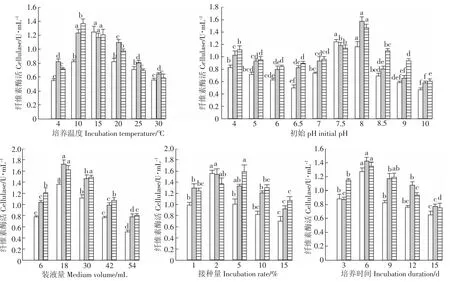
圖4 不同培養條件對菌株GF-S72生長的影響Figure 4 Effects of incubation conditions on growth of Strain GF-S72

表1 發酵條件正交試驗的因素和水平的設計Table 1 Factors and levels for orthogonal test of GF-S72 for incubation conditions
由表4可知,10%的濕度降解濾紙情況明顯高于其他處理,其次是0%和20%,而40%和80%幾乎無降解。在供試的5種比例中,GF-S72在保藏濕度為10%時,玉米秸稈降解率最高,菌株最活躍,說明在此濕度下,復合菌系可以最大程度地與載體相容,其次是保藏濕度20%,保藏濕度為80%時最差。
2.5.3保藏溫度對復合菌劑降解率的影響
保藏溫度測定結果表明,GFS-72復合菌劑在貯藏溫度為15℃條件下,濾紙降解情況和秸稈降解率明顯比其他條件高。其次是25℃,最差為45℃。這一結果也驗證了低溫降解菌系在高溫條件下玉米秸稈降解能力下降的現象(表5),說明最適保存溫度為15℃。
2.5.4負載量對復合菌劑降解率的影響
(1)當菌液與載體配比為3∶1時,降解濾紙情況和秸稈降解率都明顯高于其他條件,隨著菌液稀釋濃度越高,降解濾紙能力越低,玉米秸稈降解率也隨之降低(表6)。在供試的14種比例中,GF-S72在菌液比載體比例為3∶1時,玉米秸稈降解率最高,說明在此比例下,復合菌系可以最大程度地與載體相容,保持菌株之間的活躍性。S1∶1次之,S7∶1最差(表6)。
(2)當加入菌劑為0.05 g時,玉米秸稈降解率最高,因此最適菌劑量為0.05 g。在供試的5種比例中,GF-S72在菌劑為0.05 g時,玉米秸稈降解率最高,說明在此比例下,菌劑與玉米秸稈比例最佳。0.002 g次之,1.25 g最差(圖5)。
3 結論

表2 FPA、Cx、C1正交試驗的統計結果及極差分析Table 2 Statistical results and range analysis of FPA,Cx and C1orthogonal test
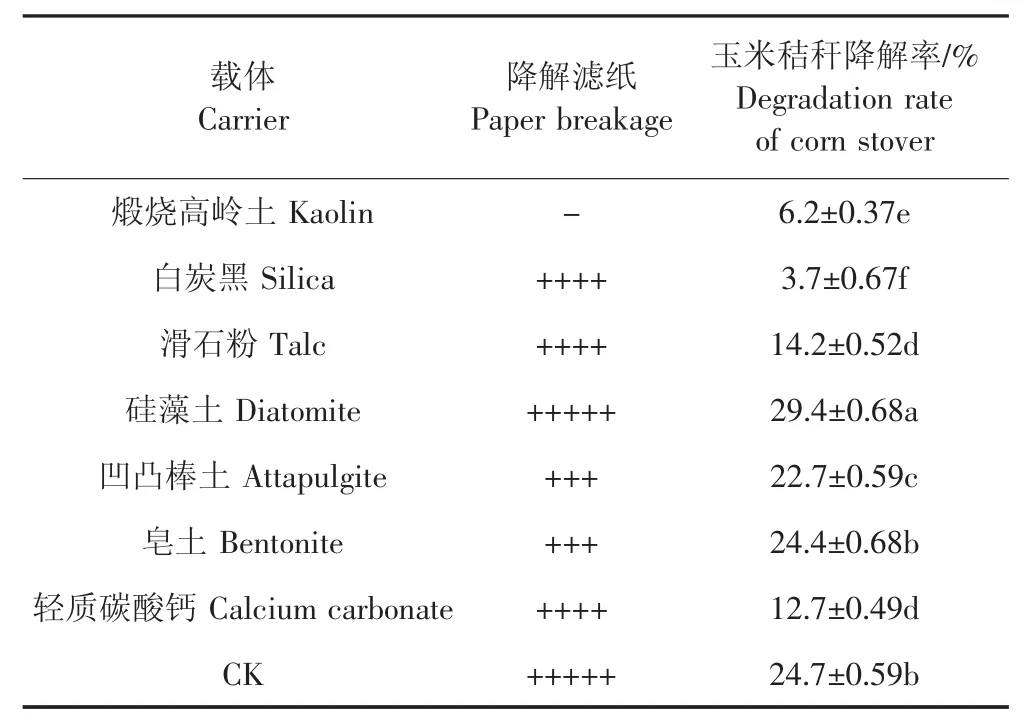
表3 不同載體處理下濾紙降解及玉米秸稈降解率Table 3 Degradation of filter paper and stover degradation by different carriers
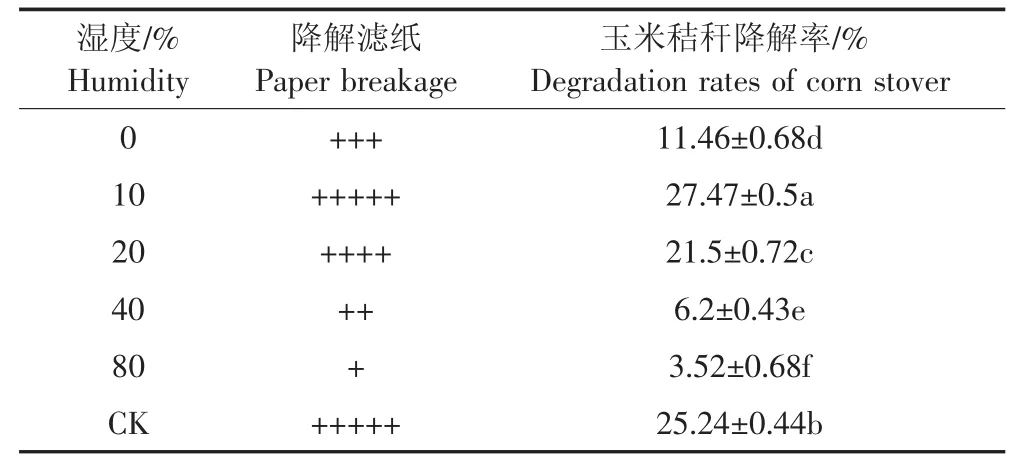
表4 不同濕度處理下濾紙降解及玉米秸稈降解率Table 4 Degradation of filter paper and corn stover degradation under different humidity
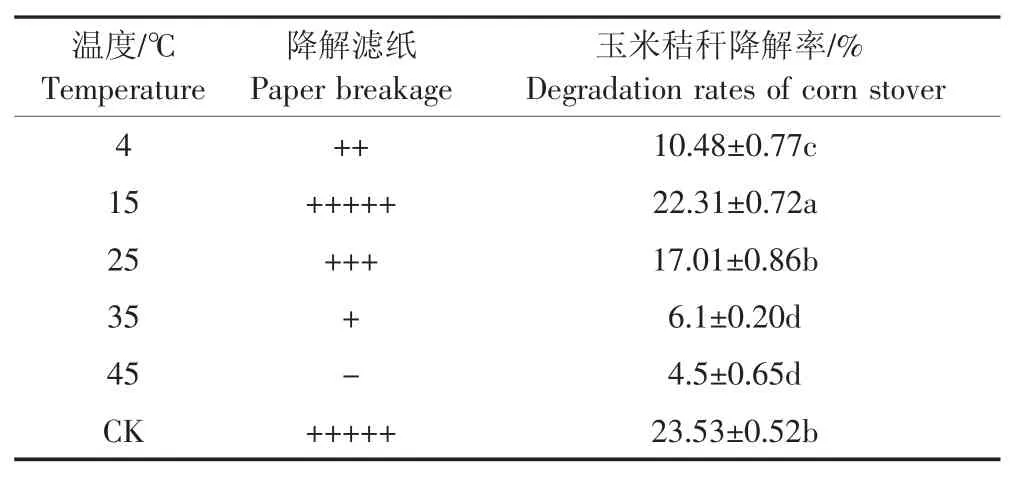
表5 不同溫度處理下濾紙降解及玉米秸稈降解率Table 5 Degradation of filter paper and corn stover degradation under different temperature
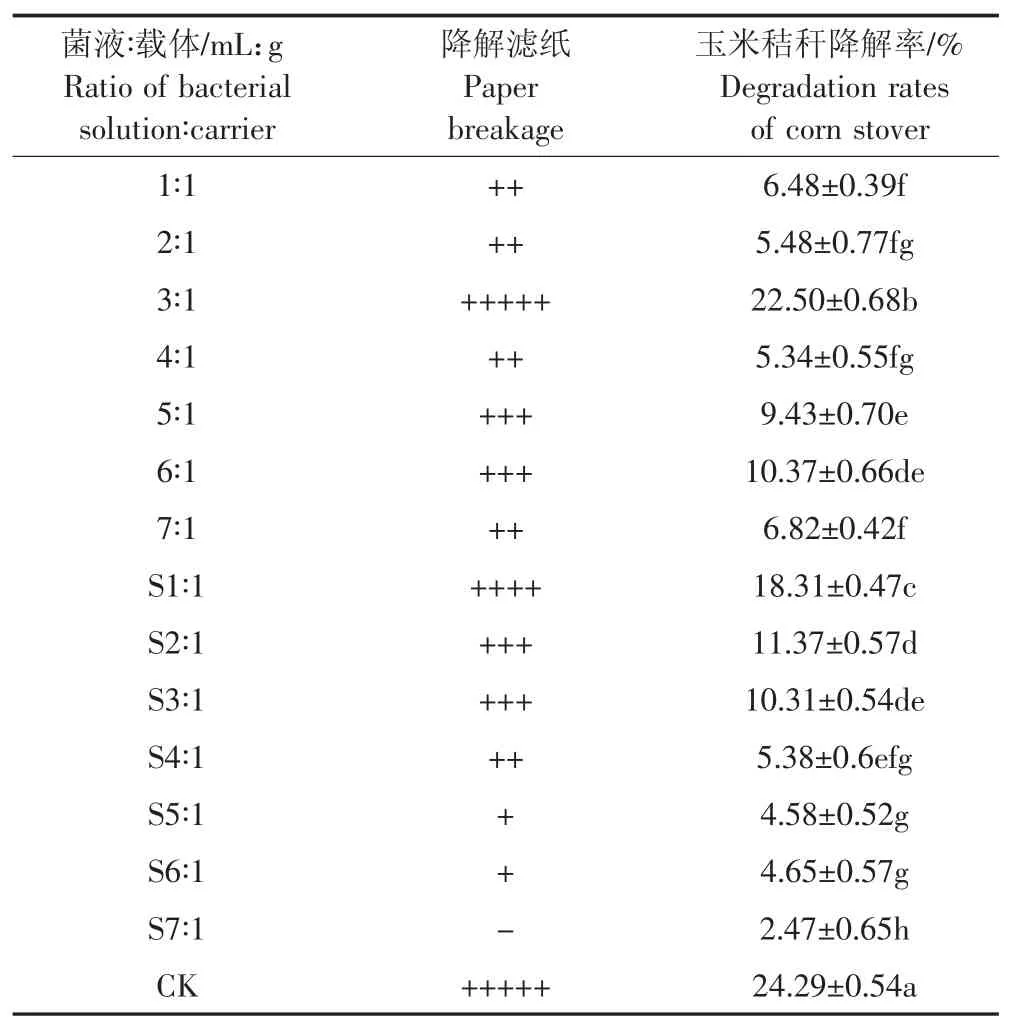
表6 不同菌液∶載體配比下濾紙降解及玉米秸稈降解率Table 6 Degradation of filter paper and corn stover degradation at different ratios of bacterial solution∶carrier
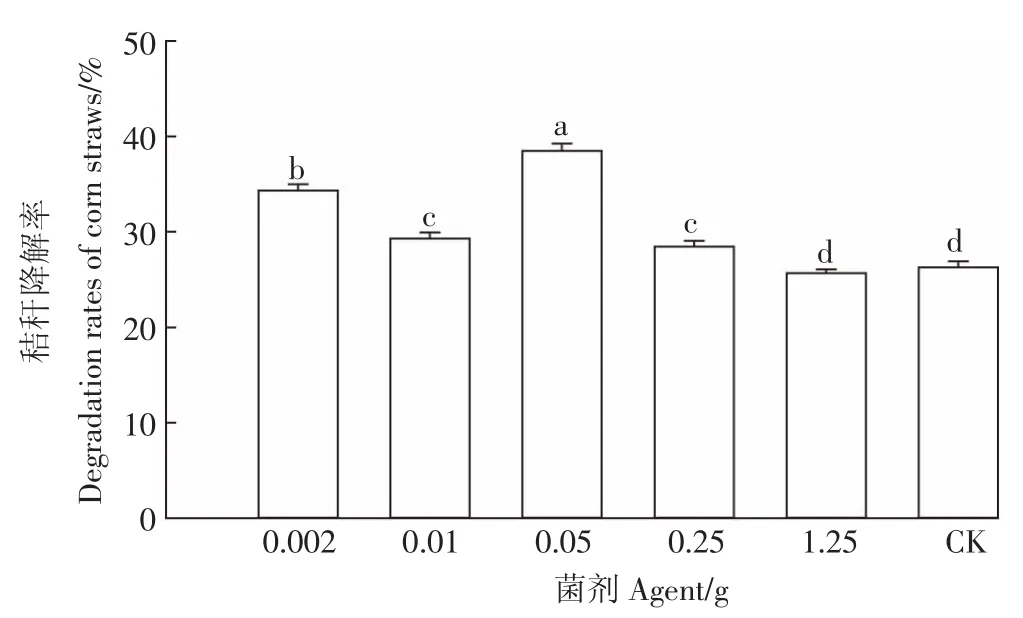
圖5 不同菌劑配比玉米秸稈降解率Figure 5 Corn stover degradation at different agent ratios
(1)采用單因素和正交試驗,確定復合菌系GF-S72最佳發酵條件為:尿素0.1%、碳氮比20∶1、培養溫度10℃、初始pH為8、裝液量為18 mL/150 mL、培養時間為6 d、接種量2%。
(2)通過試驗選取硅藻作為最佳載體,且在菌液∶載體=3∶1、菌劑與秸稈配比為0.05 g/2 g,制備低溫高效降解玉米秸稈復合型菌劑。
(3)在pH值8.2、含水量1.42%、保藏濕度10%、保藏溫度15℃時,復合型菌劑降解效率最好。
由于本試驗并未考慮成本問題,菌株如果應用到實際生產,還應綜合考慮各方面因素,在保證菌株降解效果的前提下,選用廉價原料和合適的培養條件,使菌劑的生產效益最大化。
[1]李文革,李倩,賀小香.秸稈還田研究進展[J].湖南農業科學,2006 (1):46-48. LI Wen-ge,LI Qian,HE Xiao-xiang.Straw returned[J].Hunan Agricultural Science,2006(1):46-48.
[2]高利偉,馬林,張衛峰,等.中國作物秸稈養分資源數量估算及其利用狀況[J].農業工程學報,2009,25(7):173-179. GAO Li-wei,MA Lin,ZHANG Wei-feng,et al.Estimation of nutrient resource quantity of crop straw and its utilization situation in China[J]. Transactions of the CSAE,2009,25(7):173-179.
[3]曹國良,張小曳,王丹,等.中國大陸生物質燃燒排放的污染物清單[J].中國環境科學,2005,25(4):389-393. CAO Guo-liang,ZHANG Xiao-ye,WANG Dan,et al.Inventory of atmospheric pollutants discharged from biomass burning in China continent[J].China Environmental Science,2005,25(4):389-393.
[4]趙偉,潘延欣,靳雯然,等.低溫菌劑降解秸稈還田對東北黑土微生物活性的影響[J].湖北農業科學,2014,53(17):4020-4024. ZHAO Wei,PAN Yan-xin,JI Wen-ran,et al.Effects of low-temperature agent degrading straw and returning to field on microbial activity in black soil[J].Hubei Agricultural Science,2014,53(17):4020-4024.
[5]匡恩俊.不同還田方式下大豆秸稈腐解特征研究[J].大豆科學,2010,29(3):479-482. KUANG En-jun.Decomposition characteristics of soybean stalk under different stalk returning method[J].Soybean Science,2010,29(3):479-482.
[6]趙鵬,陳阜,李莉.秸稈還田對冬小麥農田土壤無機氮和土壤脲酶的影響[J].華北農學報,2010,25(3):165-169. ZHAO Peng,CHEN Fu,LI Li.Effects of straw mulching on inorganic nitrogen and soil urease in winter wheat field[J].Acta Agriculturae Boreali-Sinica,2010,25(3):165-169.
[7]武際,郭熙盛,魯劍巍,等.連續秸稈覆蓋對土壤無機氮供應特征和作物產量的影響[J].中國農業科學,2012,45(9):1741-1749. WU Ji,GUO Xi-sheng,LU Jian-wei,et al.Effects of continuous straw mulching on supply characteristics of soil inorganic nitrogen and crop yields[J].Scientia Agricultura Sinica,2012,45(9):1741-1749.
[8]錢海燕,楊濱娟,黃國勤,等.秸稈還田配施化肥及微生物菌劑對水田土壤酶活性和微生物數量的影響[J].生態環境學報,2012,21 (3):440-445. QIAN Hai-yan,YANG Bin-juan,HUANG Guo-qin,et al.Effects of returning rice straw to fields with fertilizers and microorganism liquids on soil enzyme activities and microorganisms in paddy fields[J].Ecology and Environmental Sciences,2012,21(3):440-445.
[9]吳紅艷,王智學,陳飛,等.秸稈降解菌劑對秸稈還田土壤中細菌種群數量的影響[J].微生物學雜志,2012,32(2):79-82. WU Hong-yan,WANG Zhi-xue,CHEN Fei,et al.Effect of stalkdegradable microbial preparation on the number of microbial population in the soil using stalks as fertilizer for the fields[J].Journal of Microbiol-ogy,2012,32(2):79-82.
[10]黃繼川,彭智平,于俊紅,等.施用玉米秸稈堆肥對盆栽芥菜土壤酶活性和微生物的影響[J].植物營養與肥料學報,2010,16(2):348-353. HUANG Ji-chuan,PENG Zhi-ping,YU Jun-hong,et al.Impacts of applying corn-straw compost on microorganisms and enzyme activities in pot soil cultivated with mustard[J].Plant Nutrition and Fertilizer Science,2010,16(2):348-353.
[11]李培培,張冬冬,王小娟,等.促分解菌劑對還田玉米秸稈的分解效果及土壤微生物的影響[J].生態學報,2012,32(9):2847-2854. LI Pei-pei,ZHANG Dong-dong,WANG Xiao-juan,et al.Effects of microbial inoculants on soil microbial diversity and degrading process of corn straw returned to field[J].Acta Ecologica Sinica,2012,32(9):2847-2854.
[12]青格爾,高聚林,于曉芳,等.玉米秸稈低溫高效降解復合菌系GF-20的菌種組成及降解穩定性研究[J].中國農業科學,2016,49 (3):443-454. QING Ge-er,GAO Ju-lin,YU Xiao-fang,et al.Function and composition stability of a composite microbial system GF-20 with efficient corn stalk decomposition under low temperature[J].Scientia Agricultura Sinica,2016,49(3):443-454.
[13]薩如拉,高聚林,于曉芳,等.玉米秸稈低溫降解復合菌系的篩選[J].中國農業科學,2013,46(19):4082-4090. SA Ru-la,GAO Ju-lin,YU Xiao-fang,et al.Screening of low temperature maize stalk decomposition microorganism[J].Scientia Agricultura Sinica,2013,46(19):4082-4090.
[14]殷中偉,范丙全,任萍.纖維素降解真菌Y5的篩選及其對小麥秸稈降解效果[J].環境科學,2011,32(1):247-252. YIN Zhong-wei,FAN Bing-quan,REN Ping,et al.Isolation and identification of a cellulose degrading fungus Y5 and its capability of degradating wheat straw[J].Environmental Science,2011,32(1):247-252.
[15]趙旭,王文麗,李娟,等.低溫秸稈降解微生物菌劑的研究進展[J].生物技術通報,2014,11:55-61. ZHAO Xu,WANG Wen-li,LI Juan,et al.Advanced in microbiological agent of straw degradation under low temperature[J].Biotechnology Bulletin,2014,11:55-61.
[16]劉長莉,王小芬,牛俊玲,等.一組纖維素分解菌復合系NSC-7的酶活表達特性[J].微生物學通報,2008,35(5):720-724. LIU Chang-li,WANG Xiao-fen,NIU Jun-ling,et al.Expression characteristics of enzyme activity of a multi-functional bacterial community NSC-7[J].Microbiology,2008,35(5):720-724.
[17]Lewis S M,Montgomery L,Garleb K A,et al.Effects of alkaline hydrogen peroxide treatment on in vitro degradation of cellulosic substrates by mixed ruminal microorganisms and bacteroides succinogenes S85[J]. Applied and Environmental Microbiology,1988,54(5):1163-1169.
[18]Kato S,Haruta S,Cui Z J,et al.Stable coexistence of five bacterial strains as a cellulose-degrading community[J].Applied and Environmental Microbiology,2005,71(11):7099-7106.
[19]Van T H,Loontiens F G,Engelborgs Y,et al.Studies of the cellulolytic system of trichoderma reesei QM 9414.binding of small ligands to the 1,4-beta-glucan cellobiohydrolase II and influence of glucose on their affinity[J].European Journal of Biochemistry/FEBS,1989,184(3):553-9.
[20]Singh R,Varma A J,Seeta L R,et al.Hydrolysis of cellulose derived from steam exploded bagasse by Penicillium cellulases:Comparison with commercial cellulase[J].Bioresource Technology,2009,100(24):6679-6681.
[21]Okunowo W O,Gbenle G O,Osuntoki A A,et al.Production of cellulolytic and xylanolytic enzymes by a phytopathogenic yrothecium roridum and some avirulent fungal isolates from water hyacinth[J].African Journal of Biotechnology,2010,9(7):1074-1078.
[22]Geeraerts H A M,Vandamme E J.Cellulolytic properties of haeto-mium crispatum[J].Journal of Chemical Technology and Biotechnology,2008,33(2):107-113.
[23]Tomme P,Van T H,Pettersson G,et al.Studies of the cellulolytic system of trichoderma reesei QM 9414[J].European Journal of Biochemistry,2004,170(3):575-581.
[24]劉海靜,任萍.2種還田模式下小麥秸稈腐解菌劑應用效果研究[J].中國農學通報,2013,29(3):166-172. LIU Hai-jing,REN Ping.Effects of biodegradation agents on straw degradation in two kinds of straw returning[J].Chinese Agricultural Science Bulletin,2013,29(3):166-172.
[25]張慶華,趙新海,李莉,等.秸稈降解菌的篩選及模擬田間應用效果分析[J].微生物學雜志,2010,30(4):101-104. ZHANG Qing-hua,ZHAO Xin-hai,LI Li,et al.Screening of crops stalks degradable microbes and effect analysis of its simulated field application[J].Journal of Microbiology,2010,30(4):101-104.
[26]Haruta S,Cui Z J,Huang Z,et al.Construction of a stable microbial community with high cellulose-degradation ability[J].Applied Microbiology and Biotechnology,2002,59(4/5):529-534.
[27]Spela V B,Rok M,Franc L,et al.Microbial community structure during composting with and without mass inocula[J].Compost Science& Utilization,2003,11(1):6-15.
[28]張恒芳,李林,史喜林,等.玉米秸稈低溫纖維素分解菌的篩選及分解效果測定[J].玉米科學,2013,21(5):147-150. ZHANG Heng-fang,LI Lin,SHI Xi-lin,et al.Screening of cellulose degradation bacteria decomposing maize straw under low temperature and the function determining[J].Journal of Maize Sciences,2013,21 (5):147-150.
[29]劉堯,李力,李俊,等.玉米秸稈高效腐解復合菌系CSS-1的選育及其組成分析[J].中國農業科學,2010,43(21):4437-4446. LIU Yao,LI Li,LI Jun,et al.Construction and composition analysis of the complex microbial system CSS-1 of high decomposition efficiency for corn stalks[J].Scientia Agricultura Sinica,2010,43(21):4437-4446.
Optimization of fermentation conditions for low-temperature and high-efficiency composite microbial system for corn stover degradation and preliminary development of microbial inocula
HU Hai-hong1,SUN Ji-ying1*,GAO Ju-lin2,WANG Zhen1,BAO Nao-gan-chao-lu1,HU Shu-ping2,QING Ge-er1
(1.Agricultural College,Inner Mongolia Agricultural University,Hohhot 010018,China;2.Vocational and Technical College,Inner Mongolia Agricultural University,Baotou 014100,China)
Straw-returning to fields is an effective way to increase soil organic matter content and soil fertility,stimulate soil microbial activity,enhance crop yields and quality,and improve the soil physical and chemical properties.It,therefore,plays a crucial role in promoting agricultural sustainable development.In the spring corn region of northern China,however,maize stover degradation is often slow and is even not fully complete in the fall and winter seasons because of low temperature,which causes wasting of resources.Thus,it is necessary to develop efficient stover-decomposing bacterium agent for low-temperature conditions.A low-temperature and high-efficiency composite microbial system,GF-S72,screened from sawdust and degraded corn stover,was developed for degrading corn stover.Result indicated that the best fermentation was urea of 0.1%,C/N ratio of 20∶1,inoculating content of 2%,initial pH of culture medium at 8.0 and liquid medium volume of 18 mL/150 mL at 10℃for 6 d.The experiment showed that diatomite was the best carrier,and high-efficient composite bacterium agent for degrading corn stover was prepared at low-temperature.The experiment also showed that the highest efficient microbial inoculants of corn stover degradation was at 3∶1 of bacterial liquid/carrier,0.05 g/2 g of microbial inoculants/corn stover ratio,1.42%of moisture content,10%of preservation humidity,15℃of preservation temperature,and pH 8.2.
corn stover;degradation;composite microbial system;fermentation
X712
A
1672-2043(2016)08-1602-08
10.11654/jaes.2016-0110
2016-01-23
國家玉米產業技術體系(CARS-02-63);國家自然科學基金項目(31360304);國家糧食豐產科技工程(2011BAD16B13,2012BAD04B04,2013BAD07B04,2011BAD16B14);內蒙古農業大學引進人才科研啟動項目(YJ 2014-5)
胡海紅(1990—),女,內蒙古赤峰人,碩士研究生,主要從事玉米生理生態研究。E-mail:huhaihong121@126.com
孫繼穎E-mail:nmsunjiying@163.com

