枯草芽孢桿菌液態發酵豆粕的種子培養基和發酵培養基優化研究
羅 娟,馬海樂,劉雪姣(江蘇大學食品與生物工程學院,江蘇省食品物理加工重點實驗室,江蘇鎮江212013)
枯草芽孢桿菌液態發酵豆粕的種子培養基和發酵培養基優化研究
羅 娟,馬海樂*,劉雪姣
(江蘇大學食品與生物工程學院,江蘇省食品物理加工重點實驗室,江蘇鎮江212013)
為提高枯草芽孢桿菌液態發酵豆粕的效率,對發酵所用種子培養基和發酵培養基進行優化。通過單因素實驗研究種子培養基氮源、碳源、無機鹽種類及溫度對生物量的影響,確定種子培養基組成為1%酵母膏、1%玉米黃粉、1%KH2PO4,培養溫度36℃,其生物量、中性和堿性蛋白酶酶活較常規蛋白胨培養基分別提高210.10%、459.20%和67.50%。在此基礎上運用正交實驗對發酵培養基碳源量、接種量及溫度進行優化,得到最優發酵工藝條件為20%豆粕、2%玉米黃粉、1% KH2PO4、接種量10%,培養溫度36℃,其生物量、可溶性蛋白及多肽含量較僅含22%豆粕的培養基分別提高40.90%、28.60% 和36.40%。結果表明采用優化后的種子培養基和發酵培養基能夠顯著提高枯草芽孢桿菌液態發酵豆粕的效率。
枯草芽孢桿菌,液態發酵,培養基優化,豆粕
豆粕是大豆提取油脂后得到的副產品,我國豆粕年產量5000萬噸以上,位于美國、巴西、阿根廷之后,居世界第四位。豆粕中粗蛋白含量為30%~50%,是植物性蛋白質飼料的主要來源,占畜禽蛋白質總用量的60%以上。雖然豆粕營養價值較高,但含有多種抗營養因子[1],這些抗營養因子的存在對豆粕營養成分的消化、吸收、代謝產生不良影響。此外,大豆蛋白分子由于結構復雜[2-3]、分子量較大[4],存在消化率和生物學效價低的問題[5-7],造成豆粕中優質蛋白資源利用困難[8-9]。
枯草芽孢桿菌(Bacillus Subtilis,BS)是一種嗜熱好氧、產芽孢的革蘭氏陽性桿狀菌,具有很強的產蛋白酶能力,是工業生產堿性及中性蛋白酶的主要菌種。采用枯草芽孢桿菌對豆粕進行發酵來降解大分
子蛋白等物質,不但能夠提高產品的生物利用度及營養價值,還可降解胰蛋白酶抑制劑等抗營養因子,從而實現豆粕高值化利用[10-12]。國內外學者在研究豆粕發酵時往往只注重優化發酵培養基,而忽視種子液培養基,并且多采用如蛋白含量、多肽含量、蛋白酶活等中的單一指標衡量發酵效果,無法全面展示優化效果的好壞[13-19]。
本研究以發酵產物中菌種生物量、蛋白酶活性、可溶性蛋白及多肽含量等為指標,對種子培養基和發酵培養基進行雙重優化,多指標確定枯草芽孢桿菌發酵豆粕的最佳工藝條件,以提高豆粕液態發酵效率,并為工業化發酵豆粕提供一定理論依據及技術指導。
1 材料與方法
1.1 材料與儀器
枯草芽孢桿菌10160 江蘇大學食品與生物工程學院保藏;豆粕(粉碎過60目篩) 中儲糧鎮江糧油有限公司提供;玉米黃粉 山東天成生物科技有限公司;胰蛋白胨、酵母膏、大豆蛋白胨、磷酸二氫鉀、氯化鈉、硫酸銅、碳酸鈉、福林酚等 均為分析純,上海國藥集團。
IS-RDD3搖床 上海福瑪實驗設備有限公司;PHS-25酸度計 上海理達儀器廠;JZ5002電子天平 上海天平儀器廠;YM30Z滅菌鍋 上海三申醫療器械有限公司;SW-CJ-2FD超凈工作臺 蘇州凈化設備有限公司;LD5-2A離心機 北京醫用離心機廠;LRH-250恒溫培養箱 國華儀器有限公司;T6新世紀紫外可見光分光光度計 北京普析通用儀器有限責任公司。
1.2 實驗方法
1.2.1 培養基 枯草芽孢桿菌的保存采用固體斜面LB培養基[20],枯草芽孢桿菌生物量平板計數采用TSA培養基[21](胰蛋白胨大豆瓊脂培養基)。
1.2.2 生物量的測定 按照GB/T 13093-2006進行測定[22-23]。無菌操作下取1 mL發酵液,用無菌水稀釋為10-5、10-6、10-7濃度進行TSA培養基涂布,培養,計數,每個濃度做3次平行。
1.2.3 蛋白酶活性的測定 按照GB/T 23527-2009進行測定[24]。取發酵上清液稀釋10倍,取1 mL稀釋液加入2 mL濃度為10.0 g/L酪蛋白溶液,混勻靜置10 min,加2 mL三氯乙酸,靜置10 min后5000 r/min離心5 min,取1 mL上清液加入5 mL濃度為42.4 g/L的碳酸鈉溶液,1 mL福林酚試劑,混勻后靜置20 min,在680 nm波長下測吸光值。
1.2.4 可溶性蛋白含量測定 采用福林酚法[25-26]測定。取發酵上清液稀釋10倍,取1 mL加入試劑A [a:10 g Na2CO3,2 g NaOH和0.25 g酒石酸鉀鈉(KNaC4H4O6·4H2O),溶解于500 mL蒸餾水中;b:0.5 g硫酸銅(CuSO4·5H2O)溶解于100 mL蒸餾水中;每次使用前,現將50體積a與1體積b混合,即為試劑A],混勻后靜置10 min,加入0.5 mL福林酚試劑,立刻混勻靜置30 min,在680 nm處測吸光值。
1.2.5 多肽含量測定 采用雙縮脲法[27]測定。用15%三氯乙酸等體積沉淀發酵液,5000 r/min離心5 min,取上清液稀釋5倍,取1 mL稀釋液,加入4 mL雙縮脲試劑,混勻靜置30 min后540 nm處測定吸光值。
1.2.6 枯草芽孢桿菌的活化 取枯草芽孢桿菌10160保藏菌種,挑取一環接入固體斜面LB培養基36℃活化,1 d后將活化好的菌種接入液體LB培養基中,在160 r/min、36℃進行恒溫培養。待培養進入對數生長期后,吸取一定體積的菌液接入待篩選種子液培養基中。
1.2.7 種子液培養基的篩選 采用單因素逐步優化的方式,按表1所示,取適量活化后的枯草芽孢桿菌于不同氮源、碳源、無機鹽(以上物質濃度均為1%)及培養溫度下,在轉速為160 r/min的搖床中培養24 h后平板計數及蛋白酶活性測定,篩選種子液培養基及培養條件。
1.2.8 發酵培養基的篩選 按表2進行單因素逐步優化實驗,在36℃、200 r/min轉速的搖床中培養4 d后進行平板計數,并測定可溶性蛋白及多肽含量。
1.2.9 正交實驗 根據單因素所篩選的對枯草芽孢桿菌發酵豆粕有明顯影響的碳源量(玉米黃粉)、接種
量及培養溫度進行L9(34)正交實驗,其他條件為20%豆粕、1%KH2PO4、搖床轉速200 r/min。以可溶性蛋白、多肽含量及生物量為指標,確定枯草芽孢桿菌最佳發酵培養基的組成,各因素和水平的選擇見表3。

表1 種子培養基單因素實驗因素水平表Table1 Different factors and levels of seed culture optimization

表2 發酵培養基單因素實驗因素水平表Table2 Different factors and levels of fermentation culture optimization

表3 正交實驗的因素與水平設計Table3 Factors and levels of orthogonal test Design
1.2.10 優化與對照實驗 優化出來的種子液最優單因素組合與培養細菌常用的LB培養基作指標對照實驗。正交實驗得到的最優組合與僅含22%豆粕培養基做各指標對照實驗。
1.2.11 數據處理 所有實驗數據均重復3次,運用SPSS軟件進行數據分析處理。
2 結果與討論
2.1 種子培養基優化
2.1.1 氮源的選擇 從圖1可以看出,枯草芽孢桿菌能較好地利用有機氮產生中性及堿性蛋白酶,而在無機氮中基本不能生存。由于無機氮源被快速代謝,酶的合成會受到抑制,因此只能產生少量的蛋白酶[28]。酵母膏作為氮源時,生物量及產生的堿性蛋白酶酶活最高,分別達到1.96×109cfu/mL及60.5 U/mL;中性蛋白酶酶活也較高為63.3 U/mL,故選擇1%酵母膏作為種子培養基氮源。
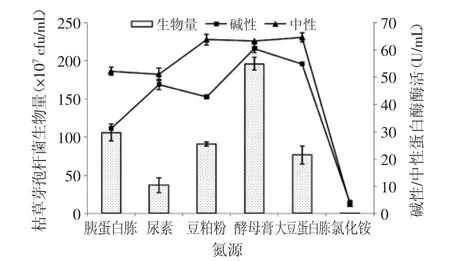
圖1 種子培養基氮源的選擇Fig.1 The selection of the nitrogen source of the seed culture
2.1.2 碳源的選擇 從圖2可以看出,枯草芽孢桿菌對有機碳的利用率較無機碳高,此時生物量和蛋白酶酶活都能達到理想效果。當使用玉米黃粉作為碳源時,生物量達到最高2.06×109cfu/mL,中性及堿性蛋白酶酶活分別達到86.8及54.9 U/mL。故選擇1%玉米黃粉作為種子培養基碳源。
2.1.3 無機鹽的選擇 從圖3可以看出,無機鹽對枯草芽孢桿菌的生長、中性及堿性蛋白酶的分泌有較大影響。其中K+、PO能促進蛋白酶酶活的提高,當使用磷酸二氫鉀作為無機鹽時,生物量能達到最大1.45×109cfu/mL;Na+及Mg2+無明顯促進效果;而Fe3+對酶活有抑制作用,且不利于枯草芽孢桿菌的生長。故選擇1%KH2PO4作為種子培養基無機鹽。
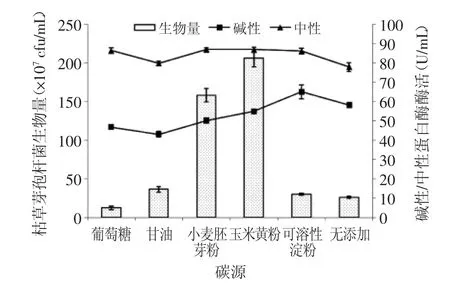
圖2 種子液培養基碳源的選擇Fig.2 The selection of carbon source for the seed culture
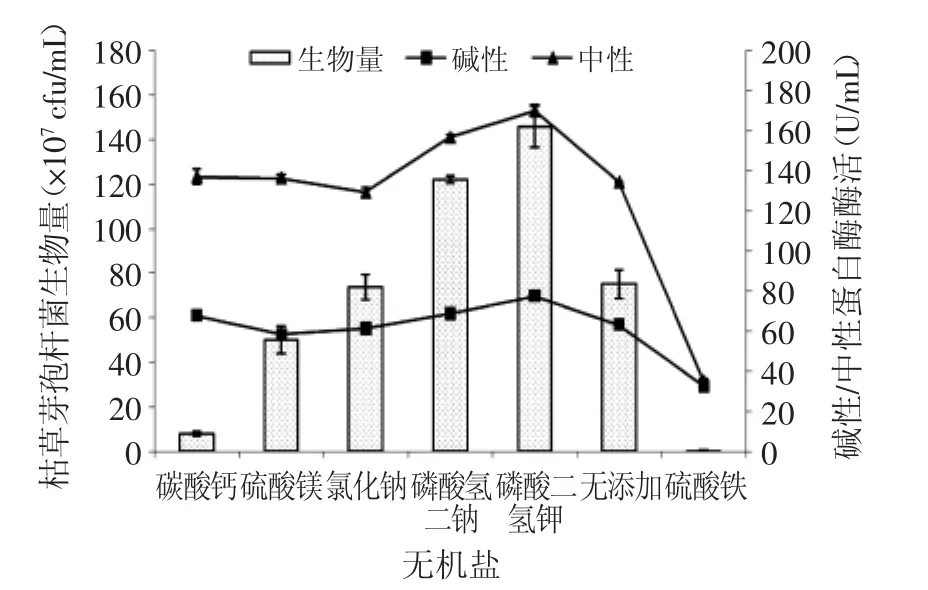
圖3 種子培養基無機鹽的選擇Fig.3 The selection of inorganic salt for the seed culture
2.1.4 溫度的選擇 從圖4可以看出,枯草芽孢桿菌生物量和中性蛋白酶酶活隨著溫度的升高先上升后下降,堿性蛋白酶活性略微上升。中性蛋白酶活性在32℃達到最高值331.2 U/mL;生物量在36℃達到最大值1.98×109cfu/mL。考慮到種子液用于發酵接種,在保持高蛋白酶活性的情況下,為保證生物量達到一定數量,在后續實驗中選擇36℃培養。
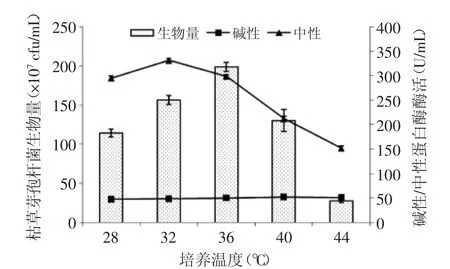
圖4 種子培養基培養溫度的選擇Fig.4 The selection of temperature for the seed culture
2.2 發酵培養基優化
篩選出枯草芽孢桿菌種子培養基及培養條件后,進一步利用其對豆粕進行發酵制備生物活性肽。為提高枯草芽孢桿菌對豆粕的利用率,因此對發酵培養基進行優化。
2.2.1 氮源量的選擇 氮源為豆粕粉,其添加量能夠影響到培養基的組成,進而影響微生物的生長。由圖5可以看出,隨著豆粕量的增加,發酵產物中可溶性蛋白及多肽含量增加,在20%處達到最大,且生物量也達到最大。故選擇氮源量為20%。

圖5 發酵培養基氮源量的選擇Fig.5 The selection of the nitrogen source quantity of the fermentation culture
2.2.2 碳源量的選擇 從圖6可看出,當采用玉米黃粉為碳源時,碳源添加量能夠顯著影響發酵培養基中的生物量、可溶性蛋白及多肽含量。當玉米黃粉添加量為2%時,生物量、可溶性蛋白及多肽含量都達到最高,分別為2.15×109cfu/mL、51.8 mg/mL及13.6 mg/mL。
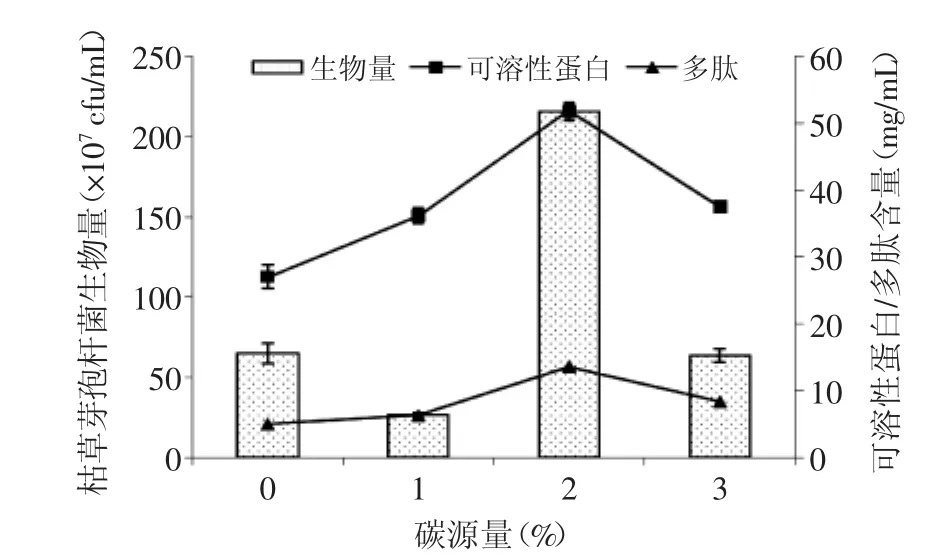
圖6 發酵培養基碳源量的選擇Fig.6 The selection of the carbon source quantity of the fermentation culture
2.2.3 無機鹽量的選擇 從圖7可以看出,當KH2PO4添加量增加到1%時,培養基中可溶性蛋白及多肽含量達到最高;當KH2PO4添加量增加到1.5%時,生物量達到最大,但是可溶性蛋白及多肽含量下降,可能是高鹽環境抑制蛋白酶酶活力導致。考慮到發酵是為了獲得蛋白及多肽,故選擇KH2PO4添加量為1%。
2.2.4 溫度的選擇 從圖8可看出,隨著培養溫度升高,培養基中可溶性蛋白含量先升后降,在36℃達到最高值82.2 mg/mL;但生物量呈下降趨勢,在28℃時最大為6.64×109cfu/mL;36℃時為2.87×109cfu/mL,多肽含量變化不明顯。36℃時生物量雖然有所下降,但和28℃處于同樣數量級,為了保證蛋白及多肽產量,選擇36℃進行發酵。
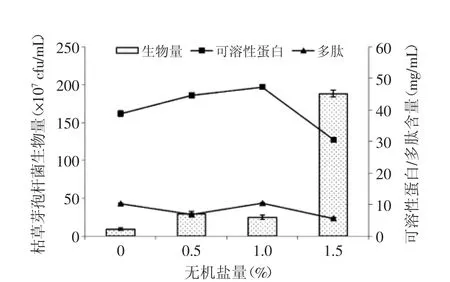
圖7 發酵培養基無機鹽量的選擇Fig.7 The selection of inorganic salt quantity for fermentation culture

圖8 發酵培養基培養溫度的選擇Fig.8 The selection of temperature for the fermentation culture
2.2.5 接種量的選擇 接種量是影響微生物發酵的重要因素之一,接種量過低則底物轉化率低,接種量過高又會影響微生物生長及代謝。從圖9可看出,接種量為10%時,發酵產物中可溶性蛋白及多肽含量最高,分別為81.5、16.6 mg/mL,說明接種量為10%時枯草芽孢桿菌發酵活力最大。
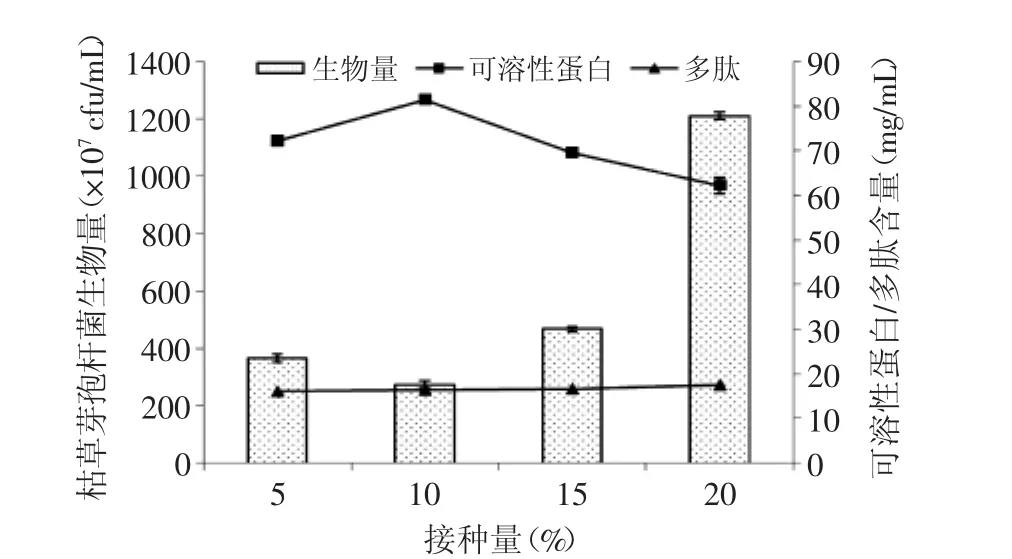
圖9 枯草芽孢桿菌接種量的選擇Fig.9 The selection of inoculation quantity of Bacillus subtilis
2.3 正交實驗結果及方差分析
在單因素實驗基礎上,設計L9(34)正交實驗以確定枯草芽孢桿菌最佳發酵培養基的組成,實驗結果見表4。
由表4可以看出,影響枯草芽孢桿菌生物量的各因素順序是:B>C>A;影響可溶性蛋白含量的各因素順序是:C>B>A;影響多肽含量的各因素順序是:C>B>A。
以可溶性蛋白、多肽含量、生物量為指標時,最優培養基組合分別為:C2B2A3、C2B2A2、B3C1A1。由于實驗設計都不包括最優組合,故做驗證實驗進行對比,結果見表5。多肽是最重要發酵產物,表5中在最佳組合C2B2A2條件下發酵,多肽含量達23.6 mg/mL,另兩項指標可溶性蛋白含量為83.0 mg/mL,生物量為8.30×109cfu/mL,生物量優于實驗最優處理組,可溶性蛋白略低于最優處理組。故可以選擇C2B2A2為最優發酵組合,即20%豆粕、2%玉米黃粉、1%KH2PO4、接種量10%及培養溫度36℃。
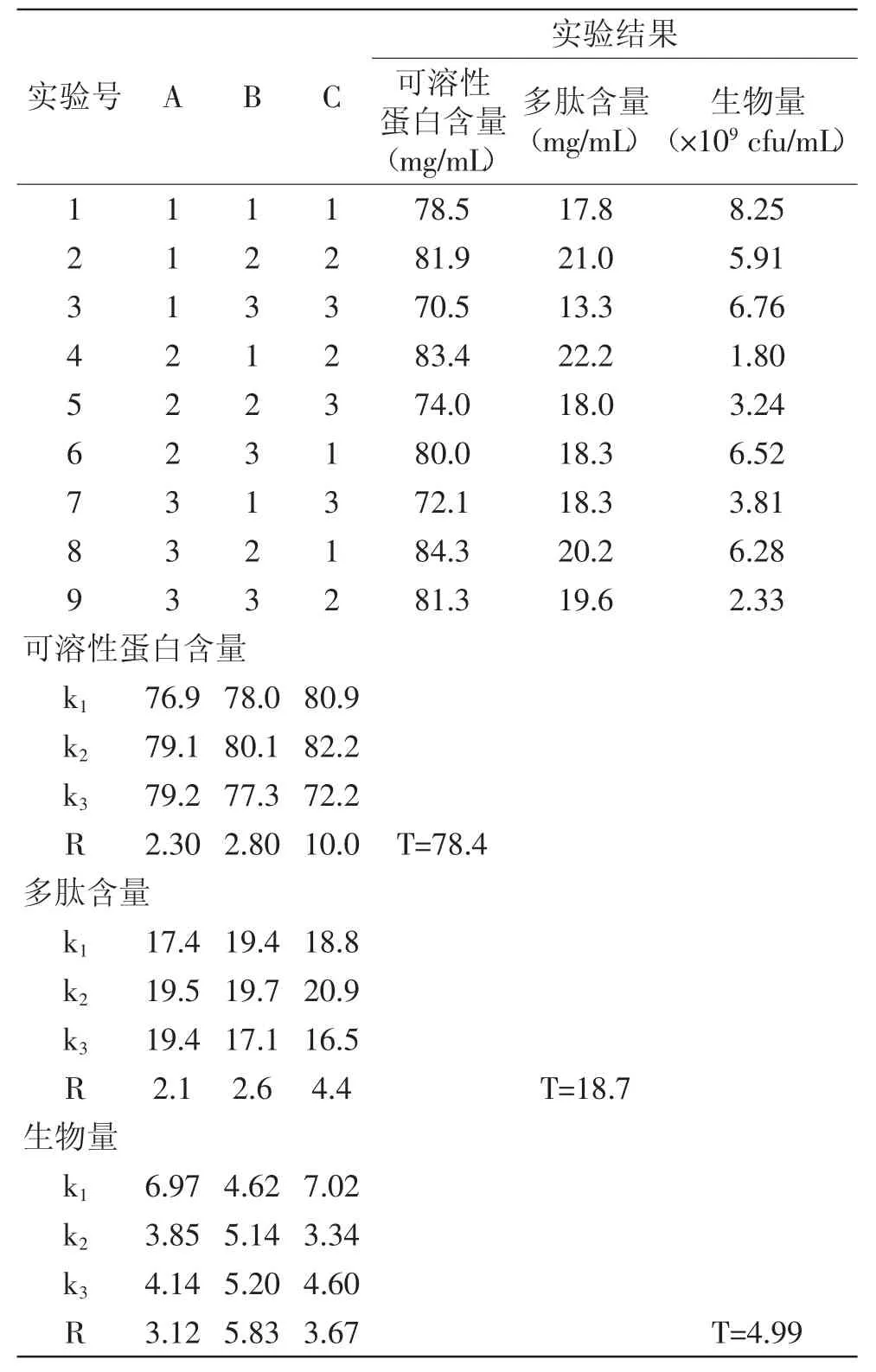
表4 發酵培養基正交實驗直觀分析圖Table4 The visual analysis chart of orthogonal test of fermentation culture

表5 發酵培養基驗證結果Table5 Verification results for the fermentation culture
2.4 優化對照實驗結果
從表6可以看出,優化后的種子培養基較常規蛋白胨培養基的生物量、中性和堿性蛋白酶活性分別提高210.10%、459.20%和67.50%。從表7可以看出,優化后的發酵培養基和僅含22%豆粕培養基(因為優化后的發酵培養基含有22%的干物質)相比其生物量、可溶性蛋白及多肽含量分別提高40.90%、28.60%和36.40%。由此可見,優化后的培養基能顯著提高發酵效率。

表6 種子液培養基優化對照Table6 The comparison of the optimation and control experiment for the seed culture
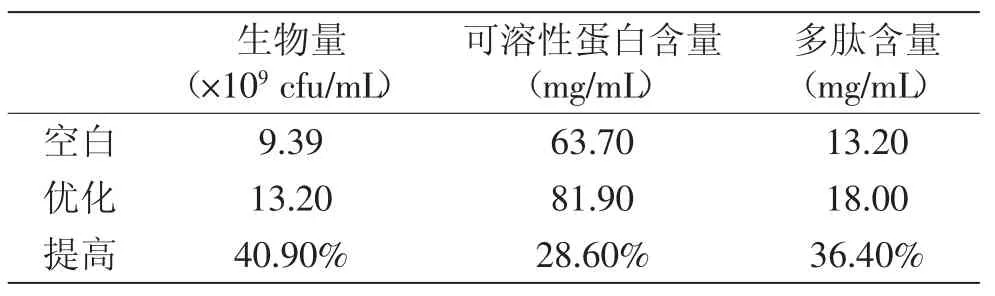
表7 發酵培養基優化對照Table7 The comparison of the optimation and control experiment for the fermentation culture
3 結論
通過單因素實驗,對豆粕發酵種子培養基的組成及培養條件進行優化,其結果為:1%酵母膏、1%玉米黃粉、1%KH2PO4,培養溫度為36℃,與LB培養基相比,培養基中生物量、中性及堿性蛋白酶酶活分別提高210.10%、459.20%及67.50%。
通過單因素實驗及正交實驗,綜合考慮生物量、可溶性蛋白及多肽含量三種指標,豆粕發酵培養基的組成及培養條件的優化結果為:20%豆粕,2%玉米黃粉,1%KH2PO4,10%接種量,培養溫度36℃。與僅含22%豆粕的發酵培養基相比,該最優使得發酵產物中的生物量、可溶性蛋白含量及多肽含量分別提高40.90%、28.60%及36.40%。優化后的培養基能顯著提高枯草芽孢桿菌液態發酵豆粕的效率。
[1]高美云,張通,劉賓,等.豆粕抗營養因子及其生物改性的研究[J].中國飼料,2010(3):37-41.
[2]葉倩.發酵豆粕深度酶解生產低分子大豆多肽[D].武漢:華中農業大學,2009.
[3]Chang J,Yin Q Q,Wang P P,et al.Effect of fermented protein feedstuffs on pig production performance,nutrient digestibility and fecal microbes[J].Turkish Journal of Veterinary and Animal Sciences,2012,36(2):143-151.
[4]Zhang H Y,Yi J Q,Piao X S,et al.The metabolizalbe energy value,standardized ileal digestibility of amino acids in soybean meal,soy protein concentrate and fermented soybean meal,and the application of these products in early-weaned piglets[J].Asian Australasian Journal of Animal Sciences,2013,26(5):691-699.
[5]魏鳳仙,高方,李紹鈺,等.膨化法與微生物發酵處理法對豆粕營養價值的影響[J].河南農業科學,2014(4):123-127.
[6]劉海燕.乳酸菌發酵豆粕及其功效研究[D].長春:吉林農業大學,2012.
[7]王園.豆粕固態發酵條件及其對斷奶仔豬飼用效果的研究[D].北京:中國農業大學,2014.
[8]宋增廷,王華朗,韓垂旺,等.我國豬非常規飼料資源的開發與利用現狀[J].中國畜牧雜志,2015(10):62-65,71.
[9]張立偉.2008-2009年度我國大豆和豆粕供需狀況分析[J].中國畜牧雜志,2009(4):9-13.
[10]王金斌,馬海樂,段玉清,等.豆粕固態發酵生產優質高蛋白飼料的菌種篩選實驗[J].安徽農業科學,2008(19):8112-8114.
[11]王偉,王世英,李佳,等.液體發酵法產大豆肽發酵條件的優化[J].飼料工業,2013(24):52-56.
[12]Junko Y,Chen H M,Takako N,et al.Changes of Functional Components and Antioxidative Activity in the Process of Fermentation of Soybeans[J].Chemistry,Texture,and Flavor of Soy,2010(10):155-169.
[13]竺禮斌,曲道峰,施春偉,等.高產蛋白酶枯草芽孢桿菌JNB001產酶條件的優化[J].中國畜牧獸醫,2015(2):414-419.
[14]宋卡魏,王星云,張榮意.培養條件對枯草芽孢桿菌B68芽孢產量的影響[J].中國生物防治,2007(3):255-259.
[15]鐘蔚.枯草芽孢桿菌微生態制劑制備工藝研究[D].南京:南京農業大學,2013.
[16]張士偉.枯草芽孢桿菌及混合發酵醬渣制備飼料的研究[D].廣州:華南理工大學,2013.
[17]劉新風,牛春華,劉香英,等.枯草芽孢桿菌BSG1產蛋白酶發酵條件優化[J].食品工業,2013(7):1-4.
[18]吳海波,江連洲,趙英,等.發酵低溫豆粕生產堿性蛋白酶的工藝研究[J].食品工業科技,2011(3):195-200.
[19]陶榮霞.17株芽孢桿菌產酶特性及益生特性的研究[D].武漢:華中農業大學,2012.
[20]Jacobs M F.Expression of the subtilisin Carlsberg-encoding gene in Bacillus lichenifoemis and Bacillus subtilis[J].Gene,1995,152(1):69-74.
[21]Clelanda D,Jastrzembskia K,Stamenovab E,et al.Growth characteristics of microorganisms on commercially available animal-free alternatives to tryptic soy medium[J].Journal of Microbiological Methods,2007,69(2):345-352.
[22]國家飼料質量監督檢驗中心(北京).GB/T 13093-2006,飼料中細菌總數的測定[S].
[23]沈萍,范秀榮,李廣武.微生物學實驗[M].北京:高等教育出版社,2006:215.
[24]全國食品工業標準化技術委員會.GB/T 23527-2009,蛋白酶制劑[S].
[25]Lowry OH,Rosebrough NJ,Farr AL,et al.Protein measurement with the Folin phenol reagent[J].The Journal of Biological Chemistry,1951(193):265-269.
[26]林智.食品中蛋白質含量的測定[J].當代化工,2010(2):224-226.
[27]張立娟,姜瞻梅,姚雪琳,等.雙縮脲法檢測大豆分離蛋白中蛋白質的研究[J].食品工業科技,2008(7):241-242.
[28]Giesecke U E,Bierbaum G,Rudde H,et al.Production of alkaline protease with Bacillus licheniformis in a controlled fedbatch process[J].Apply Microbiology Biotechnology,1991(35):720-724.
Study on the optimization of the seed and fermentation culture for fermenting soybean meal by Bacillus subtilis
LUO Juan,MA Hai-le*,LIU Xue-jiao
(School of Food and Biological Engineering,Jiangsu University,Jiangsu Provincial Key Laboratory for Physical Processing of Agricultural Products,Zhenjiang 212013,China)
In order to improve the efficiency of soybean meal fermentation in liquid state by Bacillus subtilis,the seed and fermentation culture were optimized.Through the single factor experiments to study the seed culture nitrogen sources,carbon sources,inorganic salts and temperature influence on biomass,it was concluded that the best seed culture was composed of 1%yeast extract,1%corn powder,1%KH2PO4and 36℃fermentation temperature.The biomass,neutral and alkaline protease activity was enhanced 210.10%,459.20%and 67.50% compared to conventional peptone medium.Then on this basis,by using orthogonal experiment to optimize the fermentation culture of carbon source quantity,inoculation size and temperature,the optimal fermentation conditions were 20%soybean meal,2%maize powder,1%KH2PO4,10%inoculation size and 36℃culture temperature.The biomass,soluble protein and peptide content was 40.90%,28.60%and 36.40%higher respectively,compared to the culture medium containing 22%soybean meal.The results showed that the optimized seed culture and fermentation culture could significantly improve the efficiency of the soybean meal liquid state fermentation by Bacillus subtilis.
Bacillus subtilis;liquid state fermentation;culture medium optimization;soybean meal
TS201.3
A
1002-0306(2016)08-0229-06
10.13386/j.issn1002-0306.2016.08.039
2015-08-19
羅娟(1990-),女,碩士研究生,研究方向:食品生物技術,E-mail:469846196@qq.com。
*通訊作者:馬海樂(1963-),男,教授,研究方向:功能食品與食品物理加工,E-mail:mhl@ujs.edu.cn。
國家863計劃課題(2013AA102203)。

