重組枯草芽孢桿菌素subtilosin A基因的合成及其在畢赤酵母中的表達
陳柏雄,黃佳俊,林俊芳,*,郭麗瓊,*,陳俊飛,劉英麗(.華南農業大學食品學院生物工程系,華南農業大學食品生物技術研究所,廣東廣州50640;.齊魯工業大學化學與制藥工程學院,山東濟南505;.北京工商大學食品質量與安全北京實驗室,北京00048)
重組枯草芽孢桿菌素subtilosin A基因的合成及其在畢赤酵母中的表達
陳柏雄1,黃佳俊1,林俊芳1,*,郭麗瓊1,*,陳俊飛2,劉英麗3
(1.華南農業大學食品學院生物工程系,華南農業大學食品生物技術研究所,廣東廣州510640;2.齊魯工業大學化學與制藥工程學院,山東濟南250353;3.北京工商大學食品質量與安全北京實驗室,北京100048)
人工改造并合成subtilosin A的結構基因(rsbo A),并在畢赤酵母中誘導表達重組蛋白。結果表明:經陽性大腸桿菌轉化子菌落PCR和測序鑒定,表明重組質粒pPIC9K-sbo構建正確;經陽性酵母轉化子的菌落PCR產物電泳檢測,可見清晰目的基因條帶,證明重組酵母GS115-pPIC9K-sbo構建正確;經枯草芽孢桿菌素蛋白電泳檢測,可見明顯蛋白條帶,表明重組rsbo A基因在畢赤酵母GS115中獲得了分泌表達。在抑菌效果檢測中,重組酵母工程菌的發酵液對銅綠假單胞菌具有一定的抑菌活性。本研究開創了有望替代抗生素的小分子肽細菌素異源表達新思路,為枯草芽孢桿菌素subtilosin A的工業化生產奠定了基礎。
subtilosinA,基因重組,畢赤酵母,抗菌活性
細菌素是由微生物合成的具有抑制特定微生物生長的一種多肽,由于其抑菌的特異性,有望成為替代抗生素成為新一代的治療細菌感染的藥物。枯草芽孢桿菌素subtilosin A是一種環狀細菌素,蛋白分子內含有三個特殊的硫醚鍵[1],最早是從枯草芽孢桿菌168中分離得到[2],其蛋白合成與后期加工通過八個基因的基因簇sbo-alb進行調控[3],其中sbo基因作為結構基因,編碼多肽前體[4],前體肽的成熟要經過幾個獨特的化學修飾過程。
subtilosin A作為Ⅰ類細菌素,具有分子量小,擁有特殊蛋白結構,具有很寬的抗菌譜,對革蘭氏陽性菌、革蘭氏陰性菌、好氧菌與厭氧菌都有抑制作用[5]。近幾年,對疾病相關病原體的研究也表明了subtilosin A對單純胞疹病毒Type 1[6]、與陰道疾病相關的病原體[7]具有抑制作用,有望成為代替抗生素作為新型治療藥物。
巴斯德畢赤酵母(Pichia pastoris)因具有對外源基因翻譯后加工,如糖基化、蛋白磷酸化等特點,同時也具有培養容易、生長快、表達高等優點,現已作為一種外源蛋白表達系統廣泛應用于基因工程研究中[8]。
目前,國內外對subtilosin A基因改造已進行廣泛的研究。孫會剛等利用強啟動子P45分別與subtilosin A合成基因簇中sbo-albA、albB-albC連接轉化回枯草芽孢桿菌168中以提高subtilosin A的產量[9]。Quanli Liu等通過構建purL基因缺失的解淀粉芽孢桿菌以提高subtilosin A的產量[10]。目前國內外對其研究中,只是在其原始報道的來源菌株芽孢桿菌中進行改造,但是其產量低而無法進行工業化生產的問題始終未能得到解決。由于利用非芽孢桿菌菌株進行表達以提高其產量的研究目前未見報道,本研究試圖將subtilosin A的前體編碼基因sbo按照畢赤酵母的密碼子偏好性進行改造,讓其于畢赤酵母中表達,利用酵母菌的蛋白翻譯后加工的能力,大量獲得有活性的枯草芽孢桿菌素subtilosin A。
1 材料與方法
1.1材料與儀器
大腸桿菌(Escherichia coli DH5α)、銅綠假單胞菌(Pseudomonas aeruginosa)本實驗室保存;畢赤酵母菌(Pichia pastoris GS115)及表達載體pPIC9K Invitrogen公司;質粒小提試劑盒、PCR產物純化試劑盒北京天根生化科技有限公司;Taq聚合酶、T4連接酶、DNA marker 3、DNA Marker 1廣州東盛生物科技有限公司;限制性內切酶NotⅠ、EcoRⅠ和SalⅠ、Premixed Protein Marker(Low)TaKaRa公司;其他試劑均為國產分析純。
電子分析天平ALC-2104瑞士METTLER TOLEDO公司;核酸凝膠電泳儀DYY-6C北京六一儀器廠;小型垂直蛋白電泳儀美國Bio-Rad公司;干式恒溫器MK-20杭州奧盛儀器有限公司;微量臺式冷凍離心機FRESC21美國Thermo Fisher公司。
1.2實驗方法
1.2.1培養基的配制LB培養基:Trypton 10 g/L,Yeast extraction 5 g/L,NaCl 10 g/L。
MD培養基:1.34%YNB,4×10-5%Biotin,2% Dextrose。
BMGY培養基:100 mmol/L磷酸鉀緩沖液(pH6.0),1.34%YNB,4×10-5%Biotin,1%Glycerol,1%Yeast Extract,2%Peptone。
BMMY培養基:將BMGY培養基中的1%Glycerol換成0.5%(v/v)甲醇。
1.2.2基因的設計及合成根據GenBank中登錄的枯草芽孢桿菌素subtilosin A的前體sbo成熟肽段的氨基酸序列(DQ452520.1),參照Codon Usage Database中的畢赤酵母偏愛密碼子表,利用DNASTAR軟件設計枯草芽孢桿菌素subtilosin A前體SBO核酸序列,并在兩端分別引入EcoRⅠ和NotⅠ酶切位點,得基因全長146 bp,由上海捷瑞生物工程有限公司合成。基因名稱為rsbo A。
1.3PCR引物
根據合成的重組sbo基因和pPIC9K的MCS上下游核酸序列設計引物,引物由上海捷瑞生物工程有限公司合成。重組sbo基因(擬擴增片段大小為146 bp)引物為:上游引物sbo-up:5’-GAA TTC ATG AAG AAG GCT GTT ATT G-3’(25 nt)和下游引物sbo-dn:5’-GCG GCC GCT TAA CCC CAC AAA CCA A-3’(25 nt)。pPIC9K的通用引物(擬擴增的片段大小為318 bp):上游引物α-factor:5’-TAC TAT TGC CAG CAT TGC TGC-3’(21 nt)和下游引物3’AOX1:5’-GCA AAT GGC ATT CTG ACA TCC-3’(21 nt)。反應條件為:94℃預變性5 min;94℃1 min,51℃1 min,72℃25 s,共29個循環;最后72℃延伸10 min。
1.4重組表達質粒的構建
將連有rsbo基因的pGH載體及畢赤酵母pPIC9K載體分別經EcoRⅠ和NotⅠ雙酶切(50 μL體系中按酶活力單位比經37℃酶切20 h),切膠回收目的基因rsbo片段及載體片段,按摩爾比5∶1經DNA T4連接酶16℃連接過夜,連接產物轉化感受態大腸桿菌DH5 α,經篩選獲得重組菌。重組菌經過培養提取重組質粒并經過PCR鑒定以及測序鑒定,獲得正確的重組質粒,命名為pPIC9K-sbo。
1.5酵母轉化
將重組表達質粒pPIC9K-sbo和空載體pPIC9K分別電擊轉化感受態畢赤酵母GS115,涂布于MD平板,30℃孵育2~3 d,于MD平板上挑陽性菌株單克隆于10 μL無菌ddH2O中,取其2 μL為模板,用引物α-Factor 和3′AOX1進行PCR擴增。擴增產物經3%瓊脂糖凝膠電泳進行鑒定。
1.6目的基因的誘導表達
將陽性轉化子接種于25 mL BMGY培養基中,30℃振蕩培養24 h,6000 r/min離心5 min,收集菌體,經100 mL BMMY培養基重懸,轉入1 L的三角瓶中繼續振蕩培養,每隔24 h加入甲醇使其終濃度為1%進行誘導表達,每隔0、6、12、24、36、48、60、84 h取4 mL發酵液測量菌體OD600,1 mL發酵液離心收集上清進行Tricine-SDS PAGE分析和細菌素抗菌活性的測定。
1.7Tricine-SDS PAGE分析
參照Sch?gger H的方法[11]。
1.8細菌素抗菌活性的測定
以銅綠假單胞菌作為指示菌初步測試發酵上清抗菌活性。挑銅綠假單胞菌單菌落于15 mL LB液體培養基中37℃培養12 h獲得菌液。上述發酵60 h的發酵液離心后取上清,用0.22 μm濾膜過濾菌體獲得粗提的發酵液。取稀釋100倍的銅綠假單胞菌菌液100 μL,與粗提發酵液100 μL混合均勻后涂LB板;以稀釋100倍的銅綠假單胞菌菌液100 μL,與野生型酵母粗提發酵液混合涂板作為對照組。37℃培養18 h后觀察平板上菌落生長狀況,通過菌體生長速率比對情況作為初步的抑菌能力檢測。
2 結果與分析
2.1含重組subtilosin A基因sbo的酵母重組質粒的構建與鑒定
2.1.1目的基因rsboA的合成重組目的基因由上海捷瑞生物工程有限公司協助合成并連接至pGH質粒上(圖1)。
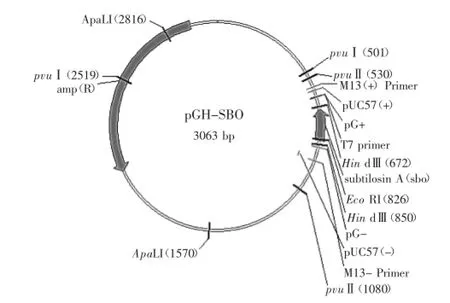
圖1 pGH-sbo載體圖Fig.1 Vector of pGH-sbo
2.1.2重組質粒pPIC9K-sbo的PCR鑒定分別進行雙酶切的pGH-sbo質粒與pPIC9K質粒經純化后過夜
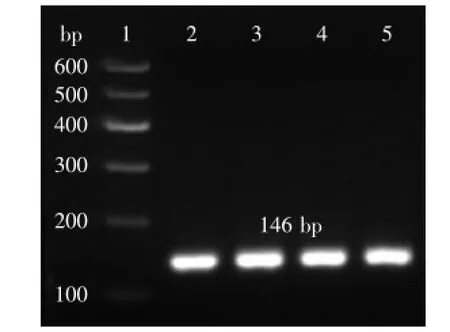
圖2 pPIC9K-sbo菌落PCR檢測陽性克隆Fig.2 Colony PCR identification of positive clones of pPIC9K-sbo

圖3 合成基因與測序結果比對Fig.3 Sequence alignment of SBO and pPIC9K-sbo
連接,連接產物轉化到Escherichia coli DH5α,通過含有100 μg/mL Amp的LB平板隨機篩選陽性克隆,用引物sbo-up和sbo-dn進行菌落PCR,進行3%瓊脂糖凝膠電泳,獲得與目的基因146 bp大小一致的單一目的條帶(圖2)。結果表明重組質粒成功轉化DH5α,將含有重組質粒菌體進行測序,測序結果與合成基因相似度達100%(圖3)完全相同,因此判斷重組質粒構建成功。
2.1.3重組質粒pPIC9K-sbo的PCR鑒定用試劑盒提取質粒,將重組表達質粒pPIC9K-sbo電擊轉化感受態畢赤酵母GS115,涂布于MD平板,隨機挑陽性克隆,用引物α-factor和3’AOX1進行菌落PCR(圖4),進行3%瓊脂糖凝膠電泳,獲得與pPIC9K載體α因子上下游基因加上目的基因大小總和為318 bp大小一致的單一目的條帶,結果表明重組質粒成功轉化為GS115。
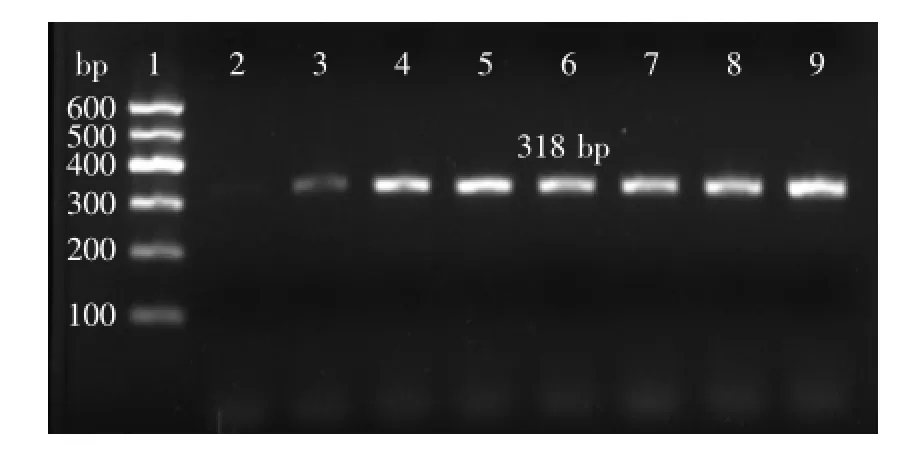
圖4 GS115-pPIC9K-sbo菌落PCR檢測陽性克隆Fig.4 Colony PCR identification of positive clones of GS115-pPIC9K-sbo
2.2含重組subtilosin A基因sbo的酵母表達與活性初測
2.2.1重組subtilosin A基因sbo表達產物的Tricine-SDS PAGE分析經驗證的重組菌體GS115-pPIC9K-sbo劃平板分離,挑單菌落于25 mL BMGY中30℃振蕩搖菌過夜,離心收集菌體轉移至100 mL BMMY中進行發酵,每24 h添加100%甲醇至發酵液中終濃度為0.5%,發酵60 h后取發酵液高速離心取上清液進行Tricine-SDS PAGE分析,subtilosin A蛋白分子量大小為4.3251 ku,結果(圖5)顯示subtilosin A通過pPIC9K在畢赤酵母GS115中表達成功。
2.2.2重組subtilosin A基因sbo表達產物的活性測定
取上述發酵60 h發酵液離心后上清液,用0.22 μm濾膜過濾菌體獲得粗提的發酵液。以銅綠假單胞菌為指示菌株進行初步的抑菌活力測試,結果見圖6,圖a為菌液與重組酵母發酵液混合涂板,圖b以野生酵母發酵液混合涂板當對照。由于銅綠假單胞菌菌體在生長過程中會分泌綠膿菌素[12],而使培養基帶淺綠色。如圖顯示,對比圖b平板,其菌體生長達到一定濃度而使培養基帶有淺綠色,而圖a平板上明顯顏色較淺,說明混有重組基因表達產物的菌體,在生長時受到了抑制,證明發酵產物具有一定的抑菌活力。
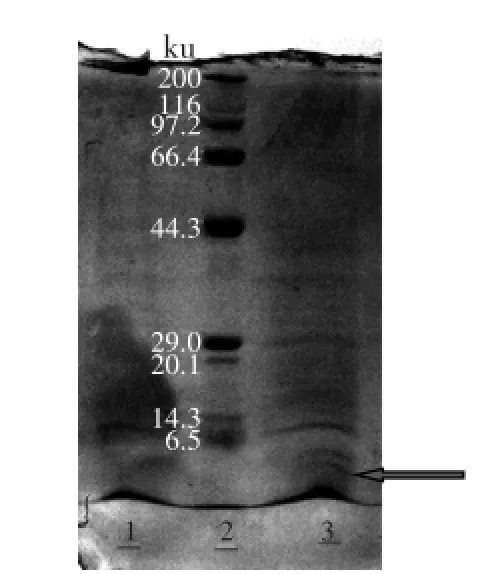
圖5 GS115-pPIC9K-sbo發酵液Tricine-SDS PAGE分析Fig.5 Fermentation broth of GS115-pPIC9K-sbo analyzed by Tricine-SDS PAGE
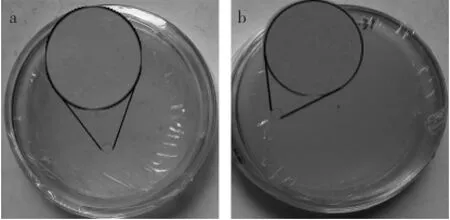
圖6 GS115-pPIC9K-sbo發酵液抑菌活力測試Fig.6 Anti-bacteria tested by fermentation broth of GS115-pPIC9K-sbo
3 結論
本實驗利用畢赤酵母作為真核生物具有成熟的蛋白加工能力,且畢赤酵母表達系統具有培養易、生長快、表達高等優點,創新性地嘗試將枯草芽孢桿菌素subtilosin A在畢赤酵母GS115中進行表達。首先合成并改造subtilosin A的結構基因sbo,連接入pPIC9K穿梭載體中,轉化大腸桿菌DH5α中大量克隆,再通過電激轉化入畢赤酵母,通過Tricine-SDS PAGE分析顯示,subtilosin A已成功于畢赤酵母GS115中表達,進一步以銅綠假單胞菌作為指示菌,初步證明了表達產物具有一定的抑菌活力。然而,本研究的結果顯示芽孢桿菌素的表達量依舊偏低,原因可能是芽孢桿菌素屬于小分子多肽,在酵母宿主中難以分離且易被酵母胞內酶所降解,導致抑菌活力不穩定,這些問題都有待進一步研究。
[1]Marx R,Stein T,Entian K-D,et al.Structure of the Bacillus subtilis peptide antibiotic subtilosin a determined by H-NMR and matrix assisted laser desorption/ionization time-of-flight mass spectrometry[J].Journal of Protein Chemistry,2001,20(6):501-506.
[2]Babasaki K,Takao T,Shimonishi Y,et al.Subtilosin A,a new antibiotic peptide produced by Bacillus subtilis 168:isolation,structural analysis,and biogenesis[J].Journal of Biochemistry,1985,98(3):585-603.
[3]Zheng guolu,Robin Hehn,Peter Zuber.Mutational Analysis of the sbo alb Locus of Bacillus subtilis:Identification of Genes Required for Subtilosin Production and Immunity[J].Journal of Bacteriology,2000,182(11):3266-3273.
[4]Zheng guolu,YAN LZ,VEDERAS JC,et al.Genes of the sbo-alb Locus of Bacillus subtilis are required for production of the antilisterial bacteriocin subtilosin[J].Journal of Bacteriology,1999,181(23):7346-7355.
[5]Shelburne CE,An FY,Dholpe V,et al.The spectrum of antimicrobial activity of the bacteriocin subtilosin A[J].The Journal of Antimicrobial Chemotherapy,2007,59(2):297-300.
[6]Torres NI,Noll KS,Xu S,et al.Safety,formulation,and in vitro antiviral activity of the antimicrobial peptide subtilosin against herpes simplex virus type 1[J].Probiotics and Antimicrobial Proteins,2013,5(1):26-35.
[7]Noll KS,Prichard MN,Khaykin A,et al.The natural antimicrobial peptide subtilosin acts synergistically with glycerol monolaurate,lauric arginate,and ε-poly-L-lysine against bacterial vaginosis-associated pathogens but not human lactobacilli[J]. Antimicrobial Agents and Chemotherapy,2012,56(4):1756-1761.
[8]胡世界,羅素蘭,張吉貞,等.巴斯德畢赤酵母表達系統及其高水平表達策略[J].生物技術,2007,17(6):78-83.
[9]孫會剛,張充,呂鳳霞,等.啟動子P43表達關鍵酶基因對subtilosinA合成的調控作用[J].食品工業科技,2013,34(23):164-71.
[10]Liu quanli,Gao guang,Xu haijin,et al.Identification of the bacteriocin subtilosin A and loss of purL results in its high-level productioninBacillusamyloliquefaciens[J].Researchin Microbiology,2012,163(6):470-478.
[11]Sch?gger H.Tricine-SDS-PAGE[J].Nature Protocols,2006,1:16-22.
[12]陳登宇,夏佩瑩,孟慶榮.銅綠假單胞菌L型的誘導及其產綠膿菌素能力的研究[J].實用醫藥雜志,2008,25(1):77-79.
Synthesis of recombinant gene for Bacillus subtilis bacteriocin subtilosin A and its expression in Pichia pastoris
CHEN Bai-xiong1,HUANG Jia-jun1,LIN Jun-fang1,*,GUO Li-qiong1,*,CHEN Jun-fei2,LIU Ying-li3
(1.Department of Bioengineering,College of Food Science,South China Agricultural University,Institute of Food Biotechnology,South China Agricultural University,Guangzhou 510640,China;2.The School of Chemistry and Pharmaceutical Engineering,Qi-Lu University of Technology,Ji’nan 250353,China;3.Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
In this study,the recombinant gene for subtilosin A(rsbo A)was synthesis for the sake of the expression for this bacteriocin in host cell P.pastoris.Both the results of colony PCR of positive Escherichia coli recombinants and DNA sequencing indicated that recombinant plasmid pPIC9K-sbo was constructed successfully.In addition,the results of colony PCR of positive P.pastoris recombinants indicated that recombinant Pichia GS115-pPIC9K-sbo was constructed successfully.Protein electrophoresis analysis of positive P.pastoris recombinants displayed that the recombinant gene rsbo A was secretory expressed in P.pastoris GS115. Analysis of antimicrobial activity showed that the fermentation broth of this recombinant yeast possess antibacterial activities against P.aeruginosa.The result of this work built a new strategy of bacteriocins,a small molecule peptide,in heterologous expression.The study laid a foundation for industrialized production of Bacillus subtilis antibiotic peptide subtilosin A.
subtilosin A;genetic recombinant;Pichia pastoris;antibacterial activity
TS201.3
A
1002-0306(2016)04-0228-04
10.13386/j.issn1002-0306.2016.04.037
2015-06-01
陳柏雄(1992-),男,碩士研究生,研究方向:微生物基因組學與基因工程,E-mail:bxiong63976@163.com。
林俊芳(1962-),男,研究員,研究方向:天然產物生物工程研究與產品開發,E-mail:linjf@scau.edu.cn。郭麗瓊(1963-),女,教授,研究方向:食品微生物和菌類食品研究與開發,E-mail:guolq@scau.edu.cn。
廣東省科技計劃項目(2015A020209121);廣州市科技計劃項目(2015Y1-00173);北京市教委一般項目(SQKM201610011004)。

