黃皮疣柄牛肝菌多酚提取及對Caco-2結腸癌細胞抑制作用研究
劉雨陽,侯玉艷,吳素蕊,趙天瑞,樊 建,*(.昆明理工大學,云南省食品安全研究院,云南昆明650500;.中華全國供銷合作總社昆明食用菌研究所,云南昆明650)
黃皮疣柄牛肝菌多酚提取及對Caco-2結腸癌細胞抑制作用研究
劉雨陽1,侯玉艷1,吳素蕊2,趙天瑞1,樊建1,*
(1.昆明理工大學,云南省食品安全研究院,云南昆明650500;2.中華全國供銷合作總社昆明食用菌研究所,云南昆明650221)
以黃皮疣柄牛肝菌為原料,乙醇為提取溶劑,采用Folin-Ciocalteu法測定多酚含量,研究了乙醇濃度、提取溫度、料液比和提取時間對多酚得率的影響。在單因素實驗的基礎之上,通過正交實驗優化提取工藝參數,并測定了所得多酚組成及其對Caco-2結腸癌細胞的抑制作用。結果表明,最佳提取工藝條件為:溫度為80℃,乙醇濃度為50%,料液比為1∶25 g/mL,提取1 h。在此提取工藝條件下,最佳提取次數為2次時,黃皮疣柄牛肝菌多酚的得率為5.46%± 0.04%;在18種酚類物質中,在黃皮疣柄牛肝菌中檢出5-磺基水楊酸、兒茶素和肉桂酸等8種多酚類物質,其中5-磺基水楊酸含量最高為779.00 mg/100 g;黃皮疣柄牛肝菌多酚對Caco-2結腸癌細胞產生一定程度的抑制作用,當其濃度為175 μg/mL時,抑制率達55.07%。
黃皮疣柄牛肝菌,多酚,Caco-2結腸癌細胞,抗癌
黃皮疣柄牛肝菌又稱黃癩頭(Leccinellum crocipodium),屬真 菌 界(Fungi),擔子菌 門(Basidiomycota),傘菌綱(Agaricomycetes),牛肝菌目(Boletales),牛肝菌科(Boletaceae),疣柄牛肝菌屬(Leccinellum),菌肉細嫩、味道鮮美[1]。外生菌根菌,夏秋季生于針闊葉混交林或闊葉林下,子實體粗壯堅實,商品性狀極佳[2]。云南、江蘇、浙江、安徽、福建、湖南、湖北、廣東、西藏、貴州和臺灣均有分布[3]。黃皮疣柄牛肝菌蛋白質含量為35.1%,可作為蛋白質來源之一,滿足人們對蛋白質營養的需求。黃皮疣柄牛肝菌含有許多生物活性物質,如多酚、多糖等[4],還含有鎂、鐵、鈣、鋅等礦物質元素。
野生菌多酚是一類廣泛存在于野生菌內的大分子化合物。其具有較強的抗氧化性[5]、抑制癌細胞[6]、降血壓[7]和降血脂[8]等特點,并應用于食品、化妝品、藥品及保健品等領域。早于1957年,Lucas E H[9]首次研究并報道了美味牛肝菌能夠發揮抗腫瘤作用。但對于黃皮疣柄牛肝菌中提取的多酚類物質抑制癌細胞的研究鮮有報道。本文以云南地區的黃皮疣柄牛肝菌為原料,采用乙醇溶劑浸提法,提取黃皮疣柄牛肝菌中的粗多酚,優化提取工藝條件,測定其多酚組成,并探究其對Caco-2結腸癌細胞的抑制作用,旨在為黃皮疣柄牛肝菌的進一步研究提供理論依據。
1 材料與方法
1.1材料與儀器
新鮮黃皮疣柄牛肝菌購自云南曲靖馬龍縣;結腸癌細胞(Caco-2) 由中科院昆明動物所提供;乙腈,HPLC級德國Merck KGaA公司;5-磺基水楊酸、沒食子酸、原兒茶酸、綠原酸、兒茶素、4-羥基苯甲酸、香草酸、咖啡酸、丁香酸、對香豆酸、蘆丁、鞣花酸、阿魏酸、3,4-二甲氧基苯甲酸、苯甲酸、白藜蘆醇、槲皮素、肉桂酸均≥99%,Sigma公司;二甲基亞砜(AMSO) Biomol公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)、胎牛血清、不完全培養基DMEMGibco公司;胰蛋白酶和磷酸鹽緩沖液(PBS)Amresco公司;Na2CO3、Folin-ciocalteu、沒食子酸、乙酸和乙醇等其他試劑均為國產分析純。
ZD-F12真空冷凍干燥機南京載智自動化設備有限公司;AL204型分析天平梅特勒-托利多儀器上海有限公司;HH-4恒溫水浴鍋金壇市科析儀器有限公司;YHZ82恒溫振蕩器常州國華電器有限公司;L500臺式低速自動平衡離心機湖南湘儀實驗室儀器開發有限公司;1260高效液相色譜儀Agilent,Germany;CCL-170B-8二氧化碳培養箱ESCO,Singapore;SpectraMax M5多功能酶標儀Molecular Devices,America;生物顯微鏡重慶澳浦光電技術有限公司。
1.2實驗方法
1.2.1黃皮疣柄牛肝菌多酚的提取流程

1.2.2黃皮疣柄牛肝菌多酚含量測定
1.2.2.1多酚得率的測定多酚含量的測定使用Folin-ciocalteu方法并經過適當修改進行測定[11]。取黃皮疣柄牛肝菌多酚提取液0.5 mL加入2.5 mL 0.2 mol/L福林酚試劑,振蕩均勻后靜置5 min,加入2.0 mL 7.5% Na2CO3溶液,搖勻,避光靜置1 h后765 nm下測定吸光值。
1.2.2.2標準曲線的繪制配制20、40、60、80 μg/mL沒食子酸溶液,參照1.2.2.1方法測定吸光值,同時等體積蒸餾水代替沒食子酸溶液調零,繪制標準曲線。
1.2.2.3多酚得率的計算取不同條件下提取的樣液,測定吸光值,按下式計算得率。
多酚得率(%)=[提取液濃度(mgGAE/mL)×提取液體積(mL)×稀釋倍數]/[菌粉質量(g)×1000]×100 1.2.3黃皮疣柄牛肝菌多酚提取實驗設計及優化
1.2.3.1單因素實驗以多酚得率為指標,考察提取溫度、乙醇濃度、提取時間、液料比對多酚得率的影響。
在其他相同的提取條件下(提取溫度80℃,乙醇濃度70%,提取時間1 h,液料比1∶25 g/mL,提取次數為2次),分別考察提取溫度(40、50、60、70、80、90℃)、乙醇濃度(30%、40%、50%、60%、70%、80%)、料液比(牛肝菌粉∶提取液)(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)、提取時間(0.5、1、1.5、2、2.5、3 h)4個單因素對黃皮疣柄牛肝菌多酚得率的影響。
1.2.3.2正交實驗設計在單因素實驗的基礎上,選擇乙醇濃度、料液比、提取溫度、提取時間為正交實驗因素,設計3個水平,以多酚提取率為考察指標,采用L9(34)正交表優化實驗方案,研究黃皮疣柄牛肝菌中多酚類物質提取的最佳工藝條件,因素水平設計見表1。
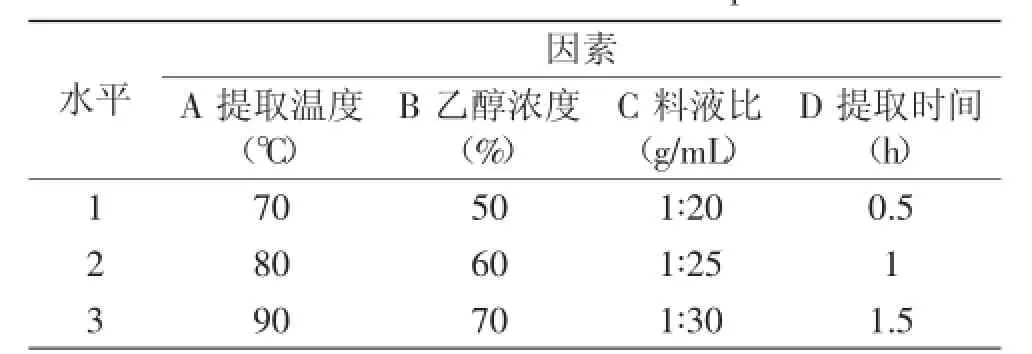
表1 實驗因素與水平Table 1 Factors and levels of the experiment
1.2.4提取次數的確定準確稱取2 g黃皮疣柄牛肝菌粉,每份加入50%的乙醇溶液50 mL,80℃水浴提取1 h。提取次數超過1次的,合并提取液,測定吸光值,計算得率。
1.2.5HPLC法測定多酚的種類樣品配制:提取黃皮疣柄牛肝菌中多酚類物質,55℃真空濃縮至膏狀,加少量水將提取物溶出后定容,測定提取物中多酚類物質含量。進樣前用0.45 μm有機膜過濾,備用。
參照Liang等[12]的方法并適當修改:色譜柱:Agilent C18(4.6 mm×250 mm,5 μm);紫外檢測波長280 nm,柱溫25℃,進樣量10 μL,流速1 mL/min,流動相A為0.1%乙酸溶液,流動相B為0.1%乙酸乙腈溶液。梯度洗脫程序:0~2 min、10%B;2~27 min、10~30%B;27~40 min、30~90%B;40~41 min、100%B;梯度均為線性變化。
1.2.6黃皮疣柄牛肝菌多酚類物質對Caco-2結腸癌細胞抑制作用
1.2.6.1細胞培養在無菌環境下吸出溶有Caco-2細胞的凍存液,加入5 mL 37℃預熱的含10%胎牛血清的完全DMEM培養基中,1000 r/min離心5 min。棄去上清液,加入適量的培養液后接種于培養皿中,置于37℃5%CO2濃度以及飽和濕度環境的培養箱中培養,24 h后更換培養液,繼續培養24 h[13],觀察生長情況。
1.2.6.2MTT法檢測細胞存活率稀釋合適的倍數使細胞濃度約為1×104個/孔。吸取200 μL稀釋后的細胞液至96孔板中,邊緣的孔中加入150 μL PBS。37℃細胞培養箱培養24 h。取出后將孔板中的培養基完全吸出,加入不同濃度的樣液(將冷凍干燥的乙醇提取物,用少量二甲基亞砜(DMSO)溶解,然后加入完全培養基稀釋)200 μL到96孔板中,置于37℃5% CO2濃度以及飽和濕度環境的培養箱中培養48 h。然后棄去其中的培養液,加入150 μL 0.5 mg/mL MTT溶液至孔板中,37℃培養箱中繼續培養4 h后,將MTT溶液吸取干凈,然后每孔加入150 μL DMSO溶液,紫色結晶產物完全溶解后[14]于570 nm波長下測定吸光值。按照如下方法計算細胞存活率:
細胞存活率(%)=(A0-A1)(/A2-A1)×100
式中:A0為單個樣品處理組吸光度,A1為培養板本底吸光度,A2為未加樣品的對照組Caco-2結腸癌細胞吸光度。
1.3數據處理
數據采用Origin 8.5統計分析,實驗重復3次,結果用表示,并用SPSS 19.0軟件進行統計處理。
2 結果與分析
2.1回歸方程確立
以沒食子酸濃度(線性范圍:0.002~0.010 mg/mL)與吸光度建立標準曲線回歸方程為:C=6.323A+0.01495 (R2=0.9986)。沒食子酸溶液在0.002~0.010 mg/mL范圍內線性關系良好。
2.2單因素實驗結果及分析
2.2.1溫度對多酚類物質提取效果的影響由圖1可知,黃皮疣柄牛肝菌多酚得率隨提取溫度的升高先增加后降低,在溫度達到80℃時,多酚提取率達最大值。溫度升高,提取液的粘度下降,分子運動加速,氫鍵更易斷裂,多酚的滲透、溶解、擴散速度也加快,因而多酚類物質更易于溶出。但溫度過高也會使多酚發生氧化或者降解等一些不可逆的化學反應。另外,溫度過高也會導致提取劑乙醇的揮發,導致多酚得率的下降[15]。
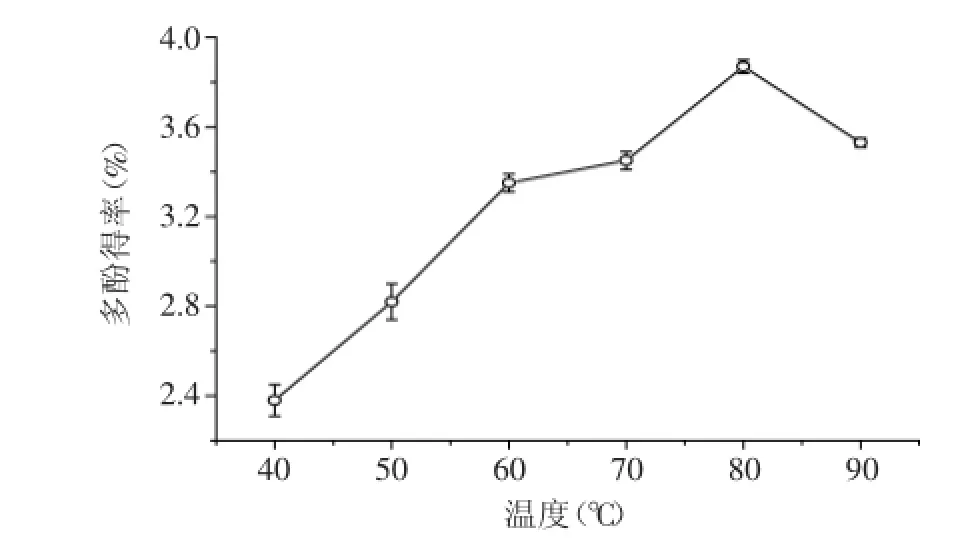
圖1 溫度對黃皮疣柄牛肝菌多酚得率的影響Fig.1 Effect of temperature on the extraction of Leccinellum crocipodium polyphenols
2.2.2乙醇濃度對多酚類物質提取效果的影響由圖2可知,隨著乙醇濃度增大,黃皮疣柄牛肝菌多酚的提取率不斷增加。當乙醇濃度達到60%時,多酚得率最高,超過此濃度,提取得率下降。可能是因為乙醇濃度過高,一部分乙醇會揮發影響提取率。另外,乙醇濃度過高會使醇溶性雜質、色素成分溶出,導致提取率下降,而乙醇濃度較低時,糖類物質和水互溶會影響多酚的提取率[16]。
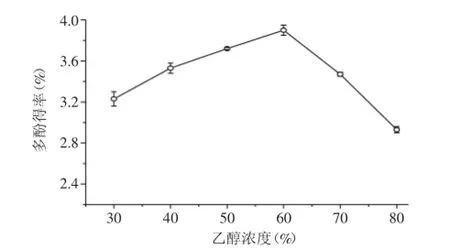
圖2 乙醇濃度對黃皮疣柄牛肝菌多酚得率的影響Fig.2 Effect of ethanol concentration on the extraction ofLeccinellum crocipodium polyphenols
2.2.3料液比對提取效果的影響由圖3可知,在相同提取條件下,隨著料液比的增大,黃皮疣柄牛肝菌多酚得率不斷增加。當料液比達到1∶25時,大多數多酚被提取出來。加大溶劑量后,多酚得率沒有顯著提高。另外,料液比過高,醇溶性雜質浸出率也會增高,對后續處理不利。因此,綜合考慮到溶劑的用量以及節能減排等需要,選取最佳料液比為1∶25。
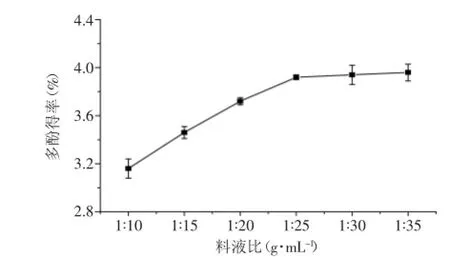
圖3 料液比對黃皮疣柄牛肝菌多酚得率的影響Fig.3 Effect of solid-liquid on the extraction of Leccinellum crocipodium polyphenols
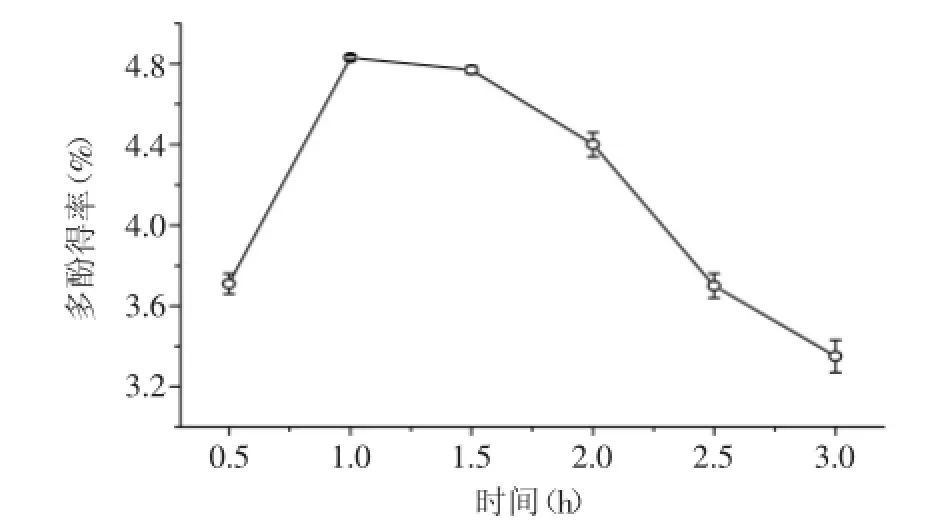
圖4 時間對黃皮疣柄牛肝菌多酚得率的影響Fig.4 Effect of time on the extraction of Leccinellum crocipodium polyphenols
2.2.4時間對多酚類物質提取效果的影響理論上說,提取率隨提取時間的增加而增大[17]。但是提取達到一定時間時,多酚的溶出達到平衡,即使再延長提取時間,提取率也不會顯著增加。另外,浸提時間過長時,多酚物質會發生降解、氧化等化學反應致使多酚分子結構發生一定的破壞。由圖4可知,提取1 h后,多酚提取率有所下降,故選取1 h為最佳提取時間。
2.3牛肝菌多酚提取工藝的正交實驗
在單因素實驗的基礎上,以黃皮疣柄多酚得率為考察指標,采用L9(34)正交表研究最佳提取條件,結果見表2。
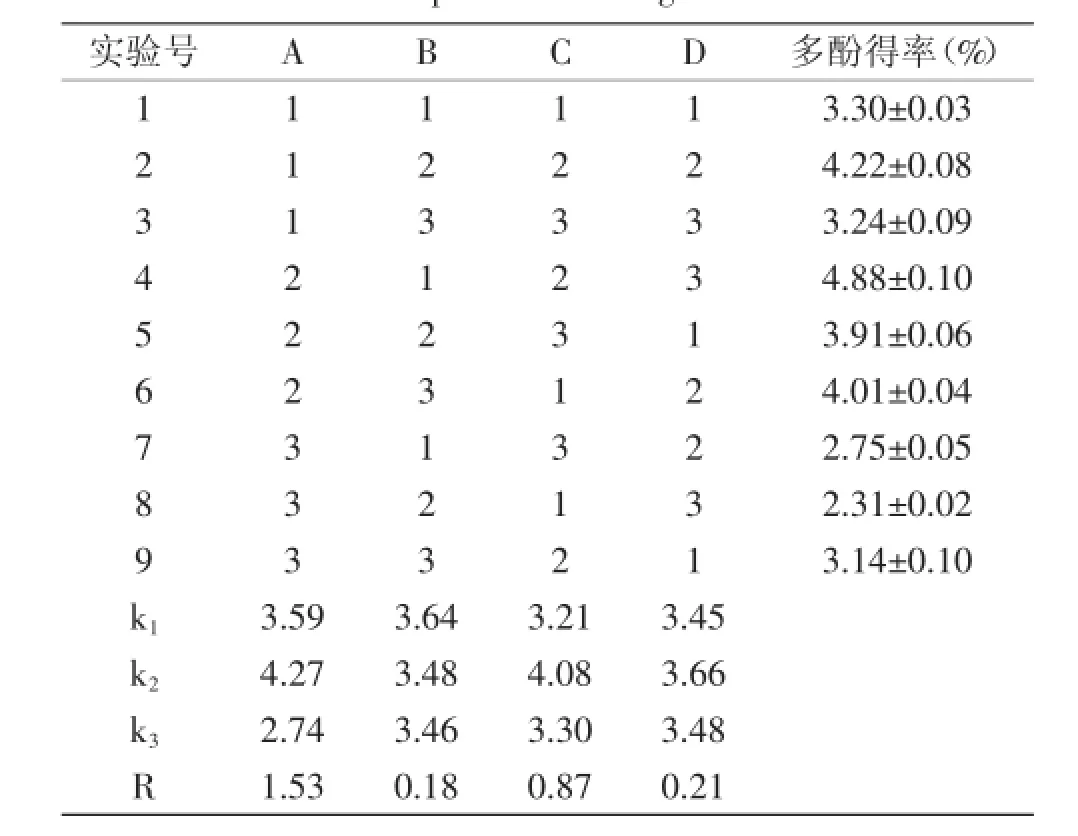
表2 實驗設計與結果Table 2 Experimental design and result
由表2結果可知,4個因素對黃皮疣柄牛肝菌多酚浸提效果影響最大的是浸提溫度,其次是料液比和時間,影響最小的是乙醇濃度。浸提黃皮疣柄牛肝菌多酚的最佳工藝條件組合為A2B1C2D2,即溫度為80℃,乙醇濃度為50%,料液比為1∶25 g/mL,提取1 h。對照正交表,正交實驗9組實驗中沒有A2C2D2B1,按A2C2D2B1條件補加實驗,重復三次取平均值,得黃皮疣柄牛肝菌多酚的得率為5.46%±0.04%,且高于正交實驗表中其他組合的多酚得率。
2.4浸提次數對多酚類物質提取效果的影響
在黃皮疣柄牛肝菌多酚提取的最佳工藝條件下,連續提取5次,分別測取單次浸提多酚類物質的含量并累計相加,浸提次數對黃皮疣柄牛肝菌多酚類物質提取效果的影響如圖5所示。提取2次和提取3次的提取物中多酚無顯著性差異(p>0.05),考慮到節約能源和人力,選取最佳浸提次數為2次。
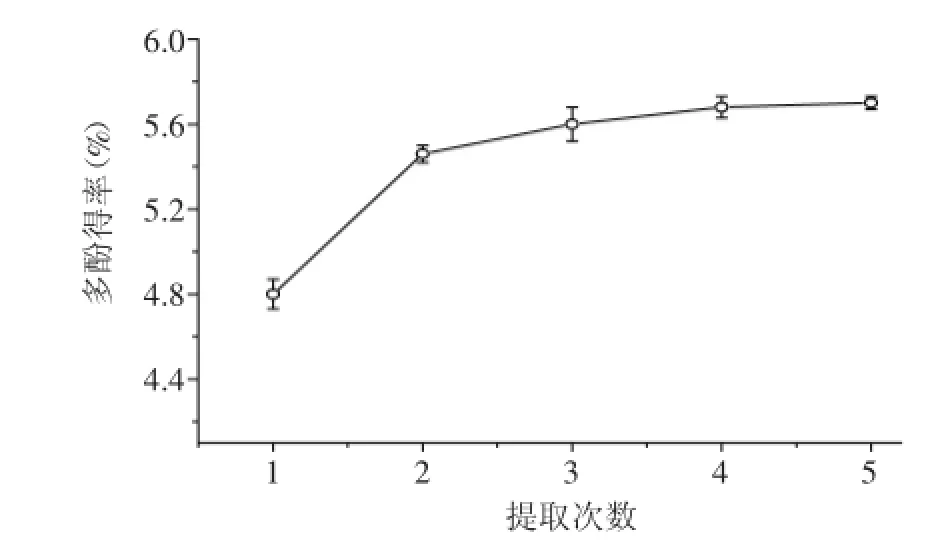
圖5 提取次數對黃皮疣柄牛肝菌多酚得率的影響Fig.5 Effect of extraction times on Leccinellum crocipodium polyphenols
2.5HPLC法測定多酚的成分
在1.2.5所述色譜條件下,將黃皮疣柄牛肝菌樣品進樣,測定18種多酚類物質的含量,各成分的含量以毫克等量每100克牛肝菌干重(mg/100 g)來表示,測定結果見表3。

表3 黃皮疣柄牛肝菌樣品多酚測定結果Table 3 Determination results of Leccinellum crocipodium samples
由表3可以看出,在該色譜條件下測定黃皮疣柄牛肝菌樣品,檢測出8種酚類物質,且5-磺基水楊酸在所檢測的18種酚類物質中含量最高。在黃皮疣柄牛肝菌中還檢測出綠原酸、兒茶素、對香豆酸、鞣花酸、苯甲酸、槲皮素和肉桂酸共8種多酚類物質。
在此色譜條件下,18種酚類物質得到了較好的分離,說明該色譜條件適合測定黃皮疣柄牛肝菌中5-磺基水楊酸、綠原酸、兒茶素、肉桂酸等多酚類物質。黃皮疣柄牛肝菌中所含多酚類物質的含量存在差異,其中5-磺基水楊酸含量最高為779.00 mg/100 g。
2.6MTT法檢測細胞存活率分析
黃皮疣柄牛肝菌對Caco-2結腸癌細胞的抑制作用如圖6所示(對照組細胞存活率設為100%)。
由圖6可知,Caco-2結腸癌細胞經過不同濃度的黃皮疣柄牛肝菌多酚提取物誘導培養48 h后,細胞存活率均有一定程度的下降。與對照組相比,呈顯著性差異(p<0.05)。且細胞存活率與多酚濃度呈良好的線性關系,隨濃度的增加而遞減。當其多酚濃度為175 μg/mL時,細胞存活率為44.93%,抑制率達55.07%。

圖6 黃皮疣柄牛肝菌乙醇提取物對細胞存活率的影響Fig.6 Effect of polyphenolic extracts from Leccinellum crocipodium on cell viability
實驗表明,黃皮疣柄牛肝菌對Caco-2結腸癌細胞產生一定程度的抑制作用。Caco-2結腸癌細胞數量的減少可能是黃皮疣柄牛肝菌多酚對細胞凋亡的誘導作用,也可能是對細胞增殖的抑制作用。細胞增殖、凋亡調控的異常與腫瘤發生、發展有關[18]。此前有報道指出,美味牛肝菌粗多糖對MCF-7細胞48 h抑制率僅為19.12%[19],低于黃皮疣柄牛肝菌多酚對結腸癌細胞的抑制作用。Fridrich等[20]研究表明,蘋果多酚能夠抑制結腸癌細胞增殖,而對正常細胞增殖作用不明顯。可可粉多酚提取物對Caco-2結腸癌細胞生長抑制率高達70%,主要原理是使細胞周期阻滯于G2/M期[21]。此外,Caco-2結腸癌細胞數量的減少可能與牛肝菌多酚的抗氧化作用相關。Caco-2結腸癌細胞細胞數量的減少還可能受黃皮疣柄牛肝菌提取物中所含多酚類物質的種類和含量的影響。黃皮疣柄牛肝菌對Caco-2結腸癌細胞抑制作用的機理有待探究,對其他癌細胞的作用效果有待進一步的實驗。
3 結論
在單因素實驗的基礎之上,通過正交實驗優化提取工藝,確定了最佳提取工藝條件為:溫度為80℃,乙醇濃度為50%,料液比為1∶25 g/mL,提取1 h,提取次數為2次時,黃皮疣柄牛肝菌多酚的得率為5.46%± 0.04%。黃皮疣柄牛肝菌中多酚含量存在較大的差異,在18種多酚類物質中,5-磺基水楊酸、兒茶素和肉桂酸等8種多酚類物質均被檢出,其中5-磺基水楊酸含量最高,為779.00 mg/100 g;體外細胞實驗結果表明,黃皮疣柄牛肝菌中提取的多酚類物質對Caco-2結腸癌細胞產生一定程度的抑制作用,可以開發為癌癥有效的治療劑。研究表明黃皮疣柄牛肝菌中多酚類化合物含量較高,具有一定的開發利用前景。
[1]袁明生.中國大型真菌彩色圖譜[M].四川科學技術出版社,2013.
[2]梅文泉,董寶生,和麗忠,等.黃皮疣柄牛肝菌營養成分分析[J].中國食用菌,2005,24(1):25-26.
[3]李泰輝,宋斌.中國食用牛肝菌的種類及其分布[J].食用菌學報,2002,9(2):22-30.
[4]朱萍,張微思,羅曉莉.美味牛肝菌膨化即食產品生產工藝技術研究[J].中國野生植物資源,2009,28(5):41-44.
[5]Huang M,Zhang S,Zhang M,et al.Effects of polysaccharides fromMorchellaconicaonnitricoxideproductionin lipopolysaccharide-treated macrophages[J].Applied Microbiology &Biotechnology,2012,94(3):763-771.
[6]Choi D Y,Lee Y J,Hong J T,et al.Antioxidant properties of naturalpolyphenolsandtheirtherapeuticpotentialsfor Alzheimer’s disease[J].Brain Research Bulletin,2012,87(2):144-153.
[7]王茂勝,連賓.美味牛肝菌研究[J].貴州林業科技,2003,31 (3):34-38.
[8]唐薇,魯新成.美味牛肝菌多糖的生物活性及其抗S-180腫瘤的效應[J].西南師范大學學報:自然科學版,1999,24(4):478-481.
[9]Byerrum R U,Clarke D A,Lucas E H,et al.Tumor inhibitors in Boletus edulis and other Holobasidiomycetes[J].Antibiotics& Chemotherapy,1957,7(1):25-29.
[10]Mei J P,Yoo E S,Koh Y S,et al.Antioxidant effects of the ethanol extract from flower of camellia japonica via scavenging of reactive oxygen species and induction of antioxidant enzymes [J].International Journal of Molecular Sciences,2011,12(4):2618-2630.
[11]Zuo L L,Wang Z Y,Fan Z L,et al.Evaluation of antioxidant andantiproliferativepropertiesofthreeactinidia(actinidia kolomikta,actinidia arguta,actinidia chinensis)extracts in Vitro [J].International Journal of Molecular Sciences,2012,13(5):5506-5518.
[12]Liang Q,Cui J,Li H,et al.Florets of sunflower(Helianthus annuus L.):potential new sources of dietary fiber and phenolic acids[J].Journal of Agricultural&Food Chemistry,2013,61 (14):3435-3442.
[13]司徒鎮強.細胞培養[M].世界圖書出版公司西安分公司,1996.
[14]Prasad K N,Hao J,Shi J,et al.Antioxidant and anticancer activities of high pressure-assisted extract of longan(Dimocarpus longan Lour.) fruit pericarp[J].Innovative Food Science& Emerging Technologies,2009,10(4):413-419.
[15]李珍.蘋果皮渣多酚提取、純化及抗氧化活性研究[D].北京:中國農業科學院,2014.
[16]呂成林,汪秋寬,宋悅凡,等.羊棲菜多酚的提取及純化工藝研究[J].食品工業科技,2014,35(22):231-240.
[17]郝少莉,仇農學,王宏.蘋果渣中多酚物質的提取技術研究[J].西北農業學報,2006,15(2):152-155.
[18]林雅軍,黃云虹,甄永占,等.賴氨大黃酸通過抑制HER-2信號通路誘導乳腺癌SK-Br-3細胞凋亡[J].藥學學報,2008,43(11):1099-1105.
[19]劉晏瑜.美味牛肝菌抗腫瘤作用及免疫功能初步探究[D].長春:吉林農業大學,2014.
[20]Fridrich D,Kern M,Pahlke G,et al.Apple polyphenols diminish the phosphorylation of the epidermal growth factor receptor in HT29 colon carcinoma cells[J].Molecular Nutrition& Food Research,2007,51(5):594-601.
[21]Carnésecchi S,Schneider Y,Lazarus S A,et al.Flavanols and procyanidins of cocoa and chocolate inhibit growth and polyamine biosynthesis of human colonic cancer cells[J].Cancer Letters,2002,175(2):147-155.
The polyphenol extraction of Leccinellum crocipodium and their inhibitory effect on proliferation of Caco-2 cells
LIU Yu-yang1,HOU Yu-yan1,WU Su-rui2,ZHAO Tian-rui1,FAN Jian1,*
(1.Yunnan Institute of Food Safety,Kunming University of Science and Technology,Kunming 650500,China;
2.Kunming Edible Fungi Institute of All China Federation of Supply and Marketing Cooperatives,Kunming 650221,China)
The polyphenols were extracted from the Leccinellum crocipodium by ethanol as extraction solvent extraction and Folin-Ciocalteu method.The effect of ethanol concentration,temperature,solid-liquid ratio and time on the extraction efficiency of polyphenols were identified.Based on single factor test,an orthogonal design was applied to optimize extraction process.The polyphenol composition and inhibitory effect on Caco-2 cells of Leccinellum crocipodium were investigated in the present work.The results showed that the optimum conditions for extraction of polyphenols were temperature of 80℃,ethanol concentration of 50%,solid-liquid ratio of 1∶25,extracted 1 h,two times.Under this condition,polyphenol extraction rate was 5.46%±0.04%. Among 18 kinds of polyphenols,the polyphenols of this wild edible fungi were mainly composed of 5-sulfosalicylic acid,catechin,cinnamon and other five kinds of polyphenols,and the content of 5-sulfosalicylic acid up to 779.00 mg/100 g.The inhibitory effects on colon carcinoma cells showed that the cell inhibition rate was up to 55.07%,when the polyphenols concentration was 175 μg/mL.
Leccinellum crocipodium;polyphenol;colon carcinoma cells;anticancer
TS201.3
B
1002-0306(2016)04-0278-06
10.13386/j.issn1002-0306.2016.04.047
2015-09-10
劉雨陽(1991-),女,碩士研究生,研究方向:發酵工程,E-mail:303245011@qq.com。
樊建(1964-),男,碩士,副教授,研究方向:食品科學與工程,E-mail:fanj333@163.com。
國家科技支撐計劃課題(2013BAD16B01)。

