琥珀酰化燕麥分離蛋白制備條件的優化及其結構分析
劉金陽,趙城彬,陳 旸,張 瑤,張 揚,吳 非(.東北農業大學食品學院,黑龍江哈爾濱50030;.黑龍江農業工程職業學院,黑龍江哈爾濱50030)
琥珀酰化燕麥分離蛋白制備條件的優化及其結構分析
劉金陽1,趙城彬1,陳旸1,張瑤1,張揚2,吳非1
(1.東北農業大學食品學院,黑龍江哈爾濱150030;2.黑龍江農業工程職業學院,黑龍江哈爾濱150030)
為提高燕麥分離蛋白(OPI)的溶解性,采用琥珀酰化法對燕麥分離蛋白進行改性。通過單因素實驗研究反應溫度、pH、酸酐添加量、蛋白濃度對OPI溶解性的影響,同時采用熒光發射光譜對其結構變化進行分析。在單因素實驗的基礎上,運用響應面法優化出琥珀酰化改性燕麥分離蛋白的適宜條件:反應溫度為50℃、pH為8.5、酸酐添加量為10%、蛋白濃度為4%,在此條件下溶解度為68.38%。熒光發射光譜檢測得出,琥珀酰化后OPI的熒光強度增強,是由于改性后側鏈結構展開,更多的亮氨酸暴露出來所引起。
燕麥分離蛋白,琥珀酰化,優化,結構
燕麥作為一種優質谷物,其蛋白質含量高于其他谷物,并且氨基酸配比均衡,必需氨基酸含量都接近或略高于世界衛生組織推薦值[1-2]。研究表明,燕麥分離蛋白(OPI)具有免疫性,可以用作嬰兒食品的添加劑以及生物醫藥制劑[3]。然而,OPI的溶解性較差,不能滿足食品加工的要求,OPI的應用由此受到了極大的限制。琥珀酸酐是美國食品法典允許使用的食品加工助劑,而且因加工中采用氫氧化鈉調節體系的pH,反應的產物中會產生少量的琥珀酸鈉和琥珀酸二鈉,兩者都是食品鮮味劑,可改善食品風味。因此,琥珀酰化改性法是一種安全無毒還能提高蛋白風味的改性方法,可以既不影響蛋白質營養價值,又能提高其功能性質。目前,國內外對燕麥蛋白的酰化改性研究很少,只能借鑒于酰化改性對其他植物蛋白溶解性等功能性質的研究[4-11],而對改性燕麥分離蛋白結構的測定分析更是鮮有報道。因此,本文不僅著重探尋適宜的酰化改性條件來改善OPI的溶解性,同時采用熒光發射光譜法對酰化改性前后的OPI結構進行初步分析,為OPI進一步的深層研究提供理論依據。
1 材料與方法
1.1材料與儀器
燕麥分離蛋白(OPI) 實驗室自制,蛋白質含量為85.76%;琥珀酸酐國藥集團化學試劑有限公司;G-250考馬斯亮藍上海荔達生物科技有限公司;牛血清蛋白上海伯奧生物科技有限公司;茚三酮萊陽市雙雙化工有限公司;所用其他試劑均為分析純。
LGJ-10型冷凍凍干機上海醫用離心機廠;JJ-1精密定時電動攪拌器江蘇省金壇市榮華儀器制造有限公司;FE20實驗室pH計梅特勒-托利多儀器(上海)有限公司;數顯攪拌水浴鍋常州賽普實驗儀器廠;紫外分光光度計北京普析通用儀器有限責任公司;日立F4500熒光分光光度計日本HITACHI公司;其他儀器均為實驗室常規儀器。
1.2實驗方法
1.2.1琥珀酰化OPI的制備將2 g OPI分散在50 mL去離子水中(蛋白質濃度為4%,w/v),在室溫下攪拌1 h,用1 mol/L NaOH調節pH為8.5,然后分批加入一定量的琥珀酸酐(琥珀酸酐占OPI的質量比為10%),反應過程中不斷攪拌,并用1 mol/L NaOH維持pH穩定不變,直至溶液pH不再變化反應結束。將蛋白溶液在4℃透析24 h以除去殘余的琥珀酸酐,凍干即為酰化蛋白[12]。
1.2.2OPI琥珀酰化條件的單因素實驗基本反應條件為:反應溫度50℃,pH8.5,琥珀酸酐添加量10%,蛋白質濃度4%。在其他條件不變的情況下,以溶解度和酰化度為考察指標,選擇反應溫度為30、40、50、60、70℃,pH為7.0、7.5、8.0、8.5、9.0,琥珀酸酐添加量為5%、10%、15%、20%、25%,蛋白濃度為1%、2%、3%、4%、5%(w/v),進行單因素實驗,考察各因素對其溶解度和酰化度的影響,每個樣品做3組平行實驗。
1.2.3OPI琥珀酰化條件的響應面實驗在單因素實驗基礎上,根據Box-Behnken設計原理,反應溫度(A)、pH(B)、琥珀酸酐添加量(C)和蛋白濃度(D)為自變量,溶解度(R1)為響應值設計響應面優化實驗設計了四因素三水平的響應面分析實驗,對實驗數據結果采用Design-Expert 7.1軟件進行分析。實驗的因素和水平取值見表1。
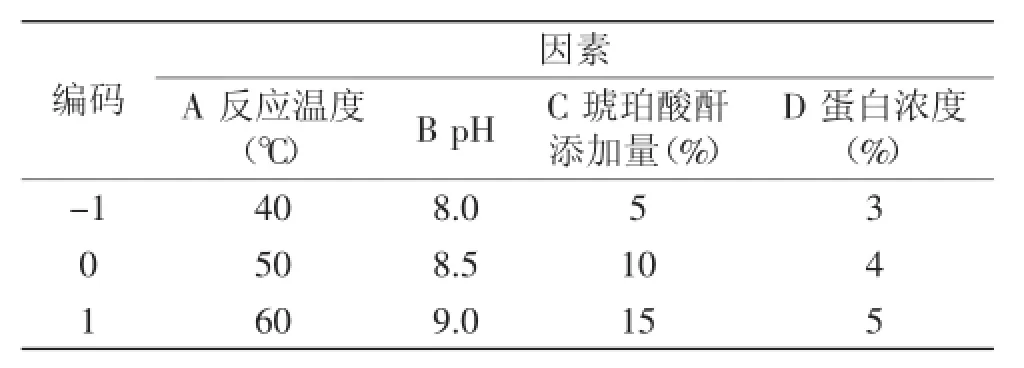
表1 響應面實驗因素水平表Table 1 Code of factors and levels
1.2.4溶解度的測定根據Bradford法稍作改動。配制1%酰化蛋白樣品10 mL,于25℃磁力攪拌0.5 h,分散液以4000 r/min離心15 min,取50 μL上清液與試管中,并加入50 μL生理鹽水和5 mL考馬斯G-250振蕩1 min,放置10 min后,以100 μL生理鹽水和5 mL考馬斯G-250作空白,于595 nm處進行比色測定,以牛血清蛋白(1 mg/mL)繪制標準曲線,所得標準曲線方程為y=0.6731x+0.0067(R2=0.9974)。蛋白質的溶解度表示為上清液蛋白濃度占總蛋白濃度的百分比。每個樣品測定三次。
1.2.5酰化度的測定酰化度采用茚三酮法測定:配制1%(w/v)的蛋白液,取1 mL放入試管中,再向試管中加入1 mL的茚三酮顯色劑[13],搖勻后蓋塞,在沸水中加熱16 min,取出后在20℃的水浴中冷卻,再向試管中加入5 mL的KIO3稀釋液,振蕩搖勻,以蒸餾水作空白,測定樣品在570 nm處的吸光值。以吸光度表示燕麥分離蛋白的酰化度,吸光度越高,酰化度越低。

1.2.6燕麥分離蛋白結構的測定采用熒光分光光度計測定,激發波長為280 nm,發射波長測定范圍為300~450 nm。將樣品稀釋到OPI濃度為0.5%[14]。
1.3數據處理
原始數據的整理采用Microsoft Exce(lOffice 2003)完成;數據均為三組平行實驗所得的平均值,數據以表示;采用Design-Expert中心組合及混合中心設計進行數據分析及方差分析。
2 結果與討論
2.1OPI琥珀酰化條件單因素實驗分析
2.1.1反應溫度對OPI溶解度的影響如圖1所示,在30~50℃這一區間內,溶解度隨著溫度的升高而升高,在50℃時達到最大值為66.2%。這是由于在一定溫度范圍內,反應溫度升高,粒子運動速率就會增加,反應速度加快,琥珀酰化對OPI的改性程度增大,OPI的酰化度也隨之升高,這樣OPI引入親水基團(琥珀羧基),消除了蛋白質中的氨基陽離子,增加了蛋白質分子的凈負電荷,減弱了分子間聚集作用,從而提高了其親水性。隨著反應溫度的繼續升高,OPI的溶解度趨于穩定,而酰化度略有下降,這可能是由于,反應溫度的升高導致粉末狀的琥珀酸酐加速了使蛋白分子沉淀的現象,從而使酰化度有所降低。因此,50℃為適宜的反應溫度。
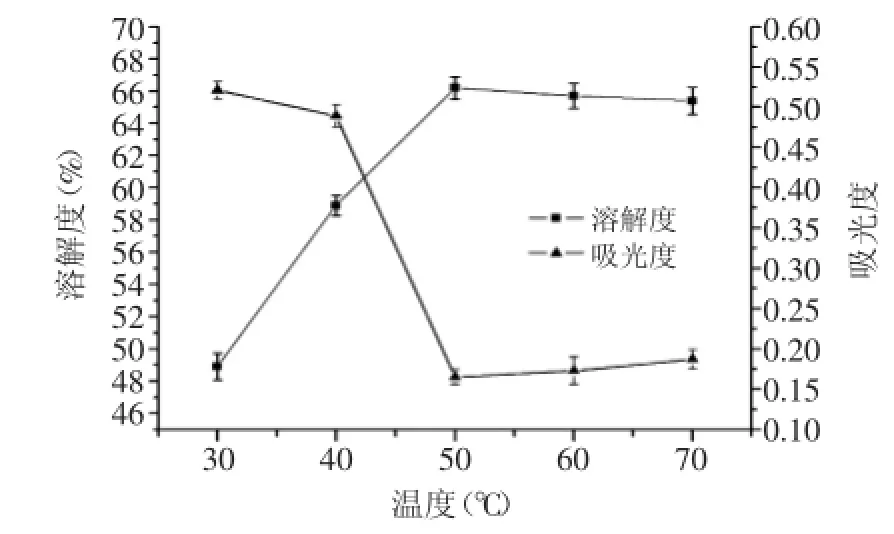
圖1 反應溫度對琥珀酰化OPI溶解度的影響Fig.1 The effect of reaction temperature on the solubility of succinylated OPI
2.1.2pH對OPI的溶解度的影響如圖2所示,琥珀酰化適宜在中性偏堿的條件下進行,當反應pH在7~8.5之間時,溶解度隨著pH提高而增加;pH8.5達到最大值68.5%,而后pH增大溶解度略有下降。這是由于琥珀酰化時引入親水基團,增加了蛋白質的凈負電荷,pH的升高導致凈負電荷更多,更易于分散,所以pH越高,溶解度越大,反應速度越快,進而琥珀酰化對OPI的改性程度增大,OPI的酰化度升高。但超過一定范圍,pH越大,OH-濃度也越大,酰化副反應程度越高,從這方面講,pH越高不利于酰化反應的進行,因此,選取8.5為適宜的pH。
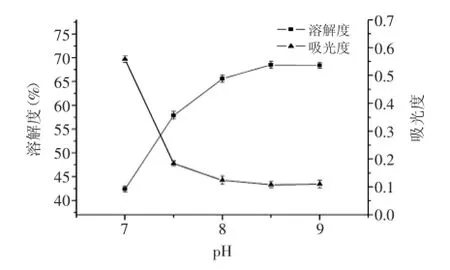
圖2 pH對琥珀酰化OPI溶解度的影響Fig.2 The effect of pH on the solubility of succinylated OPI
2.1.3琥珀酸酐添加量對OPI的溶解度的影響如圖3所示,當琥珀酸酐添加量為小于10%時,溶解度隨著琥珀酸酐添加量的增加而呈遞增趨勢,在琥珀酸酐添加量為10%時溶解度達到最大值為68.8%。當琥珀酸酐添加量繼續增加時,溶解度將趨于平穩,酰化度也趨于平衡。這是因為當酰化度達到92.4%時,被修飾的ε-NH2殘基基本反應完全,產物的溶解度隨酰化度達到最大并趨于平衡,所以琥珀酸酐添加量并不是越大越好。所以,適宜的琥珀酸酐添加量為10%。
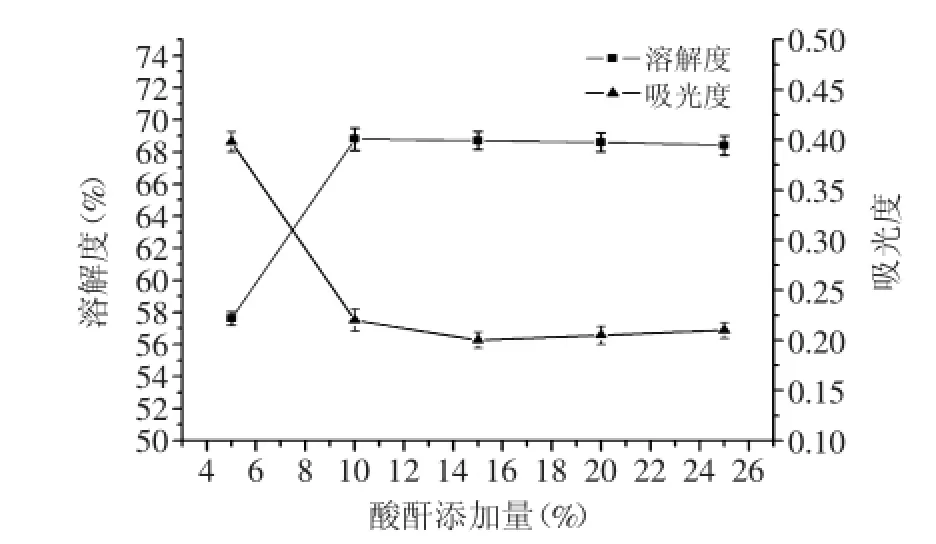
圖3 琥珀酸酐添加量對琥珀酰化OPI溶解度的影響Fig.3 The effect of addition of succinic anhydride on the solubility of succinylated OPI
2.1.4蛋白濃度對OPI的溶解度的影響如圖4所示,蛋白濃度較小時,溶解度隨著蛋白濃度的增大而增加,當達到4%時,溶解度達到最大值67.4%,而后溶解度和酰化度不再增加均趨于平緩。原因是當燕麥分離蛋白濃度較低時,蛋白質分子處于溶解狀態,與琥珀酸酐分子碰撞的幾率大,所以酰化度增加;當蛋白濃度增加到4%時,許多蛋白分子呈非溶狀態,
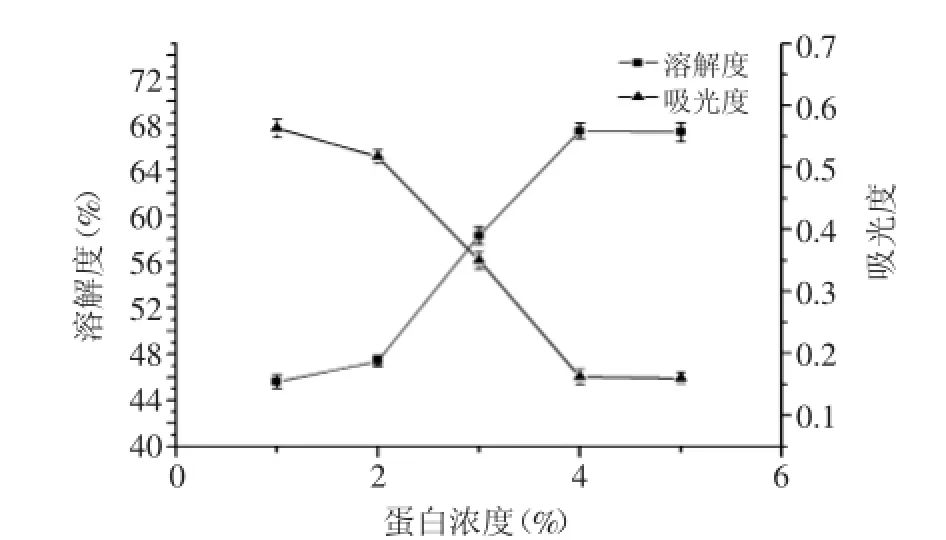
圖4 蛋白濃度對琥珀酰化OPI溶解度的影響Fig.4 The effect of the concentration of OPI on the solubility of succinylated OPI
在反應體系中,不能再與琥珀酸酐分子發生有效碰撞,因此酰化度不再增大。燕麥分離蛋白的蛋白濃度不超過4%時,其酰化度越大,溶解度也越高,因為酰化度越大,引入親水性琥珀酸酐基團越多,凈負電荷越多,靜電斥力越大,蛋白質與水的相互作用越強,溶解度提高。所以選取4%為適宜的蛋白濃度。
2.2OPI琥珀酰化條件響應面實驗分析
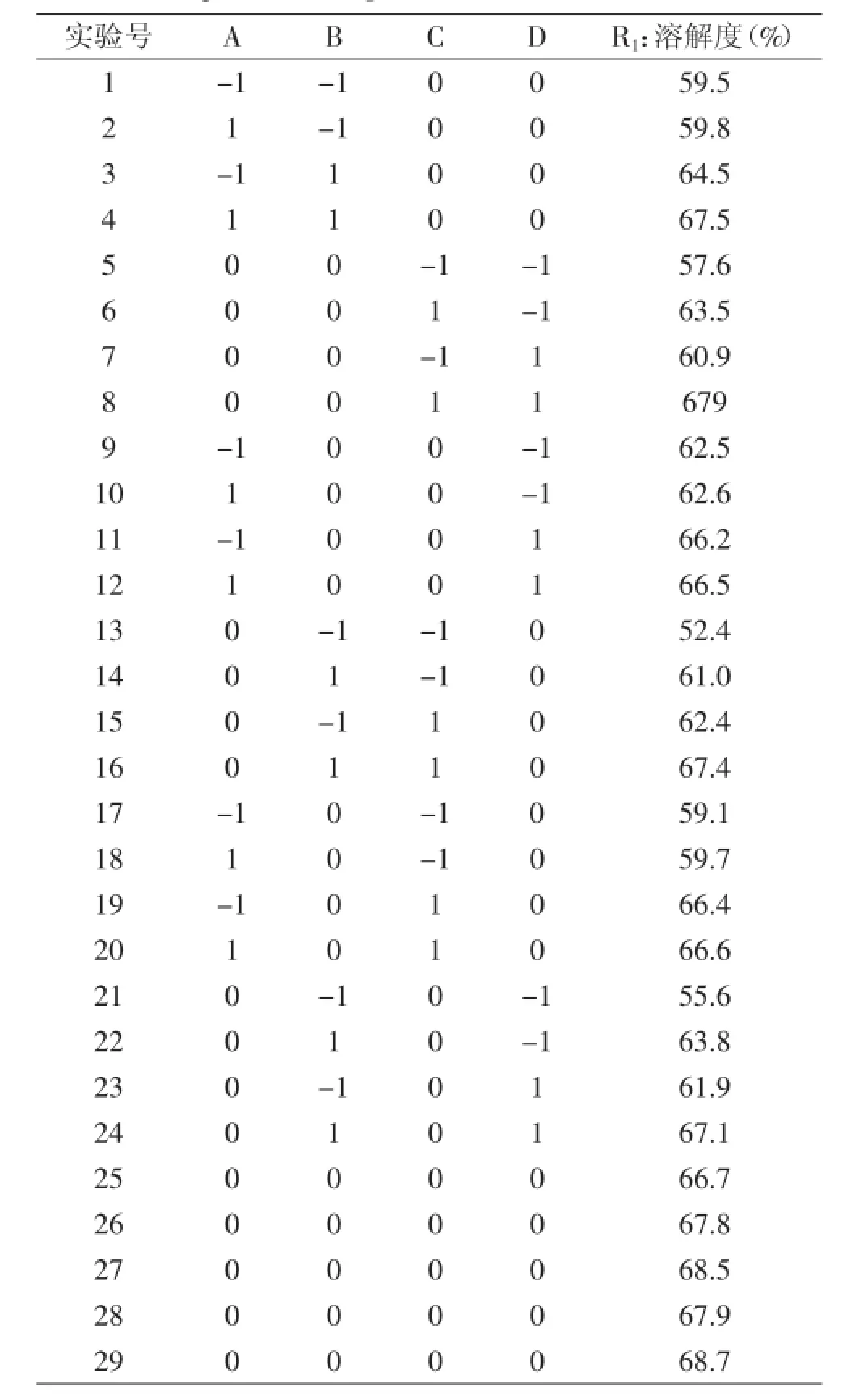
表2 Box-Behnken實驗設計及結果Table 2 Experiment design and results table of Box-Behnken
在單因素實驗的基礎上,根據Box-Behnken中心組合實驗設計原則,確定了響應面實驗因素的0水平為:A反應溫度為50℃、B pH為8.5、C琥珀酸酐添加量為10%和D蛋白濃度為4%。
響應面設計方案和實驗結果見表2,利用Design-Expert 7.1軟件對實驗結果進行二次回歸分析,計算OPI溶解性R1的回歸方程并進行方差分析(見表3)。根據表3的方差分析對Box-behnken模型方程進行優化,剔除影響不顯著項,得到優化后的回歸模型為:R1=67.92+0.49A+3.34B+3.63C+1.99D-0.90BC-0.75BD-1.56A2-3.69B2-3.39C2-2.11D2
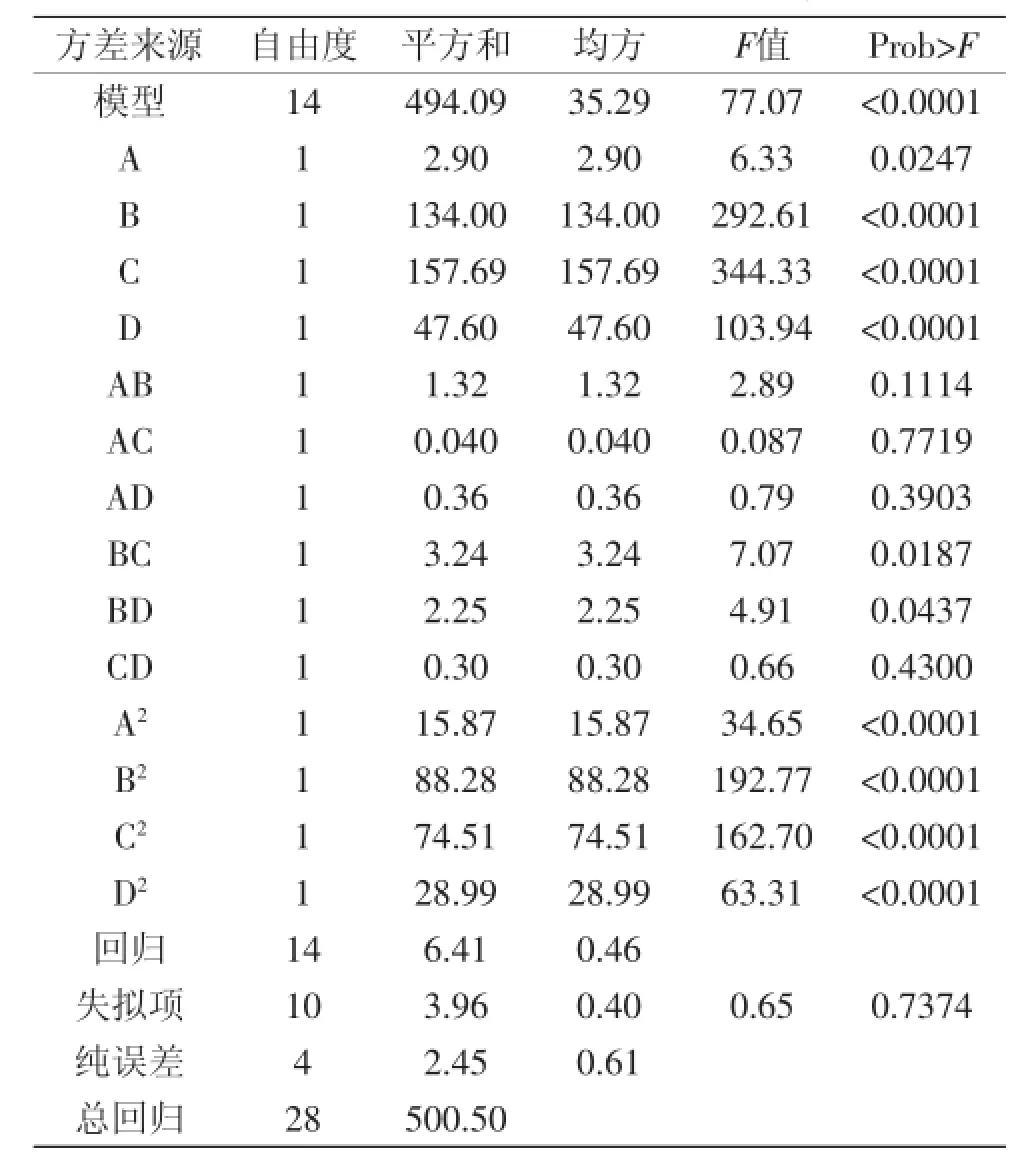
表3 方差分析結果Table 3 The test results of variance analysis
由表3可知,方程因變量與自變量之間的線性關系明顯,該模型回歸顯著(p<0.0001),失擬項不顯著(p>0.05),并且該模型R2=0.9872,R2Adj=0.9744,說明該模型與實驗擬合良好,自變量與響應值之間線性關系顯著,可以用于該反應的理論推測。由F檢驗可以得到因子貢獻率為:C>B>D>A,即琥珀酸酐添加量>pH>蛋白濃度>反應溫度。
由圖5和圖6可知,在固定兩個因素(水平值為0)水平值時,其他兩個因素的3D曲面圖的總體形狀較為相似,都是隨著另一因素的變化一直升高后趨于平緩。綜合上述圖形等高線和方差分析結果,pH(B)和琥珀酸酐添加量(C)、pH(B)和蛋白濃度(D)的交互作用影響顯著(p<0.05)。應用響應面優化分析方法對回歸模型進行分析,并根據實際情況進行修正后得到OPI琥珀酰化最優條件為:反應溫度為50℃、pH為8.5、琥珀酸酐添加量為10%、蛋白濃度為4%。按照最優工藝條件進行三次重復實驗,得到琥珀酰化改性燕麥蛋白反應條件下溶解度為68.38%,與預測值68.62%的誤差在±2%以內,預測值與實驗值之間的良好擬合性證實了模型的有效性。表明所得出的回歸方程可以很好的反映反應溫度、pH、琥珀酸酐添加量、蛋白濃度與溶解度之間的關系,說明采用響應面法優化得到的工藝條件準確可靠,按照建立的模型進行預測實際實驗是可行的。
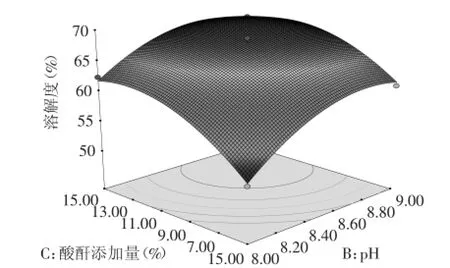
圖5 pH和琥珀酸酐添加量對OPI溶解性的影響Fig.5 Effect of pH and addition of succinic anhydrideon the solubility of OPI
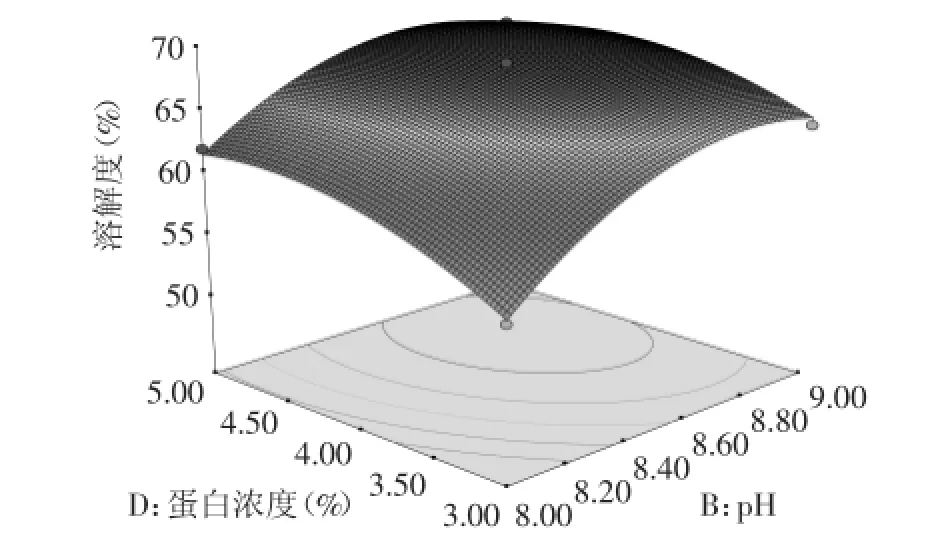
圖6 pH和蛋白濃度對OPI溶解性的影響Fig.6 Effect of pH and the concentration of OPI on the solubility of OPI
2.3琥珀酰化前后OPI的熒光光譜分析
蛋白質的熒光性由芳香族氨基酸如色氨酸、酪氨酸、苯丙氨酸引起的。色氨酸的熒光發射通常用作蛋白構想變化的指示器。因為它對局部環境的高靈敏性,因此,蛋白質的最大發射波長反映水相中暴露色氨酸殘基的平均值[15]。圖7顯示改性前后OPI的熒光發射光譜。與OPI相比,琥珀酰化后的OPI的熒光強度增加。這可能由于琥珀酰化過程中蛋白質側鏈展開,使更多的亮氨酸暴露出來,因此在347 nm處最大吸收峰增大,熒光強度增強。經琥珀酰化改性后,肽鏈伸展,空間結構發生變化,分子柔韌性提高,使得其溶解性大大提高。
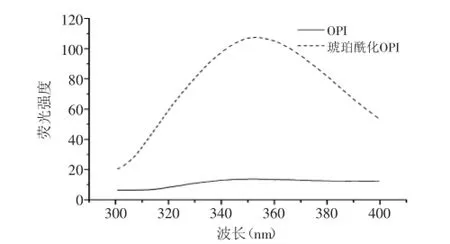
圖7 OPI和琥珀酰化OPI的熒光光譜圖Fig.7 Typical emission fluorescence spectra of untreated and succinylated OPI sample
3 結論
采用琥珀酰化法對燕麥分離蛋白進行改性,利用響應面法優化得到琥珀酰化OPI優化工藝條件為:反應溫度50℃、pH8.5、琥珀酸酐添加量10%、蛋白濃度4%。該條件下制備的琥珀酰化OPI的溶解度為68.38%,預測值與實驗值之間的良好擬合性證實了模型的有效性,說明利用本實驗建立的模型的優化結果與實際情況吻合。琥珀酰化后OPI的熒光強度增強,可能是改性后側鏈結構展開,更多的亮氨酸暴露出來引起的。經琥珀酰化改性后,肽鏈伸展,空間結構發生變化,分子柔韌性提高,使得其溶解性大大提高,為以后功能性質的深入研究及應用奠定了良好的基礎。
[1]管驍,姚惠源,張鳴鏑.燕麥麩分離蛋白的酶解對其功能性質的影響[J].農業工程學報,2006,22(11):217-221.
[2]李進.燕麥的營養價值與保健功效[J].新疆農業科技,1993 (5):38-39.
[3]李芳,劉剛,劉英.燕麥的綜合開發和利用[J].武漢工業大學學報,2007,26(1):23-26.
[4]張紅印,朱加進.小麥面筋蛋白琥珀酰化改性研究[J].中國農業科學,2003,36(3):313-317.
[5]姜紹通,唐文婷,潘麗軍.小麥面筋蛋白琥珀酰化修飾研究[J].食品科學,2005,26(12):40-44.
[6]熊正俊,趙國華.酰化對大豆蛋白結構和功能性質影響[J].糧油與油脂,2001,9:5-7.
[7]Gruener L,Ismond M A H.Effects of acetylation and succinylation on the functional properties of the canola 12S globulin[J].Food Chemistry,1997,60:513-520.
[8]Dua S,Mahajan A.Improvement of functional properties of rapseed(Brassica campestris Var.Toris)preparations by chemical modification[J].J Agriculture and Food Chemistry,1996,44:706-710.
[9]Wanasundara,Shahidi F.Functional properties of acylated flax protein isolates[J].J Agriculture and Food Chemistry,1997,45:2431-2441.
[10]Lelia M,Mahdi K,Mohammad S.Effect of succinylation and deamidation on functional properties of oat protein isolate[J].Food Chemistry,2009,114:127-131.
[11]Lawal O S,Adebowale K O.Effect of acetylation and succinylation on solubility profile,water absorption capacity,oil absorption capacity and emulsifying properties of mucuna bean (Mucuna pruriens)protein concentrate[J].Nahrung/Food,2004,48(2):129-136.
[12]姚玉靜,楊曉泉.乙酰化大豆分離蛋白的功能特性研究[J].中國調味品,2001(9):16-19.
[13]姚玉靜,楊曉泉,唐傳核,等.酰化對大豆分離蛋白水合性質的影響[J].食品與機械,2005,22(4):19-21.
[14]María J S,María J M,Ana M R P.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein dextran systems[J].Food Hydrocolloids,2014,39:223-230.
[15]Broersen K,Voragen A G J,Hamer R J,et al.Glucoforms of β-lactoglobulin with improved thermostability and preserved structural packing[J].Biotechnology and Bioengineering,2004,86:78-87.
Optimization of preparation conditions and structural analysis of succinylated oat protein isolate
LIU Jin-yang1,ZHAO Cheng-bin1,CHEN Yang1,ZHANG Yao1,ZHANG Yang2,WU Fei1(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;
2.Heilongjiang Agricultural Engineering Vocational College,Harbin 150030,China)
In order to improve the solubility of oat protein isolate(OPI),succinylation was used to modify the proteins.The effects of the temperature of reaction,pH,the ratio of succinic anhydride,and the concentration of proteins on solubility were studied by single factor experiments.The changes of structure of OPI were analyzed by fluorescence emission spectra.Through the response surface methodology,the optimal conditions were as follows:the temperature of reaction 50℃,pH8.5,the ratio of succinic anhydride 10%and the concentration of proteins 4%.The solubility of OPI reaches to 68.38%in the optimal conditions.Fluorescence intensity of succinylated oat protein isolate increased,which was obtained by fluorescence emission spectra.The increasing of fluorescence intensity was due to more exposed leucine which were caused by the expanding of the structure of side chains.
oat protein isolate;succinylation;optimization;structure
TS201.1
B
1002-0306(2016)04-0294-05
10.13386/j.issn1002-0306.2016.04.050
2015-07-06
劉金陽(1991-),女,碩士研究生,研究方向:植物蛋白,E-mail:jinnyliu2011@163.com。
吳非(1968-),女,博士,教授,研究方向:植物蛋白,E-mail:wfneau@163.com。
黑龍江省科技攻關項目(GC13B213)。

