氧化應激中ROS對FOXO3a轉錄因子的調控作用研究進展
李 昂,邢雅琪,李曉霞,章吉威,郭會彩
(河北醫科大學衛生毒理學教研室,河北 石家莊 050017)
?
氧化應激中ROS對FOXO3a轉錄因子的調控作用研究進展
李昂,邢雅琪,李曉霞,章吉威,郭會彩
(河北醫科大學衛生毒理學教研室,河北 石家莊050017)
活性氧(reactive oxygen species,ROS)介導的氧化應激參與多種細胞信號轉導過程,FOXO3a轉錄因子是氧化應激中多個信號通路的交匯點,ROS對FOXO3a存在著復雜的調控作用。由于FOXO3a在細胞增殖、細胞周期阻滯、ROS清除和誘導細胞凋亡中發揮復雜而重要的作用,已經成為氧化應激損傷的研究熱點之一。該文對氧化應激損傷中FOXO3a的活性調節機制及其靶基因進行了綜述,為FOXO3a靶向調控氧化應激和臨床治療相關疾病開辟了新的思路。
氧化應激;ROS;FOXO3a;調控作用;磷酸化作用;抗氧化酶
1 前言
活性氧(reactive oxygen species,ROS)是正常細胞代謝的一種副產物,參與多種細胞信號轉導過程。當ROS產生過多或清除能力下降,機體氧化還原水平失衡,導致機體發生氧化應激(oxidative stress)損傷[1]。ROS介導的氧化應激參與眾多病理生理學過程,是導致組織損傷、機體衰老、疾病和細胞凋亡的一個重要因素。如何通過內源性途徑有效地維持細胞內ROS穩態,恢復機體抗氧化平衡已成為許多領域的研究熱點。
FOXO3a轉錄因子屬于叉頭框轉錄因子家族(forkhead box,FOX)的O亞族,參與細胞內包括調節細胞周期、促進凋亡、抗氧化應激損傷等在內的多種生物學調控。研究表明,FOXO3a廣泛表達于成人的各種組織器官中,包括骨骼肌、心血管系統、神經系統、腎、肝、胰腺和胸腺中。基于FOXO3a維持活性氧穩態方面的重要作用及其廣泛表達、內源性等特點,為抗氧化應激損傷的研究開辟了新的途徑。
2 FOXO3a的結構基礎
Kenyon等[2]研究秀麗線蟲(C.elegans)突變體時發現,DAF-16基因在高度保守的轉導通路中發揮抗氧化應激和促進長壽的作用。而DAF-16基因與哺乳動物FOXO轉錄因子同源,人們猜想,FOXO轉錄因子可能同樣具有抗氧化應激和促進長壽的作用,引發了對FOXO廣泛而深入的研究(Fig 1)。
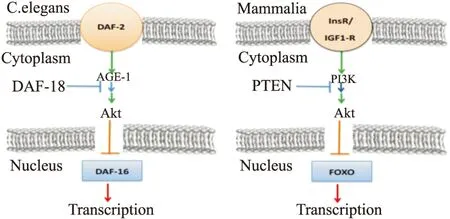
Fig 1 Insulin signaling in mammalian cells and in C. elegans
See text for further details.C.elegans DAF-2 and DAF-16 gene homologous to PI3K/Akt and FOXO respectively.DAF-2 possessing DAF-16 inhibition is similar to the PI3K/Akt suppression of FOXO
哺乳動物的FOXO轉錄因子家族包含4個成員:FOXO1、FOXO4、FOXO3a和FOXO6,它們都具有由110個氨基酸組成的DNA結合結構域,其中以FOXO3a的分布和功能最為廣泛[3]。FOXO3a上的Thr32、Ser253、Ser 315、Ser 644殘基等磷酸化位點[4],Lys242、 Lys245氨基酸殘基等乙酰化位點[5],可與細胞內的多種信號分子交互作用,從而影響FOXO3a的活性與功能。
3 氧化應激對FOXO3a的調控作用
當機體發生氧化應激時,累積的ROS通過激活多種信號通路,使FOXO3a發生磷酸化/去磷酸化,乙酰化/去乙酰化等翻譯后修飾,從而調控FOXO3a的活性與功能。而這一過程是相當復雜,有些甚至是矛盾的。以磷酸化為例,PI3K-AKT通路與p38 MAPK(p38 mitogen-activated kinase)、ERK(extracellular-signal-regulated kinase)、SGK(serum/glucocorticoid regulatedkinase 1)、IKKβ(IkB kinase β)等激酶可使FOXO3a發生磷酸化,抑制其轉錄活性;而AMPK、JNK(c-Jun N-terminal kinase)、MST1等蛋白激酶則可通過磷酸化作用,增強FOXO3a的轉錄活性(Fig 2)。
3.1ROS抑制FOXO3a
3.1.1FOXO3a的磷酸化與泛素化Coskun等[6]研究發現,在HCT 116和HT-29結腸癌細胞中,PI3K-AKT信號通路在Thr32、Ser253、Ser315位點使FOXO3a發生磷酸化,磷酸化的FOXO3a與14-3-3蛋白結合形成復合物,由胞核轉移到胞質,減少其轉錄活性,抑制細胞凋亡。Dey等[7]在乳腺癌細胞的研究中發現,使用Akt的抑制劑Iturin A,處理MDA-MB-231和 MCF-7 乳腺癌細胞后,減少了FOXO3a的磷酸化,導致FOXO3a的核內聚集,增強了其轉錄活性。紫鉚因(butein)是一種多酚類化合物。在小鼠子宮頸癌模型中,紫鉚通過抑制AKT、ERK以及p38 MAPK信號通路,減少FOXO3a的磷酸化,從而激活FOXO3a入核,增強子宮頸癌細胞對鉑化合物的敏感性,發揮抗腫瘤活性[8]。p66Shc蛋白在多種組織中介導氧化應激,有研究表明,激活p66Shc 造成的氧化應激反而可增加ERK-1/2、Akt表達,增強對FOXO3a磷酸化作用,抑制FOXO3a的轉錄活性[9]。
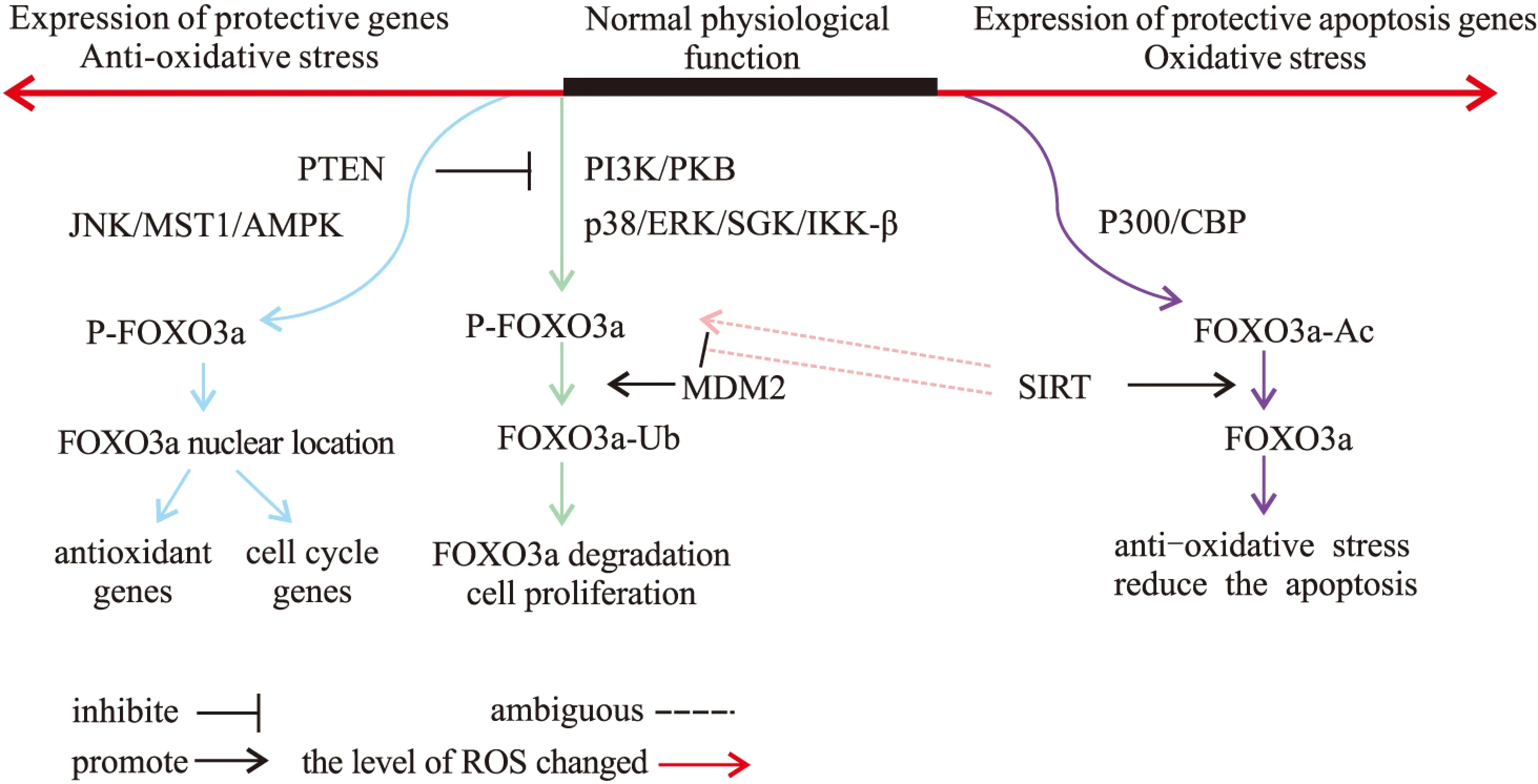
Fig 2 Activation or inhibition of FOXO3a through ROS-induced posttranslational modifications
FOXO3a蛋白分子經多種蛋白激酶的磷酸化作用后,與泛素連接酶E3 MDM2結合,作為MDM2的底物泛素化進而降解[10]。以上過程使FOXO3a與下游靶基因隔絕,導致FOXO3a的轉錄活性受到抑制。
3.1.2FOXO3a的乙酰化CBP(cAMP binding protein, CBP)/p300(cAMP binding protein p 300)乙酰基轉移酶可在叉頭區Lys242、Lys245、Lys262等位點直接乙酰化FOXO3a蛋白的賴氨酸,兩者以二硫鍵共價結合,通過這種直接的乙酰化修飾影響FOXO3a轉錄能力[11]。ROS可通過介導p300/CBP乙酰化作用,促使FOXO3a半胱氨酸與p300/CBP乙酰基轉移酶的硫醇形成含二硫鍵的復合物,從而調節FOXO3a生物學功能[12]。這種氧化還原反應對FOXO3a的直接調節,表明FOXO3a蛋白作為ROS 感受器,也是氧化應激反應的中介者,對于維持胞內氧化還原穩態具有重要作用。
3.2ROS增強FOXO3a
3.2.1FOXO3a的磷酸化與去磷酸化心臟微血管內皮細胞的研究表明,高糖刺激引起ROS積累,可通過抑制Akt激活FOXO3a,導致FOXO3a核定位,并與下游基因結合,促進細胞凋亡[13]。PTEN是PKB/Akt抑制因子,在氧化還原反應中具有重要調控作用。研究表明,在CRC(colorectal cancer)細胞中,ROS激活通過PTEN (phosphatase and tensin homologue),抑制PI3K/AKT通路,導致FOXO3a磷酸化減少,FOXO3a轉錄活性增強,從而誘導Bim等靶基因表達,介導細胞凋亡[14]。
AMPK、JNK(c-Jun N-terminal kinase)、MST1等蛋白激酶可通過磷酸化作用增強FOXO3a功能。ROS積累引起的氧化應激中,JNK、MST1(mammalian sterile 20-like kinase 1)和腫瘤壞死因子(tumor necrosis factor-α ,TNF-α) 等信號分子可使FOXO3a發生磷酸化,使FOXO3a發生核轉位,提高其轉錄活性[15]。在亞砷酸導致的氧化應激中,過量的ROS激活MST1,抑制Akt對FOXO3a的磷酸化作用,促使FOXO3a核定位并進行轉錄[16]。
3.2.2FOXO3a的去乙酰化Sirtuins是NAD+依賴的脫乙酰酶家族,其中SIRT1、SIRT3、SIRT5均可通過去乙酰化作用激活FOXO3a,增加FOXO3a的轉錄活性,在抑制細胞凋亡、抗氧化應激損傷、細胞壽命延長方面發揮重要作用[17]。香煙提取物導致肺上皮細胞的應激中,SIRT5去乙酰化FOXO3a,減少細胞凋亡[18]。同樣小膠質細胞中,Sirt3通過去乙酰化作用激活FOXO3a,降低細胞內ROS水平[19],SIRT3介導的FOXO3去乙酰化進一步減少FOXO3磷酸化、泛素化和降解,以此使FOXO3分子穩定[20],但也有研究指出內皮細胞中,SIRT1對FOXO3a的去乙酰化作用導致FOXO3a泛素化及降解,以此拮抗氧化應激介導的細胞凋亡[21]。
4 FOXO3a調控的靶基因
FOXO3a被激活后可誘導下游靶基因表達,發揮多種生物學作用。FOXO3a的靶基因包括抗氧化基因、細胞凋亡和細胞周期阻滯基因等。
4.1FOXO3a的靶基因:抗氧化基因正常生理狀態下,細胞通過其內的解毒系統來避免內源性ROS產生過多,維持細胞內ROS的穩態,保護細胞免受損傷。ROS產生后的細胞解毒依靠抗氧化酶系統(antioxidant enzymes system)調控作用。抗氧化酶系統包括:超氧化物歧化酶(superoxide dismutases,SODs)、過氧化氫酶(catatlase)、過氧化物酶(peroxidases)等(Fig 3)。
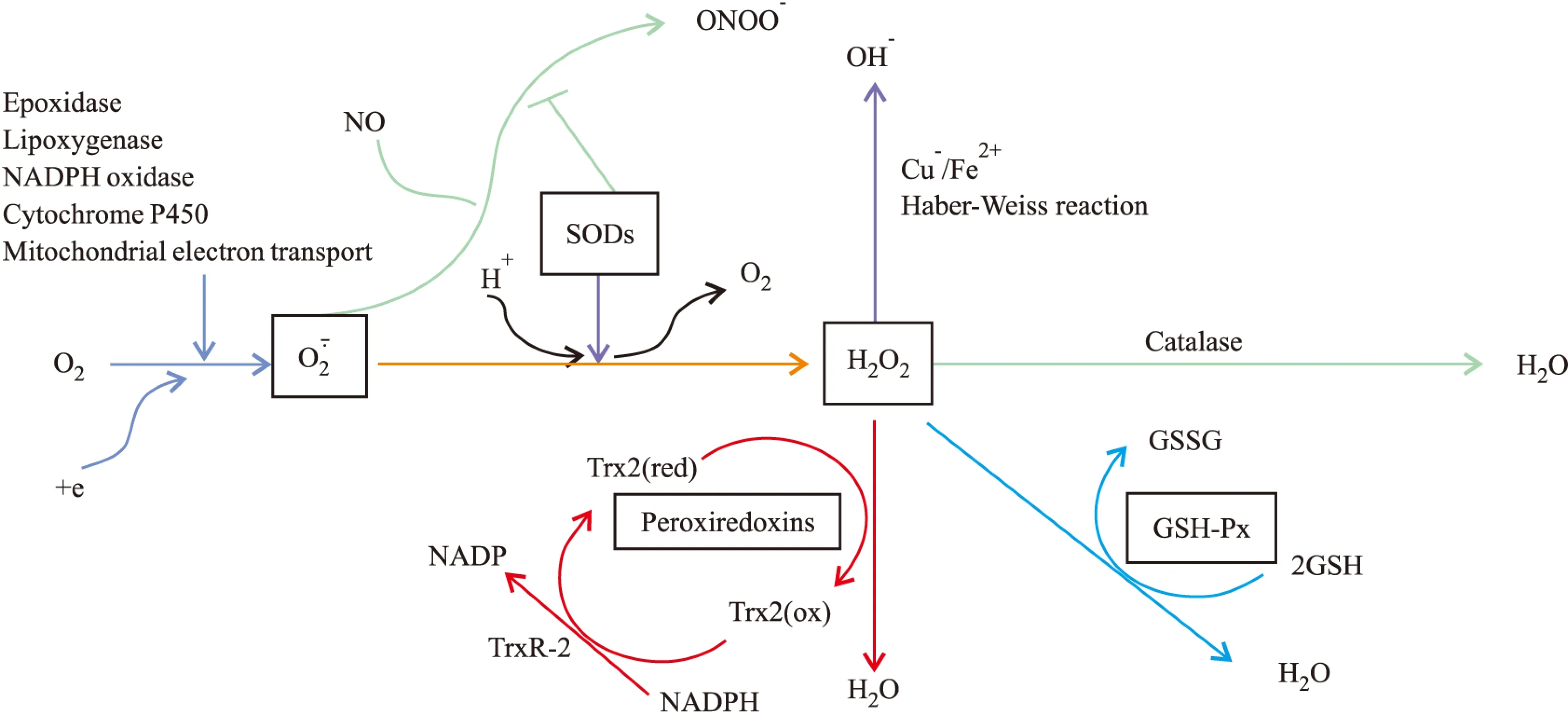
Fig 3 FOXO3a target genes coding for antioxidant proteins
正常狀態下,細胞代謝活動中產生的氧自由基能被SODs歧化為氧氣(O2)和過氧化氫(H2O2)。SODs在哺乳動物體內廣泛存在,包括位于線粒體基質中的MnSOD,位于胞液中的Cu-ZnSOD[22]。研究表明,暴露于過氧化氫的靜止期細胞通過激活FOXO3a,直接上調MnSOD的信使RNA和蛋白表達[23]。同時,當FOXO3a的轉錄活性受到抑制時,MnSOD的表達減少[24]。說明MnSOD的表達受到FOXO3a的調控作用。糖尿病周圍神經病變(DPN )小鼠實驗中,通心絡膠囊可通過抑制MAPK通路提高SOD、GSH-Px活性,有效減低小鼠的氧化應激損傷[25]。Marinkovic等[26]研究發現,FOXO3a具有調控小鼠有核紅細胞胞質中的Cu-ZnSOD表達的作用,進一步證明了轉錄因子FOXO3a在抵抗過氧化物方面發揮著重要的作用。
機體中的多種酶系統參與到了過氧化氫的分解過程,包括過氧化氫酶、谷胱甘肽過氧化物酶(GSH-Px)、抗氧化蛋白(Prxs)等,其中一些也能被FOXO3a調控。強有力的證據證明,PI3K-Akt/PKB信號通路通過調節FOXO3a的活性來增加過氧化氫酶的表達,使過氧化氫(H2O2)分解成水(H2O)和氧氣(O2)[27]。值得注意的是過氧化物酶比過氧化氫酶有更高的親和性,在低水平的H2O2時也能產生同樣的效果。谷胱甘肽過氧化物酶(GSH-Px)能催化GSH變為GSSG,使一分子H2O2還原成1分子H2O。Shalini等[28]的研究顯示,在caspase-2(-/-)的小鼠肝臟細胞中,FOXO3a的活性被抑制,導致機體的谷胱甘肽過氧化物酶GSH-Px、超氧化物歧化酶SOD表達減少,ROS的清除減少,機體的抗氧化能力減弱,提示FOXO3a可通過調控GSH-Px來發揮抗氧化作用。位于過氧化物酶體、胞液和線粒體上的抗氧化蛋白(Prxs)可將過氧化氫分解成氧氣和水。阿霉素(doxorubicin)預處理的H9C2心肌細胞中,ROS表達增加,對FOXO3a磷酸化減少,促進FOXO3a的定位到細胞核中,激活FOXO3a的轉錄活性,導致Prx Ⅲ表達增加[29]。
4.2FOXO3a的靶基因:細胞凋亡與細胞周期阻滯基因FOXO3a能增加細胞凋亡基因的表達,如Bim、FasL、TRAIL、PUMA。在結腸癌祖/干細胞中,小分子ONC201/TIC10能夠抑制Akt活性。此種情況下,Akt對FOXO3a的磷酸化將減少,可激活FOXO3a的轉錄活性,FOXO3a定位到細胞核中,促進TRAIL的表達,從而誘導細胞凋亡[30]。同樣FOXO3a還能激活細胞周期阻滯蛋白(如p21、p27)表達。p21和p27能與周期蛋白依賴性激酶(cyclin-dependent protein kinases, CDKs)結合,并抑制其活性,從而阻止細胞由G1期向S期轉變。S-雌馬酚可抑制cyclin B1和CDK1的表達,并通過增加FOXO3a的表達上調,增加p21和p27蛋白表達,使前列腺癌細胞發生細胞周期阻滯,同時可激活Bim和FasL基因表達,從而發揮抗腫瘤活性[31]。FOXO3a參與的細胞周期阻滯和細胞凋亡對于抑制腫瘤細胞具有重要作用,這提示FOXO3a的病理改變可能參與到細胞癌變,使其獲得了不死性。
4.3FOXO3a調控下游靶基因的“長壽理論”de Keizer等[32]認為,鑒于FOXO3a作為一種“長壽基因”, FOXO3a的調控作用需要作出微調以適應不同的ROS水平。不難想象,當細胞遇到較低水平的ROS產生時,倘若FOXO3a直接調控細胞凋亡,隨著時間的積累,細胞再生的資源就會消耗殆盡,這顯然與長壽不符。另一方面,對于嚴重的ROS損傷,如果FOXO3a依然調控損傷修復,那么這些受損的細胞就可能出現突變體,引發癌癥,從而限制長壽。因此,FOXO3a作為“長壽基因”發揮其功能,不在于單純的被激活或抑制,而在于調整其能力以適應特定的細胞氧化應激環境。
5 氧化應激相關疾病與FOXO3a
在心血管系統中,內皮細胞H2O2積聚導致內皮細胞功能紊亂和動脈粥樣硬化。通過激活SIRT1-FOXO3a/PGC-1α信號通路,使錳超氧化物歧化酶(MnSOD)、過氧化氫酶、抗氧化蛋白3和5(Prx3,Prx5)、硫氧還蛋白2(TRX2)、硫氧還蛋白還原酶2(TR2)及解偶聯蛋白2(UCP-2)等抗氧化基因表達增加。敲除FOXO3a基因后,即使過表達SIRT1也不能使抗氧化酶表達增加[33]。心臟瓣膜手術后再狹窄主要與抑制心臟微血管內皮細胞(cardiac microvascular endothelial cell,CMECs)增殖和遷移有關,雷帕霉素治療24 h抑制CMECs的增殖、遷移和一氧化氮(NO)的分泌,同時促進細胞凋亡和活性氧(ROS)的產生。他汀類藥物可通過Akt/mTOR(mammalian target of rapamycin)/p70S6K(p70S6 Kinase)/FOXO3a信號通路,降低ROS產生,抑制細胞凋亡,促進增殖和遷移,改善內皮功能,促進血管生成過程[34]。研究發現[35],在衰老的CMECs中過表達FOXO3a,使過氧化氫酶和SOD表達增加,可顯著抑制ROS的生成和p27基因的激活,但是這一過程并不能逆轉衰老表型。
越來越多的證據表明,氧化應激在骨質疏松的發生發展中起到舉足輕重的作用[36]。當骨組織發生氧化應激后,JNK和Mst1結合FOXO3a使其發生磷酸化,促進FOXO3a的核定位。Mst1/FOXO3a可直接誘導細胞凋亡,而JNK可通過磷酸化Mst1增強其介導的前凋亡信號,導致骨質疏松[37]。與之激活方式不同,在Bcl2(-/-)的小鼠體內,Akt的活性受到抑制,導致對FOXO3a的磷酸化減少,激活成骨細胞p53基因表達增加,介導骨質疏松的發生[38]。長期使用糖皮質激素,可誘導機體產生氧化應激,同時誘發骨質疏松[39]。Moriishi等[40]研究發現, FOXO3a既參加了糖皮質激素抑制成骨細胞分化誘發骨質疏松的過程,又能通過細胞凋亡通路增強成骨細胞分化,這兩者之間似乎是矛盾的。與以往認為FOXO3a在骨質疏松中誘導細胞凋亡不同,Kim等[41]研究發現,通過激活SIRT1轉錄因子可使FOXO3a發生去乙酰化,使其下游抗氧化基因表達(如氧化氫酶和HO-1),同時可減少破骨細胞生成和增殖,從而抑制骨質疏松。這提示我們,FOXO3a在骨質疏松中的作用可能是復雜的,有的甚至是矛盾的。
阿爾茲海默癥的發生發展也與氧化應激有關。研究發現[42],起初Cdk5(cyclin-dependent kinase 5)可直接磷酸化FOXO3a,促進FOXO3a的核定位,誘導抗氧化酶MnSOD的表達,保護細胞免受氧化應激損傷。進一步暴露于ROS后,FOXO3a則通過上調Bim和FasL基因表達,誘導細胞凋亡。提示在阿爾茲海默癥中,FOXO3a介導的抗氧化調控是細胞早期暴露于ROS的結果,當機體的氧化還原反應失調后,FOXO3a會引發凋亡基因的表達。
6 問題與展望
明確調控FOXO3a轉錄因子信號轉導通路的組成、作用及其相互關系,無疑是揭示FOXO3a氧化還原調控本質并進行精確干預的重要突破口。FOXO3a作為一種重要的核轉錄因子,是氧化還原調控多個信號通路的交匯點,在何種內環境、何種機體狀態下,FOXO3a發揮何種調控作用尚未得到明確回答。通過深入研究不同病理生理狀態下FOXO3a的調控作用及其作用機制,加大基于此通路藥物的研發,將會為臨床有效治療機體氧化應激損傷提供新的途徑。
[2]Kenyon C. The first long-lived mutants: discovery of the insulin/IGF-1pathway for ageing[J].PhilosTransRSocLondBBiolSci,2011,366(1561): 9-16.
[3]Zheng F, Wu J, Zhao S,et al.Baicalein increases the expression and reciprocal interplay of RUNX3 and FOXO3a through crosstalk of AMPKα and MEK/ERK1/2 signaling pathways in human non-small cell lung cancer cells[J].JExpClinCancerRes,2015,34(1): 41-54.
[4]Simon Taylor, Lam M, Pararasa C,et al.Evaluating the evidence for targeting FOXO3a in breast cancer: a systematic review[J].CancerCellInt,2015,15(1):1-9.
[5]Consolaro F, Ghaem-Maghami S, Bortolozzi R,et al.FOXO3a and posttranslational modifications mediate glucocorticoid sensitivity in B-ALL[J].MolCancerRes,2015,13(12):1578-90.
[6]Coskun D, Obakan P, Arisan E D,et al. Epibrassinolide alters PI3K/MAPK signaling axis via activating FOXO3a-induced mitochondria-mediated apoptosis in colon cancer cells[J].ExpCellRes,2015,338(1):10-21.
[7]Dey G, Bharti R, Dhanarajan G,et al.MarinelipopeptideIturin A inhibits Akt mediated GSK3β and FOXO3a signaling and triggers apoptosis in breast cancer[J].SciRep,2015,5:10316.
[8]Zhang L, Yang X, Li X,et al.Butein sensitizes HeLa cells to cisplatin through the AKT and ERK/p38 MAPK pathways by targeting FOXO3a[J].IntJMolMed,2015 ,36(4):957-66.
[9]Perrini S, Tortosa F, Natalicchio A,et al.The p66Shc protein controls redox signaling and oxidation-dependent DNA damage in human liver cells[J].AmJPhysiolGastrointestLiverPhysiol,2015 ,309(10):G826-40.
[10]Yang Y C, Tang Y A, Shieh J M, et al.DNMT3B overexpression by deregulation of FOXO3a-mediated transcription repression and MDM2 overexpression in lung cancer[J].JThoracOncol,2014,9(9):1305-15.
[11]Hagenbuchner J, Ausserlechner M J. Mitochondria and FOXO3: breath or die[J].FrontPhysiol,2013,4:147.
[12]Dansen T B, Smits L M, van Triest M H,et al.Redox-sensitive cysteines bridge p300/CBP-mediated acetylation and FoxO4 activity[J].NatChemBiol,2009,5(9):664-72.
[13]Peng C, Ma J, Gao X,et al.High glucose induced oxidative stress and apoptosis in cardiac microvascular endothelial cells are regulated by FOXO3a[J].PLoSOne,2013,8(11):e79739.
[14]Luo H, Yang Y, Duan J, et al.PTEN-regulated AKT/FOXO3a/Bim signaling contributes to reactive oxygen species-mediated apoptosis in selenite-treated colorectal cancer cells[J].CellDeathDis,2013,4:e481.
[15]Wilk A, Urbanska K, Yang S,et al.Factor 3a counteracts high glucose/tumor necrosis factor-α-mediated neuronal damage: implications for human immunodeficiency virus encephalitis[J].JNeurosciRes,2011,89(2):183-98.
[16]Yamaguchi Y,Madhyastha H, Madhyastha R,et al.Arsenic acid inhibits proliferation of skin fibroblasts, and increases cellular senescence through ROS mediated MST1-FOXO signaling pathway[J].JToxicolSci,2016,41(1):105-13.
[17]Zhang F, Li Z L, Xu X M,et al.Protective effects of icariin-mediated SIRT1/FOXO3 signaling pathway on intestinal ischemia/reperfusion-induced acute lung injury[J].MolMedRep,2015,1852(11):2442-55.
[18]Wang Y, Zhu Y, Xing S,et al.SIRT5 prevents cigarette smoke extract-induced apoptosis in lung epithelial cells via deacetylation of FOXO3[J].CellStressChaperones,2015,20(5):805-10.
[19]Rangarajan P, Karthikeyan A, Lu J,et al.Sirtuin 3 regulates FOXO3a-mediated antioxidant pathway in microglia[J].Neuroscience,2015,311:398-414.
[20]Tseng A H, Wu L H, Shieh S S,et al. SIRT3 interactions with FOXO3 acetylation, phosphorylation and ubiquitinylation mediate endothelial cell responses to hypoxia[J].BiochemJ,2014,464(1):157-68.
[21]Sionov R V, Vlahopoulos S A, Granot Z.Regulation of bim in health and disease[J].Oncotarget,2015,6(27):23058-134.
[22]Holzmeister C,Gaupels F,Geerlof A,et al.Differentialinhibition of Arabidopsis superoxidedismutases by peroxynitrite-mediated tyrosine nitration[J].JExpBot,2015, 66(3):989-99.
[23]Kops G J, Dansen T B, Polderman P E,et al.Forkhead transcription factor FOXO3a protects quiescent cells from oxidative stress[J].Nature,2002,419(6904):316-21.
[24]Callaway D A,Riquelme M A,Sharma R,et al.Caspase-2 modulates osteoclastogenesis through down-regulating oxidative stress[J].Bone,2015,76:40-8.
[25]王超,張會欣,邢邯英,等.通心絡膠囊抑制 p38 MAPK 磷酸化抑制糖尿病周圍神經病變小鼠氧化應激[J].中國藥理學通報,2015, 31(5):726-30.
[25]Wang C,Zhang H X,Xing G Y.Tongxinluo capsule inhibits oxidative stress in diabetic peripheral neuropathy mice by inhibiting the activity of p-p38 MAPK[J].ChinPharmacolBull,2015,31(5):726-30.
[26]Marinkovic D,Zhang X,Yalcin S,et al.Foxo3 is required for the regulation of oxidative stress in erythropoiesis[J].JClinInvest,2007,117(8):2133-44.
[27]Glorieux C,Zamocky M,Sandoval J M,et al.Regulation of catalase expression in healthy and cancerous cells[J].FreeRadicBiolMed,2015,87:84-97.
[28]Shalini S,Dorstyn L,Wilson C, et al. Impaired antioxidant defence and accumulation of oxidative stress in caspase-2-deficient mice[J].CellDeathDiffer,2012,19(8):1370-80.
[29]Liu M H, Zhang Y, He J, et al. Upregulation of peroxiredoxin Ⅲ in doxorubicin-induced cytotoxicity and the FOXO3a-dependent expression in H9c2 cardiac cells[J].ExpTherMed,2015,10(4):1515-20.
[30]Prabhu V V,Allen J E,Dicker D T, et al. Small-molecule ONC201/TIC10 targets chemotherapy-resistant colorectal cancer stem-like cells in an Akt/FOXO3a/TRAIL-dependent manner[J].CancerRes,2015,75(7):1423-32.
[31]Lu Z,Zhou R,Kong Y, et al.S-equol, a secondary metabolite of natural anticancer isoflavone daidzein, inhibits prostate cancer growthinvitroandinvivo, though activating the Akt/FOXO3a pathway[J].CurrCancerDrugTargets,2015,Epub ahead of print.
[32]de Keizer P L,Burgering B M,Dansen T B.Forkhead box o as a sensor,mediator, and regulator of redox signaling[J].AntioxidRedoxSignal,2011,14(6):1093-106.
[33]Olmos Y,Sánchez-Gómez F J,Wild B, et al. SirT1 regulation of antioxidant genes is dependent on the formation of a FOXO3a/PGC-1α complex[J].AntioxidRedoxSignal,2013,19(13):1507-21.
[34]Pan Q,Xie X,Guo Y, et al.Simvastatin promotes cardiac microvascular endothelial cells proliferation,migration and survival byphosphorylation of p70 S6K and FOXO3a[J].CellBiolInt,2014,38(5):599-609.
[35]Qi X F,Chen Z Y,Xia J B, et al.FOXO3a suppresses the senescence of cardiac microvascular endothelial cells by regulating the ROS-mediated cell cycle[J].JMolCellCardiol,2015,81:114-26.
[36]Johnson S A,Feresin R G,Soung D Y, et al.Vitamin E suppressesexvivoosteoclastogenesis in ovariectomized rats[J].FoodFunct,2016,7(3):1628-33.
[37]Almeida M.Unraveling the role of FoxOs in bone-insights from mouse models[J].Bone,2011,49(3):319-27.
[38]Moriishi T,Kawai Y,Komori H,et al.Bcl2 deficiency activates FoxO through Akt inactivation and accelerates osteoblast differentiation[J].PLoSOne,2014,9(1):e86629..
[39]Frenkel B,White W,Tuckermann J. Glucocorticoid-induced osteoporosis[J].AdvExpMedBiol,2015,872:179-215.
[40]Moriishi T,Komori T. Glucocorticoid and Bone. The inhibition of osteoblast differentiation and induction of osteocyte apoptosis through the regulation of Bcl-2 by glucocorticoids[J].ClinCalcium,2014,24(9):1329-36.
[41]Kim H N, Han L,Iyer S, et al.Sirtuin1 suppresses osteoclastogenesis by deacetylatingFoxOs[J].MolEndocrinol,2015,29(10):1498-509.
[42]Shi C,Viccaro K,Lee H G, et al.Cdk5-FOXO3a axis: initially neuroprotective, eventually neurodegenerative in Alzheimer’s disease models[J].JCellSci,2016,pii: jcs.185009.[Epub ahead of print]
Redox regulation of FOXO3a transcription factor
LI Ang,XING Ya-qi,LI Xiao-xia,ZHANG Ji-wei,GUO Hui-cai
(DeptofToxicology,HebeiMedicalUniversity,Shijiazhuang050017,China)
ROS-mediated oxidative stress involved in a variety of cellular signal transduction,FOXO3a transcription factor is an intersection in regulating a variety of cellular oxidative stress.FoxO3a has been extensively studied in regulating oxidative stress because of its rather complex and pivotal regulation of cell proliferation, cell cycle arrest, ROS scavenging and apoptosis.This review will elucidate the FOXO3a’s regulatory mechanisms and describe the target genes involved.It will also provide the clinical significance and strategies to target FOXO3a to regulate oxidative stress.
oxidative stress;ROS;FOXO3a;regulation;phosphorylation;antioxidant
2016-05-30,
2016-06-27
國家自然科學基金資助項目(No 81473292);2016年河北省“大學生創新性實驗計劃”項目(No USIP2016020)
李昂(1993-),男,本科生,研究方向:心血管藥物毒理學,E-mail:anglimail@126.com;
郭會彩(1976-),女,博士,副教授,碩士生導師,研究方向:心血管藥物毒理學,通訊作者,E-mail:huicaiguo@hotmail.com
10.3969/j.issn.1001-1978.2016.09.005
A
1001-1978(2016)09-1203-05
R-05;R329.2;R349.1;R394.2;R977.3;R977.6
網絡出版時間:2016-8-23 14:29:00網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.010.html